陶融型调味酒培菌糖化工艺研究
张大鑫,黄润娜,韩素娜,樊建辉,李 华,李建民
(河南仰韶酒业有限公司研究中心,河南渑池 472400)
陶融香型调味酒是以整粒纯高粱为原料,小曲为糖化发酵剂,采用先培菌糖化后入窖密封发酵工艺,经洗粮、泡粮、初蒸、闷水、复蒸、摊晾、下曲(两次下曲)、培菌糖化、窖池发酵、蒸馏而成。培菌糖化过程是陶融香型调味酒生产中的关键环节,培菌糖化过程就是使小曲中的根霉菌、酵母菌等微生物在熟粮上进行生长繁殖,将原料中的淀粉分解为糖,以提供适量的糖来进行酒精发酵,不要求彻底将淀粉全部变成糖。因此,培菌糖化的工艺条件(培菌糖化时间、温度、用曲量)对陶融香型调味酒的出酒率和质量影响较大。如培菌糖化时间过长,原料糖化程度过大,就会使出箱糖化料变老,进而影响窖内发酵情况,使出窖酒醅的酒精含量偏低,残糖增高,酸度增大,出酒率降低,酒的香味和风味不好;若培菌糖化时间过短,微生物的生长繁殖和淀粉分解不充分,糖含量偏低,也会使发酵缓慢,进而影响出酒率。因此培菌糖化程度的不同,对酒产量和品质的影响也不同。本实验通过控制陶融香型调味酒生产过程中培菌糖化条件,使培菌糖化料呈现出老嫩不同的两种情况,并分别配糟入窖发酵,再通过对所产原酒产质量的对比分析,来研究培菌糖化工艺条件对陶融香型调味酒出酒率和质量的影响。
1 材料与方法
1.1 材料
1.1.1 实验窖池
河南仰韶酒业酿酒十二车间,发酵使用62 组、66组水泥底陶壁砖墙窖池。
1.1.2 实验用培菌糖化料样品来源与采样方法
培菌糖化样品采集于仰韶酒业酿酒十二车间62 与66 组,根据培菌糖化时间选取0 h、4 h、8 h、12 h、16 h、20 h、24 h、28 h、32 h、36 h、40 h 进行取样,分上、中、下三层,五点取样混合均匀后为一个样品,取样后迅速置于冰箱中备用,取样同时对每个点测温记录。
1.1.3 酒醅样品来源与采样方法
出入窖酒醅样品采集于仰韶酒业酿酒十二车间62 和66 组各3 条试验窖池,入窖和出窖时进行取样,分上、中、下三层,五点取样混合均匀后为一个样品,迅速送酒醅化验室进行检测。
1.1.4 原酒取样
方案A、方案B 相同发酵周期各3 条窖池分别取3轮次酒样。
1.1.5 主要设备和仪器(表1)

表1 仪器设备信息
1.2 试验方法
1.2.1 培菌糖化方案
培菌糖化方案共两种,分别编号为A 和B。不同培菌糖化方案的条件参数见表2。

表2 不同培菌糖化方案的条件参数
酿酒生产62 组和66 组在同一时期分别各取3条窖池采用方案A 和方案B 进行培菌糖化(其他生产工艺条件均相同),配糟后进行相同3 轮次的发酵,取记录数据的平均值。
1.2.2 出箱培菌糖化料的感官评定
生产一线培菌糖化专业技术人员6 名,根据实际生产经验,对两种方案的出箱培菌糖化料的手感、口感、气味进行综合品鉴评分,判定哪种培菌糖化料更符合生产要求。感官评价标准参照表3。

表3 陶融香型调味酒出箱培菌糖化料感官指标及评分标准
1.2.3 酵母菌计数
YPD 培养基(1000 mL):葡萄糖20 g,蛋白胨10 g,酵母膏5 g,琼脂20 g,自然pH 值,灭菌完后加氯霉素100 μg/mL。称取10 g 样品于90 mL 无菌水中摇匀30 min,稀释涂布为10、10、10共3 个梯度,每个梯度分别涂布于相应YPD 培养基平板上,各3个平行,然后以30 ℃倒置培养2 d,进行酵母菌计数。选CFU(Colony-Forming Units,菌落形成单位)在30~300之间的平板进行计数,在这个范围之外不能正确地指示样品中微生物的真实数量。
1.2.4 酒醅理化分析
水分:恒温失重法;酸度:中和滴定法;还原糖、淀粉:斐林试剂法;总酸:滴定法。
1.2.5 风味成分分析
采用气相色谱法:取酒样,降度至60 %vol,进样进行气相色谱分析。GC 条件:载气(高纯氮):流速为50 mL/min;氢气:流速为40 mL/min;空气:流速为400 mL/min;检测器温度(TD):150 ℃;注样器温度(TJ):150 ℃;柱温(TC):90 ℃,等温。注:载气、氢气、空气的流速等色谱条件随仪器而异,应通过试验选取最佳操作条件,以内标峰与样品中其他组分峰获得完全分离为准。
1.2.6 原酒感官评定
6 位国家级白酒专业评委,对两种方案所产陶融香型调味原酒的色泽、香气、口味、风格进行综合品鉴评分,判定这两种原酒品质的优劣。感官评价标准参照表4。

表4 陶融香型调味酒感官指标及评分标准
1.3 陶融香型调味酒生产工艺流程(图1)
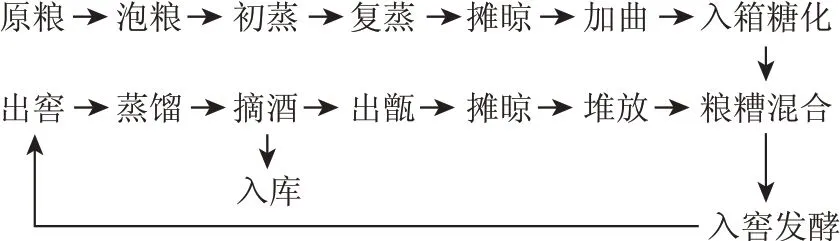
图1 陶融香型调味酒生产工艺流程
2 结果与分析
2.1 培菌糖化过程中原料状态随时间变化的情况
由表5 可以看出,方案A 原料的甜度从感官上比方案B 的小,方案B 原料既有甜味,也有酸味产生,很可能是被环境中其他杂菌污染后产生了酸败。根据感官指标评定结果(表6),方案A 出箱培菌糖化料更符合生产要求。
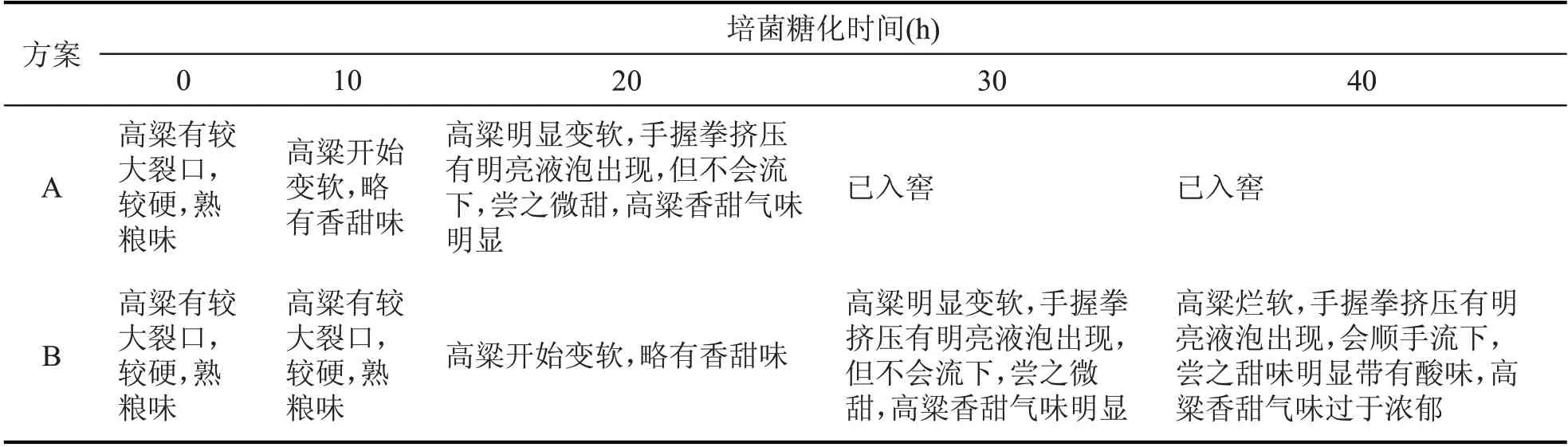
表5 方案A、方案B培菌糖化过程中原料状态随时间的变化情况

表6 方案A、方案B出箱培菌糖化料感官指标评定结果
2.2 培菌糖化过程中温度、还原糖和酵母数量变化情况
通过对方案A 和方案B 培菌糖化过程的跟踪取样,得到糖化温度、还原糖、酵母数量的变化情况,具体数据见表7和表8。
由表7 和表8 可知,方案A、方案B 的原料在前8 h 温度变化不大,微生物在这个阶段处于延滞期,酵母菌的数量没有较大变化;8~20 h 时温度迅速上升,这个阶段微生物处于高度活跃的“对数生长期”,酵母菌的数量有明显增加,同时也伴随着大量热量的释放,引起原料温度的急速上升。
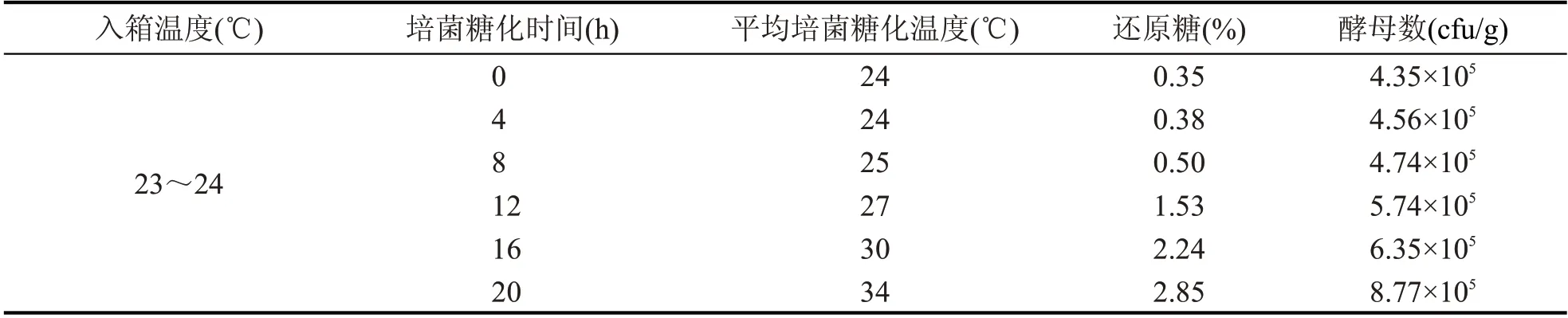
表7 方案A培菌糖化过程中理化数据
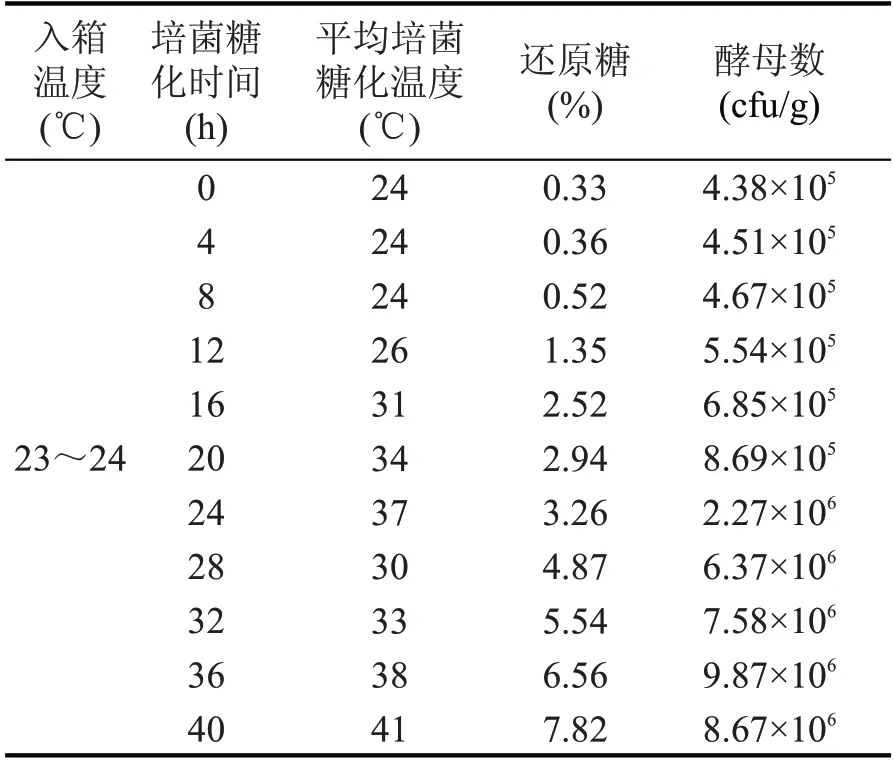
表8 方案B培菌糖化过程中理化数据
方案A 原料在20 h 时温度达到最高33~34 ℃,按工艺要求配糟入窖,进行窖内发酵。方案B 根据工艺要求继续进行培菌。有研究表明,25~30 ℃对酿酒酵母的繁殖比较有利,温度低于20 ℃或高于40 ℃时,酿酒酵母的生长明显受到抑制,为了减少长时间高温对原料培菌糖化效果的影响,在24 h 时对方案B 进行了物理降温,使其温度下降至30 ℃左右。28 h 后方案B 原料温度又进行了一次快速升温,顶火温度达到了40~42 ℃,酵母的生长受到抑制,不耐高温的酵母菌在此阶段死亡,因此酵母菌的数量逐渐减少,这可能会影响入窖后酵母菌产酒的品质。
由表7 和表8 可以看出,方案A 和方案B 原料中还原糖含量在前8 h 没有太大的增加,8 h 后还原糖的含量迅速增加,方案A 在20 h 时糖含量达到2.8 %,方案B 在40 h 时,糖含量达到了7.82 %,可见随着培菌糖化时间的延长,糖的含量也在不断地增加,堆积结束后方案B 的糖含量是方案A 的2.8倍。
2.3 出入窖指标与窖内发酵情况
2.3.1 酒醅出入窖变化情况
方案A 和方案B 酒醅出入窖变化见表9 和表10。

表9 方案A、方案B酒醅入窖指标

表10 方案A、方案B酒醅出窖指标
由表9、表10 可以看出,入窖时,方案A 的淀粉比方案B 的高1 %~5 %,但糖分却要低1 %~3.5%,这是由于方案B 原料糖化得比方案A 老,淀粉在培菌糖化过程中分解转化成较多糖。出窖时,方案A 的淀粉和糖均比方案B 的低,说明在窖内发酵过程中方案A 的淀粉不但分解转化为糖的量比方案B 多,糖分分解也比方案B 多,酵母菌无氧发酵产酒效果也比方案B 好,因而方案A 原酒的产量比方案B多。
2.3.2 入窖后酒醅温度变化情况
方案A、方案B 配糟入窖后酒醅温度随时间变化的情况分别见图2、图3。
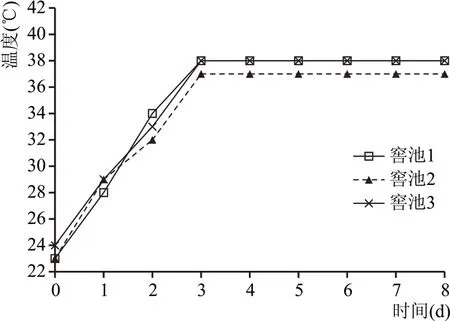
图2 方案A培菌糖化料配糟入窖后酒醅温度随时间的变化曲线
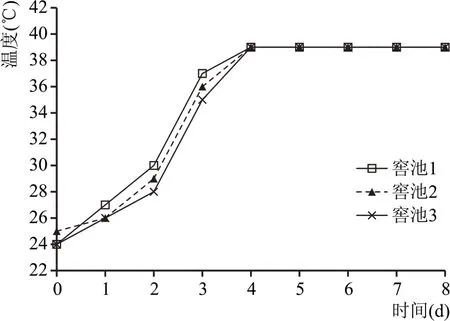
图3 方案B培菌糖化料配糟入窖后酒醅温度随时间的变化曲线
由图2、图3 可以看出,窖池方案A、方案B 酒醅入窖后均符合“前缓、中挺、后缓落”的发酵规律。虽然两种方案窖内发酵的升温情况基本相同,但是方案A 明显要比方案B 早1 d 到达顶火温度,这是因为方案A 糖化原料中的微生物入窖时处于旺盛的生长期,入窖后快速繁殖;方案B 糖化原料中的微生物由于经历了二次升温,且入窖前顶火温度过高,对其生长有一定的抑制性,活力有所下降,导致窖内升温达到顶火时间推迟1 d。从顶火温度来看方案A 的顶火温度(37~38 ℃)比方案B 的39~40 ℃低1~2 ℃。有研究表明,30~37 ℃对酿酒酵母代谢产生酒精比较有利,因此,方案A 的产酒效果优于方案B。
2.4 原酒的理化分析
2.4.1 风味物质检测结果
取方案A和方案B的3个实验窖池原酒进行风味物质含量检测,结果见表11。
由表11 可以看出,方案A 原酒中正丙醇、异戊醇的含量均低于方案B,乙酸乙酯含量明显高于方案B,由此可知方案A原酒比方案B品质好。
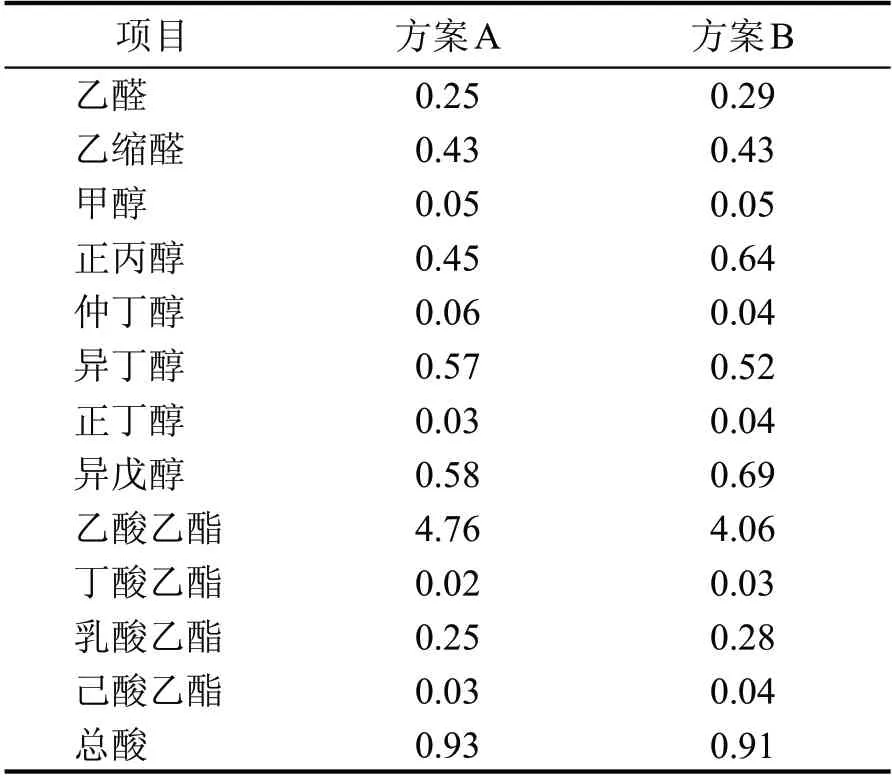
表11 风味物质含量 (g/L)
2.4.2 感官品评结果
取方案A和方案B的3个实验窖池原酒进行感官品评,并记录平均值,感官指标评分结果见表12。
由表12 可以看出,方案A 不但出酒率比方案B要高出10 %左右,而且原酒的感官评分也要高于方案B,方案A明显优于方案B。

表12 感官指标评分结果
3 结论
通过整个实验过程可以发现,方案A 培菌糖化的温度虽然偏低,糖分含量也略低,但是其过程平稳,为后续的窖内发酵做好了充足准备,使窖内发酵正常,生产的酒产量高,质量好。方案B 虽然培菌糖化过程中糖分含量高,但是,一方面培菌糖化顶火温度过高使不耐高温的酵母死亡,造成窖内产酒微生物(酵母菌)种类偏少,对原酒产质量有一定影响;另一方面,二次升温使杂菌大量滋生,代谢产物影响原酒风味物质的形成,进而影响整体质量。
综上所述,培菌糖化18~20 h 的工艺在陶融型调味酒生产过程中的作用要明显优于培菌糖化42~44 h。因此,不能片面的认为培菌糖化过程中糖含量高,后续发酵酒的产量就会高,采用合适的培菌糖化时间,才能达到最佳效果。

