技术支持下多方位探究离子浓度的教学设计
顾仲良
摘要:为弥补弱电解质的电离平衡教学中“重定性、缺定量”影响学生理解电离平衡理论的不足,教师设计并开展基于数字化传感技术多方位探究电离平衡的实验,可引导学生测定离子浓度,分析电离程度,推导电离平衡的稀释定律、同离子效应,实现“宏观—微观—符号”三重表征。实践证明,借助信息技术优化实验教学,有利于学生基于数理分析数据、探究微观变化,建构化学平衡理论模型,加深对理论的理解。
关键词:传感器;电离平衡;数字化实验
实验是实现教学目标的重要方法和途径,《普通高中化学课程标准(2017年版2020年修订)》[1]要求教师适当增加数字化实验、定量实验和创新实践活动等,让学生在实验探究活动中学习科学方法,认识科学探究过程,体会、认识技术手段的创新对化学科学的重要价值。现行教材常以CH3COOH或NH3·H2O为例来解释电离平衡,对于电离平衡内容,人教版选择性必修教材在必修一的强电解质“电离”与“离子反应”基础上做了深化、完善,同时对同章节“强弱电解质”概念加以拓展,为后续“盐类的水解”教学作铺垫。对于电离平衡内容而言,教师不仅需要让学生“知其然”,而且要让学生“知其所以然”,从微观粒子种类与浓度的变化来认识电离平衡的存在与移动。
一、教学不足与改进思路
学生要构建电离平衡,就需要深刻理解微粒观与平衡观这一核心概念。教材对于电离平衡及影响因素仅有理论分析。笔者认为在教学中辅以数字化实验让学生利用直观的数据图表进行探究,更有利于其构建电离平衡的原理模型。以往,对于这类理论与实验内容的教学,一些教师在设计时虽然考虑了数字化传感器的应用,但是往往仅从定性角度去分析实验结果,缺乏对离子浓度、电离度、电离平衡常数的定量计算,也没有设计稀释效应、同离子效应实验来完善电离平衡理论教学。微观离子的实际浓度及以此为基础而获得的电离度和电离平衡常数是证明电离平衡及平衡发生移动的直接有力的表达与判断。教师要想在教学中充分论证电离平衡理论,就需要改变思路用新颖的数字化实验进行探究,获得离子浓度数据,缜密分析数据,推理变化过程,使学生对理论更加信服。
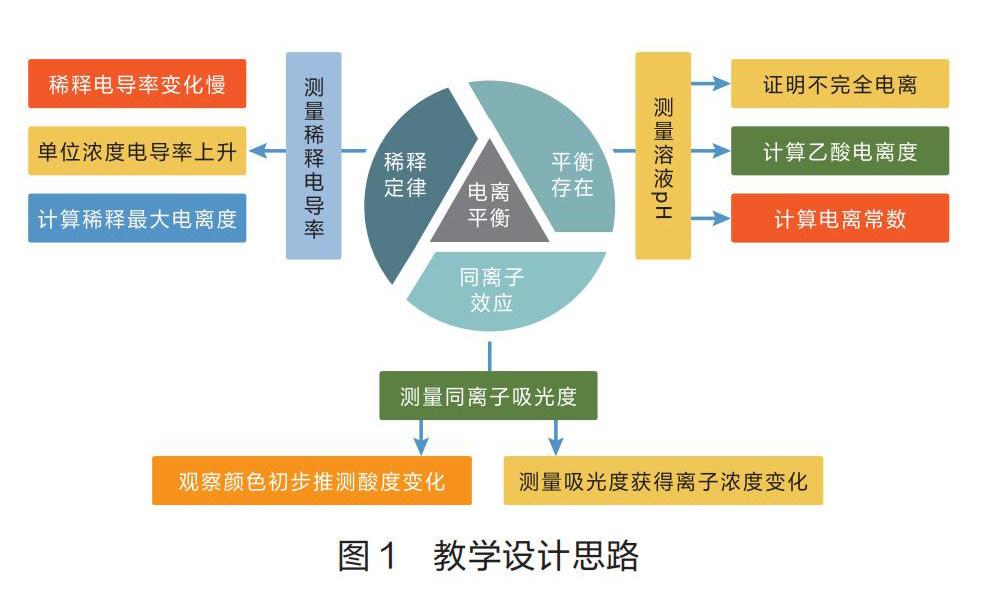
弱电解质的电离平衡是学生在高中阶段学习的重要化学平衡之一。笔者做教学设计时创新实验方案,以CH3COOH溶液为情境,使用pH传感器测量标准溶液的H+浓度,证明电离平衡的存在,并计算电离度和电离平衡常数;借助电导率传感器测量稀释过程中的电导率变化,证明弱电解质的稀释定律;通过色度计传感器测量添加不同量CH3COONa晶体的乙酸-甲基橙体系的透光率,证明电离的同离子效应。以三个教学步阶引导学生利用数字化传感器实验,探究溶液中微粒种类和浓度发生的变化,以及电离平衡的存在和移动,并以数据曲线表征变化结果,有效建构和验证化学平衡理论,具体设计思路如图1所示。
二、应用pH传感器证明电离平衡的存在
(一)实验操作内容
实验目的:引导学生测定标准溶液的pH,测得H+浓度,证明弱电解质电离不完全,感知电离平衡的存在,了解电离度与电离平衡常数的计算方法,并学会用电离度或电离平衡常数表示电离程度。
实验装置:便携式pH传感器。
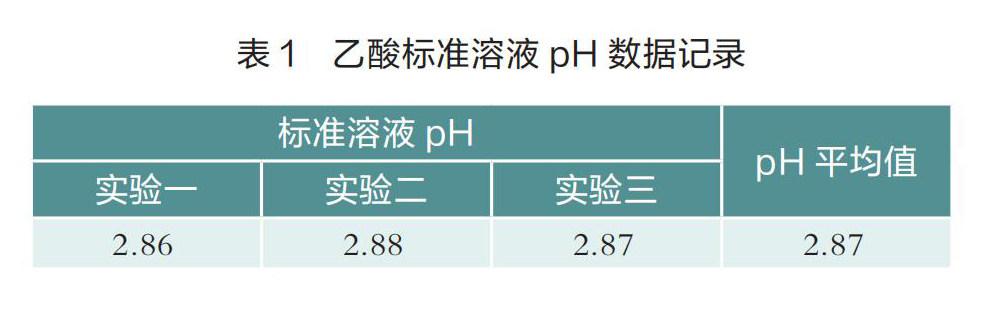
实验步骤:连接好实验装置,在烧杯中加入30 mL 0.1000 mol·L-1的CH3COOH标准溶液,打开并调试便携式pH传感器,测量溶液pH。学生按此方法进行三次测量并将数据记录在表1中。
(二)实验数据分析
学生通过实验测得0.1000 mol·L-1的CH3COOH标准溶液pH为2.87(说明c(H+)= 1.35 × 10-3mol·L-1)。CH3COOH溶液中的H+主要来自CH3COOH的电离,溶液中H+浓度(1.35×10-3mol·L-1)远小于CH3COOH分子浓度(0.100 mol·L-1),表明CH3COOH在溶液中发生不完全电离(阿累尼乌斯电离理论),存在电离平衡。学生根据电离度(α)概念,计算氢离子浓度与乙酸浓度之比即得电离度,还可根据电离度与平衡常数的关系,获得乙酸的电离平衡常数。
三、借助电导率传感器探究电离平衡稀释定律
(一)实验操作
实验目的:引导学生测定CH3COOH标准溶液在稀释过程中的电导率变化(量),探究CH3COOH浓度与电导率值的数据关系,了解可用数据表征电离度,从电离度变化的角度研判稀释过程中电离平衡移动的方向。
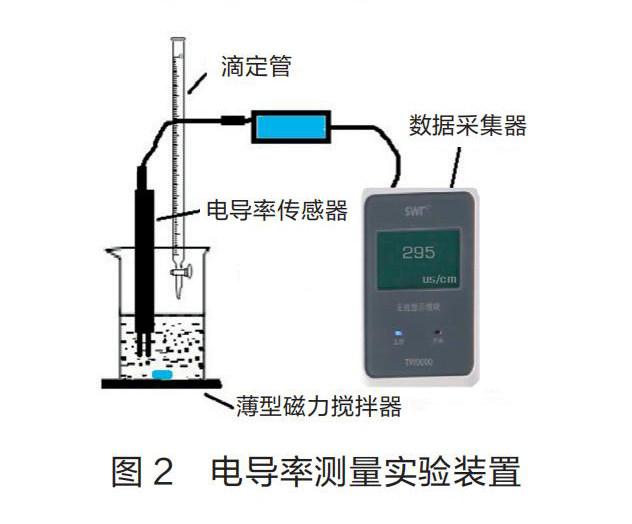
实验装置:如图2所示。
实验步骤:(1)向烧杯中加入20.00 mL 0.1000 mol·L-1 CH3COOH标准溶液;(2)置入电导率传感器,连接数据采集装置,测量电导率数值并记录;(3)用滴定管向烧杯中添加蒸馏水,每次20.00 mL,启动磁力搅拌器使之充分稀释,再次测量电导率数据并记录,将添加蒸馏水的操作做五次。
(二)实验数据分析
同溶质电解质溶液的导电性强弱与离子浓度有关。在浓度较低的电解质溶液中,离子间相互作用很微弱,离子移动受干扰小而运动速率快。所以,电解质稀溶液的离子浓度越大导电性越好,且电导率与离子浓度存在线性正比关系(比例系数k):σ=kc(离子)。CH3COOH稀溶液在稀释过程中,电导率有明显变化(如图3)。由图3可知,CH3COOH溶液稀释后电导率减小,但电导率减小程度(相比于线性正比线)明显较缓,即离子浓度减小较慢。这表明在稀释过程中离子浓度的下降受到了某种因素的抑制,该因素适当地增添了离子的物质的量,使稀释过程中离子浓度非线性下降。学生分析能产生离子的物质,发现只有溶质CH3COOH,得出结论,即乙酸在稀释过程中又在不断地电离产生离子,“越稀越电离”。
强电解质往往被视为完全电离,其稀溶液电导率与溶质浓度有线性关系,即电导率与浓度的比值 (摩尔电导率,也称单位浓度电导率)几乎保持不变[2]。但CH3COOH稀溶液在稀释过程中“单位浓度电导率”不断增大(如图4),为什么?
电导率表征的是溶液导电性,在CH3COOH稀溶液中它与离子浓度成正比:
σ=k(c(H+)+c(AC-))=2kc(H+)
将公式(1)和电离度计算式代入“单位浓度电导率”计算式,可得:
由于k是一个常数,所以CH3COOH的“单位浓度电导率”的变化可代表CH3COOH电离度变化。学生分析曲线图可知,乙酸在稀释过程中,其电离程度在不断增大。
在理论上,乙酸在稀释过程中电离度可达100%,但实际上当乙酸稀释到pH为7,再稀释也就没有意义了。学生可以根据乙酸的电离平衡常数与电离度的关系,算得乙酸在pH为7时的最大电离度为99.44%。
四、基于色度计传感器探究电离平衡的同离子效应
(一)实验操作
实验目的:引导学生对比观察添加不同量CH3COONH4晶体的乙酸-甲基橙溶液前后颜色变化,并利用色度计传感器测定它们的透光率;根据吸光度计算溶液中H+浓度的变化量,证明弱电解质电离平衡的同离子效应。
实验装置:色度计传感器。
实验步骤 :(1)配制甲基橙指示剂,量取1.000 mL 0.1 g·L-1甲基橙标准液放入10 mL规格的容量瓶中,加蒸馏水稀释使其液面到刻度线处;(2)取7支10 mL规格的容量瓶(标号1、2、3、4、5、6、7),用移液枪分别滴入0.350 mL甲基橙指示剂;(3)向1~5号容量瓶中分别注入0.1000 mol·L-1 CH3COOH标准溶液,并在其中4支容量瓶(2、3、4、5号)中分别加入不同量的CH3COONH4晶体,充分振荡,完全溶解后观察颜色变化;(4)向6号容量瓶中注入0.1000 mol·L-1盐酸,向7号容量瓶中注入0.1000 mol·L-1氢氧化钠溶液;(5)用色度计传感器的绿光源(λ=565 nm)分别对6支容量瓶内的溶液进行透光率(T)测定,利用公式A=-lgT换算吸光度(A)并记录于表2中。
(二)实验数据分析
学生对比溶液颜色,发现加入CH3COONH4晶体后,溶液由红色(pH<3.1)变为黄色(pH>4.4)。这是由于溶液中CH3COO-离子浓度增大造成的。乙酸的电离平衡方程为CH3COOH CH3COO-+H+,受到抑制时,平衡逆向移动,H+浓度下降,溶液pH 增大,这可以证明CH3COOH溶液存在同离子效应。
甲基橙在水溶液中存在电离平衡HIn In-+H+。学生查阅相关文献[3]得知用λ=565 nm的绿光测量其溶液的透光率时,微粒HIn、In-均有吸收此波长的光,吸光度有加和性,即A=A(HIn)+A(In-)。甲基橙的电离平衡常数Ka=3.802×10-4。
根据朗伯比尔定律A=Kbc,可知吸光度(A)与浓度(c)成正比,式中b为溶液的厚度即比色皿的宽度(此实验使用同一规格比色皿),K为吸收比例系数,在绿光测定时两种微粒HIn、In-的吸收比例系数分别被定义为K(HIn)、K(In-),则有以下等式:
A=A(HIn)+A(In-)=K(HIn)bc(HIn)+K(In-)bc(In-)(4)
测量6号与7号试样的吸光度,可得K(HIn)b=A(6)/c和K(In-)b=A(7)/c,代入(4)可得
c×A=A(6)×c(HIn)+A(7)×c(In-)(5)
在2、3、4、5号溶液中c=c(HIn)+c(In-),可得
c(HIn)/c(In-)=[A(7)-A]/[A-A(6)] (6)
根据平衡常数Ka的定义(公式),计算溶液中的c(H+)=Ka× =Ka× 。
然后,将2、3、4、5号样品的吸光度数据进行运算获得H+浓度填入表格。
最后,根据记录的数据,绘制加入添加不同CH3COONH4晶体后,H+浓度的变化曲线(如图5)。
观察该曲线,可以看出CH3COOH溶液中CH3COONH4晶体添加越多,溶液中CH3COO-离子浓度越大,H+浓度就越小,由此证明同离子效应存在于乙酸的电离平衡中。
总之,教师科学利用传感技术对传统实验进行改进,可以弥补以往单纯靠理论解释与定性分析造成证据欠缺的不足。对于此次弱电解质的电离平衡教学,教师组织学生参与多方位的数字化实验探究活动,实现了用数据实证来解释平衡理论的教学目标,促进了平衡理论与“宏观—微观—符号”三重表征的融合,增进了学生对化学原理的理解,提升了学生的探究意识和科学精神。
注:本文系中国化学会化学教育委员会“十四五”规划2021年度一般课题“三化实验创新落实化学学科育人功能与价值”(课题编号:HJ2021-0007)和浙江省2020年度教研规划课题“基于深度学习理念的高中化学微主题式教学的实践研究”(课题编号:G2020136)的阶段性研究成果。
参考文献
[1] 中华人民共和国教育部.普通高中化学课程标准:2017年版2020年修订[S].北京:人民教育出版社,2020.
[2] 傅献彩,沈文霞,姚天扬,等.物理化学(第5版)·下册[M].北京:高等教育出版社,2006.
[3] 方舟,钱扬义.运用手持技术测定甲基橙的电离常数Ka[J].化学教育,2011(9):71-72.
(作者张海若系华东师范大学教师教育学院研究生;王祖浩系华东师范大学教师教育学院教授、博士生导师,教育部化学课程标准研制组组长;迟少辉系华东师范大学教师教育学院副教授、硕士生导师;唐增富系华东师范大学附属东昌中学化学特级教师)
责任编辑:祝元志

