利用手持技术探究不同条件下乙酸乙酯水解速率
王彦迪 黎秀梅 李志敏
课程改革的指导思想是“立德树人,以人为本”。“发展学生的核心素养”是教学改革的关键。笔者将基于上述理论在信息技术支持下开展化学实验教学研究。教师应用乙醇传感器测定水浴加热过程中,液体上方乙醇浓度的变化以及产生乙醇的速率,精准地采集了数据,利用数字化实验实时、可视的优势,引导学生通过数据、曲线进行推理,以提高学生的证据推理素养。
一、手持技术实验有利于提高学生证据推理素养
化学教学中教师应多开展以实验为主的多种实验、探究活动,激发学生学习兴趣,培养学生的实践能力。实验是学生参与科学实践活动的重要渠道。教师应用手持技术开展数字化实验教学,能够在研究具体实验中各变量关系、减低理论知识的认知难点、解决传统实验教学难点、探究社会生活的热点问题、拓展实验时空和活动形式等方面培养学生的实验探究能力和问题解决能力,满足中学化学教学需求[1]。手持技术数字化实验在教学中的应用,创造了发展学生素养的环境,能充分发挥实验证据的教育功能[2]。教师在化学教学中适当增加手持技术实验,让学生在实验探究活动中学习科学方法,认识科学探究过程,体会、认识技术手段的创新对化学科学的重要价值,有利于培养其严谨求实、勇于实践的科学精神,提高实践能力,发展证据推理素养。
二、实验创新设计
(一)功能价值分析
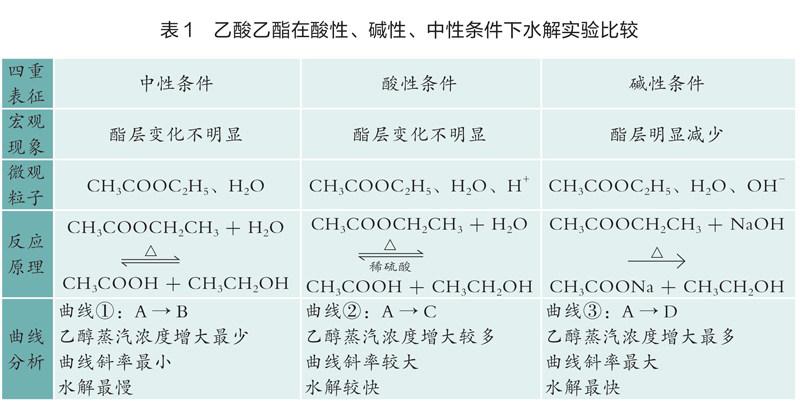
在人教版《化学》(2019年版)选择性必修3第三章第四节“羧酸 羧酸衍生物”教学中,教师要指导学生设计实验,探究乙酸乙酯在中性、酸性和碱性溶液中的水解速率。教材给予的提示是:可以通过酯层消失的时间差异来判断乙酸乙酯在不同条件下水解速率的差别。笔者认为此方案有以下缺点:耗时长;加热条件下乙酸乙酯蒸发损失;有机层与水层均为无色,不利于学生观察实验现象。教材要求学生解释乙酸乙酯在碱性条件下发生的水解是不可逆的。但仅按照教材实验方案操作难以从现象和数据中推理出乙酸乙酯的水解是彻底的这一结论。为解决这个问题,笔者设计用乙醇传感器对水解产物乙醇进行定量测定的方案,引导学生得出实验结论。同时,此实验是开展控制变量法教学的载体。笔者通过乙酸乙酯水解条件的设计与探究,可以让学生深刻地体会到控制实验条件是科学研究中的重要方法。
(二)实验原理
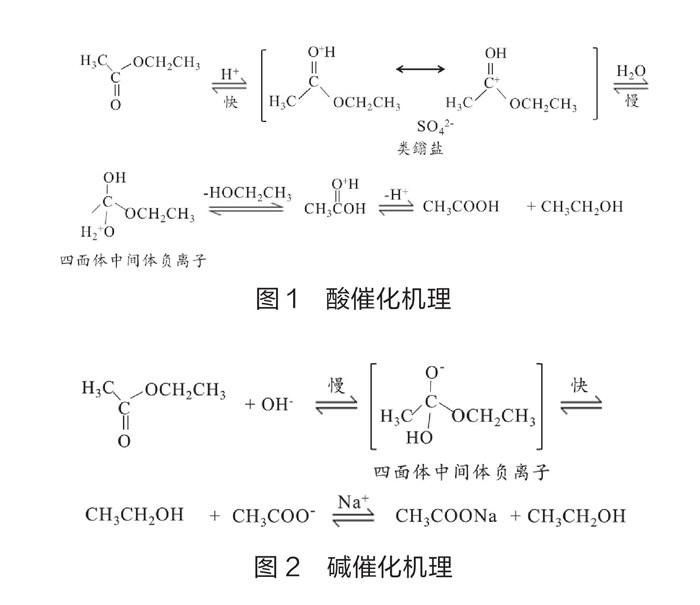
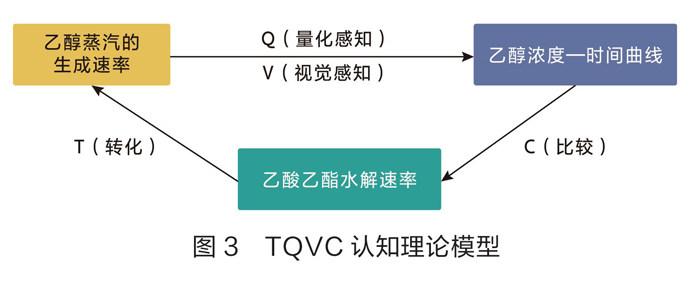
乙酸乙酯与稀硫酸、氢氧化钠的反应机理如下(如图1和图2):乙酸乙酯在中性条件下难水解,在碱性条件下水解比在酸性条件下快,而且是彻底的,在酸性条件下是可逆的。笔者应用TQVC认知理论模型(一种根据认知—建构主义学习理论并融合手持技术建构的“转化—量化感知—视觉感知—比较”概念认知模型)并利用乙醇传感器测定相同条件下乙醇—时间曲线(如图3)。
(三)仪器及药品
实验需要准备乙酸乙酯、紫色石蕊指示剂、蒸馏水、 0.25 mol/L H2SO4溶液、 0.5 mol/L
H2SO4溶液、 1 mol/L H2SO4溶液、 1.25 mol/L
H2SO4溶液、 1.75 mol/L H2SO4溶液、0.5 mol/L
NaOH溶液、1 mol/L NaOH溶液、1.5 mol/L NaOH溶液、2 mol/L NaOH溶液、2.5 mol/L NaOH溶液、有机试剂专用洗涤剂。实验装置如图4和图5所示。
(四)实验步骤
实验共六步。第一步,用导管连接双颈烧瓶和三颈烧瓶,塞紧胶塞,插入乙醇传感器(已预热10分钟),连接好装置,检验装置气密性。第二步,在双颈烧瓶中加入30 mL蒸馏水,再加入30 mL 乙酸乙酯。第三步,将双颈烧瓶放入75 ℃的恒温水浴锅中加热。第四步,采集数据,持续10分钟。第五步,取下双颈烧瓶和三颈烧瓶,洗涤,确保双颈烧瓶、三颈烧瓶及导管中无残留,并更换乙醇传感器胶带。第六步,重复上述步骤完成乙酸乙酯在不同浓度稀硫酸和不同浓度氢氧化钠溶液下的水解速率测定。
(五)实验结果与分析
1. 乙酸乙酯在中性条件下的水解
曲线分析:10分钟内,乙醇浓度从0.010%缓慢上升至16.911%,说明乙酸乙酯在蒸馏水、75 ℃水浴加热下,能够水解产生乙醇,但水解比较缓慢(如图6)。
2. 乙酸乙酯在酸性条件下的水解
曲线变化:在稀硫酸条件下乙醇含量变化值均比在蒸馏水条件下的大一些。100~200 s,乙醇含量上升较快,其他时间上升缓慢,且250 s后基本保持不变。0.5 mol/L和0.75 mol/L的稀硫酸曲线斜率较大,其次为1 mol/L和1.25 mol/L,最后是0.25 mol/L的稀硫酸。
曲线分析:在酸性条件下乙酸乙酯水解程度增大,酸对乙酸乙酯水解反应起到催化作用。0.5 mol/L和0.75 mol/L的稀硫酸条件下,测得乙醇浓度—时间曲线斜率较大,说明在这两个条件下,乙酸乙酯的水解速率较大(如图7)。250 s后曲线保持不变原因是乙酸乙酯在酸性条件下的水解反应为可逆反应,达到动态平衡。
3. 乙酸乙酯在碱性条件下的水解
曲线变化:在碱性条件下乙醇浓度变化值均比在蒸馏水条件下的大一些。开始曲线变化迅速,随着时间增加,变化缓慢,最后保持不变。碱的浓度越大,曲线斜率越大(如图8)。
曲线分析:碱对乙酸乙酯水解反应起催化作用,且催化很快。曲线变缓原因是随着反应的进行,碱与乙酸发生了中和反应,使碱的浓度减小。根据乙酸乙酯在碱性条件下水解的反应机理可知,第一步为慢反应,与OH-浓度有关。中和反应虽然能促进反应的正向进行,但是其促进作用要比碱浓度的减小所引起碱的催化作用降低产生的影响小得多。曲线后段保持不变原因是该实验中乙酸乙酯与NaOH均量取了30 mL,经计算,乙酸乙酯物质的量约为0.3 mol,NaOH物质的量最大为0.075 mol,NaOH量不足,后期相当于乙酸乙酯在水中水解。为此,笔者开展了如下补充实验:取7 mL乙酸乙酯与30 mL 2.5 mol/L NaOH溶液(即等物质的量)混合,在水浴75 ℃条件下加热,采集数据,实验数据曲线如图9所示。
其中,A~B段表明:在250 s内,2.5 mol/L NaOH溶液可使乙酸乙酯完全水解;B~C段表明 :7 mL乙酸乙酯已完全水解,故装置内无乙醇蒸汽产生,在冷水浴下,三颈烧瓶内原有的少量乙醇蒸汽迅速冷凝,故浓度下降明显。对比前11组实验的曲线变化情况,可确定B~C段乙醇浓度下降明显,受75 ℃条件下水汽影响不大。
综上,笔者引导学生证明了乙酸乙酯在碱性条件下的水解是彻底的。
4. 乙酸乙酯在同浓度酸、碱条件下的水解对比
曲线分析:氢离子与氢氧根离子浓度分别为2 mol/L时,碱性溶液水解速率最大(曲线最陡),其次为酸性水解,中性最为小(如图10)。
(六)实验结论
乙酸乙酯的水解,在碱性溶液中水解速率最大,其次为酸性条件下水解,中性条件下最小;酸催化时,酸的浓度不宜过小或过大;碱催化时,碱的浓度越大,水解速率越大(见表1)。
三、实验反思与评价
(一)创新与成功之处
一是科学性强。此实验中,笔者采用乙醇传感器测定水浴加热过程中,液体上方乙醇浓度的变化以及产生乙醇的速率,所采集的数据、曲线科学直观地证明了乙酸乙酯的水解产物中有乙醇,且不同条件下乙酸乙酯水解速率不同。
二是指导性强。笔者用手持技术数字化实验替代传统的实验数据采集和处理分析方式,构建了新型实验模式。此实验验证了手持技术数字化实验在化学教学中的效果与潜力,可以有效提高学生的证据推理素养。
(二)反思
能否利用其他传感器,多角度衡量乙酸乙酯在不同酸碱环境中的水解速率?笔者尝试用pH传感器、电导率传感器依次对乙酸乙酯在不同酸碱环境的水解速率进行探究。笔者测量后发现,在酸性和中性条件下,乙酸乙酯水解10分钟,pH变化不明显,电导率受干扰因素较多导致数据不稳定。究其原因,实验采用75 ℃水浴加热,无法忽略温度对水的电离产生的影响,根据数据推出的结论不严谨。另外,有机相与无机相混合对溶液的pH和电导率测定有较大影响。
笔者查阅文献发现,使用色度传感器对酯的水解进行探究,也是值得尝试的方向。期待在后续教学探究中能多角度测定酯的水解速率。
注:本文系全国教育科学规划2021年度教育部重点课题“指向核心素养的中学化学深度学习教学评价研究”(编号:DHA210347)和广东省基础教育教研基地项目(2021—2023年)的阶段性研究成果。
参考文献
[1] 麦裕华,钱扬义.“中学化学手持技术数字化实验案例”的多维分析[J].化学教育,2020(19):83-89.
[2] 陈秋伶,钱扬义,麦裕华,等.利用手持技术数字化实验促进学生原电池概念认知[J].化学教育,2020(1):67-73.
(作者系广东省佛山市顺德区李兆基中学教师)
责任编辑:祝元志

