畜禽消化道健康定量评估五环标准之
——黏膜免疫
■杨小军 杨 欣 孔祥峰 苏 勇 曾祥芳 刘作华 王佳堃 姚军虎*
(1.西北农林科技大学动物科技学院,陕西 杨凌 712100;2.中国科学院亚热带农业生态研究所,湖南 长沙 410125;3.南京农业大学动物科技学院,江苏 南京 210095;4.中国农业大学动物科学技术学院,北京 100193;5.重庆市畜牧科学院,重庆 402460;6.浙江大学动物科学学院,浙江 杭州 310058)
消化道不仅是营养物质消化吸收的场所,也是重要的免疫器官。消化道健康标志物的研究、标准的建立对于评估畜禽机体健康尤为重要。对于畜禽而言,消化道内强有力的消化吸收、完整的物理屏障、特异性的化学屏障、稳定的微生物区系和适度的黏膜免疫可以有效地帮助宿主调控采食、营养利用、机体健康及繁殖生理,因此,以上5个方面可作为“畜禽消化道健康五环检验标准”。其中,肠道黏膜免疫主要包括分散在肠道黏膜上皮和固有层的免疫细胞(肠上皮细胞、肠上皮内淋巴细胞、固有层淋巴细胞等)、免疫分子(如各类细胞因子和分泌型免疫球蛋白等)以及肠道相关淋巴组织(派尔集合淋巴结、肠细胞淋巴结)(见图1)[1]。它们之间相互独立,又相互联系,共同维持肠道黏膜的免疫功能。
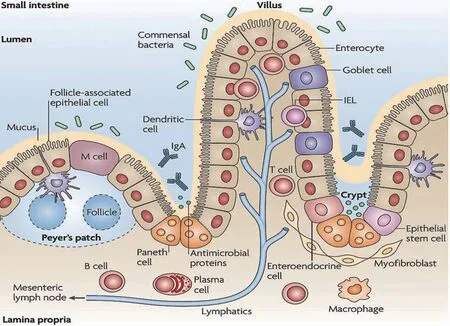
图1 肠道黏膜免疫系统的结构
由免疫细胞和肠道相关淋巴组织参与构成机体免疫防御的第一道防线,当肠道黏膜受到抗原刺激后,其黏膜内的免疫细胞和淋巴组织产生免疫应答并分泌细胞因子、免疫球蛋白,以抵御肠道内的细菌、病毒及其他有害物质的入侵[2]。其中,分泌型免疫球蛋白(secretory immunoglobulin A,sIgA)和细胞因子是目前研究最多的指标。当机体遭受侵入性微生物攻击时,sIgA 类抗体可以识别并中和黏膜上皮内的病原体、毒素等有害物质、调控肠道黏膜适应性反应,而细胞因子可以发挥调控机体固有免疫、适应性免疫、血细胞生成、细胞生长以及损伤组织修复等生理功能[3-4]。目前,大多数肠道黏膜免疫指标在人类和小鼠模型上研究得较为深入,而能否作为定量评估畜禽消化道健康的生物标记物还有待研究。文章旨在基于Meta 分析评估肠道黏膜免疫中sIgA 和细胞因子在畜禽病理状态下作为生物标记物的可行性,为畜禽消化道健康检验标准提供黏膜免疫方面的参考意见和技术指导。
1 材料与方法
1.1 文献检索
通过知网、Science Direct、PubMed、Web of Sci⁃ence等数据库,搜索从建库至2021年5月发表的研究性文献。以肠道黏膜免疫(intestinal mucosal immuni⁃ty)、肉鸡(broiler)、蛋鸡(hen)、猪(pig)、牛(cattle)、羊(sheep)相应的中英文作为检索词。
1.2 文献筛选
1.2.1 纳入标准
筛选随机对照试验设计,处理为益生或应激;肠道黏膜免疫指标含有sIgA 浓度、细胞因子表达量、免疫细胞数量,单位一致或可换算一致;数据包括“平均值±标准差(SD)或标准误(SE)”,如SD 未提供,可用公式计算。
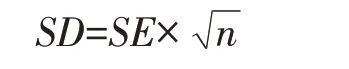
式中:n——样本量。
1.2.2 排除标准
排除会议记录、文献综述;排除未呈现数据的SD或SE的文献;排除试验方法不明确、缺乏对照组、无肠道黏膜免疫相关指标以及与同类文章差异过大的文献。
1.3 统计分析
通过RevMan 5.3软件进行数据分析,效应量为连续性变量资料,P<0.05表示差异显著。若P≥0.05,I2<50%,表明无异质性,进行固定效应模型分析;若P<0.05,I2≥50%,表明存在显著的异质性,利用随机效应模型分析异质性来源[5]。另外,漏斗图用于评估发表偏倚。
2 结果与分析
2.1 检索结果
数据库中共搜索到784篇文献,剔除数据库交叉重复文献、按照纳入和排除标准共筛选出138 篇文献,其中sIgA 44篇,肿瘤坏死因子-α(TNF-α)55篇,白细胞介素1β(IL-1β)52 篇,白细胞介素10(IL-10)46 篇,白细胞介素6(IL-6)41 篇,γ干扰素(IFN-γ)35 篇,白细胞介素4(IL-4)8 篇,白细胞介素2(IL-2)6 篇。肠道黏膜免疫其他相关指标检索到的文献不符合Meta分析的标准。
2.2 Meta分析结果
2.2.1 分泌型免疫球蛋白与肠道健康(见表1、表2)
从表1 中的效应值可以发现猪在病理状态下显著降低肠道内sIgA浓度(P<0.05),平均可降低2.89个单位;肉鸡肠道内sIgA的浓度在健康和病理状态下未发生显著变化,但肉鸡在病理状态下存在降低肠道sIgA浓度的趋势,平均可降低0.18个单位。表明动物在病理状态下,肠道sIgA浓度有明显的下降趋势。基于此,我们进一步确定了动物肠道sIgA浓度的健康范围(见表2)。
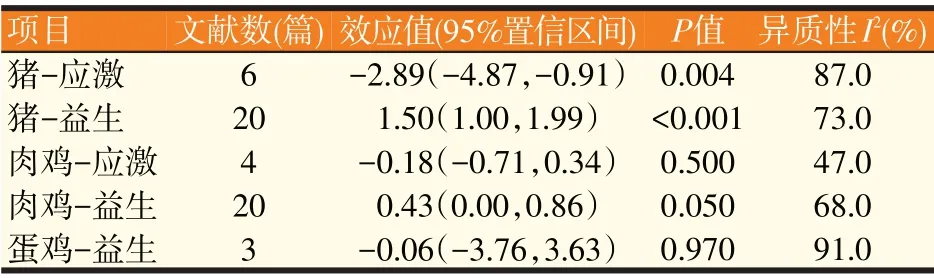
表1 sIgA的Meta分析

表2 sIgA的健康范围
2.2.2 细胞因子与肠道健康(见表3、图2~图6)
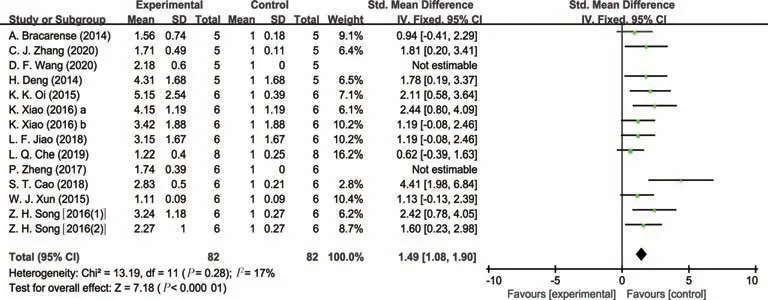
图2 猪病理状态下肠道TNF-α表达量的Meta分析
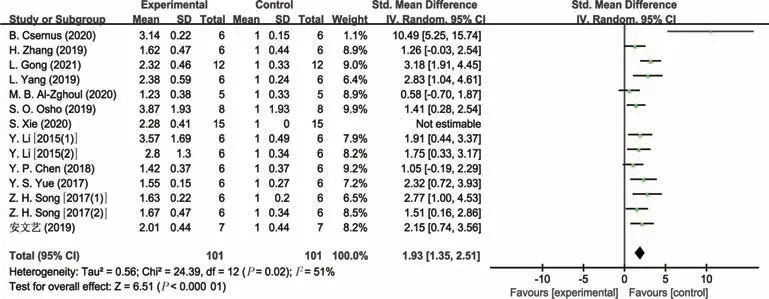
图3 肉鸡病理状态下肠道IL-1β表达量的Meta分析
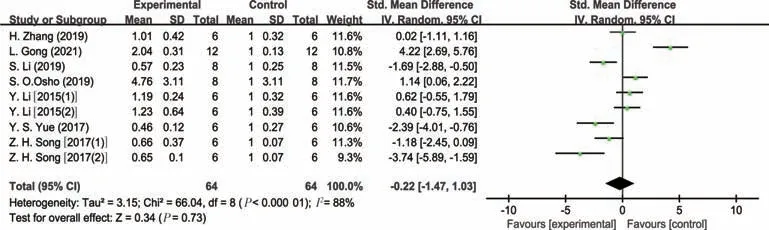
图4 肉鸡病理状态下肠道IL-10表达量的Meta分析
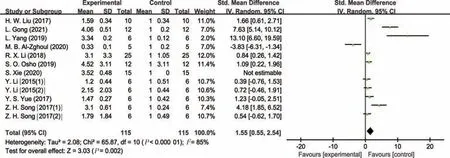
图5 肉鸡病理状态下肠道IL-6表达量的Meta分析
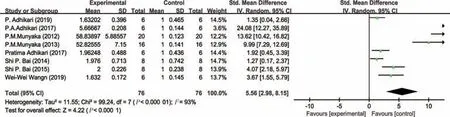
图6 蛋鸡病理状态下肠道IFN-γ表达量的Meta分析
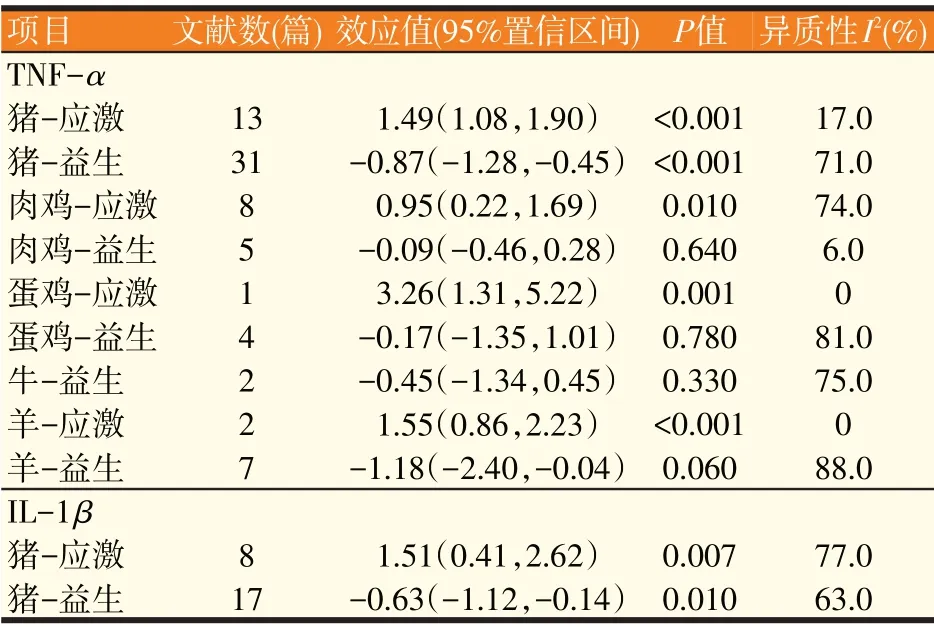
表3 细胞因子基因表达量的Meta分析
由表3可知,与对照组相比,试验组动物(益生或应激处理)肠道细胞因子的水平发生明显的变化,总体趋势是动物病理状态下促炎细胞因子TNF-α、IL-1β、IL-6、IFN-γ的水平明显增加,而抗炎因子IL-10的水平明显降低。益生组动物出现相反的趋势,其中,猪病理状态下肠道TNF-α表达量分析结果不存在研究间异质性(I2=17.0%,P=0.28),故采用固定效应模型合并效应量(见图2)。结果显示,合并效应量在无效线右侧,且不与无效线相交,表明猪病理状态下显著增加了肠道的TNF-α表达量(P<0.05),平均可增加1.49个单位。肉鸡病理状态下肠道IL-1β表达量分析结果存在研究间异质性(I2=51.0%,P=0.02),故采用随机效应模型合并效应量(见图3)。结果显示,合并效应量在无效线右侧,且不与无效线相交,表明肉鸡病理状态下显著增加了肠道IL-1β表达量(P<0.05),平均可增加1.93 个单位。肉鸡病理状态下肠道IL-10表达量分析结果同样存在研究间异质性(I2=88.0%,P<0.01),故采用随机效应模型合并效应量(见图4)。结果显示,合并效应量在无效线右侧,但与无效线相交,表明肉鸡病理状态下降低肠道IL-10 表达量(P=0.73),平均可减少0.22 个单位。肉鸡病理状态下肠道IL-6 表达量分析结果存在研究间异质性(I2=85.0%,P<0.01),故采用随机效应模型合并效应量(见图5)。结果显示,合并效应量在无效线右侧,且不与无效线相交,表明肉鸡病理状态下显著增加肠道IL-6表达量(P<0.05),平均可增加1.55个单位。另外,蛋鸡病理状态下肠道IFN-γ表达量分析结果存在研究间异质性(I2=93.0%,P<0.01),故采用随机效应模型合并效应量(见图6)。结果显示,合并效应量在无效线右侧,且不与无效线相交,表明蛋鸡病理状态下显著增加了肠道IFN-γ(P<0.05),平均可增加5.56个单位。
2.3 发表偏倚(见图7)
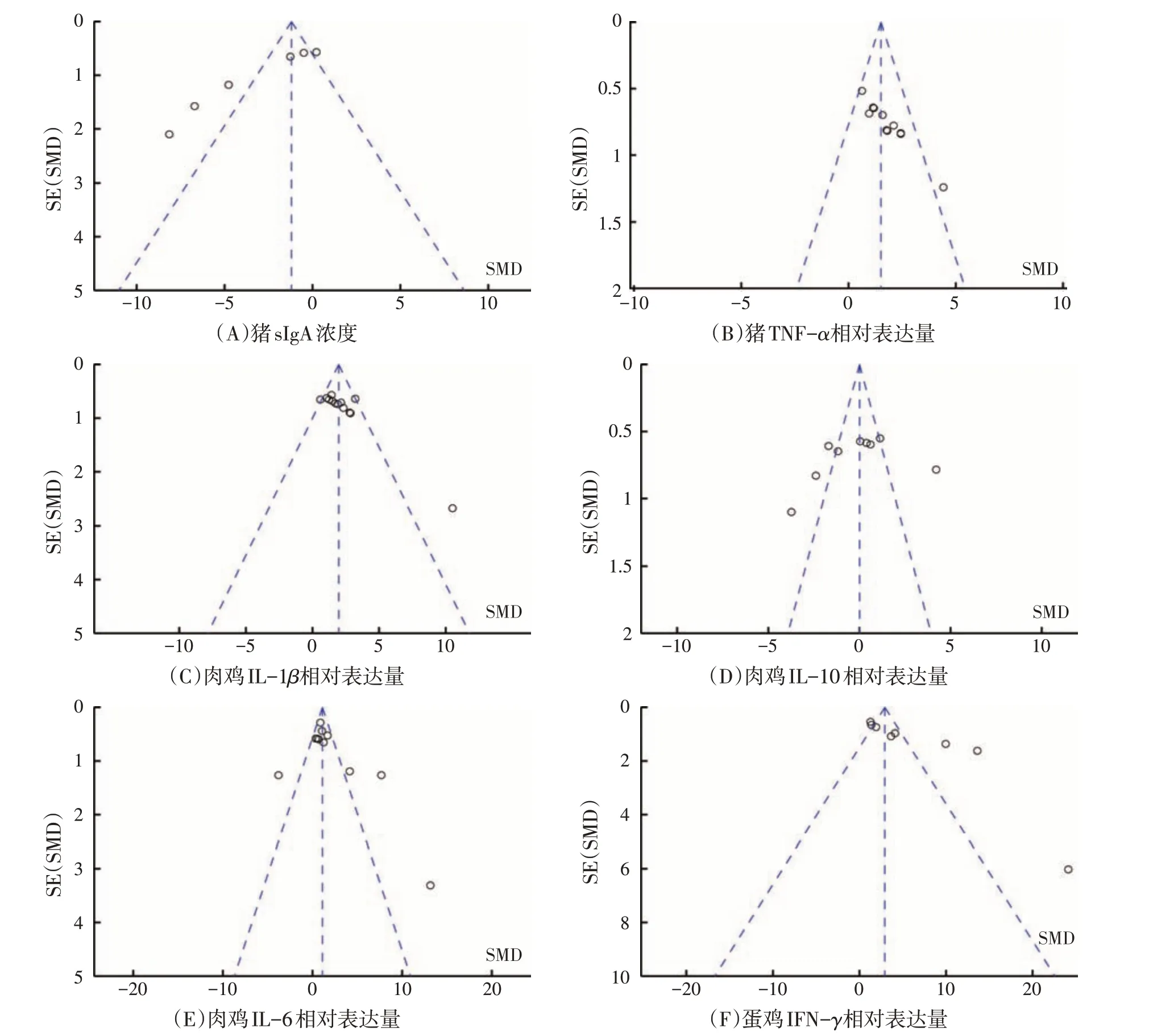
图7 畜禽病理状态下肠道黏膜免疫95%置信区间
漏斗图分析结果表明(见图7),猪病理状态下肠道TNF-α的相对表达量、肉鸡病理状态下肠道IL-1β和IL-10 的相对表达量的大部分研究均集中在漏斗图上部且向中间集中,对称性较好,仅有少量研究分布于漏斗图外,说明研究的样本量大、具有代表性,且试验精度高、数据准确。而猪病理状态下肠道sIgA浓度、肉鸡病理状态下肠道IL-6 以及蛋鸡病理状态下肠道IFN-γ的相对表达量的大部分研究集中在漏斗图的中上部,但对称性差,且有部分研究分布在漏斗图下部或外部,说明存在少量发表偏倚。
3 讨论
畜禽消化道健康在宿主行为调控、营养物质代谢调控及抵抗病原微生物等方面发挥着重要作用[6-7]。作为“畜禽消化道健康定量评估五环检验标准”之一的黏膜免疫系统是肠道接触外来抗原,最初形成免疫应答的部位,是执行局部非特异性免疫功能的场所,对于维持肠道健康起着重要作用。在目前有关肠道黏膜免疫的研究中,由于试验设计、试验对象和试验条件等多方面因素导致各个研究结果并不完全一致。汇集大量独立相关研究文献的传统文献综述(非Meta分析)可能会因为作者的主观性、研究方向、研究兴趣和认识程度的不同得出差异性结论。为了打破传统叙述性文献综述只能进行定性分析的瓶颈,Meta分析应运而生,并在基础医学、生态环境、公共卫生等多个领域得到了广泛的应用[8]。Meta分析能够系统提炼现有文献的研究数据,并对原始数据进行二次整合,从而得到大数据视角下定量的研究结论[9]。本研究通过Meta分析对不同物种(猪、牛、羊、肉鸡、蛋鸡)在不同状态下肠道黏膜免疫相关指标变化趋势的研究进行汇总,以期提供一个科学合理的肠道黏膜免疫评价体系。
3.1 分泌型免疫球蛋白与肠道健康
血浆细胞分泌的sIgA 是体内最丰富的免疫球蛋白,在肠道黏膜免疫中起着重要的作用[10]。sIgA 在肠道黏膜免疫中的作用包括免疫排斥、抗原呈递和与肠道共体相互作用[11-14],sIgA在维持肠道黏膜免疫、预防肠道感染方面发挥着至关重要的作用。从表1可以发现,猪肠道内sIgA的浓度在健康和疾病状态下存在显著差异。这与先前的研究结果一致,Huang等[15]研究发现,感染产肠毒素大肠杆菌K88 导致肠道炎症的仔猪,其肠道内sIgA 的浓度显著低于健康仔猪。同样地,产后发育迟缓仔猪肠道内sIgA的浓度也显著低于健康仔猪,并且导致肠道黏膜屏障功能恶化[16]。Zhao等[17]研究发现,sIgA具有增强肠道黏膜免疫功能的作用。表明sIgA 的浓度一定程度上可以反映肠道黏膜免疫的功能,进而反映肠道的健康状态。然而,肉鸡肠道sIgA 的Meta 分析结果未出现显著差异,但是出现了与猪Meta 分析结果同样的趋势,可能的原因是纳入Meta 分析的文章较少,不足以呈现显著差异。此外,由于牛、羊、蛋鸡关于sIgA研究的相关文献不符合本研究的纳入标准,因此对这几个物种肠道sIgA浓度未进行相应的Meta 分析。但是基于猪和肉鸡的Meta 分析结果,不难发现,动物肠道内sIgA 的浓度在其健康和疾病状态下存在明显区别。因此,建议未来在评估动物肠道健康时应该纳入黏膜sIgA这一指标。
3.2 细胞因子与肠道健康
由肠上皮细胞、淋巴细胞、巨噬细胞等肠道免疫细胞分泌的细胞因子,主要产生于天然免疫和特异性免疫的效应阶段,可介导免疫应答和炎症反应[18]。根据细胞因子的主要功能可以将其分为白细胞介素、干扰素、肿瘤坏死因子、生长因子以及趋化因子等。白细胞介素是一类能双向调节免疫系统的细胞因子家族,主要参与免疫细胞的分化和激活[19],其中的IL-2、IL-1β、IL-6属于促炎因子,IL-4和IL-10属于抗炎细胞因子;肿瘤坏死因子是一种促炎因子,主要分为TNF-α和TNF-β两种类型。在肠道黏膜内促炎因子和抗炎因子的分泌平衡是其产生正确免疫应答的关键,肠道黏膜的免疫应答主要是通过改变细胞因子的分泌来介导的,因此肠道内细胞因子的水平可反映肠道黏膜的免疫功能[20]。细胞因子的Meta 分析结果表明,动物肠道内细胞因子的水平在健康和疾病状态下存在明显的区别。这与先前的一些研究结果一致,Gong等[21]研究发现,感染产气荚膜梭菌导致坏死性肠炎的肉鸡肠道内IL-1β、IL-6 的水平显著高于健康肉鸡。感染沙门氏菌导致肠道炎症的肉鸡肠道内IL-1β、IL-6的水平同样显著高于健康肉鸡[22]。亚急性瘤胃酸中毒萨能奶山羊以及感染大肠杆菌导致肠道炎症和腹泻的仔猪肠道内细胞因子的水平与健康动物之间也存在显著差异[23-24]。因此,在评估动物肠道健康状态时,需要关注肠道内细胞因子的水平,尤其是促炎因子TNF-α、IL-1β、IL-6、IFN-γ和抗炎因子IL-10的水平。
3.3 免疫细胞与肠道健康
除sIgA和细胞因子外,肠道免疫细胞在维持肠道健康方面也发挥着重要的作用。肠道内的免疫细胞约占机体总免疫细胞的70%,其中一些可选择性接触、摄取、运输外部抗原,将抗原吞噬并转运至抗原呈递细胞从而被清除[25],还有一些可以分化为不同的效应细胞,介导分泌不同的细胞因子,产生免疫应答,修复或重塑肠道黏膜免疫屏障[26]。执行上述免疫功能的肠道免疫细胞主要包括肠上皮细胞(intestinal epi⁃thelial cell, IEC)、肠上皮淋巴细胞(intraepithelial lym⁃phocyte, IEL)、固有层内淋巴细胞以及微褶细胞等。其中,IEC 是一层排列在肠上皮层表面的细胞,主要由上皮细胞、潘氏细胞、杯状细胞以及神经内分泌细胞组成[27],可对抗原、毒素、病原体和肠道微生物形成防御[28]。其中上皮细胞在吸收和分泌免疫球蛋白方面起着重要作用。潘氏细胞分泌的颗粒中包含多种抗菌肽(如α-防御素、溶菌酶、血管生成因子4等),其在肠道病原菌的刺激下可脱颗粒释放抗菌肽至肠腔,阻止外源微生物入侵,发挥抗菌作用,同时参与肠道免疫反应[29]。杯状细胞(goblet cell, GC)在抵抗病原微生物感染、保持上皮细胞完整性以及抗原呈递和应答方面起着重要作用[30],且肠道GC 数量的变化在一定程度上可以反映肠道局部的免疫状况。
位于肠上皮细胞间及基底部的IEL 是最先接触肠腔中外病原体的免疫细胞,同时也是最先发生免疫应答的免疫细胞[31]。研究表明,大多数的IEL 含有大量具有细胞毒性活性的细胞质颗粒,他们可以表达效应细胞因子(如IFN-γ、IL-2、IL-4或IL-17等)来参与黏膜免疫应答[32]。此外,IEL 可以针对那些对自然杀伤细胞不敏感的靶细胞发挥溶解细胞活性和免疫监视功能[33],还可以诱导和维持对食物性抗原的免疫耐受,减少过敏反应。IEL 可在抵御受损上皮细胞的同时促进上皮细胞新生,维护肠道结构[34]。IEL 越多表明机体对于防御病原体和毒素的入侵能力越强,因此肠道IEL 的数量可反映肠道免疫防御功能是否完善和小肠黏膜免疫屏障的完整程度。
位于肠道上皮下方的固有层内包含着众多的免疫细胞,包括T 细胞、B 细胞、树突状细胞、巨噬细胞、粒细胞等。数量繁多的免疫细胞群,构建了肠道黏膜免疫的坚固屏障。1927年Owen等[35]学者首次使用扫描电镜观察到淋巴小结表面有一种特殊的细胞,表面没有致密的微绒毛,而是短小稀疏的皱褶,故称之为微皱褶细胞,简称为M细胞。M细胞主要存在于派尔氏淋巴结、孤立淋巴小结等黏膜相关淋巴组织上皮层。它能够捕获抗原,并将捕获的抗原传递给树突状细胞(dendritic cell,DC),而DC 进一步将抗原呈递给T细胞,介导适应性的免疫应答。故可认为M细胞是发动黏膜免疫的“起始部位”[36],肠道内M细胞的数量同样可以反映肠道黏膜的免疫功能。
综上所述,肠道免疫细胞在抵抗病原体的入侵、介导免疫反应、维持宿主肠道健康方面发挥着重要作用。
3.4 肠道相关淋巴组织与肠道健康
肠道相关淋巴组织由3 个不同的淋巴组织实体组成,包括派尔氏淋巴结(peyer patch, PP)、孤立淋巴滤泡(isolated lymphoid follicle, ILF)和肠系膜淋巴结(mesenteric lymph node, MLN),他们共同构成了机体最大的淋巴器官[37],此外禽类肠道内还存在盲肠扁桃体和法氏囊等相关免疫组织。PP是位于肠道壁上的一个凸起的淋巴组织。根据其T细胞和B细胞的分布特点,可将其划分为滤泡区、滤泡间区和上皮下圆顶区。滤泡区靠近浆膜面,主要由B 细胞组成,可以产生表面IgA,它是构成sIgA 的主要成分[38]。滤泡间区主要由T 细胞组成,占PP 内细胞数量的35%左右,此区域还分布着淋巴细胞及进出淋巴组织的通道毛细血管后微静脉,另外这个区域内也有许多B细胞和浆细胞[39]。上皮下圆顶区是指PP 表面的滤泡相关上皮和滤泡之间的区域,此区内既含有T 细胞、B 细胞,还含有一种特殊的抗原转运细胞即M细胞[40]。此外,PP内还含有各种丰富的免疫活性细胞,故被认为是机体主要免疫应答的诱导部位[41]。MLN 是一群分布在肠系膜内的大淋巴结,可作为淋巴细胞进入血液的中间站,其组织学结构也属于淋巴样组织[42]。另外,MLN是肠道相关淋巴组织的重要位置,也是免疫应答发生的重要场所,参与淋巴细胞的归巢和再循环。ILF 主要分布于肠系膜对侧的肠壁中,其结构与PP相似,有研究发现,将试验动物的PP 摘除后黏膜免疫的抗原处理过程没有被显著的影响,可能是因为ILF 中含有与PP 相似的细胞,能够完成黏膜免疫的抗原呈递[43]。此外,Fenton 等[44]研究发现,ILF 是生发中心B 细胞致敏区域,是肠道中区域化适应性免疫应答的起始区域。总而言之,肠道相关淋巴组织是肠道免疫应答重要器官,对于肠道健康的维持发挥重要作用。
3.5 本研究的局限性
在本研究中,通过Meta分析发现一些指标具有一定的异质性,异质性可能主要来源于各种动物的品种、生长阶段、饲养环境和管理技术等方面,且无法通过一个分类进行亚组分析从而降低异质性。但异质性不影响最终结果的方向和意义[45],试验结果在低异质性的情况下依然符合预期。TNF-α在猪肠道中体现的低异质性也值得关注,这表明TNF-α水平作为评估肠道健康的指标得到了多篇文献的支撑。另外,本研究也存在一定的局限性。由于不符合Meta分析的纳入标准,因此未探讨肠道相关淋巴组织和免疫细胞在动物健康和病理状态下的变化趋势。肠道相关淋巴组织和免疫细胞作为肠道黏膜免疫系统的重要组成部分,也会对最后评估动物消化道健康指标的确定产生一定的影响。
4 结论
Meta 分析结果表明,将动物肠道内sIgA 的浓度和细胞因子(TNF-α、IL-1β、IL-10、IL-6、IFN-γ)的相对表达量作为评估动物消化道健康的生物指标具有科学性和可行性。除此之外,肠道免疫细胞的数量也可以反映动物消化道的健康状态。

