左侧乳腺癌根治术后调强放疗多目标优化与直接子野优化的剂量学比较
王建刚 侯 勇 王鹏程 吕心愿
1.山东第一医科大学放射学院,山东 泰安 271016;2.山东第一医科大学第一附属医院肿瘤放疗科,山东 济南 250014;3.贵州茅台医院放射科,贵州 遵义 563000
据世界卫生组织国际癌症研究机构(international agency for research on cancer,IARC)发布的2020年全球最新癌症负担数据显示,全球乳腺癌新发病例高达226万例,超过了肺癌,成为全球第一大癌[1]。放射治疗是乳腺癌主要治疗手段之一,其中调强放射治疗(intensity-modulated radiotherapy,IMRT)能够在治疗靶区(乳腺)提供较好的剂量覆盖[2],危及器官和正常组织的受量更低[3]。而且在不影响患者的局部控制和总体生存的情况下,可降低患者正常组织受量,提升患者生活质量[4]。
目前调强放射治疗计划优化方式主要有直接子野优化(direct machine parameter optimization,DMPO)和多目标优化(multi-criteria optimization,MCO),比较两者在左侧乳腺癌根治术后的调强放射治疗计划制作中的优劣可以为以后的相关临床工作提供参考。本研究选取了54 例左侧乳腺癌术后放疗患者,分别采用DMPO和MCO优化其调强放射治疗计划,比较两种优化方式得到的靶区覆盖率、靶区 Dmax 值、靶区适形度(conformity index,CI)、靶区均匀性(homogeneity index,HI)、危及器官(organ at risks,ORAs)所受剂量等相关参数,以比较在左侧乳腺癌根治术后放疗中,MCO 优化方式与DMPO优化方式的优劣。
1 材料与方法
1.1 研究对象
自 2018 年 1 月―2020 年 11 月在山东省千佛山医院接受放射治疗的乳腺癌患者中,随机纳入54例左侧乳腺癌患者作为本研究的分析对象,TNM分期为T1 ~ T3,N0,M0,女性53 例,男性1 例,年龄 30 ~68 岁,中位年龄48 岁,其中1 例患有心脏病史。所有患者在接受放疗前均行左侧乳腺癌改良根治术。放疗范围包括胸壁、内乳及锁骨上下淋巴结引流区。
1.2 方法
1.2.1 定位 患者平躺于乳腺托架,仰卧位,左手上举置于乳腺托架壁托内,头偏向健侧,金属标记物分别放置于手术疤痕处、对侧乳腺褶皱下2 cm处、锁骨头处、体中线与两乳头交接处、腋中线与两乳头交接处、引流口处。强化扫描前经手背或肘静脉机器注射碘造影剂,扫描范围自颅顶至上腹部,层厚5 mm,层间距5 mm,像素512 × 512,120 kV,340 mA,共进行3 次扫描,分别为平扫、动脉期、静脉期和延迟期图像。将获取的平扫、增强CT 定位图像传输至varian工作站,并使用增强CT图像为指导,以便在平扫CT图像上勾画出靶区和危及器官。
1.2.2 靶区勾画 由两名资深放疗科医生共同在Eclipse15.6计划系统上勾画靶区和危及器官,勾画规则参照放射治疗肿瘤学小组(radiation therapy oncology group,RTOG)的乳腺癌放射治疗计划共识来完成,包括临床靶区(clinical target volume,CTV)、计划靶区(planning target volume,PTV)、锁骨上淋巴结区、内乳淋巴结,以及需要勾画出的危及器官心脏、肺、对侧乳腺、脊髓,其中脊髓外放5 mm(脊髓PRV)。将勾画好的靶区及危及器官传输至Eclipse15.6治疗计划系统。
1.2.3 计划设计 物理师根据临床要求制定放疗计划,在皮肤表面放置1 cm 厚的组织填充物,以PTV 的几何中心为照射野中心,根据靶区与危及器官间的位置调整照射野和旋转机架角度,尽可能避免照射危及器官。由于患者情况的不同,本研究设置了7 ~13个照射野,每个照射野由锁骨上、下野和胸壁切线野组成。根据每个患者的体型不一,准直器角度的选取会有所不同。
射野布置完成后,在治疗计划系统中采用DMPO 优化算法,计算计划,对生成的计划进行评估,若未达到临床要求,则不断修改权重因子直到满足要求。同一个患者的计划保持相同的设置条件(如照射野、照射角度、准直器角度等),在治疗计划系统中采用MCO算法优化,其权重滑动条界面如图1所示。

图1 MCO权重界面与DVH图
1.2.4 计划评估 所有的计划都以90%PTV体积达到处方剂量(50 Gy/50.4 Gy)进行归一,对MCO生成的计划与DMPO 生成的IMRT计划进行剂量学评估,具体如下:靶区:90%的PTV 体积覆盖100%的处方剂量(50 Gy/50.4 Gy),PTV 接受的最大剂量 <110%,对较难制定的计划限制可适当放宽至116%;均匀性指数:HI=D5/D95,即5%的靶区体积和95%的靶区体积所接受的照射剂量的比率,式中D5是指靶区体积的5%接受到的照射剂量,D95是指95%的靶区体积所接受的照射剂量。HI 越接近0,说明靶区得到的剂量分布越均匀;适形指数:CI=TVRI/VRI,式中TVRI表示处方等剂量面包绕的靶区体积,VRI表示靶区体积,CI的范围是0 ~1之间,越接近1,其适形度就越好。参照《肿瘤放射治疗学》第4版的剂量学评价标准,对所涉及的危及器官限制如下:(1)患侧肺 V5 < 60%,V20 < 28%,V30 < 20%,Dmean <1500 cGy;(2)心脏:V30 < 10%,V40 < 5%,Dmean <800 cGy;(3)对侧乳腺:Dmean < 150 cGy,Dmax < 5 Gy;(4)脊髓 PRVDmax < 4500 cGy,其中 Vx 表示接受≥xGy 的照射体积占总体积的百分比;DX 表示x%的体积对应的剂量。
1.3 统计学方法
采用SPSS 22.0 软件进行统计学分析,所有数据均表示为均数 ± 标准差(),采用配对样本t检验的分析方法,比较两组优化方法得出的剂量学参数的差异。检验水准α=0.05。
2 结 果
2.1 靶区剂量分布
靶区 PTV MCO-IMRT 和 DMPO-IMRT 计划的剂量参数见表1。MCO-IMRT 组计划的Dmax、Dmean 参数比 DMPO-IMRT 组下降了约 78.6、26.6 cGy(t= 11.817,P< 0.001;t= 6.407,P<0.001)。MCO-IMRT 组计划的D5、Dmin 参数要比DMPO-IMRT 组计划略低1.0%、4.5%(t= 7.662;t= 3.546,P< 0.05),MCO-IMRT 组计划的 D95 参数要比DMPO-IMRT 组计划略高0.2%(t=-2.441,P= 0.018),说明MCO-IMRT 组靶区内的冷点比DMPO-IMRT 组的冷点略多。MCO-IMRT组 CI 和 HI 均优于 DMPO-IMRT(t= 4.562;t=6.196,P< 0.001),MCO-IMRT 组计划的PTV95%的处方覆盖率与DMPO-IMRT 组计划的相当(P>0.05),差异没有统计学意义。图2 为MCO 和DMPO 优化在靶区横断面、冠状面、矢状面的剂量分布。
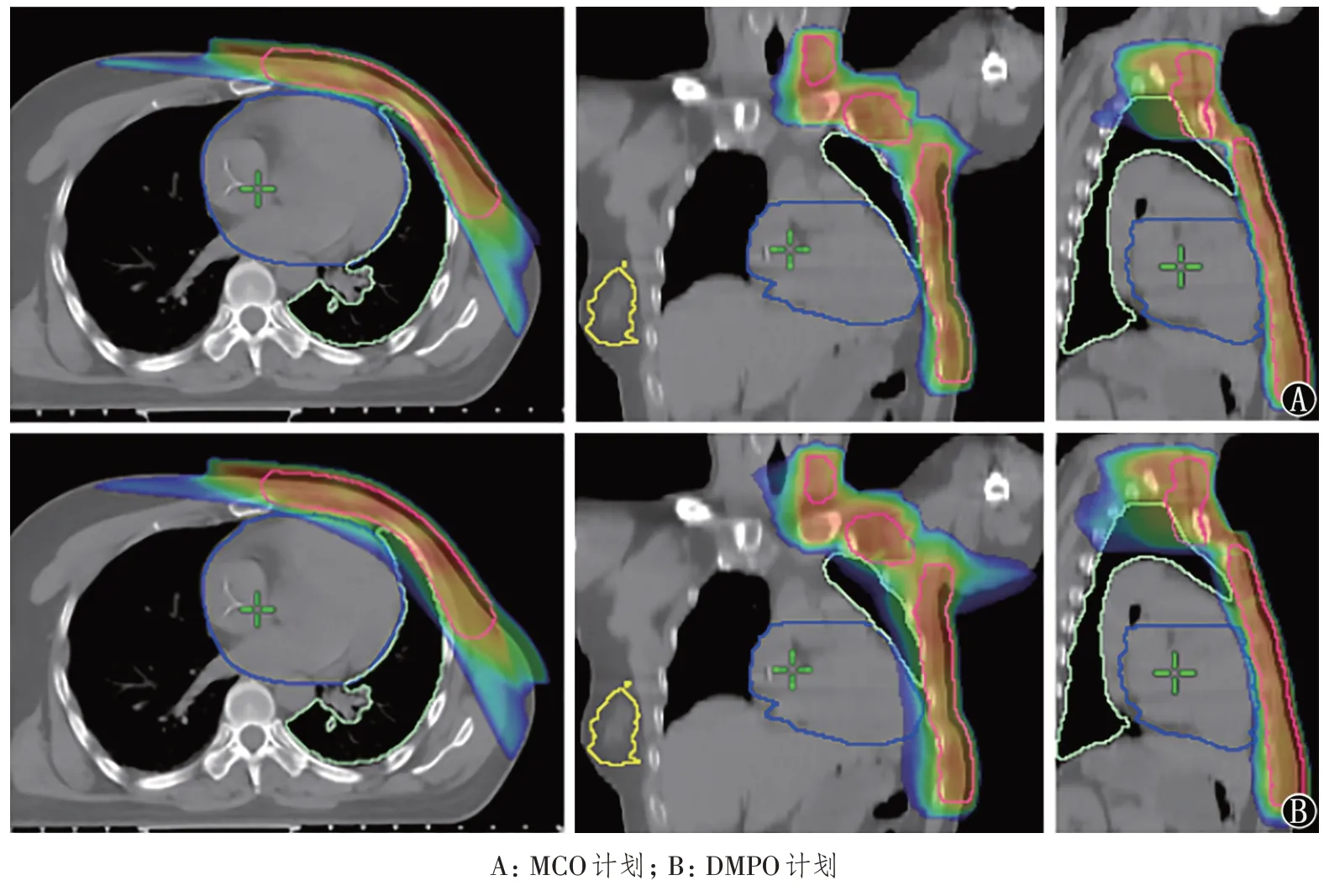
图2 同一患者MCO与DMPO横断面、冠状面、矢状面的剂量分布

表1 PTV的剂量参数
2.2 危及器官剂量分布
所有患者的MCO和DMPO计划均能满足临床需求,但MCO-IMRT计划组明显优于DMPO-IMRT计划组。结果显示,MCO-IMRT组整体比DMPO-IMRT组的剂量低。MCO-IMRT 组患侧肺的V5、V20、V30参数分别比DMPO-IMRT 组计划降低约3.1%、6.8%、4.2%,差异有统计学意义(t=9.428;t=10.529;t=6.826,P< 0.05)。患侧肺、对侧肺及双肺的Dmean参数上MCO-IMRT 组分别比DMPO-IMRT 组降低约51.6、5.8、26.7 cGy(P< 0.05)。MCO-IMRT组心脏的 V30、V40 参数分别比 DMPO-IMRT 组降低约16.4%、12.6%(t= 5.433;t= 2.291,P< 0.05),MCO-IMRT组心脏的Dmean参数、对侧乳腺的Dmax、Dmean 参数分别比 DMPO 组下降了约 49.7、110.5、42.6 cGy(t= 6.817;t= 2.440;t= 6.169,P<0.05)。而在脊髓和脊髓PRV 最大剂量上,MCOIMRT组计划均低于DMPO-IMRT组计划,分别降低了约 167.1、150.7 cGy(t= 4.912;t= 3.318,P<0.05)。以上数据均表明在符合临床要求的前提下,MCO-IMRT优化方法更能降低放射性并发症发生的风险。然而,MCO-IMRT 组计划的 MU 为 1 527.37±294.144,DMPO-IMRT 组计划的 MU 为 1 452.54 ±296.334,MCO 组比DMPO 组高出约 74.8 MU(t=-5.835,P< 0.05)。详见表2。

表2 危及器官的剂量学参数
2.3 剂量体积直方图比较
选取1 例患者的剂量直方图进行比较(图3)。从DVH 图上可以看出,相比于DMPOIMRT 算 法 ,MCO-IMRT 优 化 方 法 的 PTV 更 陡峭,高剂量区跌落更快,并且Dmax 更低。同时危及器官的受量均明显低于DMPO-IMRT 算法,更好的保护了心脏和肺以及对侧乳腺和脊髓组织。

图3 MCO与DMPO剂量体积直方图比较
3 讨 论
3.1 乳腺癌术后调强放疗计划优化的意义
放射治疗是乳腺癌治疗的重要手段。乳腺癌根治术后放射治疗靶区分布范围大,靶区沿体廓起伏较大,胸壁、腋下淋巴、胸壁淋巴深度不一,这些因素都能影响靶区的剂量均匀性,对乳腺癌放疗计划的优化具有一定挑战性。而且随着乳腺癌患者存活时间的延长,放射治疗的晚期副作用会影响患者的生活质量[5-6]。研究乳腺癌术后放疗剂量优化方案对提高放疗效果具有重要临床意义。
3.2 调强放疗的两种计划优化方式
目前调强放疗的优化通常采用DMPO 方式,即使用所有目标和约束的加权和来创建一个新目标。DMPO算法是在调强放射治疗的“两步优化”法基础上发展而来,即直接优化子野形状和权重得到理想的剂量分布[7]。使用DMPO进行优化的结果在很大程度上取决于每个目标的权重,且不能呈现出动态的交互过程。具体地说,一个目标的权重越大,在优化过程中就越受关注,从而使其在最终剂量分布中得到优先满足。但是,调强放射治疗本质上是一个多目标问题,多个目标相互冲突。这导致使用试错法探索权重设置难以快速取得令人满意的效果[8-9]。并且在这一优化过程中,需要依据剂量师的临床经验,增加了放疗计划结果的不确定性。
MCO 算法很好地解决了DMPO 存在的问题。MCO 在放疗中的应用最早由麻省总院的Halabi等[10]提出。MCO 优化技术基于 Pareto 表面,能够寻找到目标函数中各个目标分量的Pareto 优化解,所有Pareto 优化解组合到一起构成Pareto 优化解集[11],是一种可以有效权衡不同治疗计划目标的方法。其优势在于可以最大限度地对靶区或危及器官的权重进行调节,这使得放疗工作者在面对靶区和危及器官难以协调的矛盾时,可以根据个体化的剂量目标选择最适合的方案,更加直观和高效地实现对剂量分布的优化,帮助物理师和医师直观理解各个计划目标之间的相互联系,同时避免了反复的试-错-试过程,给物理师节省了大量的时间,同时还能够动态观察到最合适的目标函数权重。
3.3 MCO在乳腺癌术后放疗的优势
临床试验表明,乳腺癌放疗会诱发心血管疾病,且接受左乳房放射治疗的患者心血管死亡率更高[12-13],即使心脏受到较低剂量的辐射,也可能导致相关的心脏损伤[14-15]。相比于 DMPO-IMRT 计划,MCO-IMRT 计划能够较大程度降低心脏照射剂量,降低放射性心脏病的发生率。放射性肺炎和肺纤维化是乳腺癌放疗放射性肺损伤的重要并发症[16-17],乳腺癌术后放疗可能会增加患者罹患肺癌的风险[18]。放射性肺损伤与三维剂量分布显著相关[19],减少乳腺癌放射性肺损伤的最好办法就是在保证不降低治疗效果的前体下,尽可能地减少肺部照射的体积与剂量[20-21]。虽然DMPO-IMRT和MCO-IMRT 计划中肺的辐射剂量均满足临床需求,但MCO-IMRT极大降低肺的V5、V20、V30和Dmean,更好地保护肺组织。此外,在乳腺癌术后放射治疗中,健侧乳腺受到的剂量照射可能会导致健侧乳腺癌的发生[22],相比于 DMPO-IMRT 计划,MCO-IMRT 计划显著降低对侧乳腺的受量,降低诱发继发性乳腺癌的风险。总之,与 DMPO-IMRT 相比,MCO-IMRT 计划能够最大程度地降低心脏、肺、对侧乳腺等危及器官的辐照剂量,降低放射并发症的发生率。
本研究表明,(1)MCO 算法可降低靶区的最大剂量,能更好的保护周围正常组织和危及器官;(2)实时更新剂量分布,帮助剂量师和医生直观理解如何权衡各个计划目标;(3)避免了费时的试错过程;(4)动态研判最合适的目标函数权重。其不足之处在于:(1)MCO 计划依赖于最初导入的计划质量;(2)生成计划集所需的时间与所勾选的目标有关,目标越多,生成时间越长,如使用GPU,极大缩短生成计划时间,开展本研究时GPU 未激活,花费时间相对较长;(3)本研究没有附挂上相关临床协议,临床协议能实时显示目标状态,提示相应的计划表现。总之,MCO优化方式在乳腺癌术后调强放射治疗中能降低靶区的最大剂量以及危及器官所受剂量,进而降低并发症的发生率,避免了物理师反复试错的过程,可提高工作效率。
利益冲突所有作者均声明不存在利益冲突