超声IOTA ADNEX模型对卵巢附件肿块诊断准确性的系统评价和Meta分析
张艺馨 赵玉立 王 森 封 丽
1. 山东第一医科大学(山东省医学科学院),山东 济南 250000;2. 山东第一医科大学第一附属医院(山东省千佛山医院)超声医学科,山东省医药卫生腹部医学影像学重点实验室,山东 济南 250014
附件肿块(adnexal mass,AM)是女性生殖系统常见疾病之一,虽多数为良性,但严重威胁着女性的身心健康。其中卵巢癌由于临床症状隐匿,75%的患者发现时多为晚期,5 年生存率低[1]。良性附件肿块可保守治疗或切除,而恶性附件肿块则需行根治性细胞减灭术[2]。因此,对于附件肿块的早期评估变得尤为重要。超声通常是评估AM的一线影像学检查方法[3]。根据超声检查,AM 可以分为3类:良性、交界性和恶性[4]。然而,约20%的AM即使经过彩色多普勒评估,仍无法确定肿块性质或起源部位[5]。
为了提高卵巢AM 诊断的准确性,国际卵巢肿瘤分析组织(international ovarian tumor analysis,IOTA)新提出了一种附件模型(ADNEX),用于评估超声检查中不确定的AM,该模型包括6个超声特征和3 个临床特征[6]。尽管已有研究表明IOTA ADNEX 模型对卵巢恶性肿瘤的诊断具有良好的敏感性和特异性,但这些研究存在样本量小、研究对象招募标准不相同等局限性,且大部分研究数据都来自单中心,可能会引入偏差。因此,本次研究运用系统评价和Meta 分析的方法,对IOTA ADNEX 模型在卵巢附件肿块中的诊断价值进行评价。
1 资料与方法
1.1 检索策略
在 Pubmed、Embase、Web of Science、Clinical Trials、中国知网和万方数据库中检索相关文献,检索日期截止至2021年8月15日,检索语言限定为中文及英文。中文检索词包括超声、ADNEX、卵巢;英文的检索词包括:ultrasonography、ovarian cancer 、adnexal mass、ADNEX model,并辅助相关文献追溯和手工检索的方式。
1.2 纳入与排除标准
纳入标准:①所有关于IOTA ADNEX 模型诊断卵巢附件肿块准确性的研究;②数据完整;③研究包含真阳性、假阳性、真阴性和假阴性值;④研究包含截断值(cut-off);⑤语言限制为中文和英文。排除标准:①综述、信件、病例报道、会议摘要;②硕博士毕业论文;③研究数据缺失;④重复报道。
根据纳入与排除标准选择符合条件的研究,剔除不合条件的文献。首先在标题和摘要的基础上进行筛选,初步符合条件的研究进行全文分析进一步审查。若遇分歧则与上级医师共同讨论解决。
1.3 数据提取
本研究最终从符合条件的原始研究中提取相关数据包括第一作者、发表年份、国家、研究时间等基本信息,截断值、敏感度和特异度等,有文献报道截断值为10%时IOTA ADNEX 模型的诊断效能最好[7]。因此在所有研究中,本研究提取了截断值在10%时所对应的敏感性和特异性的数值进行统计分析,并将数据转换为四格表,即真阳性(TP)、假阳性(FP)、真阴性(TN)、假阴性(FN)。
1.4 纳入研究的方法质量学评估
使用Revman 5.4 软件进行研究的方法质量学评估。两位作者使用诊断准确性研究的质量评估工 具 QUADAS-2(quality assessment of diagnostic accuracy studies-2)对纳入研究的方法质量进行评估[8]。QUADAS-2 工具包含 14 个条目,根据每部分纳入的相关标志性问题可以评定为“是”、“否”和“不清楚”,对应地可将偏倚风险判定为“低”、“高”和“不清楚”。
1.5 统计学方法
本研究采用Stata 16.0及Revman 5.4.1软件进行数据分析。
1.5.1 联合分析诊断准确性 采用Stata 16.0 软件对数据进行联合分析,计算联合敏感性、特异性、PLR、NLR、曲线下面积和诊断优势比,绘制相关森林图和SROC 曲线,并通过曲线下的汇总面积(sAUC)评估ADNEX模型的诊断效果。
1.5.2 异质性检验 诊断性实验中存在阈值效应,并且可能是研究的异质性来源。通过Meta-Disc软件计算Spearman相关系数对阈值效应进行评价。利用Midas命令分析异质性并计算I2,其中P<0.10或I2>50%时认为研究中存在显著异质性。
1.5.3 敏感性分析 剔除个别质量低的研究后进行敏感性分析,结果与总体进行对比,以探讨研究结果的稳定性。
1.5.4 Meta回归分析 由于异质性显著,为进一步分析异质性的来源,根据以下因素进行回归分析:(1)年龄;(2)研究类型为前瞻性或回顾性;(3)研究背景是否为三级肿瘤转诊中心;(4)是否详细描述待评价试验;(5)是否详细描述金标准;(6)是否详细描述待评价人群;(7)患病率。
1.5.5 偏倚风险评估 通过Deek′s 漏斗图(Deek funnel plot)评估14 项研究的发表偏倚,当P> 0.05时认为差异不存在统计学意义,即无明显的发表性偏倚。
2 结 果
2.1 文献检索和纳入文献基本特征
通过数据库检索,文献追溯及辅助人工检索,共得到文献180篇,删除重复文献,进行标题和摘要筛选,并排除综述、个案报道、学术会议摘要、硕博士论文及数据不完整的文献,最终纳入文献14 篇。文献检索流程见图1。
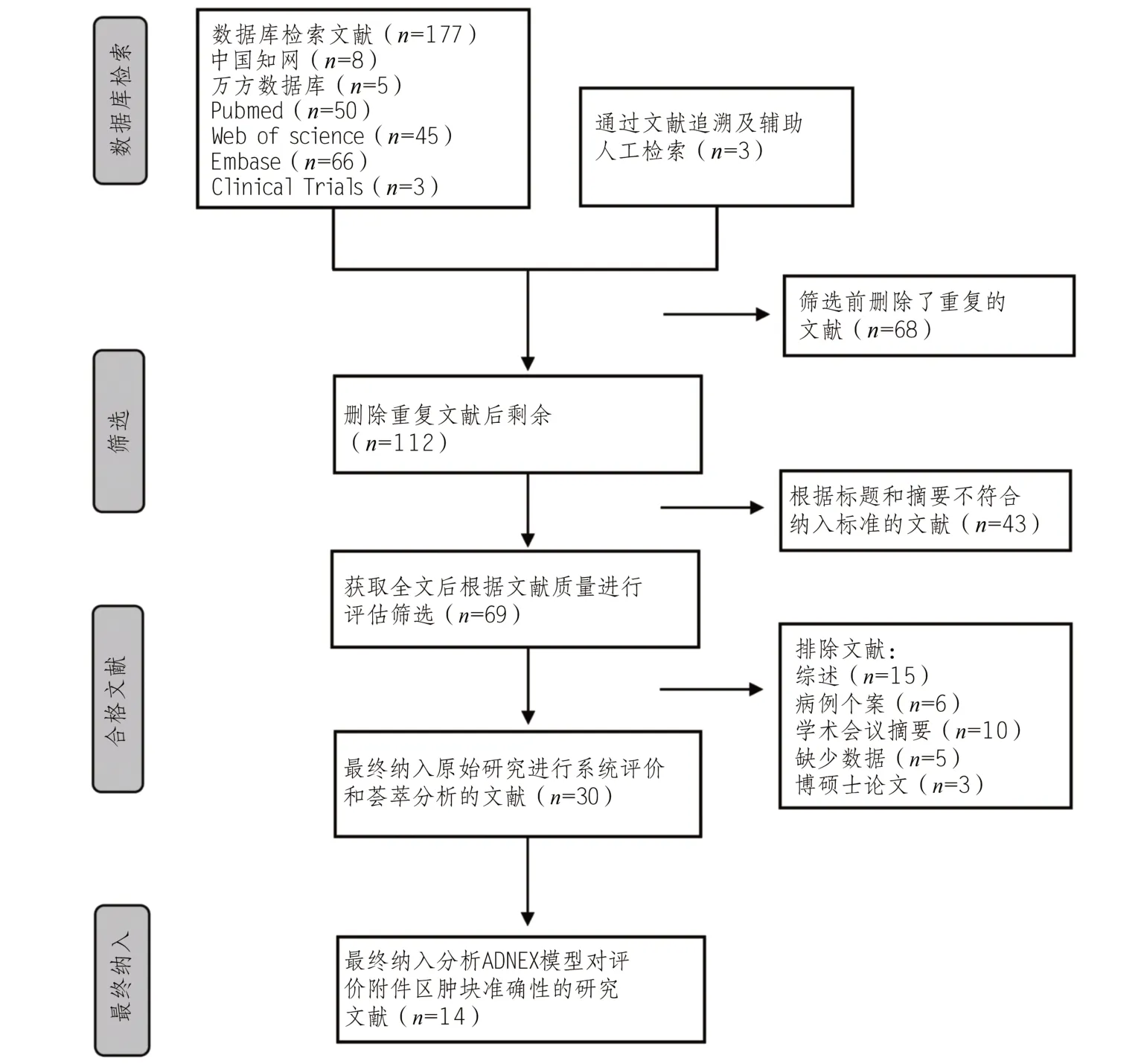
图1 文献筛选流程图
本研究共纳入了14 篇文献,均使用IOTA ADNEX系统进行评分。其中2篇[9-10]文献联合使用了 SR 评分系统,1 篇[11]联合使用了 SA 评分系统,3 篇[12-14]同时联合使用了 SR 及SA 评分系统,另有 1篇文献[15]联合使用了SR、LR2、RMI 评分系统进行评分。14 个研究分别来自英国[7,16]、波兰[14,17]、巴西[18]、哥伦比亚[10]、荷兰[15]、中国[13,19]、泰国[20]、意大利[12]、韩国[11]、比利 时[9]和法 国[21]。对 于 IOTA ADNEX 评分系统,本次荟萃分析中所包含的研究均在三级综合医院的妇科、超声科或肿瘤中心进行。纳入文献的基本特征见表1。
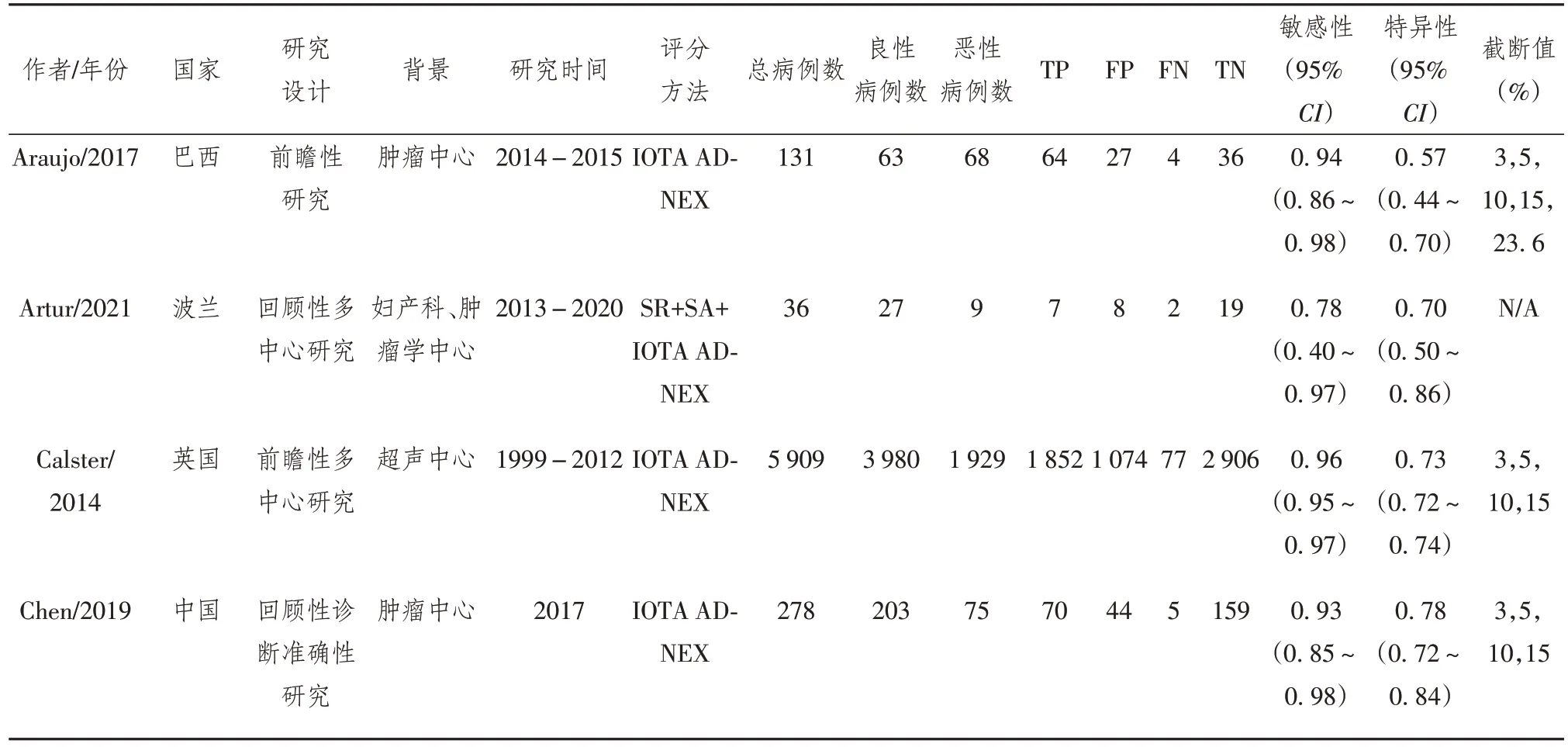
表1 纳入研究文献的基本特征
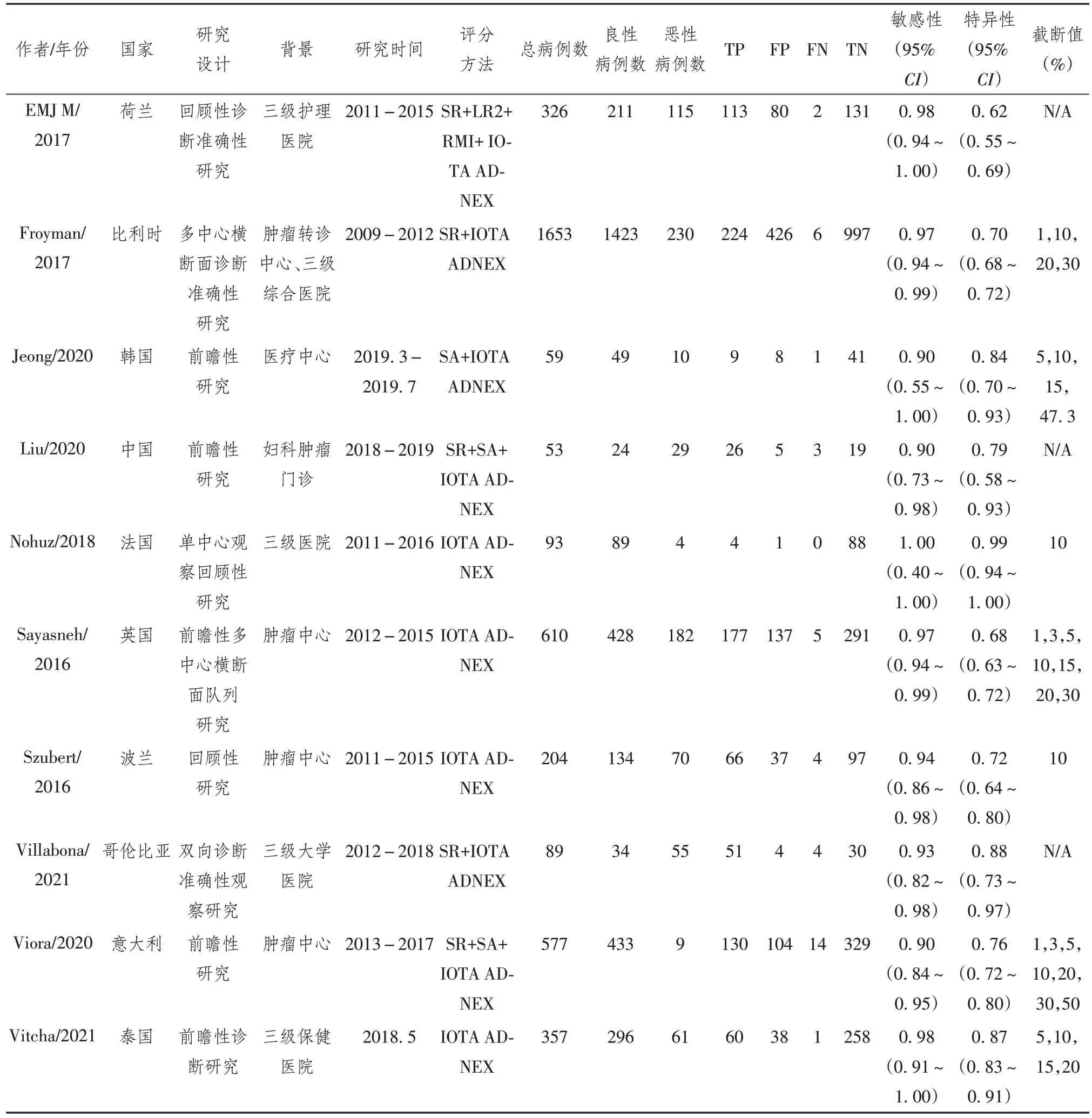
续表
2.2 方法学质量评估
使用QUADAS-2 评估纳入研究的方法学质量,结果如图2、3所示。在全部纳入的14项研究中,有1 项[9]高偏倚风险研究和 4 项[7,12,17,21]适用性评价的高风险偏倚。在风险偏倚研究和临床适用性评价中,有1项[19]研究被列为不确定的风险研究。
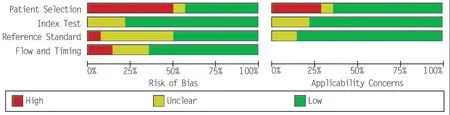
图2 QUADAS-2文献质量评价
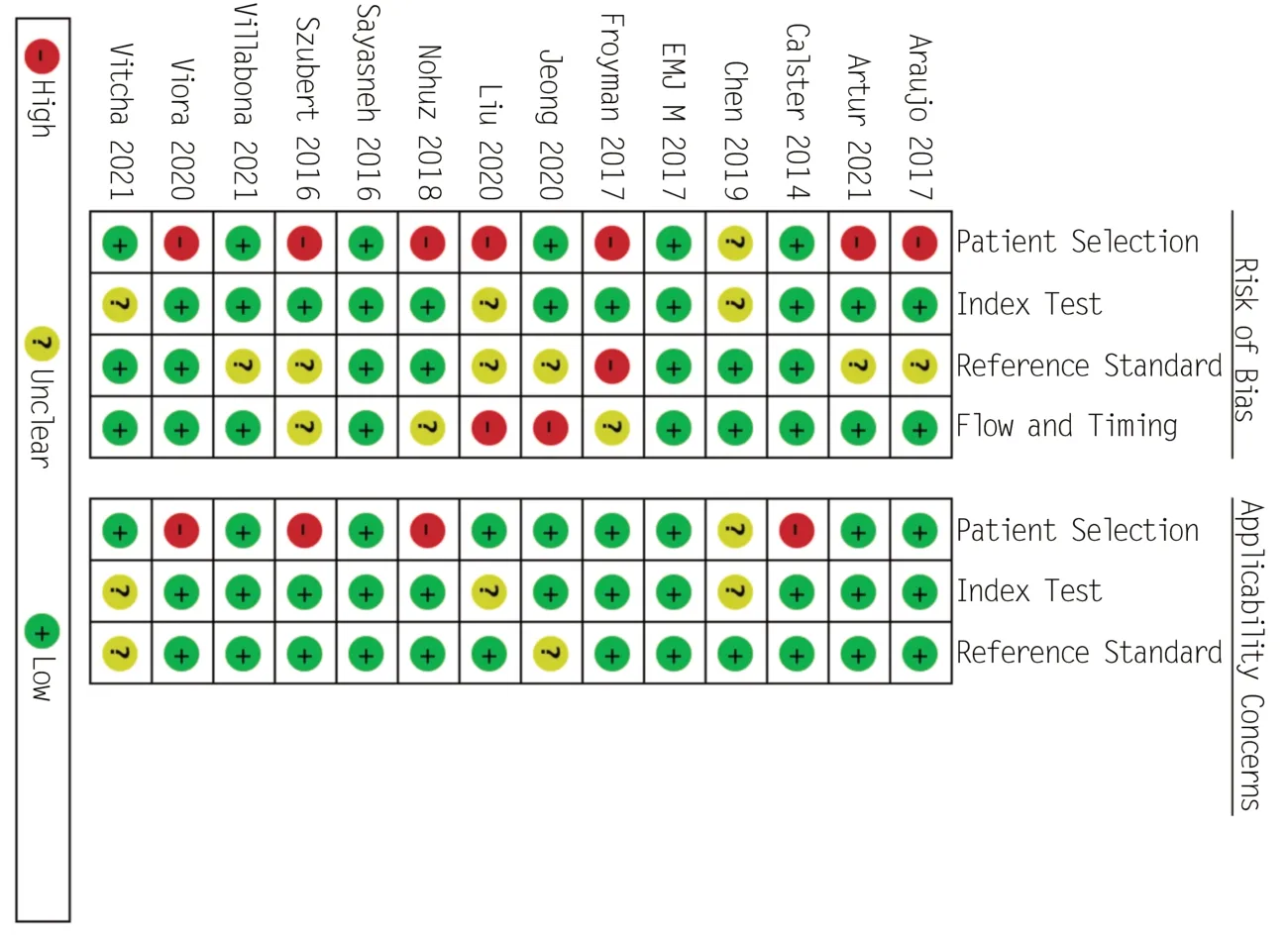
图3 QUADAS-2文献质量评价
2.3 合并分析
本研究最终合并敏感性、合并特异性结果分别是 0.95(95%CI:0.93 ~ 0.96)、0.78(95%CI:0.71 ~ 0.84),合并阳性预测值结果为 4.3(95%CI:3.2 ~ 5.8),阴性预测值结果为0.06(95%CI:0.05 ~ 0.09)。诊断优势比(diagnostic odds ratio,DOR)的值为 67.0(95%CI:44.0 ~ 101.0),表明ADNEX 模型可以显著增加诊断卵巢附件肿块为恶性的可能性。SROC 曲线下面积为0.96(95%CI:0.94 ~0.97)。本研究中,似然比和测试后概率都是中等的,假设测试前概率为20%,测试后阳性结果可能性增加至52%,负似然比为0.06 时测试后概率降低到2%。研究结果见图4 ~6。
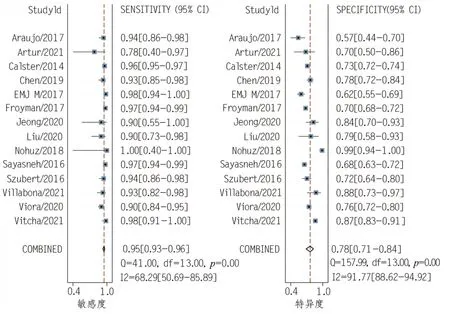
图4 合并敏感性和特异性森林图

图5 IOTA ADNEX附件系统预测卵巢癌的SROC曲线
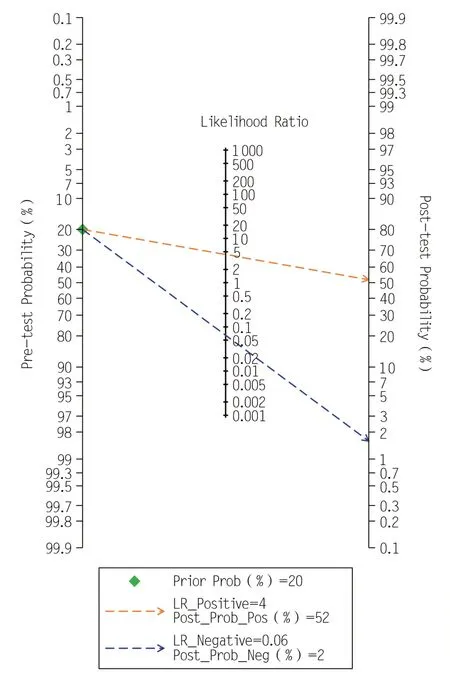
图6 Fagan列线图
2.4 异质性检验
合并敏感性异质性结果为I2=68.3%(95%CI:50.7 ~ 85.9),P< 0.01;合并特异性异质性的结果为I2=91.8%(95%CI:88.6 ~ 94.9),P< 0.01。表明存在较大的异质性,进一步通过Meta回归探索异质性可能的来源。
2.5 Meta回归分析
将年龄、研究类型(前瞻性或回顾性)、研究背景(是否为肿瘤转诊中心)、待评价试验(是否详细)、金标准(是否详细)、待评价人群(是否详细)、患病率等影响因素纳入回归分析,以探讨异质性的来源。研究发现,研究类型、研究背景及待评价人群等因素的差异具有统计学意义(P<0.05)(图7、表2),可能是本研究的异质性来源。

表2 Meta回归分析
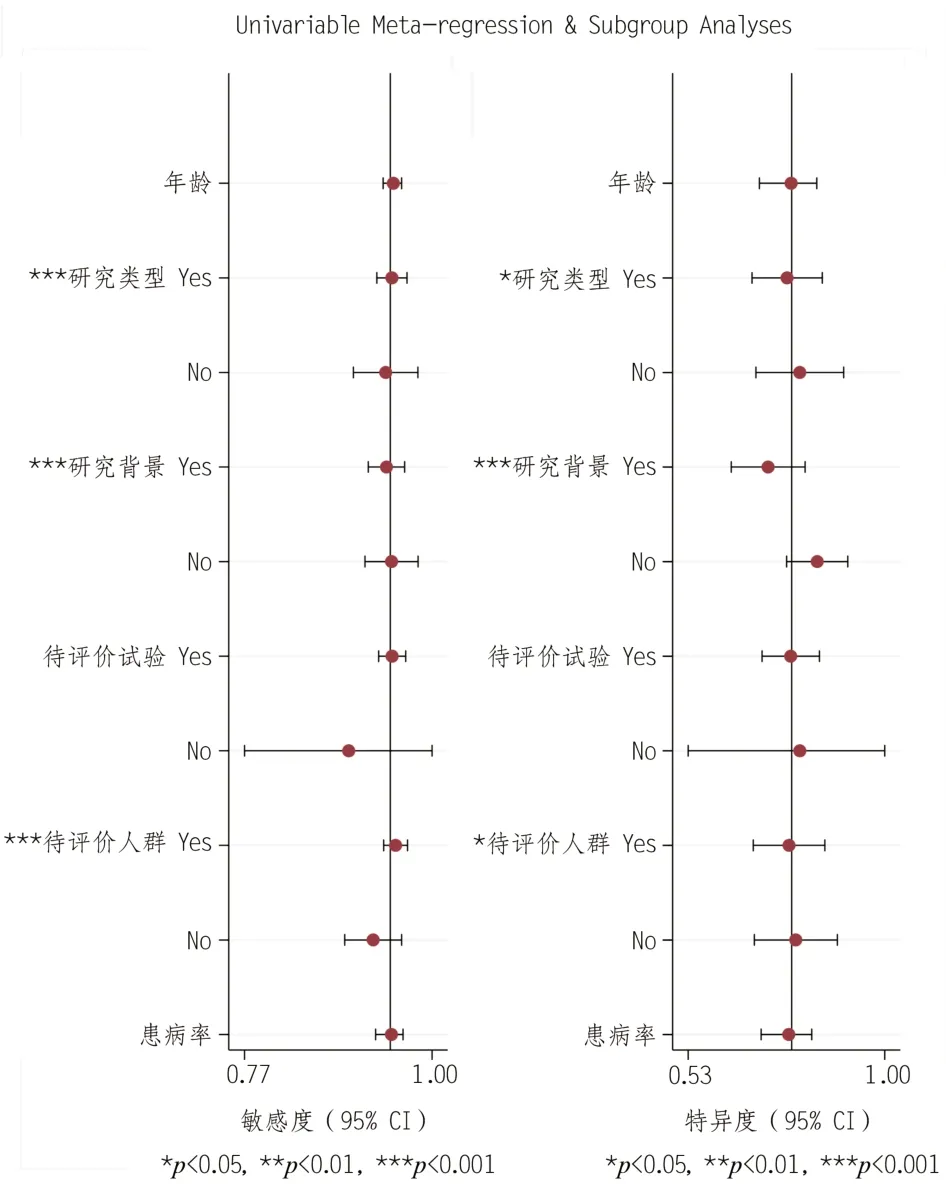
图7 Meta回归分析森林图
2.6 敏感性分析与发表偏倚
逐一剔除质量较低的研究后进行敏感性分析,结果显示敏感度及特异度相比总体没有明显变化,说明结果的稳定性较好,可信度较高。详见图8。Deek漏斗图结果显示,纳入的研究不存在发表偏倚(P=0.90),见图9。

图8 敏感性分析
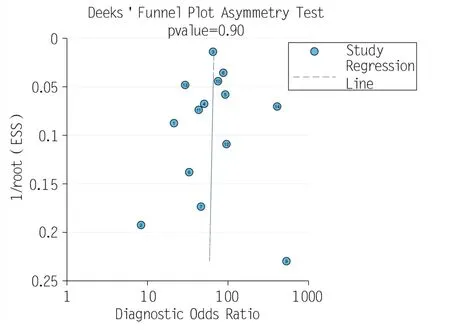
图9 Deeks’漏斗图
3 讨 论
本研究表明,IOTA ADNEX 模型对AM 良恶性诊断的准确性具有较高的联合敏感性0.95(95%CI:0.93 ~ 0.96),但联合特异性较低 0.78(95%CI:0.71 ~0.84)。较高的联合敏感性意味着可以诊断更多可疑患者,有助于帮助患者及时进一步治疗从而提高患者预后。PLR、NLR、DOR 和AUC 分别为 4.3(95%CI:3.2 ~ 5.8)、0.06(95%CI:0.05~ 0.09)、67.0(95%CI:44.0 ~ 101.0)和0.96(95%CI:0.94 ~ 0.97)。有研究表明当 PLR > 10 和NLR <0.1时意味着准确率高[22]。但在本次研究中PLR 值并不能得出模型有较高准确率的结论。此外,ROC 曲线下面积也表明模型有较高的诊断价值。因此,以上结果验证了ADNEX 模型诊断卵巢附件肿块良好的性能。
目前,为了提高卵巢癌诊断的准确性,有很多预测模型和评分系统。其中应用最广泛的是恶性肿瘤风险指数(RMI)。其中RMI I 具有最高的准确性[23]。在最近的一次荟萃分析中,ADNEX 模型的DOR 值为 33.0[24],而在本分析 中,DOR 的值为67.0,因此本研究认为IOTA ADNEX 模型的效果优于RMI。Meys 等[15]验证了4 种常用模型(SR、LR2、RMI 和ADNEX)的诊断准确性,结果同样表明ADNEX 模型的效果较好。虽然IOTA ADNEX 模型具有良好的诊断效能,但不少研究表明有无CA125对模型诊断没有显著影响[16,19-20]。同时有研究认为超声医师的主观判断对模型的准确性也存在一定影响,首次提出了不受主观影响的新的决策支持系统(decision support system,DSS),但未被广泛证实有效性[25]。因此,未来研究中是否需要进一步优化ADNEX 模型或联合新模型的使用来进一步提高卵巢附件肿块诊断的准确性值得进一步研究。
本研究存在几项局限性。首先,虽然在最初的研究中表明,截断值为10%时模型具有较好的诊断效能,但最近的一些研究表明,ADNEX 模型在截断值为15%时的性能优于10%[20,26]。也有研究表明,截断值是灵活的,取决于不同国家的医疗系统和患者的临床特征[6]。但在本研究中,均使用了截断值为10%时的数据进行后续分析。其次,联合敏感度和特异度的I2均大于50%,提示数据存在异质性。在Meta回归分析中显示患者的研究类型、研究背景及待评价人群均可能导致数据异质性。因此,在后续研究中,为了使得IOTA ADNEX 模型诊断准确性的分析更精确,建议基于多个截断值提取数据进行综合分析,并尽量避免导致数据异质性的各个因素。
综上所述,IOTA ADNEX 模型在识别卵巢附件肿块的风险方面具有较高的诊断准确性,应该被更广泛使用,从而提高患者的早期诊断率。同时,对于不同截断值模型的诊断准确性和该模型的进一步优化值得探索。
利益冲突所有作者均声明不存在利益冲突