航天用微流式细胞术研究进展
彭梦颖, 冯慧成, 常洪龙, 寻文鹏
(1. 西北工业大学机电学院, 西安 710072; 2.西北工业大学无人系统技术研究院, 西安 710072;3. 深圳迈瑞生物医疗电子股份有限公司, 深圳 518055)
1 引言
流式细胞术是一种对高速流动的细胞进行单细胞、多参数分析的技术,广泛应用于免疫学、血液学、肿瘤学、细胞生物学、细胞遗传学等领域,可以在短时间内完成对不同种类细胞的分类计数。流式细胞术的一般步骤是先对样本进行预处理,对不同目标细胞进行特异标记;然后将细胞样本流聚焦,使得细胞成单列依次通过检测区域,通过荧光检测或者电阻抗检测等方式对样本细胞进行识别与分类计数。
传统的流式细胞仪通常带有庞大的鞘流聚焦系统,其荧光检测系统也需要复杂的光学组件,对光路对准等技术要求严格,难以适用于大型实验室之外的场合。 微流控芯片技术是一种使用微型管道对微小流体系统进行处理或操纵的技术,具有集成化、微型化的特征,为流式细胞仪开拓了一种新的发展方向。 二者的结合为流式细胞仪的低成本化、全自动化、小型便携化发展提供了可能。
本文首先对微流控芯片与流式细胞术的结合-微流式细胞术的国内外研究进展总结与回顾。 综述微流式细胞术的步骤,预处理、细胞聚焦、细胞检测技术的国内外发展现状;阐述微流式细胞术在临床诊断中的广泛应用,以及航天医学检测对微流式细胞术的应用需求。 其次,介绍了应用于载人航天的微流式细胞仪。 该设备解决了样本预处理、细胞聚焦以及细胞检测系统在航天环境中面临的众多难题,通过了微重力实验验证。
2 微流式细胞术的研究进展
2.1 样本预处理技术
为了达到对目标细胞的检测功能,首先要对样本进行预处理,提取出所需要的目标细胞,消除其他细胞对后续检测流程的干扰。 预处理方式大致分为2 种,一种是裂解红细胞并对全血中不同种类的白细胞进行特异性标记,另一种是直接进行细胞分选。
2.1.1 细胞裂解
细胞裂解的预处理方式是对全血样本中的红细胞进行裂解,排除红细胞对后续白细胞检测的干扰;同时对白细胞进行特异性标记,以便在后续的荧光检测中对形态大小区别不大的白细胞类群进行准确的区分。
最具有代表性的全血预处理研究是NASA 于1999 年研制出的一种可以进行全血染色的装置,完成了世界上首次太空全血样本预处理。但是,这种装置人工参与度高,结果的一致性难以得到保证。 美国Honeywell 实验室研制出了一种由聚对苯二甲酸乙二醇酯(PET)制作的微流控芯片,可以对全血样本自动进行预处理。 但是该芯片由7 层结构组成,结构太过复杂,不易实现批量生产,并且不具备微重力适用性。 2015 年,以色列LeukoDx 公司研发出了可以进行败血症诊断的全自动CD64 检测流式细胞仪Accellix。 该细胞仪的微流控芯片是一次性的,具备对全血样本的红细胞裂解功能和细胞聚焦的功能。 但是,它采用大容积的储液、混合腔室,不能在空间站这种微重力的环境中完成工作。
2.1.2 细胞分选
以往血液以裂解红细胞的方式进行预处理,通常具有裂解孵化时间长,裂解液昂贵等缺点。直接对细胞进行分选成为微流控领域越来越重要的一个研究内容。 细胞分选分为主动分选和被动分选2 种。
主动细胞分选利用微流控相关技术,在微流控芯片上根据各类细胞的不同性质,由外力进行分选。 根据分选原理又可以分为电学方法、光学方法、声学方法等。
电学方法中具有代表意义的是介电泳(Di⁃electrophoresis, DEP ) 法 和 诱 导 电 荷 电 渗(Induced⁃Charged Electro⁃Osmosis, ICEO)法。
介电泳是指极化粒子在非均匀电场中受到电场力作用而发生的运动。 由DEP 力引起的位移的大小和方向取决于环境电场和粒子及溶液的性质。 大多数生物细胞都可以被DEP 力操纵,且包裹细胞的液滴也具有这种特性。 因此,细胞或液滴可以通过非均匀电场中的DEP 力来控制。该方法可实现30 000 细胞/秒的高通量液滴分选。 然而,生物细胞在高频电场中的存活率不能得到保证,并且这种方法的特异性差,对于一些相似细胞难以进行精准分离,高电压引起的焦耳热可能会降低细胞的分选效率和生存能力。
ICEO 所需的驱动电压低、流动温和可调,为粒子分选提供了另一种方法。 在特定的ICEO漩涡中,轻粒子被捕获并在斯托克斯力的驱动下绕涡核运动;重粒子从漩涡中逃逸出来,聚集于电极中心的滞留线(图1),从而实现不同密度微粒的分选。 ICEO 分选芯片同样可以实现不同大小颗粒的分离,通过优化中央电极的结构,分选效率得到进一步提升, 并展现出实用化前景。
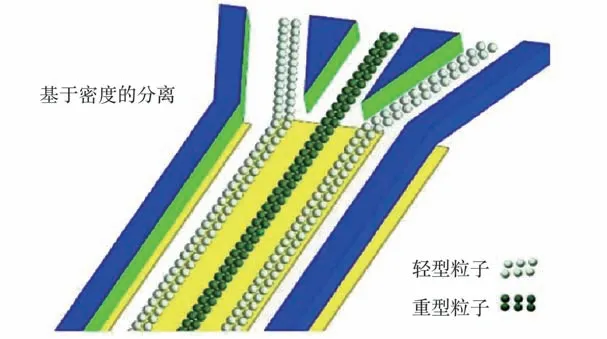
图1 ICEO 分选示意图[9]Fig.1 Schematic diagram of ICEO sorting[9]
光学分选方法有3 个特点:①尺寸匹配,典型激光束的直径可以控制在1 ~20 μm,这与微流控系统完美匹配;②力匹配,光学驱动器分别提供温和或强大的力来控制细胞或流动;③生物兼容性,光束功率和波长的可控性使得其对生物样品的影响较小。 然而,高光功率的激光设备可能会阻碍光学系统的小型化,并且激光设备的成本一直很高。
在声学微芯片中,粒子或细胞的分离可以通过微通道上驻波的辐射力将颗粒控制到压力节点或波腹来实现。 移动距离取决于细胞的大小、密度和可压缩性、周围介质性质和声波的波长。 声学方法的一个瓶颈是临界分离细胞大小由声波的频率决定,为了分离小细胞(<1 μm),这些声波发生器需要更高的频率和功率。 大功率声波可能导致通道内温度升高,解决发热问题是这些器件小型化的一个巨大的挑战。
被动细胞分选是在微流控芯片上依据细胞自身差异使得它们在特定的环境中受到不同程度的作用力而实现细胞分选的一种方法。 主要包括微过滤法、惯性分离法等。
微过滤法是最基本的技术。 它具有分离效率高、结构简单、控制精确等优点。 根据微通道中的过滤结构,过滤有4 种分类:堰、柱、横流和膜(图2)。 基于过滤的方法无需对细胞进行标记,芯片易于制造,并且能够提供连续分离。 然而,微过滤法的高剪切应力会影响被困细胞的存活率,此外,这种方法只能分离不同大小的细胞,而且容易遇到耐久性差、堵塞等问题。

图2 微滤器设计示意图[16]Fig.2 Schematic diagram of various micro filter designs[16]
基于流体动力学分选方法具有单步、高选择性和无标签的特点,而且还提供了并行化、高通量细胞分选的潜力。 其典型代表惯性分选技术在医疗、生物和化学等领域得到了广泛的应用,在多种细胞分离和富集过程中发挥了重要作用。 根据微通道结构的不同,惯性平台可分为直线型和曲线型。 学者们在使用具有不同横截面结构的大直通道进行基于尺寸的细胞或颗粒分选方面做了大量研究(图3(a))。 曲线型微通道中,靠近通道中心线的流体微元倾向于绕曲线向外流动,从而在通道的径向形成压力梯度。 在封闭的通道中,由于离心力的作用,当壁面附近相对静止的流体重新向内循环时,会产生2 个对称的涡(迪恩涡流)。 颗粒在弯曲微通道中的位置取决于惯性力和迪恩力的平衡,不同大小的细胞处于弯曲通道截面的不同位置。 在Lin 等的工作中,一个称为迷宫的弯曲微通道被用于分离循环肿瘤细胞(Circulating Tumor Cells, CTCs)和白细胞(White Blood Cells, WBCs),该通道使用了锐角和环的组合(图3(b))。 此方法分选纯度高(WBCs 为 91.4% ± 3.3%, CTCs 为 91.5% ±0.9%),通量高(2.5 mL/min)。 虽然惯性方法具有高通量和结构简单的优点,但是很难分离出大小和密度相似的不同类型的细胞。 作为主要的被动方法之一,这些方法常因堵塞的发生而发展受阻。
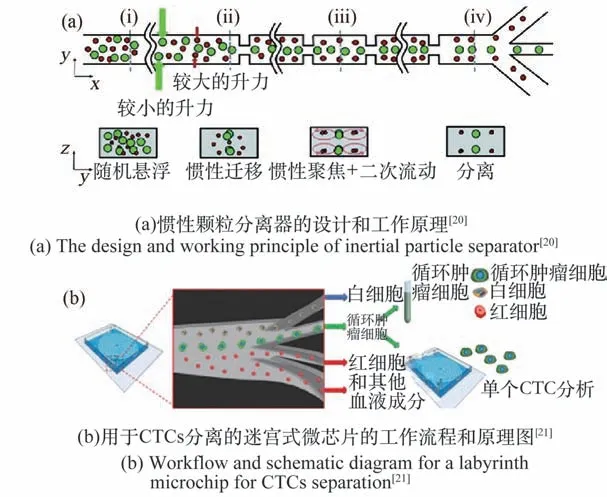
图3 分离器设计及工作原理Fig.3 Separator design and working principle
2.2 细胞聚焦技术
为了实现流式细胞仪中后续的检测功能,通常会对细胞样本流进行细胞聚焦。 在微流控芯片领域,细胞聚焦方法依据是否需要外加作用力而分为2 个大类:①是主动聚焦方法,包括水动力聚焦、介电泳聚焦、超声波聚焦等;②是被动聚焦方法,包括惯性聚焦和基于泊松过程的无鞘流聚焦等。
2.2.1 主动聚焦方法
水动力聚焦利用鞘流液挤压样本流,实现样本流中细胞的高精度聚焦。 其在聚焦维度上可以分为二维聚焦和三维聚焦。 二维聚焦的优点是简单、易用。 三维微流控聚焦系统的芯片设计要比二维方法复杂得多,因为样本流在水平方向和垂直方向上都受到鞘流液挤压聚焦,所得结果也将更加准确可靠。
介电泳聚焦法的原理是通过集成在芯片上的微型电极产生的具有特定梯度的诱导电场,电场力使细胞向场强最大的地方移动,进而实现细胞聚焦的功能,并可以对等体积颗粒进行分类,还具有其他优点,例如避免了堵塞的可能性,并可调整外部电压来满足不同的分析需求。
超声波聚焦使用换能器在微通道内产生超声驻波,依靠声波压力梯度将细胞聚焦在驻波的波峰或波谷节点位置,能够达到与水力聚焦相当的聚焦效果。 美国Life Technologies 公司于2010 年推出了第一款使用超声波增强聚焦的流式细胞仪Attune,相对于传统仪器,超声波聚焦技术允许其以较常规仪器更缓慢的速度对目标细胞进行更高精度的分析,但该仪器仍然需要鞘流系统的辅助以保证聚焦效果并避免流动室污染。 Galanzha等开发了如图4 所示的谐振器,由2 个半管或1 个半管和1 个带有附加压电换能器的平板基板组成,在血管或淋巴管中心生成驻波,利用超声和光声波诱发的梯度声力,探索了小鼠耳和肠系膜血液和淋巴流中的细胞聚焦。
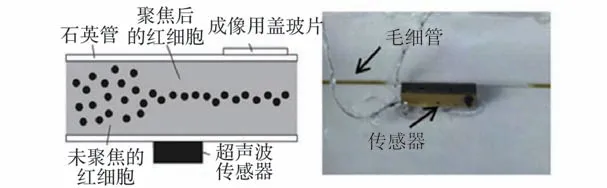
图4 声学聚焦示意图(左)和石英毛细管(右)的实验装置[26]Fig.4 Acoustic focusing diagram (left) and quartz capillary (right) of the experimental appara⁃tus[26]
2.2.2 被动聚焦方法
惯性聚焦属于被动聚焦方法,不依赖外界输入,通道中的细胞在剪切力和拖曳力等惯性力的共同作用下会发生横向移动,而通过合理设计通道结构能够产生特定方向的二次流,从而可以控制细胞向受力平衡位置移动实现聚焦。 由于具有高通量、简单、操作精确和低成本等优点,惯性微流体技术在细胞样品处理中具有广阔的应用前景,特别是对于低丰度样品。
基于泊松过程的无鞘流聚焦使用小尺寸的微通道形成低至数十皮升的检测区体积,针对浓度一定的细胞样本,根据泊松过程可以保证几乎所有的细胞依次单个通过检测区,从而实现单细胞聚焦的效果。 相对于其他细胞聚焦方法,无鞘流通道聚焦只能保证细胞单个通过检测区,而无法使细胞聚焦在一条直线上并通过检测区的某一固定位置,这会在一定程度上降低检测性能。 但得益于其简单的通道结构和良好的适用性,该技术仍然广泛地应用包括上述仪器在内的多台流式细胞仪中,充分证明了其实用性和可靠性。
2.3 细胞检测技术
微流式细胞术中的微粒检测技术主要分为光学检测和电学检测。 光学检测包括荧光检测和散射光检测,检测精度较高。 电学检测结构简单、制作方便,便于小型化,但是其在分析精度、特异性以及分析参数上与光学检测有些差距。
2.3.1 光学检测
光学检测分为传统的外置光路检测与将光学元件集成在芯片上的光流控芯片检测。
1) 外置光路检测。 根据荧光收集与激发光照射的光路布局不同,芯片外置的传统荧光检测光路可分为透射式和反射式2 种。 加州理工研制的微流式细胞仪和LeukoDx 公司推出的Accellix平台采用了如图5(a)所示的透射式检测光路,激发光由芯片底面射入,前向散射光(FSC)和荧光从芯片顶面收集检测。 这种光路结构简洁,所需元件数量也较少,但只能检测荧光和前向散射光。 南安普顿大学等单位采用如图5(b)所示的反射式检测光路,通过使用二向色分光镜从芯片的一面同时完成激光入射和荧光收集。 这种布局比较紧凑,有利于缩小整机体积。

图5 外置传统光路方案[28,31]Fig.5 Conventional external optical path scheme[28,31]
2) 光流控芯片检测方案。 光流控芯片能够集成光纤、聚焦透镜等光学元件,从而可以显著地减小整个光学系统的体积。 微芯片电泳激光诱导荧光检测技术是一种在单细胞水平上进行代谢产物分析的理想方法,但难以同时检测多种代谢产物。
2.3.2 电阻抗检测
光学采集和检测系统价格昂贵,制作复杂,检测前通常需要额外的生化标记,这大大限制了光学微流式细胞仪的低成本发展。 电阻抗流式细胞仪用简单的电极代替复杂的光学元件,可以通过电阻抗测量来提取细胞的生物物理特性。 在微通道底部制作共面微电极是一种常规的电阻抗检测方式,其主要缺点是检测区域电场不均匀,检测精度低。 为了解决这一问题,学者们开发了平行对称的微电极来生成均匀电场并提高检测精度。
3 微流式细胞术在航天免疫评估的应用
微流式细胞术在分子生物学、生物标志物发现、疾病诊断、病理学和治疗等领域都有着普遍的应用,而在航天方面,针对航天员身体健康开展的航天医学监测与医学保障工作是保证载人航天任务顺利实施的重要保障。 多项研究表明,航天飞行的极端环境会导致人体免疫功能异化。 血液中的白细胞几乎参与人体所有的免疫反应,不同种类白细胞的浓度能够直接反映人体免疫功能状况,因此检测白细胞及其亚群的浓度也自然成为免疫功能诊断的必要手段。
国内外已有多家研究机构开展了用于流式细胞术的微流控芯片技术研究,而专门针对航天需求开展相关工作的单位较少,具有代表性的单位有NASA、加州理工学院和加拿大航天局。 NASA研制的Guava 流式细胞仪和加拿大航天局的Microflow1使用常规的固定式流路和流动室,需要定期冲洗和维护,一旦发生污染或堵塞问题将很难由航天员在轨解决。 加州理工的微流式细胞仪和LeukoDx 公司的Accellix采用一次性微流控芯片方案避免了这种问题,但仍需要解决芯片对准和侧向散射光(Side Scatter, SSC)检测的问题,以实现一次性芯片的实用化和淋巴细胞亚群的分类。 因此目前仍未有能完全满足航天使用需求的流式细胞仪。
4 一款面向载人航天的微流式细胞仪
针对载人航天中的在轨免疫检测需求,本课题组对航天微流式细胞术中的样品预处理、细胞聚焦和荧光检测3 个环节中的微流控芯片技术进行了研究,研制了全血自动预处理芯片和无鞘流细胞聚焦芯片2 种聚合物基微流控芯片以及高容错荧光检测光路方案,解决流式细胞术的在轨应用难题,开发了一款航天用全自动微流式细胞仪样机(ACC Microflow Cytometer 1.0)。
4.1 适应微重力的自动预处理微流控芯片
自动预处理微流控芯片能够适应微重力环境,确定淋巴细胞亚群计数所需的全血与试剂用量,对基于延时截止阀的自动定量取样技术和适应微重力的多通道流体混合技术进行了研究,并对比验证了全血的自动预处理效果。
4.1.1 自动预处理芯片设计
样本预处理模块的目的是对白细胞进行染色以及裂解红细胞。 需要完成微重力环境下对液体试剂的加注、混匀以及孵育。 因此该芯片需要具有以下特性:全血样本定量进样,样本与试剂混合孵育,操作可自动进行。 按照上述要求设计如图6 所示的具备微重力适应性的全血自动预处理芯片,尺寸为50.5 mm×28.0 mm×5.0 mm。 抗体试剂和裂解液存储于储液通道内,芯片通过底面的4 个驱动口与预处理模块内的4 个注射泵连接。
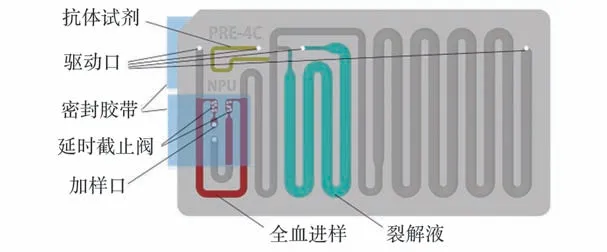
图6 自动预处理芯片设计[49]Fig.6 Design of automatic pretreatment chip[49]
4.1.2 自动定量取样技术
为解决微重力环境下全血定量加样的问题,遂提出一种基于高吸水树脂吸水溶胀的延时截止阀,实现了微流控芯片上的全血自动定量取样。利用该阀门自动延时关断的特性可以实现原理如图7 所示的自动定量取样。 取样通道一端的A口连接预处理芯片的驱动口,另一端B 口连接后续混合通道,C 和D 两口通过延时截止阀分别与全血加样口和排气口相连。 由C 口加入血样时,首先经过阀1,由于A 和B 两口被芯片底面的密封胶带封闭,血样只能沿定量通道段流动并由D口经阀2 流出至溢样通道。 2 个延时截止阀在血样流过后分别开始逐渐关断,并最终将血样截取在定量通道段内。
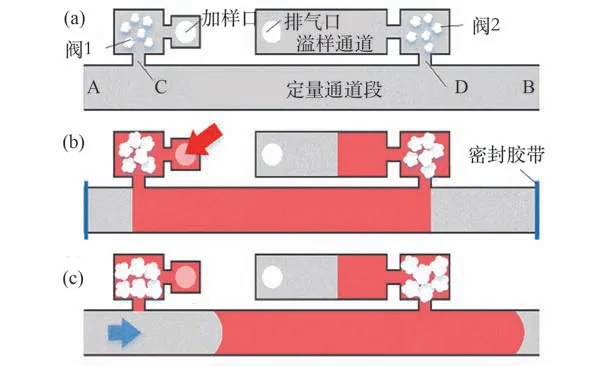
图7 自动取样工作原理[49]Fig.7 Working principle of the automatic sampling[49]
4.1.3 预处理芯片的微重力适应性
全血预处理中需要驱动全血样本、抗体试剂和裂解液3 路液体进行混合。 针对微重力环境下的液体混合需求,设计了一种4 路联动的液路驱动系统。 全血预处理芯片中的所有液体操作均在细长微通道内进行,借助段塞流特性使各部分液体保持整体连续。 使用差动驱动方式保证液体驱动精度以使参与混合的2 路液体同时到达通道交叉口以防止混入气泡,通过弯曲通道内的往复流动实现血样与试剂的混匀。对经由手动处理和预处理芯片处理后的血样进行检测,得到散点图如图8 所示,2 种处理方式得到的散点图相似度高,该预处理芯片可以代替传统手动预处理。
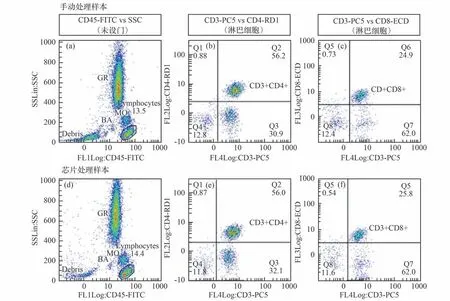
图8 手动处理(a⁃c)与芯片处理(d⁃f)的检测结果散点图[48]Fig.8 Manual processing and chip processing test results with the scatter plot[48]
4.2 无鞘流聚焦微流控芯片技术
无鞘流聚焦微流控芯片研究了基于泊松过程的无鞘流聚焦原理,针对淋巴细胞亚群检测设计了聚焦微流控芯片(图9)。 基于泊松过程的无鞘流聚焦仅依靠微通道的尺寸将细胞样本流聚焦,结构和驱动液路最为简洁。 设计的集成血样和废液储液通道的无鞘流聚焦芯片如图10 所示,外形尺寸为80 mm×22 mm×7.5 mm。

图9 聚焦通道结构图[48]Fig.9 Schematic diagram of focus channel[48]
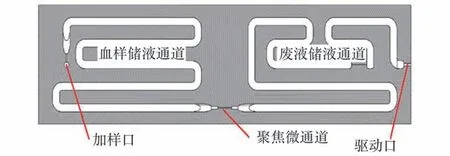
图10 无鞘流聚焦芯片[48]Fig.10 Sheathless flow focusing chip[48]
4.3 高容错单光四色荧光检测技术
荧光检测光路采用正交光路方案识别SSC淋巴细胞。 为了提高荧光检测的灵敏度,需要选用数值孔径较大的镜头以获得较高的荧光收集效率。 从与聚焦微通道距离较近的芯片顶面(厚1.5 mm)收集荧光信号,从靠近微通道的一侧(厚3 mm)入射激光,如图11 所示。
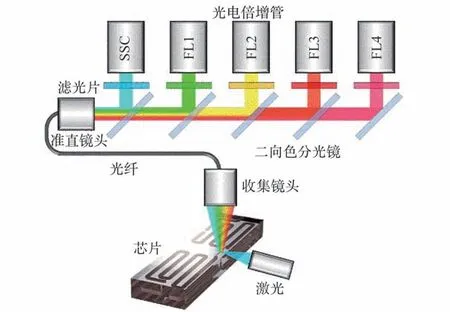
图11 荧光检测光路方案[48]Fig.11 Optical path scheme of fluorescence detection[48]
在无鞘流聚焦微流控芯片中,样本流尺寸即为聚焦微通道尺寸,为50 μm×50 μm,且聚焦微通道存在±15 μm 的位置误差,细胞可能出现的区域尺寸为80 μm×80 μm,超出了传统荧光检测光路的检测范围。 因此针对无鞘流聚焦微流控芯片的特点设计了一种检测区域大于80 μm×80 μm的高容错荧光检测光路,以实现对所有细胞的一致性荧光检测。
4.4 性能及微重力适应性验证
整套航天用自动微流式细胞仪样机(ACC Microflow Cytometer 1.0)如图12 所示,由全血预处理芯片与无鞘流聚焦芯片2 种即插即用的一次性微流控芯片,以及全血预处理模块和流式细胞术检测模块2 个仪器模块组成。

图12 航天用自动流式细胞仪(ACC microflow cy⁃tometer 1.0)[51]Fig.12 Automated flow cytometry for aerospace ap⁃plications[51]
对同一份血样,分别使用ACC Microflow Cy⁃tometer 1.0 检测10 份实验组样本,使用传统手段检测的4 份对照组样本。 检测结果如图13 所示。和对照组结果对比可知,虽有差异但符合临床要求。
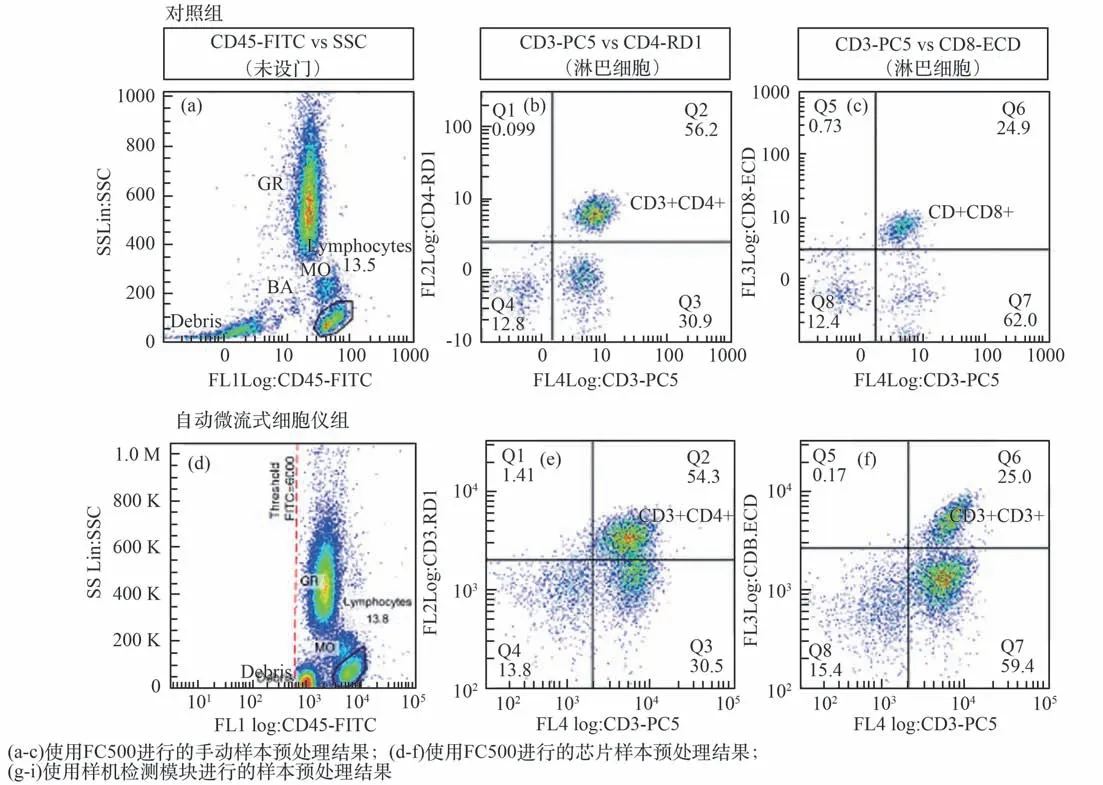
图13 淋巴细胞亚群检测结果对比[48]Fig.13 Comparison of lymphocyte subsets detection[48]
为了进一步验证淋巴细胞亚群检测功能,样机参加了绿航星际4 人180 天受控生态生保系统集成试验。 试验共成功进行了4 次淋巴细胞亚群检测,其中2 名参试者的淋巴细胞亚群数据如图14 所示。 2 名参试者的淋巴细胞亚群比例在试验期间略有波动,但整体比较平稳且均处于正常参考范围内,说明2 人免疫功能水平正常。整个试验过程中使用了300 多支芯片,用于操作手册编写、参试志愿者前期培训和正式进舱试验。
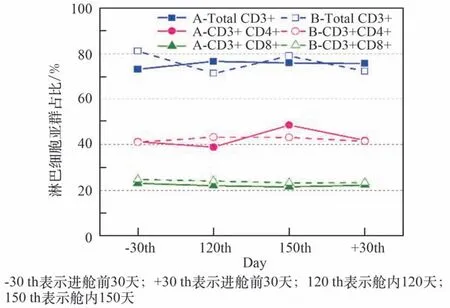
图14 绿航星际试验中两名参试者的淋巴细胞亚群数据[48]Fig.14 Data of lymphocyte subsets from two volunteers in 180 CELSS integration experiment[48]
其后,样机在法国国家太空研究中心的抛物线飞行飞机ZERO⁃G 上进行了微重力适用性测试。 每次失重约20 s。 表1 结果表明,微重力和超重力阶段的CV 性能略有下降。 这是由于该抛物线操纵是加速度在±0.05 G 内,而不是精确的0 G。 这种加速度的变化可能会干扰微通道内的流动,导致CV 的增加。 使用处理荧光分辨率数据的方法将飞行实验组数据划分为3 个不同的重力阶段进行统计,通过荧光MESF 校准曲线计算得到FITC 通道荧光灵敏度,结果如表1 所示。 其中3 种飞行阶段的FITC 通道MESF值略高于地面对照组,但并无显著差别。 因此失重和超重环境对微流式细胞仪的荧光灵敏度性能无显著影响。
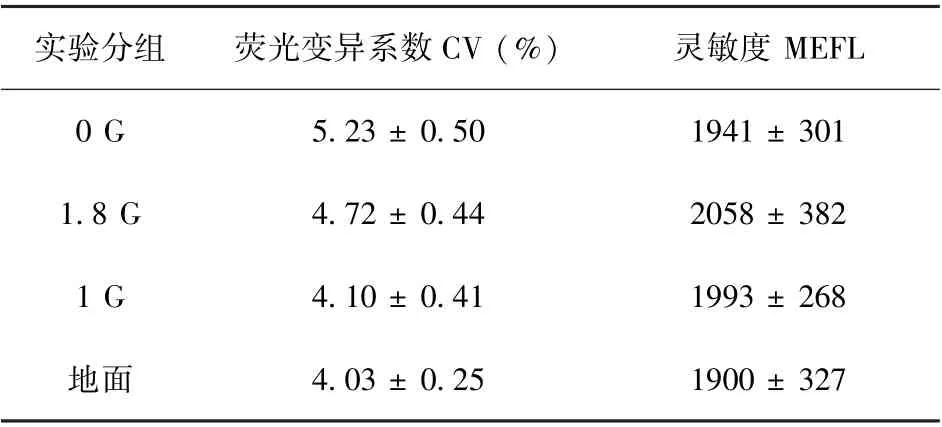
表1 荧光分辨率与荧光灵敏度指标对比[48]Table 1 Comparison of fluorescence resolution and fluo⁃rescence sensitivity indexes[48]
该样机能够满足淋巴细胞亚群检测需求,且具备良好的微重力适应性。 表2 列举了国内外最具代表性的若干小型流式细胞仪及其关键性能指标。

表2 部分小型流式细胞仪的性能指标对比[51]Table 2 Comparison of performance indicators of some small flow cytometers[51]
5 总结与展望
本文首先对微流式细胞术的发展现状进行了概述,包括预处理技术、细胞聚焦技术、细胞检测技术;其次,着重介绍了其在航天医学领域中的应用,即实现对航天员免疫状态的实时、在轨监测;最后,针对载人航天中的在轨免疫检测需求,介绍了航天微流式细胞术中的样品预处理、细胞聚焦和荧光检测3 个环节中的微流控芯片技术的研究,包括开发了全血自动预处理芯片和无鞘流细胞聚焦芯片两种聚合物基微流控芯片以及高容错荧光检测光路方案,研制了航天用全自动微流式细胞仪样机(ACC Microflow Cytometer 1.0)。
流式细胞术仍然具有很大的发展空间。 目前,流式细胞仪的其中一个发展趋势是从实验用大型仪器向便携式、高质量分选、高分辨率检测的研究用流式细胞仪发展。 流式细胞术的应用对象也不仅局限于常规的血细胞,一些非细胞体,如病毒、细胞核、染色体、原生质体等也是流式细胞仪的检测对象。 实际上,用颗粒而不仅仅是细胞来定义流式细胞仪的检测对象,显然更有代表意义。这样,也带来了扩大检测范围的考验。 可以预见,具有更强的专业性和临床型的流式细胞仪在之后的研究中将带来更多的成果,最终实现全自动流式检测。

