玉米ZmMYB2基因的克隆及表达分析
杨晓艺 王聪 鹿锦浩 吕绍芝 林海东 裴玉贺







摘要:为了研究MYB转录因子的功能及其对逆境胁迫的响应,本研究对玉米自交系辽3162三叶期幼苗进行干旱和盐胁迫处理,克隆ZmMYB2基因并进行生物信息学分析,探究该基因在胁迫条件下的表达。该基因开放阅读框长1233bp,编码410个氨基酸,具有多个MYB转录因子结合位点,为MYB转录因子。经生物信息学分析推测ZmMYB2蛋白分子量为46.08kDa,等电点为6.38,属于亲水性酸性非分泌蛋白,具有2个MYB保守结构域,定位在细胞核内,与高粱、南荻的亲缘关系较近。qRT-PCR结果表明,该基因在玉米叶片中的表达量最高,具有组织特异性,且能响应干旱和盐等非生物胁迫。初步判断该基因对玉米的非生物胁迫应答起着重要作用。
关键词:玉米;ZmMYB2;基因克隆;胁迫应答;生物信息学分析;基因表达
MYB转录因子家族是一类DNA结合蛋白,在植物次生生长发育、细胞周期调控和抗逆生理等方面有着重要作用。1987年PazAres等从玉米中发现并克隆了植物中第一个参与花青素合成的MYB基因ZmMYB2C1[1],此后随着研究的深入,越来越多的该家族成员被挖掘出来。MYB转录因子家族成员具有相似的结构,完整的MYB蛋白由三部分组成:MYB结构域、转录激活结构域和负调控结构域。MYB结构域位于MYB蛋白的N-末端,含有约52个氨基酸残基[2]。MYB蛋白通常包含1~4个保守的MYB结构域,根据MYB结构域的数量分为4类———1R-MYB、2RMYB、3R-MYB、4R-MYB[3]。其中2R-MYB中的R2R3-MYB蛋白是高等植物所独有的,由在N端高度保守的MYB域和在C端高度可变的C端域组成[4],具有多种功能,是目前研究最广泛的MYB蛋白,仅在被子植物基因组中就有超过100个成员[5]。
尽管MYB蛋白显示出高度的结构相似性,但来自不同物种或生物体的相似蛋白之间却存在明显的功能差异。例如,在烟草中过表达BpMYB4可以诱导一些木质素生物合成基因的表达,导致次生壁增厚[6]。在拟南芥中过表达AtMYB75基因也会导致木质素积累的轻微增加,参与木质素生物合成的调控;AtMYB3R1和AtMYB3R4基因可以激活KNOLLE基因的表达,从而在核分裂中起到积极的调节作用;AtMYB88和AtMYB124基因可以控制细胞周期和细胞分化过程;AtMYB24、AtMYB57、AtMYB80等基因对花药和花粉粒的发育起重要作用[7]。RgMYB10基因能促进合成毛蕊花糖苷[8],ZmMYB48能调控植物对干旱胁迫的防御[9],ZmMYB268在植物抵御高温方面起重要作用[10]。
本研究以玉米自交系辽3162幼苗为试材,对ZmMYB2基因进行克隆并进行生物信息学分析,通过模拟盐胁迫和干旱胁迫,研究其在非生物胁迫下的表达情况,旨在为玉米抗逆育种提供基因资源,为探究MYB转录因子调控非生物胁迫的分子机制奠定基础。
1材料与方法
1.1试验材料
取玉米自交系辽3162种植在青岛农业大学培养室内,培养条件为(25±2)℃、16h光照/8h黑暗、相对湿度70%,培养至三叶一心时进行盐和干旱胁迫处理,分别用250mmol/L的NaCl溶液和20%的PEG-6000溶液浇灌幼苗,分别在处理0、6、12、24、48h采集玉米幼嫩的根、茎、叶,于-80℃冰箱内保存备用。
1.2RNA提取及cDNA合成
使用TaKaRaMiniBESTPlantRNAExtractionKit(TaKaRa公司),从三叶期幼苗组织中提取RNA。用超微量分光光度计(Nanodrop2000,美国)对提取的总RNA浓度和纯度进行检测,同时用1%琼脂糖凝胶电泳进一步检测RNA质量。采用HiScriptⅡQRTSuperMixforqPCR(+gDNAwiper)试剂盒(南京诺唯赞生物科技有限公司)进行cDNA第一链的合成。
1.3ZmMYB2基因的克隆
用PrimerPremier5.0软件设计引物。以反转录产生的cDNA为模板,利用高保真酶进行PCR扩增,对PCR产物进行1%的琼脂糖凝胶电泳后切胶回收;将目的条带与克隆载体pMD19-T进行连接,转化大肠杆菌感受态细胞DH5α,LB培养基复苏后筛选出多个阳性克隆,选择单菌落进行PCR扩增,选择扩增出目标条带的细菌溶液,送样测序。
1.4ZmMYB2的生物信息学分析
通过NCBI搜索获得基因基本信息,然后利用在线分析工具ExPASy、NetPhos3.1、SignalP4.1、SOPMA、TMHMM、PlantCARE等[11-15]对ZmMYB2蛋白的理化性质、磷酸位点、保守结构域、亚细胞定位、进化关系、二三级结构、启动子顺式作用元件等进行预测分析。
1.5荧光定量PCR
通过检索获得的ZmMYB2基因序列,设计cDNA快速扩增的上、下游引物(表1)。使用试剂盒ChamQTMUniversalSYBRqPCRMasterMix(南京诺唯赞生物科技有限公司)在荧光定量PCR仪(QuantStudio3,美國ABI)上进行荧光定量PCR扩增。采用2-ΔΔCt方法[16]计算ZmMYB2基因在幼嫩根、茎、叶中的相对表达量及处理0、6、12、24、48h的相对表达量。使用MicrosoftExcel2010处理数据并进行差异显著性分析和作图。
2结果与分析
2.1ZmMYB2基因的克隆及鉴定
根据基因序列设计全长编码区引物,以cDNA为模板对ZmMYB2进行PCR扩增,从玉米自交系辽3162中扩增出一条长度为1233bp的基因序列,用琼脂糖凝胶电泳对RNA和目的基因序列进行验证(图1),根据ORFfinder可知该基因编码410个氨基酸(图2)。
2.2ZmMYB2的启动子序列顺式作用元件预测分析
从NCBI数据库获得ZmMYB2基因的启动子前3000bp序列,使用在线软件plantCARE对启动子序列的顺式作用元件进行预测,结果(表2)发现,在ZmMYB2基因上游不仅有CAAT-box、TATA-box等常见的核心启动子元件,还发现了13个MYB转录因子结合位点,表明ZmMYB2具有启动子驱动的功能,可能受玉米MYB家族成员的调控。
2.3ZmMYB2蛋白的理化性质分析
利用在线软件ExPASy对ZmMYB2蛋白进行理化性质分析,结果(表3)显示,ZmMYB2蛋白分子式为C2003H3157N589O636S13,由20种常见氨基酸组成,含量最高的为亮氨酸(Leu),占总含量的9.8%,谷氨酸(Glu)和丝氨酸(Ser)次之,占总含量的8.5%,色氨酸(Trp)含量最低,仅占0.5%;理论等电点为6.38,小于7,表明ZmMYB2蛋白是一个弱酸性蛋白;亲水指数为-0.714,推测为亲水性蛋白。利用在线工具ProtScale分析得到玉米ZmMYB2蛋白的亲/疏水信号图(图3),其多肽链N端和C端皆表现为亲水性,中间部位多数也表现为亲水性,亲水峰值在-0.5以下的信号明显多于峰值在0.5以上的信号,进一步证明了ZmMYB2蛋白具有亲水性。
2.4ZmMYB2蛋白的磷酸位点、信号肽、结构域预测及亚细胞定位
通过在线软件NetPhos3.1分析可知,ZmMYB2蛋白可能存在46种磷酸化位点(图4),分別为28个丝氨酸(Ser)位点、12个苏氨酸(Thr)位点和6个酪氨酸(Tyr)位点,可以与磷酸基团结合,传递磷酸基团。利用在线软件SignalP4.1和TMHMM对ZmMYB2蛋白进行信号肽和跨膜结构域预测,结果显示ZmMYB2基因编码的蛋白中不存在信号肽和跨膜结构域,从而推测ZmMYB2蛋白为非分泌蛋白,是在细胞内起作用的蛋白。根据在线工具CDSearch,查找ZmMYB2基因的保守结构域,结果(图5)表明,ZmMYB2蛋白含有MYB-SHAQKYF和MYB-CC-LHEQLE两个MYB域,推测ZmMYB2蛋白属于MYB家族的转录因子。利用在线工具Plant-mPLoc对ZmMYB2蛋白进行亚细胞定位,结果表明ZmMYB2蛋白定位在细胞核中的可能性最大,推断ZmMYB2蛋白最有可能在细胞核中起作用,是能够与DNA特定片段结合调控下游基因表达的转录因子。
2.5ZmMYB2蛋白的二三级结构预测
利用在线工具SOPMA分析得知,ZmMYB蛋白的多肽链中多以无规则卷曲为主,含量为55.85%,其次为34.88%的α-螺旋,延伸链和β-折叠含量较少,各占7.07%和2.20%。利用在线工具SWISS-MODEL对ZmMYB2蛋白的410个氨基酸进行3D建模,模板覆盖率为62.07%,得到ZmMYB2蛋白的三级结构(图6)。
2.6ZmMYB2蛋白的序列对比和进化分析
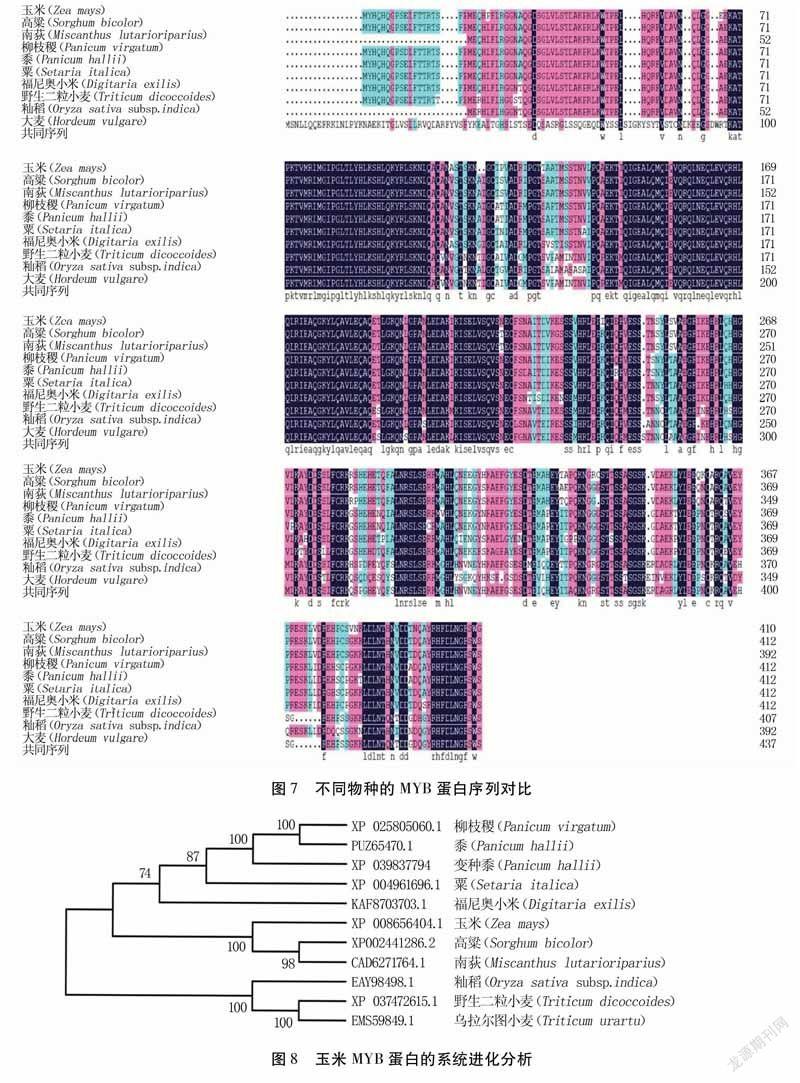
利用在线工具DNAMAN6.0,以ZmMYB2基因序列为探针,按照最大似然法,将ZmMYB2蛋白序列与高粱(Sorghumbicolor)、南荻(Miscanthuslutarioriparius)、柳枝稷(Panicumvirgatum)、黍(Panicumhallii)、粟(Setariaitalica)、福尼奥小米(Digitariaexilis)、野生二粒小麦(Triticumdicoccoides)、籼稻(Oryzasativasubsp.indica)、大麦(Hordeumvulgare)等植物的MYB序列进行对比,结果(图7)显示MYB蛋白序列的重叠性较高,表明MYB转录因子具有较高的同源性,在进化过程中具有一定的保守性。采用DNAMAN6.0进行多序列比对,利用MEGA-X构建各植物蛋白的系统发育进化树(图8),发现ZmMYB2蛋白序列与高粱和南荻的MYB序列亲缘关系最近,同属高粱族,而与籼稻、野生二粒小麦和乌拉尔图小麦(Triticumurartu)的亲缘关系最远。
2.7ZmMYB2基因的表达分析
qRT-PCR分析ZmMYB2基因在不同组织中的表达,结果(图9)显示,ZmMYB2基因在玉米根、茎、叶中均有表达,但不同部位的表达量存在差异,根中的表达量最低,叶中最高,为根的3.88倍,茎中的表达量仅次于叶,为根的3.15倍,说明ZmMYB2基因的表达具有组织特异性。ZmMYB2基因在盐胁迫和干旱胁迫0~48h的表达水平变化情况如图10所示,可见,ZmMYB2基因的表达量在NaCl胁迫后呈现先降低后升高、处理48h后又显著下降的变化趋势;在模拟干旱处理下呈现升-降-升-降的波动趋势,在处理的12h后显著升高,24h时达到最高。推测ZmMYB2基因能够响应NaCl和PEG胁迫。
3讨论与结论
本研究从玉米中克隆出ZmMYB2基因,生物信息学分析结果表明该蛋白为弱酸性亲水性非分泌蛋白,定位在细胞核内;上游序列中含有多个启动子顺式作用元件,具有多个转录因子结合位点,包括MYB转录因子结合位点;含有MYBSHAQKYF和MYB-CC-LHEQLE两个保守结构域。说明ZmMYB2属于MYB转录因子家族。
本研究发现,ZmMYB2基因主要在玉米叶片中表达,其次为茎中,在根中的表达量较低。与前人研究结果类似,如澳洲坚果MiMYB2基因主要在枝叶中表达,在花中的表达量较低[17];地黄RgMYB10基因主要在须根中表达,在块根中的表达量较低[8]。Chen等利用拟南芥非生物胁迫反应MYB蛋白序列,通过比较基因组学,从玉米中鉴定到46个可能参与非生物胁迫的MYB基因,其中,转ZmMYB30基因能够提高拟南芥对盐胁迫的耐受性,并能增加非生物胁迫相关基因的表达数目[18];胡育峰等研究发现在胚乳中过表达MYB14能够提高玉米籽粒淀粉含量[19];TaMYB3R1、TaMYB1和TaMYBsdu1基因也在小麦干旱反应中起着重要作用,TaMYB2A、TaMYB3R1、TaPIMP1等基因通过抑制植物蛋白磷酸酶2C的表达来提高小麦耐盐性[20];TaMYBsm3基因通过提高P5CS1、DREB2A、RD29A等非生物胁迫应答基因的表达水平来增强小麦抗旱性[21]。本研究发现,盐胁迫和干旱胁迫均能使ZmMYB2基因表达量上调。综合上述分析,可推断MYB家族基因的表达具有组织特异性,并对植物抵御非生物胁迫起着重要的调控作用。
本研究结果可为进一步研究ZmMYB2基因的生物学功能以及玉米对非生物胁迫应答的分子机制奠定基础。

