p38 MAPK信号通路在脑卒中后认知障碍中的作用及在中药防治中的药理研究进展
丁志敏 高静 苏凯奇 余明月 齐士魁 冯一璇 冯晓东
中图分类号 R932;R743 文献标志码 A 文章编号 1001-0408(2022)08-1014-07
DOI 10.6039/j.issn.1001-0408.2022.08.19
摘 要 腦卒中后认知障碍(PSCI)是指由脑卒中引起的从轻度认知障碍到痴呆的一系列综合征。促分裂原活化的蛋白激酶(MAPK)信号通路是哺乳动物体内传递细胞信号一个关键路径,p38是其中的一个经典分支。p38 MAPK信号通路参与了中枢神经系统疾病相关细胞生长、分化、凋亡、炎症反应等多种病理生理过程。如今,中药防治PSCI的基础实验研究取得较大进展,但缺乏相关的系统性总结。因此,本文综述了p38 MAPK信号通路在PSCI中的作用及其在中药防治领域中的药理研究进展。
关键词 脑卒中后认知障碍;中药;p38促分裂原活化的蛋白激酶信号通路;炎症反应
Role of p38 MAPK signaling pathway on post-stroke cognitive impairment and pharmacological research progress in the prevention and treatment with traditional Chinese medicine
DING Zhimin1,GAO Jing1,2,SU Kaiqi1,2,YU Mingyue1,QI Shikui1,FENG Yixuan1,FENG Xiaodong1,2(1. School of Rehabilitation Medicine, Henan University of Chinese Medicine, Zhengzhou 450046, China; 2. Rehabilitation Centre, the First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450099, China)
ABSTRACT Post-stroke cognitive impairment (PSCI) refers to a series of syndromes from mild cognitive impairment to dementia caused by stroke. The mitogen-activated protein kinases (MAPK) signaling pathway is a key pathway for transmitting cellular signals in mammals,and p38 is a classic branch of it. p38 MAPK signaling pathway is involved in various pathophysiological processes such as cell growth,differentiation,apoptosis and inflammatory response in central nervous system diseases. At present,great progress has been made in clinical and basic experimental studies on prevention and treatment of PSCI by traditional Chinese medicine (TCM), but there is a lack of relevant systematic summary. Therefore,this article summarizes the role of p38 MAPK signaling pathway in PSCI and the pharmacological research progress of TCM in prevention and treatment of PSCI through p38 MAPK signaling pathway.
KEYWORDS post-stroke cognitive impairment; traditional Chinese medicine; p38 mitogen-activated protein kinase signaling pathway; inflammatory response
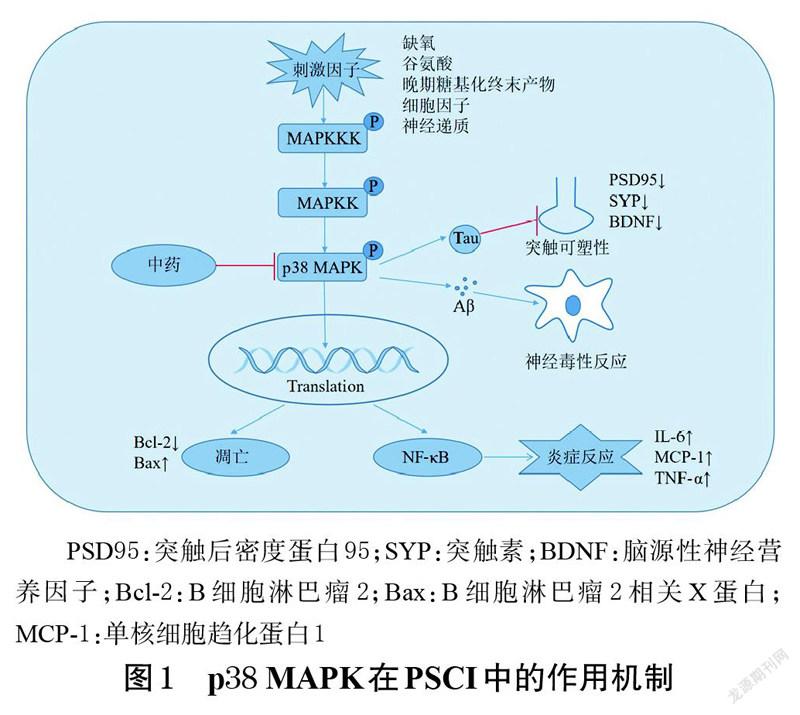
脑卒中后认知障碍(post-stroke cognitive impairment,PSCI)是脑卒中后较常见的功能障碍之一,是指由脑卒中引起的从轻度认知障碍到痴呆的一系列综合征,其临床表现主要为学习、记忆能力下降,执行功能减退等。据统计,约80%的脑卒中患者会伴有一定程度的认知功能障碍[1]。目前学界普遍认为,脑卒中所致的炎症反应、海马神经元凋亡及突触可塑性降低、微管相关蛋白Tau磷酸化水平升高、β淀粉样蛋白(amyloid β-protein,Aβ)诱导的神经毒性等是导致PSCI发生发展的重要病理机制[2]。因此,研究上述病理因素信号转导的发生机制可能为PSCI的治疗提供新思路。
促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的激活为典型的三级酶促级联反应:神经递质、细胞因子等与特定受体结合后,依次激活MAPK激酶的激酶(mitogen-activated protein kinase kinase kinase,MAPKKK)、MAPK激酶(mitogen-acti- vated protein kinase kinase,MAPKK)、MAPK,进而调节靶细胞的生长、分化、凋亡、炎症等多种生理病理过程,p38是MAPK中的一个经典分支[3]。有基础研究表明,PSCI模型大鼠的海马组织中p38 MAPK水平明显升高,而电针治疗后模型大鼠脑卒中及认知功能均有所恢复,并伴随着海马组织中p38 MAPK水平的降低。可见,p38 MAPK在PSCI的发生发展中发挥着重要作用[4]。此外,中药治疗PSCI的有效性及安全性已被临床研究所证实[5],其潜在作用机制主要包括抗炎、抗凋亡、调节突触可塑性和大脑中脑源性神经营养因子水平等[6-7],但缺乏相关的系统性总结。为此,本文综述了p38 MAPK信号通路在PSCI中的作用及在中药防治PSCI领域中的药理研究进展,以期为明确中药治疗PSCI的作用机制提供参考。
1 p38 MAPK信号通路的结构基础
1.1 MAPK
MAPK是一组分化保守的丝氨酸/苏氨酸蛋白激酶,由360个氨基酸构成,分子量为41 360 Da。p38 MAPK、胞外信号调节激酶(extracellular signal-regulated kinase,ERK)、c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)和ERK5是在哺乳动物体内发现的4个MAPK家族成员[8],能被不同的细胞外刺激激活,并介导不同的生物学效应:ERK及ERK5与细胞的增殖、分化、转录调节等过程密切相关,在肿瘤领域中的研究颇多[9-10];而JNK与p38 MAPK在功能上较为相似,主要参与炎症反应、细胞凋亡等,在缺血再灌注损伤、阿尔茨海默病(Alzheimer’s disease,AD)等领域中的研究较为广泛[11-12]。
1.2 p38 MAPK结构基础
p38 MAPK于1993年首次由Brewster等[13]在研究高渗环境对真菌的影响时被发现。目前,在哺乳动物细胞内共发现4种p38的亚型,分别为α、β、γ、δ。4种亚型的结构保持着高序列同源性,但其分布却存在着组织特异性:p38α、p38β大量存在于各种组织细胞中,p38γ仅存于骨骼肌细胞中,p38δ则主要在腺体组织中发挥作用[14]。有研究发现,下调星形胶质细胞中p38α的表达,可以通过调节海马神经元突触的可塑性来改善模型动物的长期记忆力[15]。此外,Li等[16]研究发现,抑制p38 MAPK信号通路的激活,可以显著提高血管性痴呆(vascular dementia,VD)模型大鼠的认知功能。因此,笔者推测p38α、p38β可能是PSCI防治的潜在作用靶点。
1.3 p38 MAPK在中枢神经系统中的作用
在中枢神经系统中,p38 MAPK可以被神经递质、细胞因子、谷氨酸、晚期糖基化终末产物、缺氧等多种细胞外刺激激活,并通过作用于不同的细胞而产生特异性的下游效应。在神经元中,磷脂酶C被代谢性谷氨酸受体激活后,可通过促进MAPKK3/6蛋白的磷酸化来激活p38 MAPK信号通路,从而诱导p38各亚型产生特异性的生物学效应:p38α、p38β能诱导突触可塑性关键蛋白表达的改变,p38γ、p38δ则可在突触相关蛋白的调节中起作用[17]。在星形胶质细胞中,过量的谷氨酸、Aβ可以激活p38α和p38β:p38α激活后可进一步促进其下游信号核因子κB(nuclear factor-κB,NF-κB)的表達,导致活性氧累积及星形胶质细胞活化,从而诱导神经炎症反应;而激活的p38β则可以抑制星形胶质细胞的凋亡[18]。在小胶质细胞中,p38α和p38β可在缺氧条件下被激活,并可通过刺激MAPK而激活蛋白激酶2上调,进而促进白细胞介素6(interleukin-6,IL-6)、单核细胞趋化蛋白1等炎症因子的释放[19]。
2 p38 MAPK在PSCI发生发展中的作用
2.1 促进炎症反应
炎症因子在PSCI的发病过程中起着重要的作用[20]。脑卒中后,一方面,脑缺血区释放炎症趋化因子,促进IL-1β、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等炎症因子的聚集,加重脑组织水肿,促进神经元凋亡[21];另一方面,小胶质细胞可在缺氧条件下被激活,并通过释放TNF-α、一氧化氮、超氧化物等促炎性细胞因子来促进中性粒细胞的活化和募集,进一步破坏血脑屏障和脑实质。有研究指出,脑卒中后炎症级联反应的增加可以加重认知功能的损伤[22]。Narasimhalu等[23]在研究炎症因子水平与PSCI的关联时发现,IL-8与患者的认知状态密切相关,且IL-12是脑卒中后认知功能下降的独立预测因素。因此,抑制脑卒中后神经炎症的激活可以有效缓解认知功能的损伤[24-25]。p38 MAPK信号通路是调节NF-κB介导炎症反应的关键途径之一[26-27],那么是否可以通过抑制p38 MAPK信号通路的表达来修复脑卒中后的认知功能损伤呢?基于这一思想,Zhu等[28]通过一项动物实验发现,应用p38 MAPK抑制剂可以减弱神经炎症反应并减少海马神经元凋亡,显著提高缺血缺氧大鼠的学习记忆能力。由此可见,抑制p38 MAPK信号通路的激活,即可通过降低脑卒中后的炎症反应来改善PSCI。
2.2 提高Tau蛋白磷酸化水平
在哺乳动物神经系统内,Tau蛋白含量丰富。既往学界普遍认为,Tau蛋白可以稳定轴突中的微管;但最新研究表明,Tau蛋白在神经元中的作用是允许微管生长并维持其动态平衡,并非传统意义上的轴突微管稳定剂[29]。有研究发现,AD患者认知减退与脑脊液中Tau蛋白磷酸化水平的升高密切相关[30]。此外,缺血诱导的Tau蛋白过度磷酸化是PSCI的关键因素之一[31];而上调p38 MAPK的表达,可以促进Tau蛋白过度磷酸化和沉积[32]。张敏等[33]应用针灸干预AD模型大鼠时发现,电针改善大鼠学习记忆能力是通过抑制p38 MAPK信号通路激活、降低Tau蛋白磷酸化水平而实现的。由此可见,抑制p38 MAPK信号通路的激活,即可通过降低脑缺血诱导的Tau蛋白磷酸化水平来改善认知功能障碍。
2.3 提高Aβ诱导的神经元损伤
Xiao等[34]研究发现,认知障碍模型小鼠的海马神经元凋亡和自噬相关基因表达均明显升高。有研究指出,抑制海马神经元的凋亡和自噬,可改善反复脑缺血再灌注损伤模型小鼠的认知障碍[35]。脑卒中发生后,一方面,Aβ可诱导B细胞淋巴瘤2及其相关X蛋白的比例失调,从而促进细胞凋亡;另一方面,Aβ沉积形成老年斑,容易引起神经毒性并进一步促进Tau蛋白磷酸化,最终导致神经元凋亡和神经变性[36]。Kocki等[37]研究发现,Aβ与脑缺血发生后海马CA1区神经元凋亡相关。上述研究提示,Aβ诱导的神经元退行性改变是PSCI发生的重要因素之一。p38 MAPK是Aβ诱导毒性的重要调节因子之一。Kheiri等[38]研究发现,抑制p38 MAPK的激活可以打破Aβ神经毒性的恶性循环并延缓AD模型动物的认知功能衰退。由此可见,下调p38 MAPK信号通路的表达,即可通过抑制脑卒中后Aβ诱导的神经元损伤来延缓脑卒中后认知功能的下降。
2.4 降低海马神经元突触可塑性
突触可塑性主要包括长时程增强(long-term potentiation,LTP)和长时程抑制,两者均参与了学习记忆活动。陈景等[39]研究发现,慢性脑低灌注大鼠的海马CA1区LTP和神经元核、突触素的表达均下调,并伴有显著的认知功能障碍。Wang等[40]在一项药理学研究中发现,左旋多巴可以提高海马白质完整性并改善灰质密度,增加突触数量,促进海马突触可塑性相关蛋白的表达,提高大鼠学习记忆能力,改善其神经功能损伤。上述研究提示,脑卒中后出现的海马神经元突触可塑性下降与认知功能损伤密切相关。Dai等[41]研究发现,认知障碍小鼠的海马中p38 MAPK蛋白的磷酸化水平升高,CA1区LTP和海马突触可塑性均下降。而认知功能的改善可以通过抑制p38 MAPK信号通路激活、促进突触后密度蛋白95和突触素的表达来实现[42]。由此可见,PSCI的治疗可以通过抑制p38 MAPK信号通路表达、调节脑卒中后海马神经元突触可塑性来实现。
p38 MAPK在PSCI中的作用机制见图1。
3 中药及其有效成分预防及治疗PSCI
早期有临床研究表明,乙酰胆碱酯酶抑制剂能够促进脑卒中老年患者认知功能的恢复[43];然而,最新的关于PSCI的管理指南指出,目前并没有足够的证据证明胆碱酯酶抑制剂的安全性及有效性[44]。因此,寻找预防及治疗PSCI的有效方法十分迫切。中药具有多途径、多靶点等治疗优势,中药复方及其有效成分可以通过抑制p38 MAPK信号通路的激活来促进或抑制靶基因的表达,从而发挥神经保护作用,预防及减轻脑卒中后的认知功能损伤。
3.1 中药复方作用于p38 MAPK
一项对中药用药规律的数据挖掘研究显示,脑卒中后用药以补虚药、活血化瘀药为主[45]。对于认知障碍的治疗,行气活血化瘀类中药有显著的治疗效果[46]。现就中药复方通过作用于p38 MAPK信号通路来防治PSCI的药理研究进展进行总结。
3.1.1 桃红四物汤 桃红四物汤具有祛瘀、养血、行气等功效[47]。现代药理学研究发现,该方可促进缺血性中风模型大鼠的血管生成、减少炎症反应、改善学习记忆功能[48]。Wang等[49]通过一项基础研究发现,桃红四物汤可以通过抑制p38 MAPK及高迁移率族蛋白B1/Toll样受体4/NF-κB信号通路来降低缺血半影区IL-6、IL-18、TNF-α等炎症因子水平,改善大脑中动脉缺血再灌注模型大鼠的行为功能,缓解由缺血引起的腦损伤。
3.1.2 龙生蛭胶囊 龙生蛭胶囊具有补气、活血、逐瘀的功效[50]。现代药理学研究显示,该药可减少内皮细胞和血小板的数量、降低氧化应激反应、抑制血栓生成[51]。Yang等[52]研究发现,龙生蛭胶囊能通过调节p38 MAPK和缺氧诱导因子1α/血管内皮生长因子信号通路来降低氧化应激和炎症因子水平,从而提高大脑中动脉缺血再灌注模型大鼠的神经突触可塑性。
3.1.3 苏合香丸 苏合香丸具有芳香开窍、行气止痛的功效[53]。网络药理学研究结果显示,该药不仅可以降低血清中IL-6、TNF-α等炎症因子的表达,抑制氧化应激反应,同时还可以提高神经递质转运活性,保持大脑兴奋性[54]。Jeon等[55]研究发现,苏合香丸可抑制Aβ诱导的p38 MAPK、JNK、Tau蛋白磷酸化水平的升高,减少细胞的凋亡和活性氧的产生,从而改善AD模型小鼠的记忆损伤。
3.1.4 养血清脑颗粒 养血清脑颗粒具有养血平肝、活血通络的功效[56]。有动物实验研究发现,该药可以通过抑制VD模型大鼠海马CA1区小胶质细胞的增殖与活化来改善其脑损伤,从而起到神经保护作用[57]。伞云琨[58]研究发现,养血清脑颗粒改善VD模型大鼠认知障碍的作用是基于抑制p38 MAPK信号通路的表达来实现的。
3.1.5 颐脑解郁方 颐脑解郁方具有行气解郁、疏肝利胆的功效,同时可以通过调节脑内单胺类神经递质的水平来改善认知功能[59]。一项动物实验研究发现,该方可通过抑制VD模型大鼠右侧皮质及海马中p38 MAPK的表达来改善其学习记忆功能[60]。
3.1.6 丹红注射液 丹红注射液具有活血化瘀的功效[61]。网络药理学研究显示,丹红注射液具有显著的抗炎活性[62]。Du等[63]研究发现,丹红注射液可通过调控MAPK和NF-κB信号通路来降低p38 MAPK、ERK、JNK蛋白磷酸化水平和血清中IL-1、TNF-α等炎症因子水平,从而减轻中枢神经系统损伤。
3.1.7 脑心安胶囊 脑心安胶囊具有益气活血、醒脑开窍的功效,临床上主要用于治疗中风后遗症、心脑供血不足等[64]。有研究表明,该药可下调p38 MAPK和NF-κB信号通路的表达,降低VD模型大鼠脑内IL-1β、TNF-α等炎症因子水平,抑制海马CA1区细胞凋亡,改善其学习记忆能力[64]。
3.1.8 自拟中药复方 张野等[65]通过自拟活血化瘀类中药复方(赤芍、川芎、蒲黄、葛根、地龙、槐花、红花、豨莶草、三七)联合头针干预PSCI模型大鼠后发现,该联合方案可降低模型大鼠血清中p38 MAPK水平、抑制细胞凋亡、改善记忆障碍。
3.2 中药有效成分作用于p38 MAPK
依据不同的化学结构,中药有效成分涉及生物碱类、皂苷类、酮类等多种类别。现代药理学研究表明,部分中药的有效成分具有抗脑缺血、抗炎、抗凋亡等作用[66]。现对中药有效成分通过作用p38 MAPK信号通路来防治PSCI的药理研究进展进行总结。
3.2.1 多酚类 (1)姜黄素:姜黄素是从姜科植物中提取的一种具有二酮结构的多酚类化合物,具有抗氧化、抗炎、改善血管内皮功能等作用[67]。Huang等[68]研究发现,腹腔注射姜黄素可以降低缺血再灌注损伤模型大鼠体内IL-1、Toll样受体4水平及p38 MAPK蛋白的磷酸化水平,减轻炎症反应。此结果表明,姜黄素的神经保护作用可能是通过调节Toll样受体4/p38 MAPK信号通路、抑制炎症反应来实现的。(2)葛根素:葛根素是来源于中药葛根中的一种异黄酮类衍生物,可降低血管阻力、增加脑血流量[69]。一项实验研究发现,葛根素可通过调控p38 MAPK/环磷酸腺苷反应元件结合蛋白信号通路来增加突触的厚度、密度和长度,从而改善AD模型大鼠的认知功能[70]。
3.2.2 皂苷类 (1)人参皂苷Rg1:人参皂苷Rg1是从传统中药人参中提取的主要皂苷类成分,具有促进海马神经发生、提高突触可塑性、增强免疫力等多种生物活性[71]。现代药理学研究表明,人参皂苷Rg1可以通过抑制p38 MAPK信号通路表达、减少脑卒中后海马神经元凋亡、抑制炎症反应来改善神经损伤[72-73]。(2)三七总皂苷:三七总皂苷是从中药三七中提取的药用部位,含20多种皂苷成分。研究表明,其具有抗炎、抗氧化等多种神经保护作用[73]。动物实验研究发现,三七总皂苷可以改善脑缺血引起的慢性脑低灌注大鼠认知功能减退[74],其作用机制可能是通过调节蛋白激酶B/p38 MAPK/NF-κB信号通路进而抑制炎症反应来实现的[75]。
3.2.3 其他 (1)玄参提取物:玄参提取物是从玄参科植物的根茎中提取的药用部位,含多种化学成分,具有清热凉血、舒缓抗炎的作用[76]。Meng等[76]在一项实验研究中发现,使用玄参提取物预处理缺血再灌注损伤模型小鼠可以明显降低其p38 MAPK及ERK蛋白的磷酸化水平,并通过提高B细胞淋巴瘤2及其相关X蛋白的比例、减少神经元凋亡来发挥神经保护作用。以上结果说明,玄参提取物对缺血再灌注致神经元损伤的缓解作用可能通过调控p38 MAPK和ERK信号通路来实现。(2)当归提取物:当归提取物是从中药当归的根茎中提取的由多種化学成分构成的药用部位,包括阿魏酸、正丁烯酰内酯等,具有补血活血的功效[77]。Cheng等[78]研究发现,当归提取物可通过调控p38 MAPK信号通路来抑制海马CA1区细胞凋亡、提高脑源性神经营养因子水平,从而起到保护短暂性全脑缺血大鼠神经的作用。(3)银杏叶提取物:银杏叶提取物是从银杏科植物的干叶中提取的多种化学成分,具有抑制氧化应激反应、减少细胞凋亡、抑制血管生成蛋白过表达等多重药理作用[79]。有研究表明,银杏叶提取物可通过抑制海马中p38 MAPK的表达、减少细胞凋亡来改善VD模型大鼠的认知功能[80]。
4 结语
PSCI临床多发且致残率、病死率较高,给患者家庭及社会带来了沉重的经济负担[81]。如何减轻脑卒中后神经元损伤、缓解脑卒中所致认知功能障碍是我国乃至全球亟待解决的重要难题[82]。目前,p38 MAPK信号通路的抑制及活化与多种中枢神经系统疾病的发生发展及预后的关系正受到学界的广泛关注。据此,本文较系统地阐述了中药干预、p38 MAPK信号通路及PSCI发病机制之间的关系,便于从整体上认识p38 MAPK在PSCI发生发展中的价值,为中药防治PSCI提供了理论依据。笔者通过对近些年来的相关文献进行搜集和系统整理后发现,中药复方及多种有效成分可以通过调控p38 MAPK信号通路的表达,抑制脑卒中所致多种复杂的病理反应,进而改善认知功能。综上可知,p38 MAPK信号通路可能是中药防治PSCI的重要靶点。但中药防治PSCI的现有研究较为基础,仍有许多方面需要深入和延续:首先,研究体系不够完善,绝大多数研究未采用信号通路及其上下游相关抑制剂作为对照,且大多研究尚停留在单一信号通路研究的层面;其次,至今尚无研究表明中药抑制p38 MAPK信号通路的分子过程,中药与p38 MAPK的潜在结合位点仍需进一步阐明。建议在今后的研究中,可从中药的多靶点治疗入手,从多角度阐述中药防治PSCI的具体机制,从而提供更加确切的科学依据。
参考文献
[ 1 ] 史慧玲,张敏,汪梦月,等.脑卒中后认知障碍病人筛查与管理最佳证据总结[J].护理研究,2021,35(8):1346- 1352.
[ 2 ] 许志祥,吴云成.卒中后认知功能障碍发病机制的研究进展[J].上海医药,2018,39(17):5-8.
[ 3 ] CAUNT C J,KEYSE S M.Dual-specificity MAP kinase phosphatases(MKPs):shaping the outcome of MAP kinase signalling[J].FEBS J,2012,280(2):489-504.
[ 4 ] 刘飞来.电针神庭、百会对缺血性卒中后认知障碍大鼠p38 MAPK信号通路的影响[D].郑州:河南中医学院,2014.
[ 5 ] 申伟,曾子修,金香兰,等.中药治疗卒中后认知障碍疗效和安全性的系统评价[J].中国实验方剂学杂志,2020,26(11):185-193.
[ 6 ] 曾子修,申伟,魏竞竞,等.基于网络药理学探讨健脾益肾化浊方治疗卒中后认知障碍的作用机制[J].世界中医药,2021,16(23):3545-3460.
[ 7 ] LI Z,WANG H,XIAO G,et al. Recovery of post-stroke cognitive and motor deficiencies by Shuxuening injection via regulating hippocampal BDNF-mediated neurotro- phin/Trk signaling[J]. Biomed Pharmacother,2021,141:111828.
[ 8 ] ARTHUR J S C,LEY S C. Mitogen-activated protein kinases in innate immunity[J]. Nat Rev Immunol,2013,13(9):679-692.
[ 9 ] GUO Y J,PAN W W,LIU S B,et al. ERK/MAPK signalling pathway and tumorigenesis[J]. Exp Ther Med,2020,19(3):1997-2007.
[10] TUBITA A,LOMBARDI Z,TUSA I,et al. Beyond kinase activity:ERK5 nucleo-cytoplasmic shuttling as a novel target for anticancer therapy[J]. Int J Mol Sci,2020,21(3):938.
[11] YANG Z H,LU Y J,GU K P,et al. Effect of ulinastatin on myocardial ischemia-reperfusion injury through JNK and p38 MAPK signaling pathways[J]. Eur Rev Med Pharmacol Sci,2019,23(19):8658-8664.
[12] MUNOZ L,AMMIT A J. Targeting p38 MAPK pathway for the treatment of Alzheimer’s disease[J]. Neuropharmacology,2010,58(3):561-568.
[13] BREWSTER J L,DE VALOIR T,DWYER N D,et al. An osmosensing signal transduction pathway in yeast[J]. Science,1993,259(5102):1760-1763.
[14] CUENDA A,NEBREDA A R. p38delta and PKD1:kinase switches for insulin secretion[J]. Cell,2009,136(2):209- 210.
[15] NAVARRETE M,CUARTERO M I,PALENZUELA R,et al. Astrocytic p38α MAPK drives NMDA receptor-dependent long-term depression and modulates long-term memory[J]. Nat Commun,2019,10(1):2968.
[16] LI Y W,LI Q Y,WANG J H,et al. Contribution of p38 MAPK to the ameliorating effect of enriched environment on the cognitive deficits induced by chronic cerebral hypoperfusion[J]. Cell Physiol Biochem,2016,40(3/4):549- 557.
[17] FALCICCHIA C,TOZZI F,ARANCIO O,et al. Involvement of p38 MAPK in synaptic function and dysfunction[J]. Int J Mol Sci,2020,21(16):5624.
[18] ASIH P R,PRIKAS E,STEFANOSKA K,et al. Functions of p38 MAP kinases in the central nervous system[J]. Front Mol Neurosci,2020,13:570586.
[19] GHASEMLOU N,LOPEZ-VALES R,LACHANCE C,et al. Mitogen-activated protein kinase-activated protein kinase 2(MK2)contributes to secondary damage after spinal cord injury[J]. J Neurosci,2010,30(41):13750- 13759.
[20] ZHANG X X,BI X. Post-stroke cognitive impairment:a review focusing on molecular biomarkers[J]. J Mol Neurosci,2020,70(8):1244-1254.
[21] BONAVENTURA A,LIBERALE L,VECCHIÉ A,et al. Update on inflammatory biomarkers and treatments in ischemic stroke[J]. Int J Mol Sci,2016,17(12):1967.
[22] GRIGOLASHVILI M A,MUSTAFINA R M. The role of the inflammatory process in the development of post-stroke cognitive impairment[J]. Zh Nevrol Psikhiatr Im S S Korsakova,2021,121(3. Vyp. 2):16-21.
[23] NARASIMHALU K,LEE J,LEONG Y L,et al. Inflammatory markers and their association with post stroke cognitive decline[J]. Int J Stroke,2015,10(4):513-518.
[24] WAN L,CHENG Y F,LUO Z Y,et al. Neuroprotection,learning and memory improvement of a standardized extract from Renshen Shouwu against neuronal injury and vascular dementia in rats with brain ischemia[J]. J Ethnopharmacol,2015,165:118-126.
[25] LIU H,ZHANG Z H,ZANG C X,et al. GJ-4 ameliorates memory impairment in focal cerebral ischemia/reperfusion of rats via inhibiting JAK2/STAT1-mediated neuroinflammation[J]. J Ethnopharmacol,2021,267:113491.
[26] LIM H S,KIM Y J,KIM B Y,et al. Bakuchiol suppresses inflammatory responses via the downregulation of the p38 MAPK/ERK signaling pathway[J]. Int J Mol Sci,2019,20(14):3574.
[27] CAI M Y,ZHUANG W X,LV E,et al. Kaemperfol alle- viates pyroptosis and microglia-mediated neuroinflammation in Parkinson’s disease via inhibiting p38 MAPK/NF-κB signaling pathway[J]. Neurochem Int,2022,152:105221.
[28] ZHU Z J,GE M,LI C L,et al. Effects of p38 MAPK signaling pathway on cognitive function and recovery of neuronal function after hypoxic-ischemic brain injury in newborn rats[J]. J Clin Neurosci,2020,78:365-370.
[29] QIANG L,SUN X H,AUSTIN T O,et al. Tau does not stabilize axonal microtubules but rather enables them to have long labile domains[J]. Curr Biol,2018,28(13):2181-2189.
[30] SHOJI M. Cerebrospinal fluid and plasma Tau as a biomarker for brain tauopathy[J]. Adv Exp Med Biol,2019,1184:393-405.
[31] CHI N F,CHAO S P,HUANG L K,et al. Plasma amyloid beta and Tau levels are predictors of post-stroke cognitive impairment:a longitudinal study[J]. Front Neurol,2019,10:715.
[32] PUIG B,VINALS F,FERRER I. Active stress kinase p38 enhances and perpetuates abnormal Tau phosphorylation and deposition in Pick’s disease[J]. Acta Neuropathol,2004,107(3):185-189.
[33] 张敏,徐桂华,王维新,等.电针調控p38 MAPK通路降低AD大鼠海马磷酸化Tau蛋白表达的研究[J].南京中医药大学学报,2015,31(3):261-264.
[34] XIAO X Y,ZHU Y X,BU J Y,et al. The autophagy inhi- bitor 3-methyladenine restores sevoflurane anesthesia- induced cognitive dysfunction and neurons apoptosis[J]. Pharmazie,2017,72(4):214-218.
[35] XU J,HUAI Y P,MENG N,et al. L-3-N-butylphthalide activates Akt/mTOR signaling,inhibits neuronal apoptosis and autophagy and improves cognitive impairment in mice with repeated cerebral ischemia-reperfusion injury[J]. Neurochem Res,2017,42(10):2968-2981.
[36] ZHU H L,LIU Z P,YANG W Y,et al. Liraglutide ameliorates β-amyloid deposits and secondary damage in the ipsilateral thalamus and sensory deficits after focal cerebral infarction in rats[J]. Front Neurosci,2018,12:962.
[37] KOCKI J,UŁAMEK-KOZIOŁ M,BOGUCKA-KOCKA A,et al. Dysregulation of amyloid-β protein precursor,β-secretase,presenilin 1 and 2 genes in the rat selectively vulne- rable CA1 subfield of hippocampus following transient global brain ischemia[J]. J Alzheimer’s Dis,2015,47(4):1047-1056.
[38] KHEIRI G,DOLATSHAHI M,RAHMANI F,et al. Role of p38/MAPKs in Alzheimer’s disease:implications for amyloid beta toxicity targeted therapy[J]. Rev Neurosci,2018,30(1):9-30.
[39] 陈景,杨磊,左亚杰,等.黄芩苷改善慢性脑低灌注大鼠认知障碍的作用及机制研究[J].中南药学,2021,19(7):1333-1338.
[40] WANG W Z,LIU X,YANG Z Y,et al. Levodopa improves cognitive function and the deficits of structural synaptic plasticity in Hippocampus induced by global cerebral ischemia/reperfusion injury in rats[J]. Front Neurosci,2020,14:586321.
[41] DAI H L,HU W Y,JIANG L H,et al. p38 MAPK inhibition improves synaptic plasticity and memory in angiotensin Ⅱ-dependent hypertensive mice[J]. Sci Rep,2016,6:27600.
[42] YE Q,ZENG C M,LUO C,et al. Ferrostatin-1 mitigates cognitive impairment of epileptic rats by inhibiting p38 MAPK activation[J]. Epilepsy Behav,2020,103(Pt A):106670.
[43] WHYTE E M,LENZE E J,BUTTERS M,et al. An open-label pilot study of acetylcholinesterase inhibitors to promote functional recovery in elderly cognitively impaired stroke patients[J]. Cerebrovasc Dis,2008,26(3):317-321.
[44] QUINN T J,RICHARD E,TEUSCHl Y,et al. European Stroke Organisation and European Academy of Neurology Joint guidelines on post-stroke cognitive impairment[J]. Eur Stroke J,2022,7(1):85.
[45] 王灿,刘茜茜,田单单,等.基于数据挖掘中药治疗中风病用药规律分析[J].辽宁中医药大学学报,2021,23(10):116-120.
[46] 李虎虎,高青,孙淳,等.基于数据挖掘的糖尿病认知障碍用药规律的研究[J].辽宁中医杂志,2018,45(12):2521- 2523.
[47] 张艾嘉,王爽,王萍,等.缺血性脑卒中的病理机制研究进展及中医药防治[J].中国实验方剂学杂志,2020,26(5):227-240.
[48] WANG M M,WANG F L,PENG D Y,et al. Tao-hong Si-wu decoction alleviates cerebral ischemic damage in rats by improving anti-oxidant and inhibiting apoptosis pathway[J]. Int J Pharmacol,2020,16(3):214-222.
[49] WANG M M,LIU Z Q,HU S S,et al. Taohong siwu decoction ameliorates ischemic stroke injury via suppressing pyroptosis[J]. Front Pharmacol,2020,11:590453.
[50] 孙晓丽,王勇,刘俊杰,等.龙生蛭胶囊对脑卒中大鼠行为学的影响及脑组织的保护作用[J].中国实验方剂学杂志,2019,25(24):23-29.
[51] LI Q,CHEN Y,ZHAO D,et al. Longshengzhi capsule reduces carrageenan-induced thrombosis by reducing activation of platelets and endothelial cells[J]. Pharmacol Res,2019,144:167-180.
[52] YANG W N,ZHANG L C,CHEN S M,et al. Longshengzhi capsules improve ischemic stroke outcomes and reperfusion injury via the promotion of anti-inflammatory and neuroprotective effects in MCAO/R rats[J]. Evid Based Complement Alternat Med,2020,2020:9654175.
[53] 李春雷,張峰,黄川锋.血塞通注射液联合苏合香丸治疗脑梗死急性期的临床研究[J].中国临床药理学杂志,2016,32(15):1350-1352,1366.
[54] 劉辉,王姣,马岱朝,等.苏合香丸治疗蛛网膜下腔出血的网络药理学研究[J].辽宁中医杂志,2020,47(7):131- 136,223.
[55] JEON S,HUR J,JEONG H J,et al. SuHeXiang Wan essential oil alleviates amyloid beta induced memory impairment through inhibition of tau protein phosphorylation in mice[J]. Am J Chin Med,2011,39(5):917-932.
[56] 马春潮,郭洁,姜昭,等.养血清脑颗粒联合多奈哌齐对脑小血管病认知障碍的疗效观察[J].山西中医药大学学报,2020,21(3):196-198.
[57] 李晶,马原源,刘斌,等.养血清脑颗粒对血管性痴呆大鼠海马CA1区CD11b表达的影响[J].中国中西医结合杂志,2016,36(5):619-623.
[58] 伞云琨.养血清脑颗粒对血管性痴呆大鼠海马CA1区BDNF及相关信号转导蛋白表达的影响[D].唐山:华北理工大学,2016.
[59] 王丹,赵瑞珍,李小黎,等.益肾调气法对血管性痴呆模型大鼠脑单胺神经递质的干预作用[J].世界中医药,2020,15(10):1395-1399.
[60] 郑春翔,赵瑞珍,赵子珺,等.颐脑解郁方对血管性痴呆模型大鼠p38-MAPK信号蛋白表达的影响[J].中西医结合心脑血管病杂志,2020,18(3):419-423.
[61] 高新,王宁,刘继男,等.丹红注射液联合依达拉奉治疗老年急性脑梗死的疗效及对血液流变学的影响[J].中国老年学杂志,2021,41(20):4357-4360.
[62] LYU M,YAN C L,LIU H X,et al. Network pharmaco- logy exploration reveals endothelial inflammation as a common mechanism for stroke and coronary artery disease treatment of Danhong injection[J]. Sci Rep,2017,7(1):15427.
[63] DU H X,HE Y,PAN Y J,et al. Danhong injection atte- nuates cerebral ischemia-reperfusion injury in rats through the suppression of the neuroinflammation[J]. Front Pharmacol,2021,12:561237.
[64] 韩广卉,李东岳,余虹霓,等.脑心安胶囊对慢性脑缺血致血管性认知障碍大鼠胶质细胞激活及炎性反应的调节作用[J].中国实验方剂学杂志,2021,27(19):46-55.
[65] 张野,丛德毓,张红石,等.头针联合中药对缺血性脑卒中后认知障碍大鼠p38 MAPK作用研究[J].吉林中医药,2021,41(7):935-938.
[66] SUN K,FAN J Y,HAN J Y. Ameliorating effects of traditional Chinese medicine preparation,Chinese materia medica and active compounds on ischemia/reperfusion-induced cerebral microcirculatory disturbances and neuron damage[J]. Acta Pharm Sin B,2015,5(1):8-24.
[67] FLEENOR B S,SINDLER A L,MARVI N K,et al. Curcumin ameliorates arterial dysfunction and oxidative stress with aging[J]. Exp Gerontol,2013,48(2):269-276.
[68] HUANG L F,CHEN C W,ZHANG X,et al. Neuropro- tective effect of curcumin against cerebral ischemia-reperfusion via mediating autophagy and inflammation[J]. J Mol Neurosci,2018,64(1):129-139.
[69] XU H,WANG E,CHEN F,et al. Neuroprotective phytochemicals in experimental ischemic stroke:mechanisms and potential clinical applications[J]. Oxid Med Cell Longev,2021,2021(4):1-45.
[70] LIU S,ZHOU T,CHEN D,et al. In silico-determined compound from the root of Pueraria lobate alleviates sy- naptic plasticity injury induced by Alzheimer’s disease via the p38 MAPK-CREB signaling pathway[J]. Food Funct,2021,12(3):1039-1050.
[71] ZHU T,WANG L,FENG Y,et al. Classical active ingre- dients and extracts of Chinese herbal medicines:pharmacokinetics,pharmacodynamics,and molecular mechanisms for ischemic stroke[J]. Oxid Med Cell Longev,2021,2021(7):1-27.
[72] 武文文,吴诗卉,刘春红,等.人参皂苷Rg1对局灶性脑缺血再灌注损伤模型大鼠的预防作用及机制研究[J].中国药房,2020,31(11):1287-1293.
[73] 王敏,刘建勋,姚明江,等.抗脑缺血后神经损伤中药及其药理学研究进展[J].中国中药杂志,2020,45(3):513- 517.
[74] 李思宇,李余霞,王庆松,等.三七总皂苷改善慢性脑低灌注大鼠认知障碍的行为学研究[J].中华老年心脑血管病杂志,2020,22(12):1316-1320.
[75] WANG X S,YANG L,YANG L,et al. Gypenoside Ⅸsuppresses p38 MAPK/Akt/NFκB signaling pathway activation and inflammatory responses in astrocytes stimu- lated by proinflammatory mediators[J]. Inflammation,2017,40(6):2137-2150.
[76] MENG X B,XIE W J,XU Q F,et al. Neuroprotective effects of Radix Scrophulariae on cerebral ischemia and reperfusion injury via MAPK pathways[J]. Molecules,2018,23(9):2401.
[77] 纪禄风,石向慧,陈蓓蓓,等.当归提取物降血压机制的研究现状[J].时珍国医国药,2016,27(8):1965-1967.
[78] CHENG C Y,KAO S T,LEE Y C. Angelica sinensis extract protects against ischemia-reperfusion injury in the hippocampus by activating p38 MAPK-mediated p90RSK/p-Bad and p90RSK/CREB/BDNF signaling after transient global cerebral ischemia in rats[J]. J Ethnopharmacol,2020,252:112612.
[79] TULSULKAR J,GLUECK B,HINDS T D,Jr,et al. Ginkgo biloba extract prevents female mice from ischemic brain damage and the mechanism is independent of the HO1/Wnt pathway[J]. Transl Stroke Res,2016,7(2):120-131.
[80] 楊申. p38 MAPK信号转导通路参与血管性痴呆大鼠海马细胞凋亡机制及Egb761保护作用的研究[J].社区医学杂志,2014,12(16):4-6.
[81] 董强,郭起浩,罗本燕,等.卒中后认知障碍管理专家共识[J].中国卒中杂志,2017,12(6):519-531.
[82] MIJAJIONIC M D,PAVLOVIC A,BRAININ M,et al. Post-stroke dementia:a comprehensive review[J]. BMC Med,2017,15(1):11.
(收稿日期:2021-12-20 修回日期:2022-03-29)
(编辑:邹丽娟)

