新型3-烯色满酮拼接季碳氧化吲哚类化合物的合成
谢 丹, 陈子月, 朱 君, 韩晓雪, 张 敏, 刘雄利, 邓国栋
(贵州大学 西南药食两用资源开发利用技术国家地方联合工程研究中心,贵州 贵阳 550025)
根据新药设计中基于药物优势骨架导向的结构多样化合成策略[1-4],将多个潜在生物活性骨架拼接成一个骨架多样化的结构分子,在新药开发中是极其重要的研究领域。色满酮骨架和色酮骨架在药物分子和天然产物中普遍存在。例如天然产物分子ergochrome AD, ergochrome CD, Diaportheone A, Isoagarotetrol和isocochlioquinone A共享一个色满酮骨架或色酮骨架单元,该类骨架化合物在药物合成领域发挥着重要作用[5];季碳氧化吲哚广泛存在天然产物和合成药物分子中[6-17],吸引了药物化学团队的广泛关注。因此,将色满酮骨架和色酮骨架拼接到季碳氧化吲哚骨架上,有望合成一系列具备潜在生物活性的3-烯色满酮拼接季碳氧化吲哚类化合物。这能够为生物活性筛选提供物质基础,对医药行业有潜在应用价值。
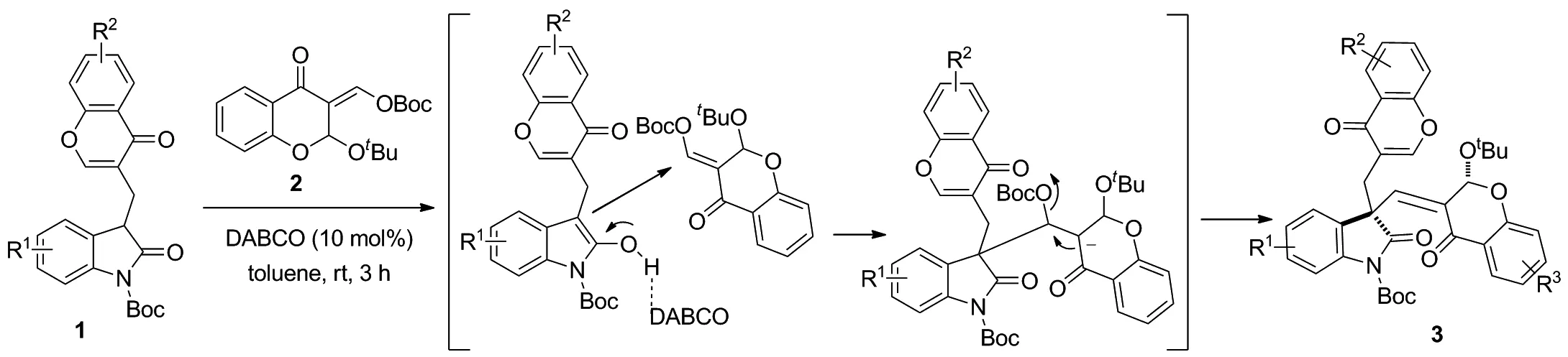
本文基于新的方法学研究,以色酮取代氧化吲哚(1)为原料,在有机碱DABCO的催化作用下,进攻3-烯色满酮(2)的烯键,发生Michael加成反应,然后脱除OBoc基团生成烯键,合成了9个未见文献报道的3-烯色满酮拼接季碳氧化吲哚类化合物(3a~3i, Scheme 1),产率60%~87%,dr值为2∶1~5∶1,其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征,并通过单晶培养确定了化合物3f的相对构型。

Scheme 1
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪;Bruker-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标); MicroTMQ-TOF型高分辨质谱仪。
所用试剂均为分析纯。
1.2 3a~3i的合成(以3a为例)
在反应管中依次加入78.2 mg色酮取代氧化吲哚1a(0.20 mmol), 104.4 mg 3-烯色满酮2a(0.30 mmol), 2.3 mg催化剂DABCO(10 mol/mol, 0.002 mmol)和2.0 mL甲苯,搅拌反应3 h(TLC检测)。经硅胶柱层析[洗脱剂:V(石油醚):V(乙酸乙酯)=6∶1]纯化得化合物3a108.1 mg。
用类似的方法合成3b~3i。
3a: 淡黄色固体,m.p.51.6~52.7 ℃,产率87%, 3∶1dr;1H NMRδ: 0.77(s, 9H), 1.54(s, 9H), 3.20(d,J=13.6 Hz, 1H), 3.43(d,J=14.0 Hz, 1H), 5.84(s, 1H), 6.71~6.74(m, 2H), 6.93~6.97(m, 2H), 7.10~7.16(m, 2H), 7.27~7.31(m, 3H), 7.48~7.54(m, 2H), 7.62(s, 1H), 7.86(d,J=8.4 Hz, 1H), 7.92(d,J=7.6 Hz, 1H);13C NMRδ: 27.0, 27.1, 34.4, 52.8, 75.5, 83.8, 91.7, 113.7, 116.9, 117.5, 120.6, 124.1, 124.5, 124.9, 126.2, 128.0, 132.5, 134.8, 136.3, 147.7, 153.4, 155.0, 156.2, 174.3, 175.2, 181.4; HR-MS(ESI-TOF)m/z: Calcd. for C37H35NNaO8{[M+Na]+}644.2255, found 644.2251。
3b: 淡黄色固体,m.p.62.0~63.5 ℃,产率79%, 4∶1dr;1H NMRδ: 0.77(s, 9H), 1.54(s, 9H), 2.30(s, 3H), 3.19(d,J=13.6 Hz, 1H), 3.43(d,J=14.0 Hz, 1H), 5.85(s, 1H), 6.71(d,J=8.0 Hz, 1H), 6.92~6.95(m, 2H), 7.10~7.12(m, 1H), 7.14~7.19(m, 2H), 7.29~7.36(m, 3H), 7.60(s, 1H), 7.70(s, 1H), 7.86~7.88(m, 1H);13C NMRδ: 19.8, 27.0, 27.2, 34.3, 52.9, 75.5, 83.8, 91.7, 113.7, 116.6, 117.5, 120.6, 122.1, 124.1, 124.2, 124.5, 126.2, 128.0, 128.7, 133.7, 134.0, 134.8, 135.2, 136.4, 137.5, 147.7, 153.3, 156.2; HR-MS(ESI-TOF)m/z: Calcd. for C38H37NNaO8{[M+Na]+}658.2411, found 658.2414。
3c: 淡黄色固体,m.p.61.7~63.4 ℃,产率67%, 3∶1dr;1H NMRδ: 0.78(s, 9H), 1.55(s, 9H), 3.20(d,J=14.0 Hz, 1H), 3.38(d,J=13.6 Hz, 1H), 5.84(s, 1H), 6.66~6.71(m, 1H), 6.94(s, 1H), 7.11~7.13(m, 1H), 7.18~7.20(m, 1H), 7.24~7.25(m, 1H), 7.27~7.30(m, 2H), 7.44~7.48(m, 3H), 7.59(d,J=8.0 Hz, 1H), 7.66~7.68(m, 1H), 7.87~7.88(m, 1H);13C NMRδ: 27.0, 27.2, 34.3, 52.7, 75.5, 83.9, 91.7, 113.7, 117.0, 117.5, 117.6, 118.7, 120.6, 124.2, 124.3, 124.4, 125.2, 125.6, 126.2, 128.1, 130.1, 132.7, 133.8, 134.9, 136.0, 153.6, 159.6, 174.1, 181.4; HR-MS(ESI-TOF)m/z: Calcd. for C37H34ClNNaO8{[M+Na]+}678.1865, found 678.1866。
3d: 淡黄色固体,m.p.57.1~59.1 ℃,产率65%, 2∶1dr;1H NMRδ: 0.82(s, 9H), 1.56(s, 9H), 2.35(s, 3H), 3.24(d,J=13.6 Hz, 1H), 3.43(d,J=13.6 Hz, 1H), 5.83(s, 1H), 6.64~6.67(m, 1H), 6.7(d,J=8.0 Hz, 1H), 6.77~6.79(m, 1H), 6.85~6.87(m, 1H), 6.93~6.97(m, 1H), 7.03~7.05(m, 1H), 7.19(d,J=12.0 Hz, 1H), 7.32~7.37(m, 3H), 7.55(s, 1H), 7.65(s, 1H), 7.81(s, 1H);13C NMRδ: 18.8, 26.0, 26.1, 52.3, 74.5, 82.0, 95.8, 108.6, 111.2, 115.4, 115.6, 115.8, 119.7, 123.3, 125.5, 132.8, 133.2, 133.8, 133.9, 134.5, 137.3, 147.5, 152.3, 174.2, 180.3; HR-MS(ESI-TOF)m/z: Calcd. for C38H36FNNaO8{[M+Na]+}676.2317, found 676.2316。
3e: 淡黄色固体,m.p.94.0~95.1 ℃,产率61%, 3∶1dr;1H NMRδ: 0.81(s, 9H), 1.53(s, 9H), 2.23(s, 3H), 3.21(d,J=13.6 Hz, 1H), 3.36(d,J=14.0 Hz, 1H), 5.76(s, 1H), 6.61~6.64(m, 2H), 7.12~7.17(m, 3H), 7.25~7.29(m, 3H), 7.57~7.59(m, 2H), 7.67~7.66(m, 2H);13C NMRδ: 19.4, 27.0, 27.2, 34.7, 52.6, 75.4, 84.1, 91.6, 115.0, 116.9, 117.3, 120.3, 122.3, 124.6, 125.0, 126.0, 128.0, 130.1, 132.6, 135.1, 135.9, 136.0, 138.0, 147.6, 153.3, 154.4, 155.0, 173.4, 181.4; HR-MS(ESI-TOF)m/z: Calcd. for C38H36ClNNaO8{[M+Na]+}692.2022, found 692.2025。
3f: 淡黄色固体,m.p.77.3~79.1 ℃,产率60%, 2∶1dr;1H NMRδ: 0.84(s, 9H), 1.58(s, 9H), 3.25(d,J=13.6 Hz, 1H), 3.47(d,J=13.6 Hz, 1H), 5.88(s, 1H), 6.74~6.78(m, 1H), 6.83~6.85(m, 3H), 7.24(d,J=8.0 Hz, 1H), 7.30~7.33(m, 3H), 7.53~7.56(m, 2H), 7.67(s, 1H), 7.93~7.95(m, 1H), 8.03~8.05(m, 1H);13C NMRδ: 27.1, 27.5, 34.6, 52.8, 75.7, 84.0, 96.8, 114.2, 117.0, 117.1, 117.2, 117.5, 120.7, 122.9, 123.0, 124.2, 124.3, 125.0, 126.6, 132.6, 134.8, 148.3, 153.5, 155.1, 156.8, 173.0, 176.0, 181.3; HR-MS(ESI-TOF)m/z: Calcd. for C37H34ClNNaO8{[M+Na]+}678.1865, found 678.1869。
3g: 淡黄色固体,m.p.56.2~57.7 ℃,产率69%, 2∶1dr;1H NMRδ: 0.83(s, 9H), 1.55(s, 9H), 2.23(s, 3H), 3.15(d,J=16.0 Hz, 1H), 3.48(d,J=13.6 Hz, 1H), 5.84(s, 1H), 6.62~6.68(m, 2H), 6.84(s, 1H), 7.07~7.10(m, 1H), 7.19(s, 1H), 7.23~7.29(m, 3H), 7.56(s, 1H), 7.66~7.67(m, 2H), 7.93~7.95(m, 1H);13C NMRδ: 19.4, 26.9, 27.2, 34.1, 52.6, 75.5, 84.4, 91.6, 114.4, 116.9, 117.3, 120.3, 124.1, 124.2, 125.0, 125.5, 126.0, 132.6, 136.0, 138.3, 138.6, 153.5, 155.0, 173.9, 175.2, 181.4; HR-MS(ESI-TOF)m/z: Calcd. for C38H36ClNNaO8{[M+Na]+}692.2022, found 692.2023。
3h: 淡黄色固体,m.p.52.7~53.2 ℃,产率70%, 3∶1dr;1H NMRδ: 0.77(s, 9H), 1.53(s, 9H), 2.22(s, 3H), 2.30(s, 3H), 3.19(d,J=13.6 Hz, 1H), 3.42(d,J=13.6 Hz, 1H), 5.81(s, 1H), 6.60(d,J=8.4 Hz, 1H), 6.91(s, 1H), 7.09~7.11(m, 1H), 7.14~7.17(m, 3H), 7.29~7.30(m, 2H), 7.60(s, 1H), 7.65~7.66(m, 1H), 7.70(s, 1H);13C NMRδ: 19.4, 19.8, 27.0, 27.2, 52.8, 75.4, 83.8, 91.6, 113.7, 116.6, 117.3, 120.3, 124.3, 125.9, 127.9, 133.7, 134.0, 135.9, 136.3, 147.7, 153.4, 154.2, 174.4, 175.3, 181.6; HR-MS(ESI-TOF)m/z: Calcd. for C39H39NNaO8{[M+Na]+}672.2568, found 672.2573。
3i: 淡黄色固体,m.p.59.3~61.7 ℃,产率63%, 5∶1dr;1H NMRδ: 0.76(s, 9H), 1.53(s, 9H), 2.22(s, 3H), 3.20(d,J=13.6 Hz, 1H), 3.42(d,J=13.6 Hz, 1H), 5.80(s, 1H), 6.61(d,J=8.0 Hz, 1H), 6.92(s, 1H), 7.10~7.12(m, 1H), 7.16~7.18(m, 2H), 7.24(d,J=7.6 Hz, 1H), 7.27~7.31(m, 2H), 7.51~7.53(m, 1H), 7.57~7.59(m, 1H), 7.62(s, 1H), 7.66(s, 1H), 7.92~7.95(m, 1H);13C NMRδ: 19.4, 27.0, 27.1, 34.4, 52.8, 75.4, 83.8, 91.6, 113.7, 116.9, 117.3, 120.3, 124.1, 124.5, 124.9, 125.9, 128.0, 130.0, 132.5, 135.4, 135.9, 136.2, 137.6, 147.7, 153.4, 155.0, 174.4, 181.5; HR-MS(ESI-TOF)m/z: Calcd. for C38H37NNaO8{[M+Na]+}658.2411, found 658.2414。
2 结果与讨论
2.1 合成
对底物通过扩展,返现该反应活性较高,在甲苯、室温条件下反应3 h基本能反应完全,目标化合物3产率为60%~87%,dr值为2∶1~5∶1。色酮环无论吸电子取代或者给电子取代,该反应都能顺利进行。
2.2 化合物3f的单晶分析
在无水乙醇溶剂中对化合物3f进行了单晶培养,分析了白色晶体3f(CCDC: 2128743)的结构。图1为化合物3f的单晶结构图。由图1分析可知,化合物3f属orthorhombic晶系,Pbca空间群,晶胞参数a=11.0548(5) Å,b=22.1326(11) Å,c=27.632(2) Å,α=90°,β=90°,γ=90°。
Scheme 2
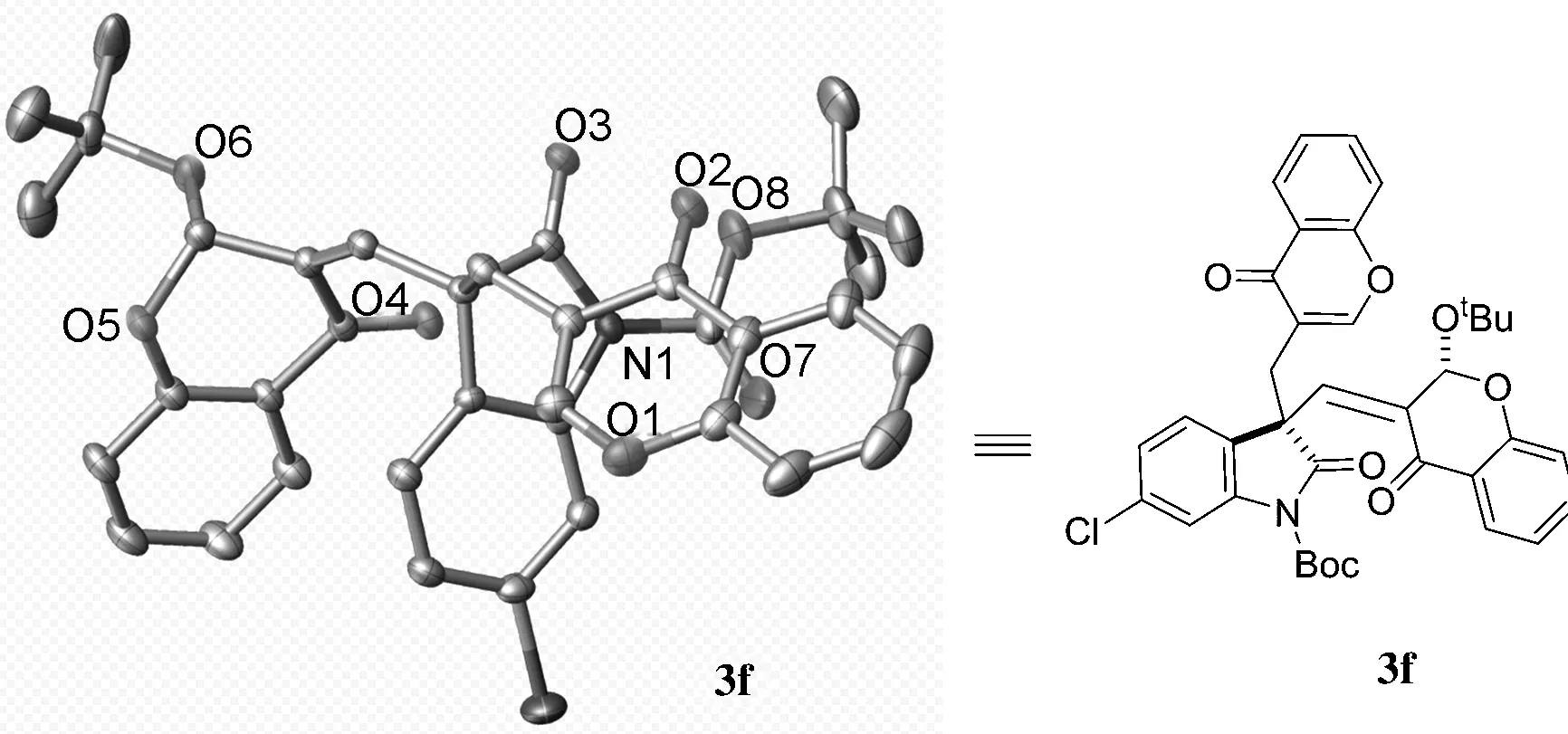
图1 化合物3f的单晶结构
2.3 反应机理
在实验基础上,推测了反应的可能机理:首先,色酮取代氧化吲哚1在有机碱DABCO的催化作用下,进攻3-烯色满酮2的烯键发生Michael加成反应;然后脱除OBoc基团生成烯键得目标产物3-烯色满酮拼接季碳氧化吲哚类化合物3。
基于新的方法学研究,合成了9个未见文献报道的3-烯色满酮拼接季碳氧化吲哚类化合物3a~3i,并通过单晶培养确定了化合物3f的相对构型。该类化合物含有色酮、色满酮和氧化吲哚等3个具有潜在生物活性的骨架,有望为生物活性筛选提供化合物源。

