苯胺类受体荧光探针识别位点的差异性构筑与识别机制研究
成 昭, 郑 蕾, 徐 玥, 何 昊
(西安医学院 药学院,陕西 西安 710021)
作为一种在分子水平进行目标物检测的分析测试技术,并明显区别于诸多传统检测手段对检测设备与样品处理的较高要求,小分子荧光探针能够实现对目标物的快速、灵敏与直观检测[1-2]。
现阶段针对小分子荧光探针的研究,多集中于已合成探针对诸多可能目标物的识别性能筛选与后续定性、定量分析,而如何基于探针与目标物分子水平的识别机制、进行探针分子结构的定向构筑与合成,仍是该领域的研究难点。
本论文对苯胺类受体荧光探针进行识别位点的差异性设计,分别以苯胺、邻苯二胺、间苯二胺作为起始原料,通过溴乙酸甲酯对氨基氢的取代,分别在识别基团中引入了两个、邻位四个与间位四个识别位点,定向构筑一系列结构相似、仅识别位点具有差异的探针S1、S4与S5(图1),。通过识别位点数目与识别基团空间排布的差异性设计,调控探针与目标物的结合能力,以期实现对探针与目标物结合过程的识别机制研究。

图1 探针S1、 S4、 S5的结构
本文以苯胺、邻苯二胺、间苯二胺、溴乙酸甲酯、三氯氧磷等为原料,经3步合成得到一系列苯胺型荧光探针S1、S4、S5(光谱测试中使用探针S1、S4、S5的铯盐,即T1、T4、T5),合成路线(以S4/T4为例, Scheme 1)。
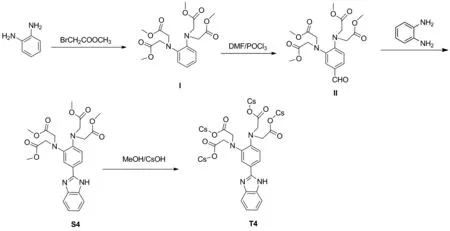
Scheme 1
1 实验部分
1.1 仪器与试剂
XT-4型显微熔点仪;SHIMADZU UV-1700型紫外分光光度计;Bruker AVANCE III 400 MHz型超导核磁共振波谱仪(CDCl3、 CD3OD为溶剂,TMS为内标);Bruker TENSOR T-27型傅里叶变换红外光谱仪(KBr压片);Bruker microTOF-QⅡ ESI-Q-TOF LC/MS/MS型飞行时间-质联仪;PerkinElmer LS-55型荧光分光光度计。
苯胺、邻苯二胺、间苯二胺、溴乙酸甲酯、三氯氧磷、无水碳酸钾,化学纯,国药集团化学试剂有限公司;乙腈、N,N-二甲基甲酰胺(DMF),、甲醇、乙醇、乙酸乙酯、正己烷,化学纯,天津市天力化学试剂有限公司。
1.2 合成
(1) 化合物I的合成
向25 mL乙腈中,加入邻苯二胺(1.08 g, 0.01 mol),二异丙基乙基胺(17.4 mL, 0.1 mol),与溴乙酸甲酯为(9.4 mL, 0.1 mol),于80 ℃反应12 h。待反应结束,冷却至室温,以100 mL冰水稀释、二氯甲烷(3×100 mL),萃取,用无水硫酸钠干燥,真空旋干溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/正己烷=1/3,V/V)纯化得1-N,N-2-N′,N′-四乙酸甲酯基-1,2-二氨基苯(I)。
反应物投入量分别为苯胺(2.28 mL, 0.025 mol),二异丙基乙胺(21.75 mL, 0.125 mol),溴乙酸甲酯(11.75 mL, 0.125 mol),以及间苯二胺(1.08 g, 0.01 mol),二异丙基乙基胺(17.4 mL, 0.1 mol),溴乙酸甲酯为(9.4 mL, 0.1 mol),用类似的方法合成N,N-二乙酸甲酯基苯胺和1-N,N-3-N′,N′-四乙酸甲酯基-1,3-二氨基苯。
N,N-二乙酸甲酯基苯胺: 淡黄色油状液体,收率88%;1H NMR(CDCl3, 400MHz)δ: 6.75(t,J=8.0 Hz, 2H, Ar-H), 6.31(t,J=7.3 Hz, 1H, Ar-H), 6.14(d,J=8.4 Hz, 2H, Ar-H), 3.67(s, 4H, 2×-CH2-), 3.28(s, 6H, 2×-CH3); IRν: 3031.33, 2952.76, 2849.55, 1742.01, 1601.25, 1504.75, 1270.22, 1204.01, 752.82, 693.38 cm-1; ESI-MSm/z: 260.0891{[M+Na]+}。
1-N,N-2-N′,N′-四乙酸甲酯基-1,2-二氨基苯: 白色粉末状固体,收率89%, m.p.135~136 ℃;1H NMR(CDCl3, 400MHz)δ: 7.09~7.05(m, 2H, Ar-H), 6.98~6.92(m, 2H, Ar-H), 4.32(s, 8H, 4×-CH2-), 3.66(s, 12H, 4×-CH3); IRν: 2954.99, 1737.74, 1595.73, 1498.15, 1206.20, 768.23 cm-1; ESI-MSm/z: 419.1420 {[M+Na]+}。
1-N,N-3-N′,N′-四乙酸甲酯基-1,3-二氨基苯: 白色粉末状固体,收率82%, m.p.85~86 ℃;1H NMR(CDCl3, 400MHz)δ: 7.06(t,J=8.2 Hz, 1H, Ar-H), 6.07(d,J=8.1 Hz, 2H, Ar-H), 5.79(s, 1H, Ar-H), 4.11(s, 8H, 4×-CH2-), 3.75(s, 12H, 4×-CH3); IRν: 3002.65, 2951.82, 2847.39, 1727.88, 1611.92, 1576.57, 1513.09, 1196.52, 800.94, 678.11 cm-1; ESI-MSm/z: 419.1430{[M+Na]+}。
(2) 化合物II的合成
控制温度为5~10 ℃,向20 mL DMF中,缓慢滴入POCl3(2.4 mL),再向化合物I(3.96 g, 0.01 mol)的20 mL DMF溶液中,滴入上述POCl3/DMF混合物,于75 ℃反应4 h。待反应结束,冷却至室温,将其倒入100 mL冰水中,抽滤得到固体粗品,经硅胶柱层析(洗脱剂:乙酸乙酯/正己烷=1/1,V/V),纯化得得4-甲酰基-1-N,N-2-N′,N′-四乙酸甲酯基-1,2-二氨基苯(II)。
反应物投入量为N,N-二乙酸甲酯基苯胺(2.37 g, 0.01 mol), 1-N,N-2-N′,N′-四乙酸甲酯基-1,2-二氨基苯/1-N,N-3-N′,N′-四乙酸甲酯基-1,3-二氨基苯(3.96 g, 0.01 mol),。
4-甲酰基-N,N-二乙酸甲酯基苯胺: 淡黄色粉末状固体,收率85%, m.p.58~60 ℃;1H NMR(CDCl3, 400 MHz)δ: 9.79(s, 1H, -CHO), 7.76(d,J=7.8Hz, 2H, Ar-H), 6.66(d,J=8.0 Hz, 2H, Ar-H), 4.23(s, 4H, 2×-CH2-), 3.79(s, 6H, 2×-CH3); IRν: 2824.47, 2743.11, 1746.67, 1599.54, 1523.10, 1207.48, 814.96 cm-1; ESI-MSm/z: 288.0847{[M+Na]+}。
4-甲酰基-1-N,N-2-N′,N′-四乙酸甲酯基-1,2-二氨基苯: 淡黄色粉末状固体,收率88%, m.p.114~115 ℃;1H NMR(CDCl3, 400 MHz)δ: 9.84(s, 1H, -CHO), 7.60(s, 1H, Ar-H), 7.50(d,J=8.2Hz, 1H, Ar-H), 7.11(d,J=8.6Hz, 1H, Ar-H), 4.44(s, 4H, 2×-CH2-), 4.30(s, 4H, 2×-CH2-), 3.69(s, 6H, 2×-CH3), 3.67(s, 6H, 2×-CH3); IRν: 3003.45, 2955.46, 2919.72, 1740.53, 1593.81, 1505.48, 1207.25, 906.75, 834.22 cm-1; ESI-MSm/z: 447.1378 {[M+Na]+}。
4-甲酰基-1-N,N-3-N′,N′-四乙酸甲酯基-1,3-二氨基苯: 淡黄色粉末状固体,收率80%, m.p.98~99 ℃;1H NMR(CDCl3, 400 MHz)δ: 9.85(s, 1H, -CHO), 7.60(d,J=8.7 Hz, 1H, Ar-H), 6.29(d,J=8.6 Hz, 1H, Ar-H), 6.09(s, 1H, Ar-H), 4.15(s, 8H, 4×-CH2-), 3.77(s, 6H, 2×-CH3), 3.74(s, 6H, 2×-CH3); IRν: 3006.48, 1744.59, 1679.51, 1605.68, 1510.75, 1475.49, 1216.20, 1169.55, 824.26, 794.20 cm-1; ESI-MSm/z: 447.1370{[M+Na]+}。
(3) 探针S1、S4、S5的合成
向20 mL无水乙醇中,加入化合物II(0.42 g, 1 mmol)与邻苯二胺(0.11 g, 1 mmol),于80 ℃反应8 h。待反应结束,冷却至室温,真空旋干溶剂,残余物经硅胶柱层析(洗脱剂:乙酸乙酯/正己烷=2/1,V/V),纯化得目标荧光探针S4。
反应物投入量为4-甲酰基-N,N-二乙酸甲酯基苯胺(0.27 g, 1 mmol), 4-甲酰基-1-N,N-2-N′,N′-四乙酸甲酯基-1,2-二氨基苯/4-甲酰基-1-N,N-3-N′,N′-四乙酸甲酯基-1,3-二氨基苯(0.42 g, 1 mmol)。
4-苯并咪唑基-N,N-二乙酸甲酯基苯胺(探针S1): 白色粉末状固体,收率71%, m.p.202~204 ℃;1H NMR(CD3OD, 400MHz)δ: 7.86(d,J=8.6Hz, 2H, Ar-H), 7.48(dd,J=5.7, 3.1 Hz, 2H, Ar-H), 7.13(dd,J=5.8, 3.0 Hz, 2H, Ar-H), 6.61(d,J=8.7 Hz, 2H, Ar-H), 4.13(s, 4H, 2×-CH2-), 3.70(s, 6H, 2×-CH3), 3.27(s, 1H, -NH-); IRν: 3599.68, 1740.71, 1614.33, 1504.57, 1446.39, 1207.37, 836.18 cm-1; ESI-MSm/z: 354.1445{[M+H]+}。
4-苯并咪唑基-1-N,N-2-N′,N′-四乙酸甲酯基-1,2-二氨基苯(探针S4): 黄色粉末状固体,收率80%, m.p.186~187 ℃;1H NMR(CD3OD, 400 MHz)δ: 7.97(s, 1H, -NH-), 7.87(d,J=1.7Hz, 1H, Ar-H), 7.67(dd,J=8.4, 1.7 Hz, 1H, Ar-H), 7.58(dd,J=6.0, 3.1 Hz, 2H, Ar-H), 7.25(dd,J=6.0, 3.1 Hz, 2H, Ar-H), 7.17(d,J=8.4 Hz, 1H, Ar-H), 4.43(s, 4H, 2×-CH2-), 4.41(s, 4H, 2×-CH2-), 3.65(s, 6H, 2×-CH3), 3.64(s, 6H, 2×-CH3); IRν: 3463.73, 1744.10, 1672.38, 1612.50, 1500.43, 439.38, 1208.08, 1172.26, 938.24, 879.17 cm-1; ESI-MSm/z: 513.1984{[M+H]+}。
4-苯并咪唑基-1-N,N-3-N′,N′-四乙酸甲酯基-1,3-二氨基苯(探针S5): 黄色粉末状固体,收率78%, m.p.189~191 ℃;1H NMR(CD3OD, 400 MHz)δ: 7.52(d,J=8.5 Hz, 1H, Ar-H), 7.13(s, 2H, Ar-H), 6.81(s, 2H, Ar-H), 6. 25(s, 1H, Ar-H), 6.13(d,J=8.6 Hz, 1H, Ar-H), 3.84(s, 4H, 2×-CH2-), 3.68(s, 1H, -NH-), 3.53(s, 4H, 2×-CH2-), 3.33(s, 6H, 2×-CH3), 3.23(s, 6H, 2×-CH3); IRν: 3443.23, 1743.25, 1605.59, 1507.98, 1459.24, 1208.12, 883.82, 809.11 cm-1; ESI-MSm/z: 513.1985{[M+H]+}。
(4) 探针T1、T4、T5的合成
用于水系离子分析时,将乙酸甲酯结构的荧光探针S1、S4、S5水解为其羧酸盐形式,即铯盐结构的荧光探针T1、T4、T5。水解方法为:向10 mL无水乙醇中加入S1(0.0353 g,0.1 mmol), CsOH·H2O(0.1679 g, 1 mmol), 80 ℃反应12 h。待反应结束、冷却,旋干溶剂,即得到探针T1。
T4、T5的制备方法类似,反应用量为S4/S5(0.0512 g,0.1 mmol)。
2 结果与讨论
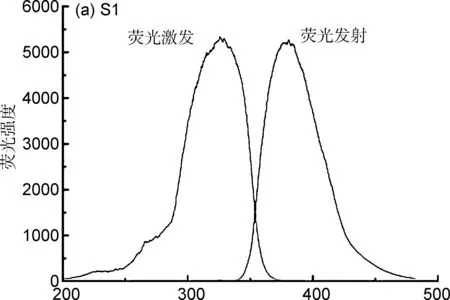
2.1 探针的荧光激发与发射光谱
配制探针溶液,使S1、S4、S5浓度均为1×10-5mol L-1,进行200~500 nm波段荧光光谱扫描,得到如图2所示的探针荧光激发与发射光谱。由图2可知,S1、S4、S5荧光激发与发射光谱呈现良好的镜像对称关系(S1: λex,max=325 nm, λem,max=380 nm;S4: λex,max=326 nm, λem,max=410 nm;S5: λex,max=353 nm, λem,max=410 nm),斯托克位移分别为55、 84、 57 nm。相对于S1,探针S4与S5分子中,受体部分邻位/间位氨基的引入与氨基氢的后续修饰,使S4、S5荧光吸收与发射光谱均表现红移。通过改变取代基,进而调控探针分子的荧光光谱,对于新型荧光探针的设计具有一定的指导意义。
λ/nm
2.2 探针对金属离子的选择性
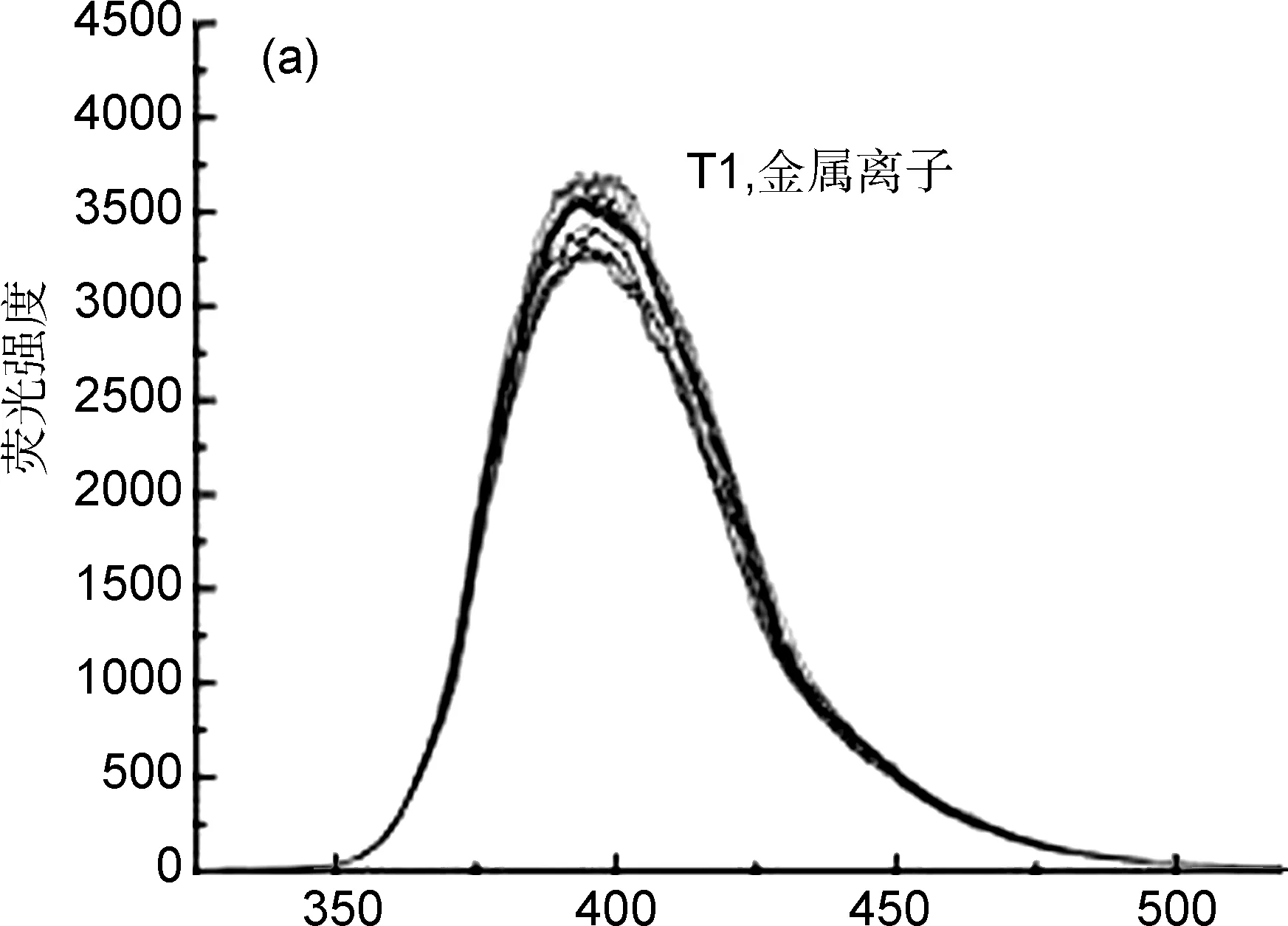
设计以碱金属(Na+),碱土金属(Mg2+、 Ca2+、 Ba2+),过渡金属(Fe3+、 Fe2+、 Cu2+、Zn2+、 Cd2+、 Cr3+、 Hg2+、 Ag+)及Sn2+、 Al3+等15种常见金属离子,进行探针对金属离子的选择性研究。向1号比色管中加入探针T1/T4/T5溶液,向2~15号比色管中,分别加入Tris-HCl、探针与各金属离子,使探针与金属离子的终浓度均为1×10-5mol L-1,混匀后进行300~550 nm波段内的光谱扫描,得到图3。由图3(a)可知,各金属离子的加入均未引起探针T1的荧光改变,说明T1对上述金属离子均无响应。探针T5与金属混合时,各金属离子的加入均使T5荧光信号增强,致使图3(b)中包括Cu2+的所有T5-金属离子体系的荧光曲线均出现相对于T5的增强,只是因为Cu2+较强的电子效应致使荧光部分猝灭,才使T5-Cu2+荧光曲线出现相对于T5的最小增幅,从而表现出T5-Cu2+与其他离子的差别。
λ/nm
严格地说,T5与所有待测离子的混合体系,均出现相似的、一致性的荧光增强变化趋势,T5对各金属离子不表现选择性响应。图3(c)与(d)中,探针T4对Zn2+表现出增强型的识别,对Cu2+和Hg2+具有猝灭型响应,其它金属离子则未引起探针T4荧光强度的明显变化,说明探针T4对Zn2+/Cu2+/Hg2+呈现选择性响应。从探针的离子选择实验来看,通过对T1、T4、T5进行识别基团中两个、邻位四个、间位四个识别位点的差异性设计,致使识别位点所形成的离子包合空腔、探针与离子结合的能力均出现显著差别。探针T4结构中,邻位N、N、N′、N′上所连接的4个乙酸根柔性链形成尺寸合适的包合空腔,初步实现了T4对Zn2+/Cu2+/Hg2+的合适作用距离与选择性识别,结合探针分子的电子效应变化,将能够进一步分析和解释离子识别的作用机制。
Zn、Cu、Hg在生命体中广泛分布,在多种生理过程中表现相应离子浓度水平的动态分布与动态变化,已被证明与表现认知、行动障碍的多种退行性疾病紧密相关[3-4]。而空气、土壤、水体中过量分布的Cu和Hg,以食物链富集、经食源性摄入后,将危及人体健康[5]。探针T4对Cu2+、Hg2+和Zn2+的快速检测,具有广泛的应用性[6-7]。
2.3 Zn2+/Cu2+/Hg2+对探针T4的荧光滴定曲线
向探针T4溶液中分别加入浓度依次递增的Zn2+/Cu2+/Hg2+溶液,使T4终浓度为1×10-5mol L-1、金属离子终浓度为0~800 μmol L-1(Cu2+),或0~1000 μmol L-1(Zn2+/Hg2+),混匀后扫描300~550 nm波段范围,得图4。

λ/nm
如图4所示,当Zn2+/Cu2+/Hg2+浓度从0至800/1000 μmol L-1递增时,探针T4荧光强度随Zn2+浓度升高而增强,随Cu2+、Hg2+浓度升高而减小。进行荧光强度峰值与Zn2+/Cu2+/Hg2+浓度的相关性分析[8-9],得到荧光强度F与[Zn2+]/[Cu2+]/[Hg2+]的线性关系(图5,F:T4- Zn2+/Cu2+/Hg2+在410 nm处的荧光强度峰值)。线性方程分别为T4-Zn2+(0~16 μmol L-1): y=177.24x+6002.2(R2=0.9967),T4-Cu2+(0~16 μmol L-1): y=-343.01x+5701.6(R2=0.99),T4-Hg2+(0~16 μmol L-1):y=-395.36x+6722.8(R2=0.9904)。当Zn2+/Cu2+/Hg2+浓度为0~16 μmol L-1时,探针荧光强度与[Zn2+]/[Cu2+]/[Hg2+]均呈现良好线性关系,能够进行Zn2+/Cu2+/Hg2+的准确定量分析,初步满足μmol L-1浓度数量级的生理Zn2+/Cu2+/Hg2+检测。

[Zn2+]/μ·mol L-1
2.4 探针T4与Zn2+/Cu2+的络合比
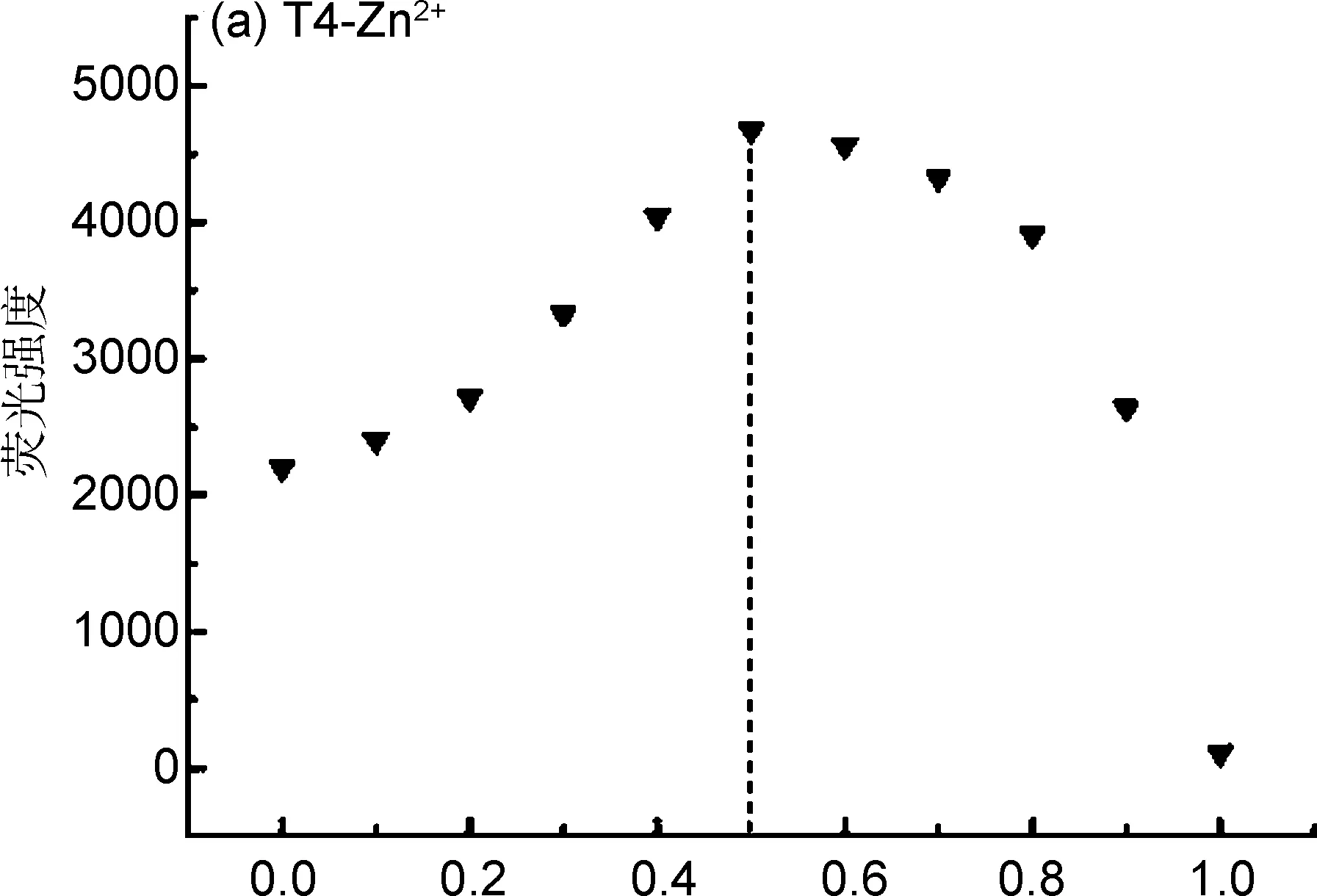
分别向比色管中加入体积依次递增的Zn2+和体积依次递减的T4,保持T4与Zn2+总浓度为1×10-5mol L-1,使Zn2+摩尔分数依次为0、10%、 20%、 30%、 40%、 50%、 60%、 70%、 80%、 90%、 100%,经荧光强度与Zn2+摩尔分数分析,得到图6(a)所示探针T4与Zn2+的Job’s曲线。由图6(a)可知,对于T4-Zn2+的荧光增强型识别,Zn2+的摩尔分数为0.5时,在其荧光最大发射波长410 nm处,T4-Zn2+络合物出现荧光强度的最大值,表明探针T4与Zn2+的定量结合比例是1∶1。
Zn2+摩尔分数
对于T4-Cu2+的荧光猝灭型响应,由图4(b)所示的Cu2+对探针T4的荧光滴定曲线可得到图6(b),当Cu2+浓度较小时,探针T4荧光不完全猝灭,当T4与Cu2+物质的量一致或Cu2+浓度较大时,探针与Cu2+达到1/1结合,探针-Cu2+络合物荧光几乎完全猝灭、荧光强度不再变化。图4(c)与图6(c)所示的T4-Hg2+体系,其变化趋势类似于T4-Cu2+,可推知探针T4与Cu2+/Hg2+的定量结合比例均为1∶1。
2.5 探针识别机制
探针T4对Zn2+、 Cu2+/Hg2+表现差别性荧光响应,而T4-Zn2+/Cu2+/Hg2+体系的紫外吸收光谱中,吸收谱峰无明显变化(图7)。
λ/nm
综合来看,T4-Zn2+/Cu2+/Hg2+体系荧光与紫外-可见光谱的不同,主要基于以下因素:一方面,依据分子内电荷转移机制[10-11],T4分子内同时具有电子给体和电子受体,当识别基团与Zn2+/Cu2+/Hg2+结合时,首先影响分子内的推-拉电子作用,进而诱使分子内电荷转移过程随之减弱或强化,导致荧光光谱变化;而当探针-金属离子识别作用中的电子转移变化引起其荧光发射信号变化时,分子吸收则几乎不受影响,紫外光谱无改变。
另一方面,探针T4识别部分的氮原子具有孤对电子、表现给电子作用,不饱和环作为电子受体,分子内电子转移路径发生于电子给体至电子受体,使探针分子呈现荧光。1)在T4对Cu2+/Hg2+的荧光猝灭型响应中,配位作用与探针分子内ICT过程减弱,成为T4-Cu2+/Hg2+体系荧光强度变化的主要影响因素。T4结合目标物Cu2+/Hg2+时,探针提供孤对电子、金属离子提供空轨道的配位作用,致使探针分子内电荷转移过程被完全阻断或部分削弱,使T4-Cu2+/Hg2+体系荧光强度显著降低。此外,Cu2+/Hg2+的自旋-轨道耦合、电子或能量转移可能进一步加剧了荧光信号猝灭[12-13]。2)在T4与Zn2+的识别过程中,Zn2+配位能力较弱,且极化能力与变形性较弱、空轨道较少,此外,Zn的还原性远大于Cu和Hg。上述因素的综合作用,致使Zn2+作为电子受体的能力较弱,难以接受探针提供的孤对电子、进行配位,探针T4分子内的ICT过程并未明显受阻,相反,还可能因为T4-Zn2+的结合,使分子刚性略有增强,导致T4-Zn2+体系荧光增强,呈现与T4-Cu2+/Hg2+相反的识别方式。
综合来看,T4邻位四羧酸结构的识别位点,首先形成了合适尺寸的包合空腔[14-15],这意味着T4与Zn2+/Cu2+/Hg2+合适的分子间作用距离,区别于分子中没有合适作用空腔的探针T1及T5(图8),,T4自身的荧光光谱与T4-Zn2+/Cu2+/Hg2+体系的荧光光谱,因此显现明显差异。而T4对Zn2+、 Cu2+/Hg2+进一步的识别趋势差异,则因3种金属离子的电子效应、配位能力的差异而产生。综上,探针T4分别与Zn2+、 Cu2+/Hg2+作用时,荧光强度的变化趋势不同。
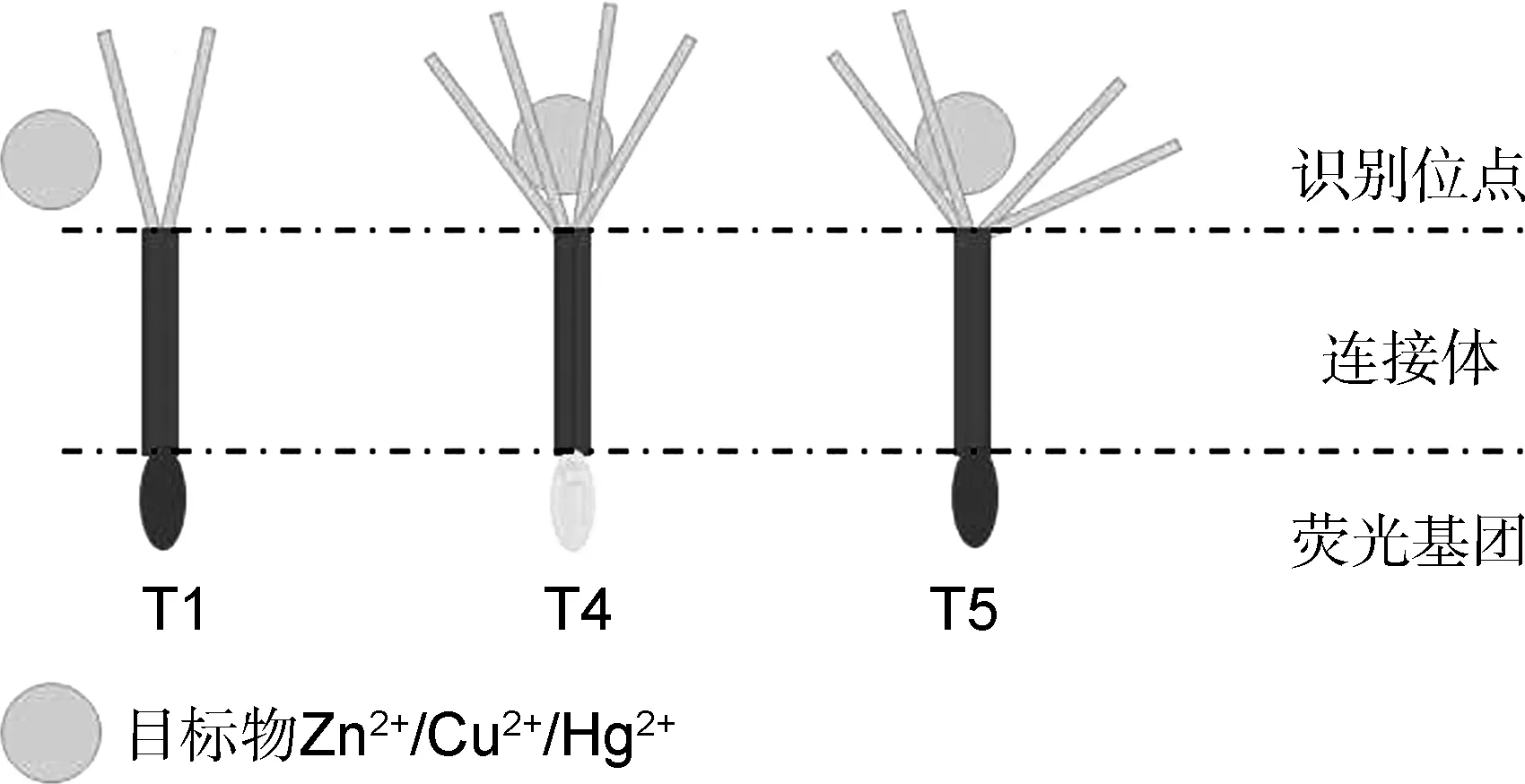
图8 探针T1、T4、T5的识别位点与识别性能差异
经离子识别实验筛选,具有两个识别位点的探针T1对金属离子均无响应,各种金属离子与间位四位点的探针T5混合时,T5荧光光谱的整体变化趋于一致,对各金属离子无显著性、特征性响应差异。而邻位四位点的探针T4对Zn2+表现特异性的荧光增强型识别、对Cu2+/Hg2+具有荧光猝灭型响应。这种识别性能上的差异性,与探针T1、T4、T5识别位点设计的差异具有直接关系[16],T1、T4、T5识别基团中的多羧酸柔性链能够形成包合空腔,通过目标物包合、进行目标离子的初步响应,进一步受到目标离子的电子效应、配位与还原性能综合影响,给出各自的特征荧光信号变化,发生对不同目标离子的特征性响应过程。由图8可知,探针T1的两条羧酸柔性链仅构成两个识别位点,形成的包合空腔尺寸过小,无法有效包合目标离子,对金属离子均无响应。间位四位点的探针T5,则因形成包合空腔的四条柔性羧酸链分处于间位,孔隙过大,亦无法有效包合目标离子[17]。经识别位点设计与离子识别实验筛选,证明邻位四位点的探针T4形成了尺寸合适的包合空腔,能够容纳目标物Zn2+/Cu2+/Hg2+,并因目标物电子效应、配位能力的差别,对Zn2+、Cu2+/Hg2+表现差别性荧光响应。
经识别位点的差异性设计,定向构筑二位点探针T1、邻位四位点探针T4与间位四位点探针T5,其中,探针T4结构中处于邻位的四条羧酸柔性链作为识别位点、形成有效的目标物包合空腔,并受到目标离子的电子效应、配位与还原性能综合影响,表现出对Zn2+、 Cu2+、 Hg2+的特征响应、荧光性能稳定,且探针T4与上述离子均以1∶1定量结合、线性关系良好,能够初步满足μ·mol L-1数量级的生理Zn2+、 Cu2+、 Hg2+浓度检测。结合荧光、紫外等光谱学手段,电子效应与识别位点设计/包合空腔,初步阐明了探针T4对Zn2+、 Cu2+/Hg2+的不同识别机制,对于探针结构优化与性能筛选研究提供了研究基础。

