阻塞性睡眠呼吸暂停患者颈动脉内膜中层厚度进展的相关因素分析
冯剑 许爱国 李赛赛 王盼盼
阻塞性睡眠呼吸暂停(Obstructive sleep apnea,OSA)是一种独立的、可改变的心血管疾病危险因素[1]。颈动脉粥样硬化,表现为血管壁增厚或斑块形成,是未来心血管事件的早期指标。越来越多的证据表明,OSA中的反复脱氧和复氧,增加氧化应激和炎症活性,引起组织细胞损伤,可能导致动脉壁肥厚、僵硬和斑块形成[2-3]。此外,最近的研究表明,打鼾引起的振动是OSA的一个主要症状,它可能会传递到邻近的血管或组织(如颈动脉),并通过引起血管损伤或血流紊乱而加速动脉粥样硬化进程[4]。一些研究表明OSA与颈动脉内中膜厚度(intima-media thickness,IMT)增加显著相关;IMT是亚临床动脉僵硬度的替代标志,其加速进展与动脉僵硬发展相关,可以预测未来的心血管事件[5]。尽管IMT进展的危险因素众所周知,但它们在OSA患者中随时间变化框架之间的差异效应,尚不清楚。在当前的研究中,我们观察了以往队列研究确定的传统危险因素的短期变化与OSA患者IMT进展之间的关系,并分析了这些因素与未来亚临床颈动脉疾病之间的相关性。
资料与方法
一、一般资料
在2015年1月至8月期间,从本院耳鼻喉科和呼吸内科招募了同意参加研究的具有打鼾和白天疲劳主观症状的169名患者。纳入标准:患者的年龄在30至60岁之间,参照《阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)》诊断标准[6]诊断为OSA,定义为经整夜多导睡眠监测发现在每夜7h睡眠过程中呼吸暂停及低通气反复发作>30次,或呼吸暂停低通气指数≥5次/h。排除标准:体重指数(BMI)>35 kg/m2;根据临床信息和多导睡眠图诊断除OSA之外的另一种睡眠障碍(例如周期性肢体运动障碍,中枢性睡眠呼吸暂停,失眠,肥胖性低通气综合征或发作性睡病);扁桃体切除或OSA手术的既往史;有CVD病史、卒中或肺部疾病;焦虑、抑郁或精神障碍;活动性感染,恶性肿瘤或慢性炎症性疾病。此外,排除在进入队列时使用持续气道正压通气治疗的OSA受试者,但是在基线多导睡眠图研究之后开始的持续气道正压通气治疗患者被纳入,并在分析中进行调整。该方案获得本院伦理机构审查委员会的批准,并取得所有参与者的书面知情同意。
在3年的随访检查(2018年5月至12月)中,93名患者接受了本研究。76名患者无法进行随访,因为这些患者决定不再参与研究(n=18),或者无法获得进一步的随访信息(n=58)。我们发现随访组和排除的76名患者在基线时的年龄、性别、BMI和几个危险因素(吸烟、饮酒、胆固醇、甘油三酯(TG)、收缩压(SBP)和舒张压(DBP))值,以及心率方面没有显著差异(表1)。所有参与者提供病史,在基线检查时进行临床检查,然后在第三年完成随访。标准化问卷用于确定基线检查时和第三次就诊时的病史、用药和心血管风险评估。
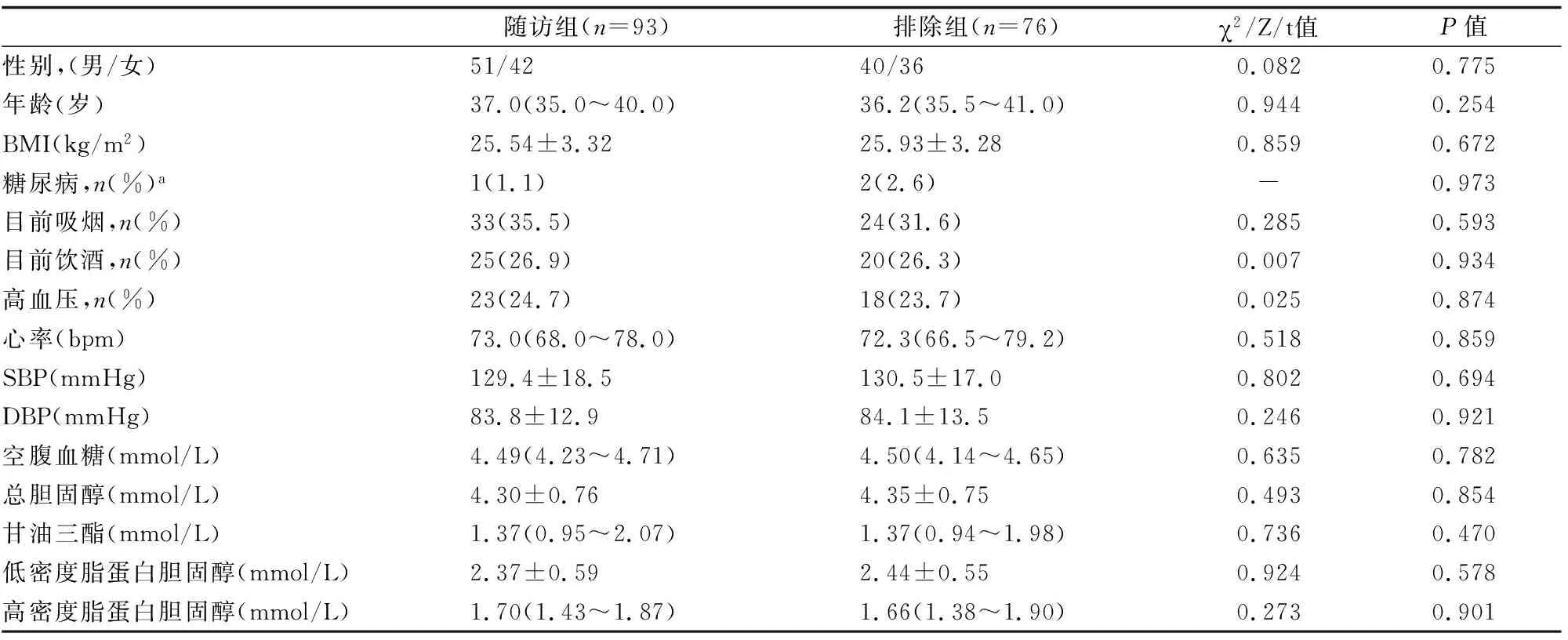
表1 随访组和排除的76名患者的特征
二、方法
所有患者接受全面临床检查、实验室评估、超声检查、多导睡眠图检查和血压监测。睡眠研究结束后第二天早晨,进行静脉穿刺,测定空腹血糖和血脂。
1.多导睡眠图
所有患者使用SOMNO T7多导睡眠分析诊断系统(德国SOMNO公司)进行过夜标准多导睡眠图检查。阻塞性呼吸暂停的定义是,如胸腔或腹部信号所示,在持续的呼吸努力下,气流停止超过10秒;低通气的定义是:鼻腔压力信号漂移下降≥30%,持续至少10秒,同时与事件前基线相比,饱和度降低4%或更多,或从睡眠中唤醒。计算呼吸暂停低通气指数(AHI),该指数表示每小时睡眠中呼吸暂停或低通气事件的次数。
2.颈动脉IMT测量及颈动脉斑块评估
由一位不了解受试者临床信息的心脏病学家进行颈动脉超声检查,以尽量减少观察者的偏见。使用超声B模式系统(飞利浦HDI 5000系统,美国ATL-Philips公司)和10~12 MHz探头评估颈总动脉。远端颈总动脉的图像是在两侧靠近分叉处的1 cm左右的远壁处获得。远端颈总动脉与测量的最小变异性相关。重复测量双侧颈动脉三次,计算IMT平均值。颈动脉斑块的定义为:颈动脉IMT≥1.5mm的局灶性壁增厚或明显向内腔突出,其厚度比相邻壁大≥50%。从所有颈动脉的横断面和纵切面评估了颈动脉斑块。
3.血压测量
使用HEM-7130电子血压计(日本OMRON公司)测量临床BP。参与者在坐姿中休息10分钟以后,根据欧洲高血压学会的建议连续获取了三个BP读数。取三个读数平均值用于分析。
三、统计学处理
数据表示为正态分布值的平均值±标准差、非正态分布值的中位数(P25和P75)和百分比。分类变量使用χ2检验,连续变量中正态分布数据使用studentt检验和非正态分布数据使用Mann-Whitney检验计算各组间的统计学差异。采用多元线性回归分析评价随访时危险因素与IMT及其进展的独立关系。采用logistic回归分析探讨危险因素对动脉僵硬发生率的预测作用。所有统计分析均采用SPSS 16.0进行。统计显著性设为P值小于0.05。
结 果
一、患者特征
共有93名符合纳入标准的患者接受了随访,并纳入了当前的分析。(表1)比较了实验人群在基线和随访时的人口统计学、人体测量学和生化特征。随着随访时间的延长,OSA患者的颈动脉IMT、AHI、BMI、高密度脂蛋白胆固醇、总胆固醇和同型半胱氨酸水平升高,颈动脉壁增厚或斑块、高血压、中度OSA和糖尿病比例升高P<0.05(见表2)。
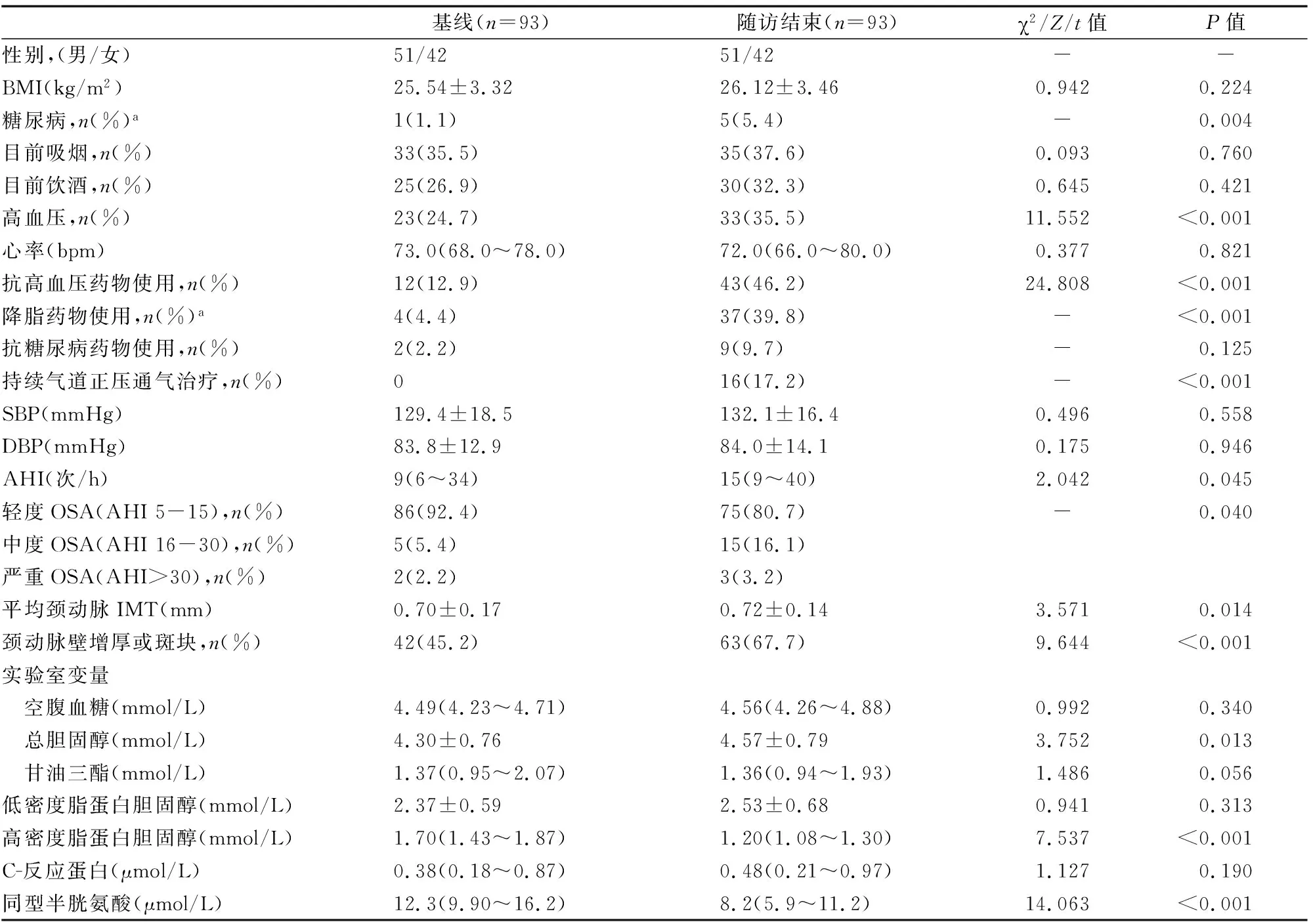
表2 基线和随访结束时患者的特征
二、IMT的预测因子
(表3)显示了逐步多变量回归分析的结果,包括在基线和随访结束时测得的预测IMT及其进展(2015-2018年)的危险因素,其中年龄与基线IMT值显著相关,而性别与随访结束时IMT显著相关(P<0.05),并且性别和HR与IMT进展独立相关(P<0.05)。此外,在基线和随访结束时的AHI均与横截面测量的IMT及其进展独立相关(P<0.05)(见表3)。
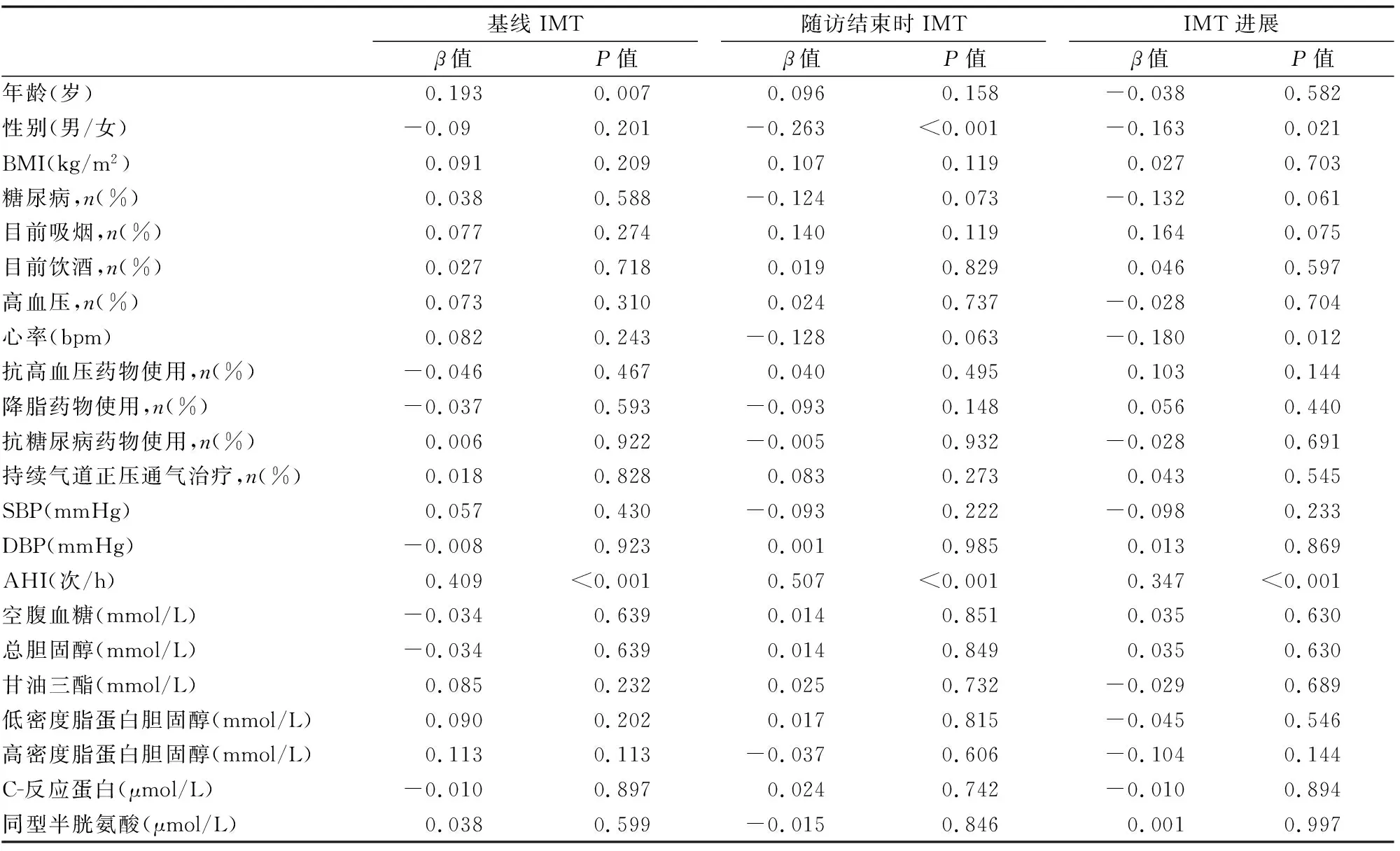
表3 逐步多变量回归分析IMT的预测因子
三、OSA患者发生亚临床颈动脉疾病的危险因素
研究还分析了传统危险因素与亚临床颈动脉疾病之间的相关性(表4)。在对年龄、性别、BMI、SBP、DBP、心率、空腹血糖、总胆固醇、甘油三酯、低密度脂蛋白、高密度脂蛋白、C-反应蛋白、血清同型半胱氨酸、饮酒、吸烟、高血压和糖尿病调整后,用Logistic回归分析检测亚临床颈动脉疾病的风险。结果显示,AHI、SBP和甘油三酯与动脉斑块存在风险独立相关(P<0.05),AHI、LDL-C和甘油三酯与高IMT的风险独立相关(P<0.05)。此外,AHI、DBP、BMI、甘油三酯和HDL胆固醇3年(2015-2018年)内的变化与动脉斑块存在风险独立相关(P<0.05),其中AHI的变化还与高IMT独立相关(P<0.05)(见表4)。
四、颈动脉IMT传统危险因素的变化
(表4)显示了随访和进展时危险因素变化与IMT关系的逐步多变量回归分析结果。其中,空腹血糖3年(2015-2018年)的变化与基线IMT独立相关(P<0.05),并且HR和AHI变化与随访结束时IMT及其进展独立相关(P<0.05)。

表4 逐步多元回归分析传统危险因素及其变化与颈动脉IMT、颈动脉斑块存在的关联
五、心率和AHI变化与颈动脉IMT进展之间的关联
为进一步说明心率和AHI变化与颈动脉IMT进展之间的关系,研究根据从基线到随访结束时的心率和AHI变化,将所有参与者细分为三组:大幅度下降(<25%),中等变化(25%~75%)和大幅度增长(>75%)。卡方趋势性检验结果显示,IMT进展与HR和AHI变化呈线性关系(P=0.014、0.008)(图1)。
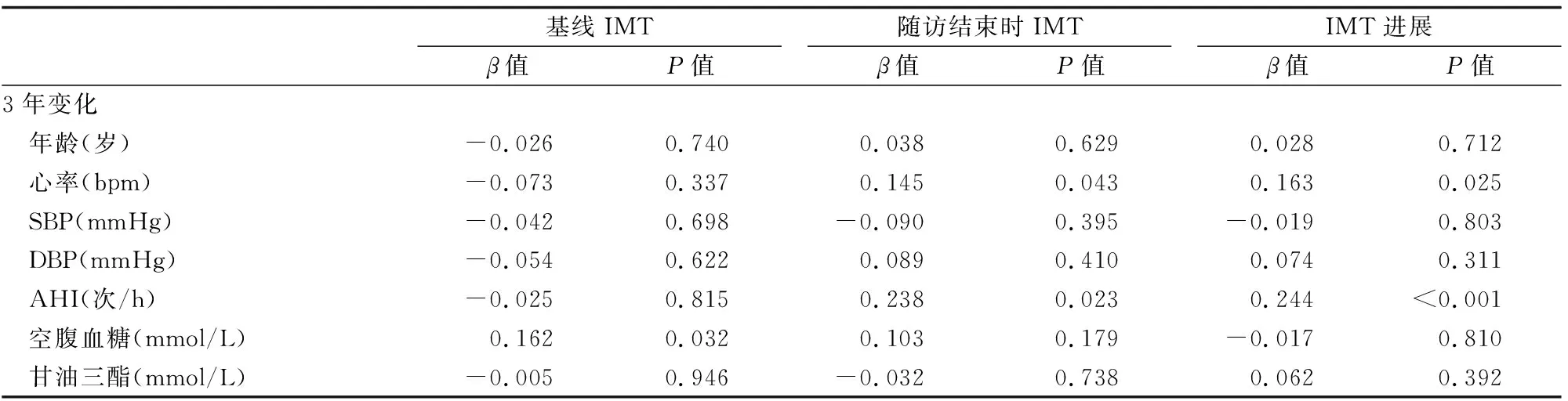
表5 逐步多变量回归分析中随访和进展时危险因素变化与IMT的关系

图1 HR(A)和AHI(B)的大幅度下降(<25%),中等变化(25%~75%)和大幅度增长(>75%)的参与者之间颈动脉IMT进展的比较
讨 论
OSA与心血管疾病和全因死亡率增加有关,其特征是反复发作气道阻塞,并伴有氧饱和度降低、通气量增加和夜间觉醒。与OSA相关的反复低氧损伤和胸腔内压力过大波动,会改变心血管血流动力学,并可能导致内皮功能障碍、血管炎症,被认为与动脉粥样硬化的发生和发展有关[1]。由于OSA的发生率上升,可能与肥胖的流行有关,因此已成为重要的公共卫生问题。IMT的增加和颈动脉斑块的存在是预测未来CVD事件的亚临床动脉疾病的标志物。最近对6项研究的荟萃分析得出结论,患有OSA的受试者的颈动脉IMT较高[7]。同样,病例对照研究表明OSA与斑块之间存在正相关。本研究中,AHI变化始终与OSA患者的IMT进展相关,并且在将研究人群分组时也观察到线性(正)趋势。这些新发现具有重要的预防意义,因为在我国OSA的患病率不断上升,并且由于颈动脉IMT和斑块是动脉粥样硬化的替代标志物,可预测卒中和冠心病。此外,本研究发现,AHI在研究期间(2015-2018年)内的变化与高IMT和动脉斑块存在风险独立相关,这进一步表明AHI是OSA患者颈动脉测量的可靠独立预测因子。
近年来,HR被发现是心力衰竭、心血管事件和死亡率的有力和有价值的预测因子[8]。在一项横断面研究中[9],HR与PWV独立相关,但与IMT不相关,表明HR在动脉僵硬度和动脉厚度的发展中起着不同的作用。先前的研究通常集中在HR和周围或冠状动脉僵硬。HR与颈动脉僵硬度(尤其是颈动脉厚度)之间的关系尚不清楚。Wang等[10]在我国中老年人群中的一项研究发现,HR与IMT和颈动脉斑块呈正向和分级关联。另进一步发现与HR低于67 bpm的参与者相比,HR高于81 bpm的参与者的IMT风险升高约三倍,而颈动脉斑块的风险则为2倍[10]。这一观察结果与本研究结果一致,在本研究中,HR与IMT的进展相关,并且短期的HR变化始终与OSA患者的IMT进展相关。此外,据报道可反映自主神经活动的HR变异性在不同情况下与颈动脉IMT的增加独立相关[11]。这些发现表明,将HR维持在最佳水平至关重要,因为具有最佳心率水平的OSA患者的颈动脉IMT进展最低。
迄今为止的证据表明,OSA的传统危险因素,例如BMI、年龄、BP、高半胱氨酸水平和血脂与IMT的发展密切相关。Jenner等[12]分析了712名无卒中和无心肌梗塞的OSA患者的数据,发现年龄和吸烟是颈动脉IMT进展的预测因素。此外,Suzuki等[13]发现血浆总同型半胱氨酸水平升高的OSA患者具有较厚的颈动脉IMT有关。Kozakova等[14]研究了人体成分与颈总动脉重塑之间的关系,并最终发现年龄、颈总动脉直径、SBP和LDL-C与IMT独立相关。与先前的报告一致,我们的队列研究发现年龄和性别分别与基线和随访结束时的IMT显著相关,而SBP和甘油三酯与动脉斑块存在风险独立相关。然而,在纳入患者中,未发现抗高血压药物、降脂药物、抗糖尿病药物使用与IMT进展相关,考虑可能与研究中大部分为轻度OSA患者有关,这些患者中大部分在纳入研究时未服用这些药物。
此外,这项研究发现,纳入的OSA患者的IMT进展率似乎很高。Kozàkovà等[15]在一项为期3年颈动脉粥样硬化进展研究中报道,来自614名健康男性和女性的颈总动脉、颈动脉球和颈内动脉的平均IMT变化分别为17±48、56±100和52±110 μm。Takato等[16]报道,IMT的CCA进展率男性为0.011 mm/年,女性为0.010 mm/年。与这项研究不同,本研究结果提示OSA促进了颈动脉IMT的进展,诱发未来CVD事件的亚临床动脉疾病。值得注意的是,在本研究中部分患者在随访期间接受了持续气道正压通气治疗,但在多变量回归分析中未发现持续气道正压通气治疗与IMT之间的关联。之前一项纳入7项研究的Meta分析发现,在OSA患者中,持续气道正压通气治疗前后颈动脉IMT没有变化(WMD=0.052,95%CI=-0.002~0.105,Z=1.90,P=0.057);同时,与对照组相比,持续气道正压通气治疗组的颈动脉IMT没有改变;然而,在他们进行的亚组分析中发现重度OSA患者(WMD=0.073,95%CI=0.022~0.124,Z=2.80,P=0.005)(WMD=0.121,95%CI=0.019~0.223,Z=2.32,P=0.021)使用CPAP后颈动脉IMT显著降低[17]。由于本研究纳入的严重OSA患者较少,因此目前本研究尚不能判断持续气道正压通气治疗是否对IMT的进展产生影响。
总之,当前的研究表明,在这个OSA患者队列中,AHI、HR参与IMT的进展,并且AHI、SBP和DBP与动脉斑块存在风险独立相关。这些发现强调了早期发现和控制AHI、BP和HR对于预防OSA患者未来亚临床颈动脉疾病进展的重要性。

