哮喘易感基因多态性与毛细支气管炎预后的相关性分析
钱前 张玉红 王宜芬 李伟 刘丽 于艳艳
毛细支气管炎是婴幼儿时期常见的喘息性疾病,也是导致婴幼儿住院的重要病因,其临床表现轻重不一,以阵发性憋咳、喘息及气促为临床表现,在世界范围内广泛流行[1]。哮喘是儿童时期最常见的慢性气道疾病,喘息反复发作影响患儿身心健康,也给家庭及社会造成经济负担[2]。有研究报道因毛细支气管炎住院的患儿中约22%~48%发展为儿童哮喘[3],由此可见部分毛细支气管炎很可能是儿童哮喘的早期阶段,如何从毛细支气管炎患儿中甄别出哮喘高危儿以早期管理及干预,是减少哮喘发病率的重要举措。哮喘作为一种异质性疾病,其发生、发展与遗传背景密切相关,研究表明哮喘易感基因SNPs IL13 A2044G、IL4-590C>T、ADRβ2 R16G 和 FcεR1β E237G与汉族儿童哮喘发生密切相关[4],本文旨在探讨上述位点与毛细支气管炎后喘息情况的相关性,为甄别毛细支气管炎中的哮喘高危儿提供参考。
资料与方法
一、研究对象
纳入2018年12月—2020年01月在连云港市妇幼保健院儿童呼吸科住院的毛细支气管炎患儿132例,其中男95人,女37人。入选标准:(1)年龄1~24月,性别不限;(2)符合第八版《诸福棠实用儿科学》中毛细支气管炎诊断标准;(3)所有患儿入组前均未使用吸入性及全身性糖皮质激素,未使用抗组胺药物;(4)无继发细菌感染;(5)排除支气管异物、先天性心血管疾病、免疫缺陷病、胃食管反流、先天性气道发育异常等疾病。所有研究均得到患儿家长同意且签署知情同意书,同时获得我院医学伦理委员会批准。
二、研究方法
1.分组方式 纳入对象以既往是否有医师诊断的特异性皮炎病史作为依据,分为特应性体质组(atopic group,简称A组)63人、非特应性体质组(non-atopic group,简称N组)69人。
2.哮喘易感基因检测
(1)基因组DNA提取:两组患儿采集口腔黏膜拭子后,口腔拭子基因组DNA提取试剂盒(天根生化科技有限公司)提取 DNA。
(2)引物设计:参照 GenBank 中人 DNA 基因序列,在NCBI网站上查询包含相应位点的基因序列,确定相应的突变位点,利用Primer5.0软件设计 PCR引物,引物序列见(表1)。

表1 基因扩增引物序列
(3)Massarray SNP 分型技术对多态性位点进行基因分型:多重 PCR 反应:模板 DNA 2 μL,热启动 Taq DNA 聚合酶0.2μL,扩增引物各为 0.5 μL,25mM/L dNTPs 0.1 μL,25mM/L MgCl20.4 μL,PCR缓冲液0.5 μL,水0.8μL,反应体积为5 μL;反应条件为 95℃ 2 min,(95℃ 30 s,60℃ 30 s,72℃ 1 min)×45 cycles,72℃ 5 min;4℃保存。
虾碱性磷酸酶(SAP)反应:PCR 产物 5 μL,SAP 缓冲液0.17 μL,SAP酶0.30 μL,水1.53 μL。反应条件为:37℃ 40 min,85℃ 5 min,4℃保存。
延伸反应:SAP处理后 PCR 产物 7 μL,iPLEX缓冲液0.2 μL,iPLEX混合物0.2 μL,iPLEX 酶为0.04 μL,延伸引物混合物0.94μL,水0.62 μL。反应条件为:94℃ 30 s,[94℃ 5 s,(52℃ 5 s,80℃ 5 s)×5 cycles]×40 cycles,72℃ 3 min,4℃保存。
芯片点样:将所得产物脱盐处理,用 MassARRAYTMRS 1000 点样仪将样本点到对应的 SpectroCHIP(芯片)上,使用 MALDI-TOF(基质辅助激光解吸电离-飞行时间)质谱仪获得数据,进行基因分型并输出结果。
3.呼出气一氧化氮检测 采用无锡尚沃医疗电子SV-O2纳库仑一氧化氮分析仪测定患儿FeNO 水平。检测时患儿处于自然睡眠或水合氯醛镇静睡眠状态,用采气面罩连接采气袋后,紧扣被检查者的口鼻处,防止漏气,在平静呼吸状态下取样品气,对样品气体进行离线检测[5]。
4.血常规检测 入院24小时内常规采集静脉血检测外周血嗜酸性粒细胞(Eosinophil,EOS)比例。
三、随访指标
对入选所有毛细支气管炎患儿在出院后3月、6月、9月、12月时进行随访,随访指标:喘息情况、喘息次数。
四、统计学分析

结 果
一、研究对象一般情况
共纳入132例汉族毛细支气管炎患儿,其中A组63人,男48人(76.2%),女15人(23.8%),平均年龄(12.10±6.57)月,N组69人,男47人(68.1%),女22人(31.9%),平均年龄(11.35±6.58)月,两组间性别,年龄均无显著差异(P>0.05)(见表2)。

表2 两组毛细支气管炎患儿人口统计学比较
二、毛细支气管炎临床数据分析
132例毛细支气管炎患儿,出院后一年内有喘息发作人数92人(69.7%),其中A组毛细支气管炎患儿外周血嗜酸性粒细胞比例、出院1年内发生喘息再发人数、喘息再发次数均显著高于N组(P<0.05)。A组呼出气一氧化氮(FENO)水平较N组升高,但无统计学差异(P>0.05)(见表3)。
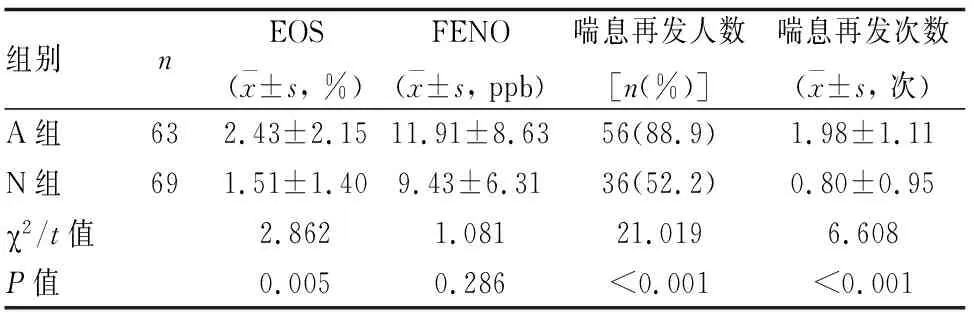
表3 两组毛细支气管炎患儿临床数据比较
三、两组间哮喘易感基因基因型比较
A组哮喘易感基因SNPs ADβ2 R16G以 AA型频率最高,其次是AG型,GG型频率最低,N组以AG型频率最高,AA型频率次之,GG型频率最低,组间比较具有显著性差异(P<0.05)。IL13 A2044G、IL4-590C>T、FcεR1β E237G位点基因型分布在两组间均无统计学差异(P>0.05)(见表4)。

表4 两组间哮喘易感基因单核苷酸多态性基因型分布[n(%)]
讨 论
毛细支气管炎是2岁以下患儿所特有的下呼吸道感染,以气道阻塞所致的气促和喘鸣为特征,肺部听诊可闻及哮鸣音、湿啰音,其流行范围广,6月龄以下毛细支气管炎患儿常需住院治疗。近年来,大量研究发现毛细支气管炎与日后反复喘息乃至哮喘发生密切相关,特应性体质和早期重症毛细支气管炎可能是日后发展为哮喘的高危因素[1]。鉴于不断攀升的的哮喘发病率以及哮喘对患儿生理、心理发育的影响乃至对家庭和社会造成的负担,需早期甄别哮喘高危儿,纳入管理、及时防治,以降低儿童哮喘发病率。
5岁以下儿童哮喘诊断缺乏统一标准,且引起婴幼儿喘息发作的因素复杂,故难以精准做出哮喘诊断。2000年提出的哮喘预测指数(asthma predictive index,API),目前广泛用于评估5岁以内喘息婴幼儿日后发展为哮喘的风险,然而API虽具有较高的特异度,但灵敏度不足,限制了在中等风险以及喘息次数小于4次的患儿中使用[6]。因此在更早期甚至在婴儿喘息临床表型尚未显现的毛细支气管炎阶段,探讨可以识别的哮喘高危风险指标十分必要。
哮喘是一种异质性疾病,哮喘易感基因在哮喘发生发展中起重要作用,可以用于预测哮喘发病风险,毛细支气管炎是婴幼儿生命早期喘息的独有形式,特应性体质、毛细支气管炎后反复喘息是毛细支气管炎向哮喘发展的风险因素[7],本研究拟探讨哮喘易感基因与不同体质毛细支气管炎及毛细支气管炎后喘息的相关性,以指导哮喘高危风险患儿纳入管理,实现哮喘的二级预防。
一、临床资料在两组间的差异
本研究以队列初期是否曾患特应性皮炎进行分组,进行为期1年随访,对两组间入院时外周血嗜酸性粒细胞(EOS)水平、呼出气一氧化氮(FENO)水平、发生喘息人数以及喘息次数进行对比。研究发现A组嗜酸性粒细胞水平显著高于N组,与张奕等报道一致[8],提示A组患儿体内存在嗜酸性粒细胞性炎症。通过趋化粘附募集在气道黏膜的嗜酸性粒细胞可进行脱颗粒释放多种炎症因子,如嗜酸性粒细胞阳离子蛋白等,导致气道高反应性以及肺组织损伤。有报道称毛细支气管炎期间嗜酸性粒细胞水平降低与一过性喘息相关,而嗜酸性粒细胞水平显著升高则预示着3岁以内反复喘息[9]。本研究经随访发现,A组无论是再次喘息人数占比还是个体喘息再次发生次数都显著高于N组,与既往研究一致。Törmänen S等发现2岁以内因毛细支气管炎住院的患儿在12~13岁时患哮喘的风险高2.6~5倍,其风险因素为特应性皮炎、反复喘息、外周血嗜酸性粒细胞增多[7],本研究中特应性毛细支气管炎患儿嗜酸性粒细胞增多、易反复喘息,从一定层面证明了特应性体质毛细支气管炎患儿哮喘发病风险更高。本研究还发现毛细支气管炎患儿出院后1年内再喘息的发生率高达69.7%,特应性体质组再喘息率更是高达88.9%,因此将毛细支气管炎群体纳入长期随访管理或更有益于患儿喘息的规范诊疗。
呼出气一氧化氮(FENO)检测是检测气道嗜酸性粒细胞炎症水平的首选方法,其具备无创、操作便利、可重复性好等特点,被用于辅助诊断、管理儿童哮喘以及指导、评估吸入性糖皮质激素的使用。由于婴幼儿配合度不够,干扰因素多,潮气离线测定公认度不够,且缺乏不同年龄段婴幼儿标准值参考,FENO在毛细支气管炎患儿中的诊疗价值存在争议,研究结果也常不一致[10]。本研究发现A组FENO值高于N组,但是无显著统计学差异。因此FENO在毛细支气管炎中评估气道炎症水平的意义有待进一步探讨。
二、哮喘易感基因在两组间的差异性
近些年,随着分子生物学和遗传学的发展,对易感基因在哮喘发生、发展方面作用的探讨不断深入。易感基因多态性,即单碱基对变异是发生哮喘主要的风险因素。了解这些变异基因有助于研究哮喘发病机制、预测哮喘发生、加速抗哮喘药物研发以及实现个体精准靶向治疗等[11]。有研究指出四个哮喘易感基因SNPs IL13 A2044G、IL4-590C>T、ADRβ2R16G 和 FcεR1β E237G,任何一个基因位点对哮喘的发展具有独立影响,综合四个基因在哮喘预测方面具有协同效果[4]。也有文献报道上述四个位点与哮喘预测指数阳性婴幼儿具有相关性[12],然而这些基因位点与毛细支气管炎相关性探讨目前鲜有报导。
位于染色体5q31上的β2肾上腺素能受体基因,其至少存在9个突变位点,其中一个重要突变位点即ADRβ2R16G,氨基酸位点16表达精氨酸还是甘氨酸由基因A或G决定,与β2肾上腺素能受体的敏感度下调有关[13-14]。本研究显示A组AA基因型频率显著高于N组,而GG基因型频率A组低于N组,两组间存在显著统计学差异。说明ADRβ2R16G易感基因多态性与不同体质的毛细支气管炎存在关联,其中AA基因型频率在A组患儿中表达增高,而这部分患儿随访数据显示,无论是喘息再次发作的次数和人数均明显高于N组患儿,提示A组患儿具有明显的哮喘倾向,由此推测ADRβ2R16G易感基因的AA基因型高频率及GG基因型低频率对预警毛细支气管炎后喘息及哮喘发作风险,具有一定价值。既往研究也表明AA纯合子基因型与气道高反应性及哮喘严重程度相关,而纯合子GG基因型对严重哮喘的发展具有保护作用[14]。与本研究的推论一致。
IL13基因位于染色体5q31-33,IL13 A2044G是IL13基因单核苷酸多态性突变位点之一。参与调节IgE合成,与过敏性哮喘的发生密切相关。也有研究表明此基因多态性分布在哮喘组和对照组之间无显著差异[13,15]。本研究显示该位点AA、AG、GG基因型分布频率在两组间并无显著差异。表明IL13 A2044G基因多态性分布在两组间无统计学差异。
人类IL4基因位于染色体5q31,目前已发现超过50个多态性突变等位基因位点,IL4-590C>T位点位于IL4基因启动子区域,可增强IL4活性以及修饰IL4基因转录,与血清IgE水平升高及哮喘发生相关[16]。本研究两组中此基因位点均以TT基因型分布频率最高,CT基因型次之,CC基因型分布频率最低,组间无统计学差异。
FcεR1由三个亚基形成的异四聚体构成,信号传导增强亚基FcεR1β由 FcεR1β E237G编码,此多态性位点碱基由A变成G,可使氨基酸残基237由谷氨酸替代为甘氨酸,影响高亲和力受体的胞内信号传导,与血清总IgE、特异性IgE水平及过敏性哮喘发生密切相关[13,17]。本研究结果显示此多态性位点基因型在两组间分布,均以AA基因型频率最高,GG基因型频率最低,组间无显著差异。国内一项研究指出API阳性喘息患儿AG基因型分布频率明显高于API阴性喘息患儿[13],与本研究存在不一致性,考虑可能与病例对照分组方式不同以及地区差异性有关。
综上,哮喘易感基因SNPs ADRβ2 R16G与特应性体质毛细支气管炎密切相关,ADRβ2 R16G易感基因的AA基因型高频率及GG基因型低频率对预警毛细支气管炎后喘息及哮喘发作风险具有一定价值,可作为毛细支气管炎后喘息乃至哮喘倾向的高危指标,宜将此类患儿纳入哮喘高危人群管理以实现哮喘的二级预防。
本研究尚存在一些局限性,比如随访时间短,对病情轻重不同的毛细支气管炎患儿没有进行分组随访等。下一步我们将扩大样本量,对病情轻重不同的毛细支气管炎患儿进行相关性分析,并延长随访时间,以哮喘发生的节点分组探讨哮喘易感基因在毛细支气管炎中的预测价值,为阻止哮喘的发生发展提供更有价值的参考指标。

