新型蓝莓花色苷含量测定及抗氧化性能研究
连悦汝,甘慧,孟志云,顾若兰,朱晓霞,吴卓娜,杨雯婕,康明,窦桂芳*
(1.河北大学生命科学学院,河北 保定 071000;2.军事医学研究院辐射医学研究所,北京 100850;3.浙江蓝美科技股份有限公司,浙江 绍兴 312000)
蓝莓学名越橘,是一种经济价值较高且营养丰富的水果。蓝莓浆果含有碳水化合物、蛋白质、多种维生素及花色苷,素有“浆果之王”的称号[1]。蓝莓花色苷具有改善慢性疾病[2-3]、抗氧化[4]、抗菌[5]、减轻炎症[2]、保护视力[6]、抗癌[7]等生理活性,是蓝莓的主要功效成分。花色苷还可作为一种天然抗氧化剂,有效应对机体的氧化损伤,从而改善机体微循环[1]。花色苷是花青素与糖以糖苷键相连的化合物,也是动植物体中花青素的主要存在形式。花色苷以花青素为苷元,其基本结构单元为2-苯基苯并吡喃型阳离子,它包含两个苯环和一个含氧六元环[8]。普遍存在于动植物中的6种花青素为矢车菊素、飞燕草素、芍药素、矮牵牛素、锦葵素及芍药素[9]。蓝莓中主要包含以矢车菊素、飞燕草素、芍药素、矮牵牛素及锦葵素为基础的苷元及糖苷。葡萄糖、阿拉伯糖、半乳糖、木糖、芸香糖、鼠李糖等糖配基的主要结合位点是苷元的3,5,7号位,连接形式有单糖、二糖、三糖[10]。
目前蓝莓花色苷常用检测方法有紫外光谱法、液相色谱法、液相质谱联用法、红外光谱法等[11-12]。紫外光谱法是检测蓝莓中花青素和花色苷含量的常用方法,其定量方便,但无法鉴定花青素及花色苷的结构种类,只能检测总花色苷含量。近年来,液相色谱电喷雾离子源与三重四极杆质谱的联用,已成功应用于多种水果化合物成分的分离定量[13-14]。本研究针对我国自主研发的国家级林木良种“蓝美1号”提取的蓝莓粉(blueberry No.1 powder,B1P),测定 B1P 的含量,并探讨其抗氧化活性。本试验先采用紫外光谱法对B1P中的总花色苷含量进行测定。再利用超高效液相色谱串联质谱(ultra performance liquid chromatography-mass spectrum,UPLC-MS/MS)技术,建立一种同时检测多种蓝莓花色苷单体的定量方法,选取多反应监测模式准确定量,从而为鉴定不同品种蓝莓中花色苷的结构差异,快速获取蓝莓提取物中花色苷种类及结构的信息提供理论支持。最后利用在氧化还原反应中能产生特殊吸收峰的物质,如1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-氨基-二(3-乙基-苯并噻唑啉磺酸-6)铵盐[2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS]、羟基自由基(·OH)、超氧阴离子及铁离子,考察B1P中花色苷的抗氧化活性,研究“蓝美1号”蓝莓粉的生物活性。
1 材料与方法
1.1 材料与试剂
“蓝美1号”蓝莓粉(批号:SLMF1201):浙江蓝美科技股份有限公司;乙腈、甲醇、甲酸(均为色谱纯):美国Thermo Fisher公司;抗坏血酸、过硫酸钾(均为分析纯):国药集团化学试剂有限公司;2,4,6-三吡啶基三嗪[2,4,6-tri(2-pyridyl)-striazine,TPTZ](纯度>99%):上海阿拉丁生化科技股份有限公司;氯化硝基四唑兰(nitroblue tetrazolium salt,NBT)(纯度>98%)、还原型辅酶-钠(dihydro nicotine amidadenine dinucleotide,NADH-2Na)(纯度>98%)、邻二氮菲(纯度>99%)、吩嗪硫酸甲酯(phenazine metho sulfate,PMS)(纯度>98%):北京索莱宝科技有限公司;ABTS、DPPH:美国GLPBIO公司;标准品矢车菊素-3-O-葡萄糖苷、飞燕草素-3-O-葡萄糖苷、锦葵色素-3-O-葡糖苷、矮牵牛素-3-O-葡萄糖苷、芍药素-3-O-葡萄糖苷:法国Extrasynthese公司;矮牵牛素-3-阿拉伯糖苷、飞燕草素-3-O-阿拉伯糖苷、锦葵色素-3-O-阿拉伯糖苷标准品:上海甄准生物科技有限公司。
1.2 仪器与设备
ACQUITY UPLC I-Class超高效液相色谱仪、ACQUITY Xevo TQ-S三重四极杆质谱仪、ACQUITY UPLC BEH C18色谱柱:美国waters公司;UV-2600紫外分光光度计:日本SHIMADZU公司;PB-10pH计:德国Sartorius公司;Spectra MAX190酶标仪:美国Molecular Devices公司;3K15离心机:德国Sigma公司;ME235S电子分析天平:德国Sartorius公司;GHP-9080隔水式恒温培养箱:昆山一恒仪器有限公司。
1.3 试验方法
1.3.1 pH示差法测定总花色苷含量
参照Wang等[15]的方法,稍作修改。首先将B1P用含有0.1%盐酸的甲醇溶液溶解并配制成1 mg/mL的溶液,采用紫外分光光度计对B1P进行全波长扫描(200 nm~1 200 nm),确定最大吸收波长为518 nm。再将B1P溶液用pH 1.0和pH 4.5的缓冲液分别稀释100倍,37℃平衡60min后,用紫外分光光度计在518nm处测定吸光度,利用700 nm处吸光度进行校正。
总花色苷含量计算公式如下。

式中:ε为摩尔消光系数,26 900 L/(mol·cm);L为光程,1 cm;MW为矢车菊素花色苷相对分子质量,449.2 g/mol;DF 为稀释倍数;V 为总取液体积,L;Mt为样品质量,g。
1.3.2 基于UPLC-MS/MS测定B1P中8种花色苷含量
1.3.2.1 标准曲线的制备
用含有0.1%盐酸的甲醇溶液将8种蓝莓花色苷标准品[芍药素葡萄糖苷(peonidin-3-O-glucoside,Pn-3-G)、飞燕草素葡萄糖苷(delphindin-3-O-glucoside,Dp-3-G)、矮牵牛素葡萄糖苷(petunidin-3-O-glucoside,Pt-3-G)、矢车菊素葡萄糖苷(cyanidin-3-O-glucoside,Cy-3-G)、锦葵素葡萄糖苷(malvidin-3-O-glucoside,Mv-3-G)、锦葵素阿拉伯糖苷(malvidin-3-O-arabinoside,Mv-3-A)、矮牵牛阿拉伯糖苷(petunidin-3-O-arabinoside,Pt-3-A)和飞燕草阿拉伯糖苷(delphindin-3-o-arabinoside,Dp-3-A)],配制成浓度为1 mg/mL的储备液,再将8种花色苷的储备液用0.1%盐酸的甲醇溶液稀释成浓度为 0.5、1.0、2.0、5.0、10.0、20.0、50.0 ng/mL的工作溶液。在14 000 r/min,4℃条件下离心15 min,吸取200 μL上清液进样检测。
1.3.2.2 色谱条件
色谱条件:色谱柱为ACQUITY UPLC BEH C18(4.6 mm×50 mm,1.7 μm);流动相A为0.1%甲酸水溶液,流动相B为 0.1%甲酸乙腈;进样量1 μL;流速0.3 mL/min;柱温45℃;线性洗脱梯度为0~0.5 min(5%B)、0.5 min~2.5 min(5%~90%B)、2.5 min~4 min(90%~5%B)。
质谱条件:电喷雾离子源;扫描模式为多反应监测(multiple reaction monitoring,MRM);正离子检测模式;锥孔电压3.00 kV;去溶剂温度350℃;去溶剂气体650 L/h;喷雾气压力6.0 bar(1 bar=100kPa);毛细管电压3.00 kV;碰撞能量20 eV。
首先利用质谱全波长扫描(m/z100~2 000)B1P,确定几种含量较高的化合物,与花色苷标准品以及文献[12]结果进行比对,得到含量较高的8种花色苷,8个化合物及碎片信息如表1所示。
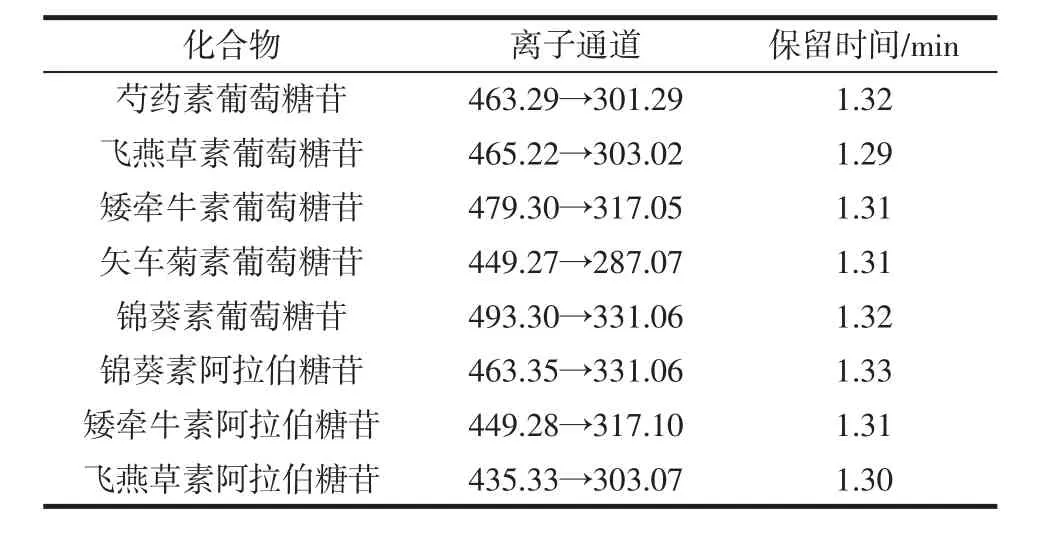
表1 8种花色苷的典型质谱参数Table 1 Specific mass spectrometric parameters of 8 anthocyanins
1.3.3 抗氧化活性的测定
1.3.3.1 样品的配制
将B1P和抗坏血酸(vitamin C,VC)分别用无水乙醇配制成 10、20、40、50、60、80、100 μg/mL 的样品溶液。VC作为阳性对照。试验涉及的样品及试剂均现配现用。
1.3.3.2 ABTS+·清除率的测定
7 mmol/L ABTS溶液与4.95 mmol/L过硫酸钾溶液等体积混合,避光反应14 h,得ABTS+溶液备用[4]。用磷酸盐缓冲液(phosphate buffer saline,PBS)稀释 ABTS+溶液20倍,使其在734 nm处吸光度为0.70±0.02。20 μL样品与200 μLABTS+溶液加至96微孔板。酶标仪在734 nm波长处测定吸光度,记为A1。用20 μL无水乙醇代替样品在734 nm处测吸光度,记为A0。用PBS代替ABTS+溶液测定吸光度,记为A2。ABTS+·清除率计算公式如下。
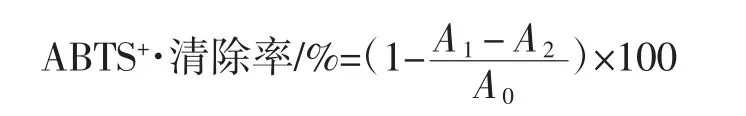
1.3.3.3 DPPH·清除率的测定
参照Zhou等[4]的方法并稍作修改,将100 μL样品与100 μL 0.5 mmol/L DPPH溶液加至96微孔板。在37℃恒温培养箱中,避光孵育30 min。酶标仪在517 nm处测吸光度,记为A1。以无水乙醇作对照,测得吸光度记为A0;用无水乙醇代替DPPH溶液,测得吸光度记为A2。DPPH·清除率计算公式如下。

1.3.3.4 羟基自由基(·OH)清除率的测定
96微孔板中加入40μL样品、40μL1.864mmol/L的邻二氮菲溶液,80 μL PBS(pH 7.4),40 μL 1.864 mmol/L的FeSO4·7H2O 溶液、40 μL 0.03% H2O2,混匀后避光37℃孵育60 min,酶标仪在536 nm处测定吸光度记为As,水作对照吸光度记为An,水代替样品和H2O2的吸光度记为Ab[16]。羟基自由基清除率计算公式如下。
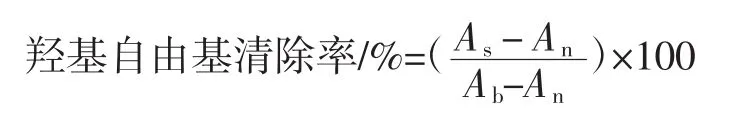
1.3.3.5 铁离子还原能力(ferric ion reducing antioxidant power,FRAP)测定
FRAP工作液为10 mmol/L TPTZ(40 mmol/L盐酸溶解)溶液:20 mmol/L FeCl3·6H2O∶0.3 mol/L的醋酸盐缓冲溶液以体积比为1∶1∶10混匀[17]。将FeSO4·7H2O稀释成 1.50、1.20、0.90、0.60、0.30、0.15 mmol/L 梯度溶液作为标准品[18]。20 μL FeSO4·7H2O和样品溶液、180 μL FRAP工作液依次加至96微孔板。37℃放置10 min后,用酶标仪在593 nm处测得吸光度为A。以FeSO4·7H2O为标准品绘制标准曲线,样品的总抗氧化能力以FRAP值表示。
1.3.3.6 超氧阴离子自由基清除率的测定
用0.1 mmol/L的磷酸盐缓冲液分别将NBT、NADH-2Na、PMS溶解并配制成 120 μmol/L 的 PMS溶液、300 μmol/L 的 NBT 溶液、936 μmol/L 的 NADH-2Na溶液[4]。将样品与上述溶液按照体积比1∶1∶2∶2加至96微孔板,混匀,25℃培养5 min,用酶标仪在560 nm处测得吸光度为A1。用乙醇代替样品测得吸光度为A0,用250 μL PBS缓冲液代替所加试剂测得吸光度为A2。超氧阴离子自由基清除率计算公式如下。

1.4 数据处理与统计分析
所有试验测定均重复3次,96微孔板平行设置3个孔,结果以平均值±标准差表示。采用Excel进行统计学计算,采用GraphPad Prism 8作图,采用UNIFI Ver.1.6.1软件进行数据处理及统计分析,显著性差异水平定为p<0.05。
2 结果与分析
2.1 B1P中总花色苷含量的测定
花色苷在pH1.0缓冲溶液中呈紫红色,而在pH4.5的缓冲液中稳定后为无色液体。这与文献[19]报道相符,即不同pH值条件下花色苷的结构不同,从而导致紫外吸收波长改变。pH1.0时,花色苷为稳定的黄盐阳离子,紫外吸收较强。pH4.5时,花色苷转化为甲醇假碱,颜色消失[19]。pH示差法利用紫外光吸收性质对花色苷进行定量检测,得到3批B1P总花色苷含量平均为(443.08±16.40)mg/g。此种B1P的总花色苷含量达到了40%以上,提取纯度高,质量稳定,为其后的结构分析和体外抗氧化活性试验提供了物质基础。
2.2 基于UPLC-MS/MS测定B1P中8种花色苷含量
本课题组前期分析了B1P中主要成分,根据目前国内外已知花色苷的种类及离子对,并将分析结果与花色苷标准品进行比对,确认了B1P中含量较高的8种花色苷。基于UPLC-MS/MS建立了B1P中8种花色苷的检测方法,此方法得到的线性范围为0.5 ng/mL~50.0ng/mL,采用最小二乘法进行回归分析,得到的R2均大于0.990 0,线性良好,各花色苷的回归方程及含量见表2。相对含量按照8种花色苷之和为100%进行计算。

表2 8种花色苷的标准曲线与含量Table 2 Standard curves and contents of 8 anthocyanins
由表2可知,Dp-3-G 含量为(80.90±0.30)mg/g,占8种花色苷之和的23.13%。其次是Mv-3-G,含量为(73.13±0.05)mg/g,相对含量为20.91%。以花色苷苷元划分,花色苷标准品含量总和由高到低为Mv(36.25%)>Dp(34.11%)>Pt(23.2%)>Cy(4.71%)>Pn(1.73%)。该液质联用方法不仅能够在短时间内同步定量8种花色苷,且仅需1 μL进样体积降低定量下限至0.5 ng/mL,很大程度上提高了检测效率。8种花色苷的总含量(349.77±0.94)mg/g与总花色苷检测结果(443.08±16.40)mg/g相比偏低,表明此种B1P中的花色苷种类不止这8种。根据文献报道,在所含花色苷种类方面,黑醋栗、美国蔓越莓等其他浆果主要含以矢车菊素为苷元的糖苷,与之相比,B1P 中含有以 Mv、Dp、Pt、Cy、Pn为苷元的糖苷,种类更加丰富,并与欧洲越橘、高丛蓝莓成分相似。B1P中以矮牵牛素为苷元的糖苷占总含量的23.2%,与欧洲越橘(3.3%)和高丛蓝莓(7.9%)相比,相对含量更高[20]。
2.3 B1P的体外抗氧化活性分析
2.3.1 ABTS+·清除率的测定
B1P与阳性对照VC的ABTS+·清除率如图1所示。

图1 不同浓度样品对ABTS+·清除率的影响Fig.1 Effects of different concentrations of ABTS free radical scavenging
根据自由基被清除一半时所需样品浓度计算得到两者半数抑制浓度(IC50),并作比较,VC的IC50为(52.69±2.46)μg/mL,高于B1P的IC50(37.81±4.30)μg/mL,即B1P的ABTS+·清除率优于VC。由图1可知,样品浓度在10μg/mL~60 μg/mL,B1P 的 ABTS+·清除率优于 VC且差异高度显著(p<0.001);当样品浓度高于 60 μg/mL时,清除率趋于饱和,此时二者的ABTS+·清除率均较强。
2.3.2 DPPH自由基清除率的测定
DPPH自由基清除率见图2。

图2 不同浓度样品对DPPH自由基清除率的影响Fig.2 Effects of different concentrations of DPPH free radical scavenging
由图2可知,VC和B1P二者清除率与样品浓度呈明显的剂量依赖关系。经计算得到B1P对0.5 mmol/L DPPH 自由基的IC50为(45.51±1.13)μg/mL,VC的IC50为(21.21±0.26)μg/mL。经分析得两者浓度在10 μg/mL~80 μg/mL时,VC的DPPH自由基清除率显著优于B1P;当两者浓度为100 μg/mL时,B1P和VC对DPPH自由基清除率差异不显著,清除能力均达到饱和状态。样品浓度在 10 μg/mL~80 μg/mL,B1P 的 DPPH 自由基清除率呈浓度依赖性,但较VC稍弱。B1P对ABTS+·清除率更高可能是因为抗氧化剂在DPPH体系反应中将溶解氧转化为氧气,而在ABTS反应体系中直接与氧气作用,且ABTS法适用于考察亲水性抗氧化剂,而DPPH法更适用于考察疏水抗氧化剂[21]。
2.3.3 羟基自由基清除率的测定
根据董晨阳等[22]的方法,利用芬顿体系产生·OH,当·OH被清除后随着体系中Fe2+的浓度升高,吸光度也随之上升。羟基自由基清除率的测定见图3。

图3 不同浓度样品对·OH清除率的影响Fig.3 Effects of different concentrations of OH free radical scavenging
由图3可知,B1P和VC在浓度小于50 μg/mL时,对·OH清除率均较低且差异不显著;但在浓度为50 μg/mL时,B1P对·OH的清除率极显著高于VC(p<0.01),样品浓度高于 50 μg/mL时,B1P对·OH 的清除效率显著高于 VC(p<0.05)。B1P对·OH 的 IC50为(51.33±8.03)μg/mL。结果表明,VC对·OH 清除率较低且不呈剂量依赖性,而B1P的·OH清除率较低高且呈剂量依赖性。
2.3.4 FRAP的测定
FRAP是花色苷总抗氧化能力的一种检测方法,TPTZ和FeCl3在酸性条件下还原,溶液呈微棕色,在还原反应完成后形成蓝色的亚铁配合物[23],样品的还原能力与待测物的抗氧化能力相关。以不同浓度的硫酸亚铁溶液结果绘制标准曲线(如图4),线性方程为y=1.080x+0.058,x表示硫酸亚铁溶液的浓度,y表示吸光度。相关系数R2=0.9996,表明其浓度在0.15mmol/L~1.50 mmol/L时线性良好。
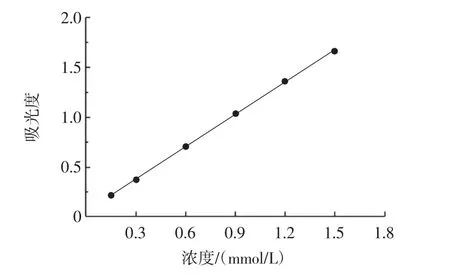
图4 FeSO4·7H2O标准曲线Fig.4 The standard curve of FeSO4·7H2O
样品的铁离子还原能力见图5。
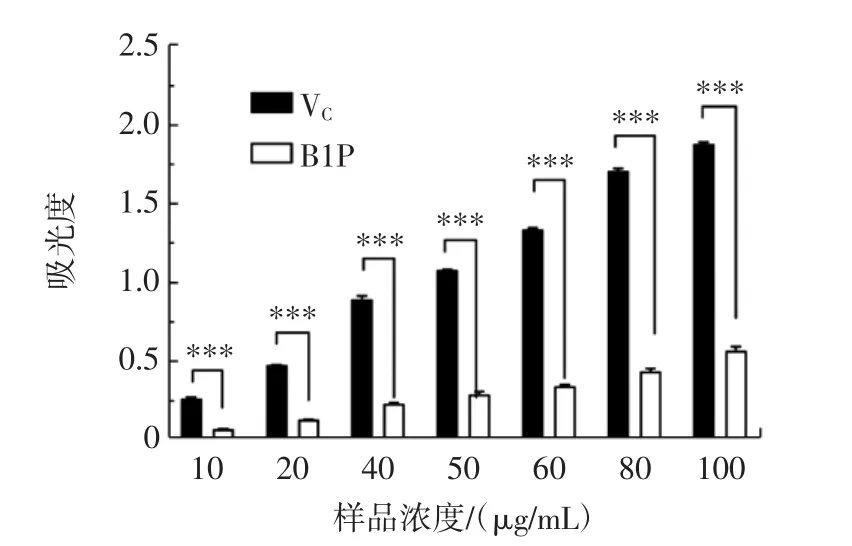
图5 不同浓度样品的铁离子还原能力Fig.5 Ferric ion reducing antioxidant power of different concentrations of sample solution
由图5可知,B1P的FRAP值呈明显的剂量依赖性。以上结果表明,B1P虽具有还原铁离子的能力,但是比VC弱。
2.3.5 超氧阴离子自由基清除率的测定
超氧阴离子是单线态氧分子和·OH的前体之一,会间接产生脂质过氧化物,因此超氧阴离子自由基的清除效率对鉴定抗氧化能力具有重要意义[10]。超氧阴离子自由基是通过PMS-NADH系统产生,本研究通过减少NBT来测定样品对超氧阴离子自由基的清除能力。超氧阴离子自由基清除率的测定结果见图6。

图6 B1P超氧阴离子自由基清除能力Fig.6 Clearance of B1P sample solution by superoxide anion assay
由图6可知,B1P和VC对超氧阴离子自由基的清除能力均具有一定的浓度依赖性,将二者IC50值作比较,VC的 IC50值为(29.76±10.31)μg/mL,高于 B1P 的IC50值(19.88±2.88)μg/mL。以上结果说明,B1P 具有较强的超氧阴离子自由基清除效果,且超氧阴离子自由基活性显著优于VC。
B1P具有较好的抗氧化活性,试验样品浓度在10 μg/mL~100 μg/mL 内,B1P 对 ABTS+·、·OH、超氧阴离子自由基清除率的IC50值分别为37.81±4.30、51.33±8.03、(19.88±2.88)μg/mL,抗氧化能力达到了微克级。FRAISSE等[24]认为花色苷的自由基清除活性可能不受花色苷糖基部分的影响,且随着B环上羟基数量增加而增加。也有研究表明苷元结构对DPPH活性强度依次为飞燕草素>矮牵牛素>矢车菊素>芍药素>锦葵素;对超氧阴离子自由基的活性强度依次为飞燕草素>矮牵牛素>锦葵素、矢车菊素>芍药素[25]。结合UPLC-MS/MS测得B1P花色苷含量结果中,苷元含量高低依次为飞燕草素>锦葵素>矮牵牛素>矢车菊素>芍药素。综合考量,对B1P抗氧化能力贡献较大的可能是飞燕草素糖苷和矮牵牛素糖苷。
3 结论
“蓝美1号”蓝莓粉(B1P)是从新型蓝莓中提取出来的富含花色苷的提取物,本文主要围绕B1P从定量分析和抗氧化活性方面展开研究。利用pH示差法测得B1P提取总花色苷浓度在40%以上,高于标准化花色苷提取物(含量为36%)。在此基础上建立了一种快速、灵敏的UPLC-MS/MS分析方法,并测定了B1P中主要花色苷(Pn-3-G、Dp-3-G、Pt-3-G、Cy-3-G、Mv-3-G、Mv-3-A、Pt-3-A 和 Dp-3-A)的含量。通过 ABTS、DPPH、·OH、FRAP、超氧阴离子自由基方法,考察了B1P中花色苷的抗氧化活性,结果显示B1P抗氧化能力较好,甚至部分优于VC,抗氧化能力能达到微克级。

