原子吸收法间接测定石膏矿中氯离子
欧阳泉根,黄龙
(核工业二八〇研究所,四川广汉 618300)
石膏建材中主要工业原料来源于石膏矿。石膏矿含有的氯离子对石膏产品的吸脱水﹑渗透率[1–4],脱硫率[5–7],膨胀率[8]有一定的影响,在其用作建筑材料时甚至对钢筋具有一定的腐蚀[9–12]作用。因此石膏矿中氯离子的测定具有重要的意义。目前,测定石膏矿标准方法主要采用建材行业标准(JC/T 1021.8–2007)硫氰酸汞比色法,而该方法中硫氰酸汞[此试剂已进入《中国禁止或严格限制的有毒化学品目录(第一批)》]具有剧毒,对安全环保影响较大,属于中国明令禁止使用的试剂,在国家限制购买违禁药品下,分析检测需要测定石膏矿中氯离子,必然需要采用别的替换方法。测定氯离子方法主要有分光光度比浊法[13–16]﹑滴定法[17–19]﹑选择电极电位滴定法[20–22]﹑离子色谱法[23–26]﹑原子吸收法[27–29]等。分光光度比浊法由于受外界干扰大,所得吸光度重现性较差,不易于掌握;滴定法适用于氯离子含量较高的样品,如果是用硝酸汞滴定法会生成含汞废液,不安全环保,且滴定条件苛刻(需严格控制pH 值在适当范围);选择电极电位滴定法由于矿物的消解液中含有一些物质会影响工作电池的电动势,进而干扰滴定结果,更适用于水样中氯离子的检测;离子色谱法中的色谱柱价格昂贵,石膏矿中硫酸根含量较高,易污染色谱柱,使得测定成本极其高昂,且矿石类样品中离子组成比较复杂,对色谱柱吸附容易造成干扰;原子吸收法多为间接检测法,虽然银离子在火焰原子吸收法中有很高的灵敏度,且氯化银在常温下溶度积常数较小,在高温下极易产生沉淀,且不溶于酸,但是针对其中S2–﹑Br–﹑I–离子干扰,以及微量氯离子测定等难点,使得原子吸收间接法测定氯离子还存在一定难度。笔者采用过氧化氢加热法除去S2–﹑Br–﹑I–离子干扰,并运用氯化银溶度积矫正法使得原子吸收测定微量氯离子更为准确。
1 实验部分
1.1 主要仪器与试剂
原子吸收分光光度计:Z–2000 型,日本日立公司。
硝酸:优级纯,天津市科密欧化学试剂有限公司。
硝酸银:分析纯,北京化工厂。
氯化钠:光谱纯,南京化学试剂股份有限公司。
硫酸钙:优级纯,南京化学试剂股份有限公司。
过氧化氢:分析纯,成都市科龙试剂有限公司。
氯化银:分析纯,南京化学试剂股份有限公司。
石膏成份分析标准物质:编号为GBW 03109a,ω(Cl)=0.033%;编号为GBW 03110,ω(Cl)=0.019%;编号为GBW 03111a,ω(Cl)=0.003 2%,国家建筑材料工业局地质研究所。
银离子标准储备溶液:1.000 mg/mL,准确称取1.574 8 g(精确至±0.000 1 g)经120 ℃干燥2 h 的硝酸银溶于水中,加入10 mL 硝酸,移入1 000 mL 容量瓶中,用水稀释至标线,摇匀,贮存于棕色磨口瓶中并于避光阴凉处保存。
银离子标准工作溶液:100 μg/mL,用50.00 mL 胖度移液管(20 ℃)准确移取50.00 mL 银标准储备溶液于500 mL 容量瓶中,加入4.50 mL 硝酸,用水稀释至标线,摇匀,贮存于棕色磨口瓶中并于避光阴凉处保存。
氯离子标准储备溶液:1.000 mg/mL,准确称取1.647 9 g 氯化钠,溶于水中,移入1 000 mL 容量瓶中,用水稀释至标线,摇匀,贮存于棕色磨口瓶中。
氯离子标准工作溶液:100.0 μg/mL 用50.00 mL 胖度移液管(20 ℃中)准确移取50.00 mL 氯离子标准储备溶液于500 mL 容量瓶中,用水稀释至标线,摇匀,贮存于磨口瓶中。
实验用水均为去离子水。
1.2 仪器工作条件
检测波长:328.1 nm;狭缝宽度:0.40 nm;灯电流:7.0 mA;燃烧器高度:7.5 cm;负高压:330 V;空气流量:15.0 L/min;乙炔气流量:2.0 L/min。
1.3 实验方法
1.3.1 样品消解
准确称取0.500 0~1.000 g(精确至0.000 1 g)样品于250 mL 烧杯中,用水润湿,加入5 mL 硝酸溶液(1+1)﹑20 mL 水﹑2 mL 过氧化氢,盖上表面皿,摇散样品,放置于恒温电热板上,控制温度为90~100 ℃,微沸15 min,期间摇晃烧杯2~3 次(每次均将样品摇散),冷却,转移至100 mL 容量瓶中,用水稀释至标线,摇匀,澄清。按同样的方法随做样品空白。
1.3.2 氯化银生成及测定
分取25 mL 上述样品消解溶液的上层清液于50 mL 比色管中,每份均准确加入含500μg 的银离子标准溶液,摇匀,加入1.25 mL 硝酸溶液(1+1),摇匀。然后于水浴锅中煮25 min,其间摇动两次,取出冷却,用水稀释至标线,摇匀,于25 ℃环境中将溶液陈化过夜,作为待测样品溶液。
1.3.3 样品中氯离子含量的计算
用原子吸收分光光度计测定待测样品溶液,可得到银离子浓度ρAg+,由于样品溶液中已加入了500 μg 银离子,那么发生了反应的银离子为原有银离子含量减去测得银离子含量,再者,氯化银沉淀的形成是氯离子和银离子等摩尔进行的,因此,可以根据发生了反应生成了氯化银沉淀的银离子含量得出相应氯离子含量。同时,从氯离子与银离子(25 ℃)溶度积可知,溶液中银离子含量可以根据氯化银溶度积来计算溶解于溶液中氯离子含量,这两者氯离子含量之和即为分取溶液中氯离子含量。按式(1)计算样品中氯离子的含量。

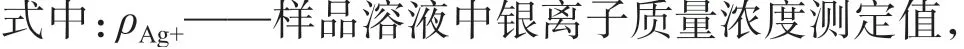

2 结果与讨论
2.1 共存离子的影响
在相同温度下,Ag2S﹑AgBr﹑AgI 的溶度积均比AgCl 的溶度积小,共存溶液中S2–﹑Br–﹑I–离子均干扰Cl–的测定,使Cl–测定结果偏高。由于过氧化氢可以氧化溶液中S2–﹑Br–﹑I–离子而不能氧化Cl–。在酸性介质和加热条件下,S2–被氧化成硫酸根离子;Br–被氧化成Br2,在加热条件下挥发除去Br2;I–被氧化成碘单质,单质碘对本实验影响小。称取7份1.000 0 g 分析纯CaSO4并均加入200 μg Cl–标准溶液,1 份用作空白,另6 份分别加入50 μg S2–﹑50 μg Br–和50 μg I–溶液,其中3 份不加入过氧化氢,按照1.3 实验方法进行实验。经原子吸收分光光度计对银离子的测定显示:空白所测银离子浓度与加入过氧化氢加热除去的S2–﹑Br–和I–干扰离子所测浓度一致;未加入过氧化氢的银离子浓度明显偏低。结果表明,S2–﹑Br–和I–在过氧化氢处理下不干扰对Cl–的测定。
2.2 氯化银沉淀溶解度的影响
氯化银沉淀溶解度对石膏矿中微量氯离子的测定存在较大的影响。在25 ℃时氯化银在水中的溶度积为KSP,AgCl=1.80×10–10mol/L,按50 mL 比色管计算,饱和溶液中氯离子含量为22.02 μg。这对于氯含量较低的石膏矿会产生较大的影响。为解决这一影响,氯离子结果须以氯化银溶度积来矫正,由于KSP,AgCl=[Ag+]×[Cl–],根据公式可以绘制出25 ℃时不同量银离子对氯化银溶解度关系图,所得氯离子与银离子溶度积曲线图(25 ℃)如图1 所示。
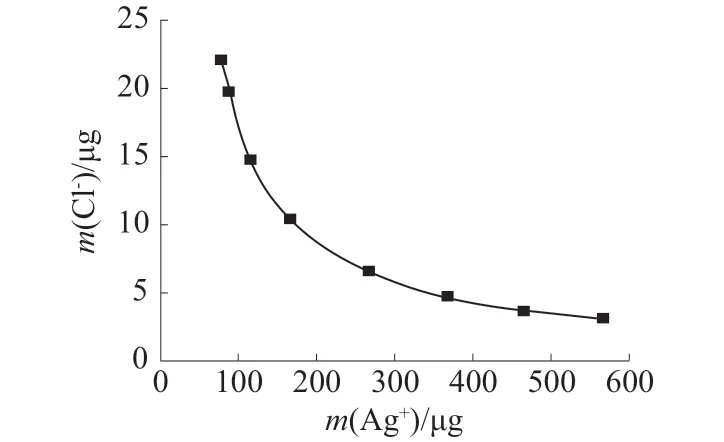
图1 溶度积曲线图(25℃)
从图1 中可得,50 mL 比色管中氯离子含量与银离子含量存在幂关系,计算得m(Cl–)=1 683.8m(Ag+)–0.996 [式中m(Cl–)为氯离子含量,m(Ag+)为银离子含量],即当溶液中加入500 μg 银离子时,加上氯化银溶解时的银离子可得:氯离子含量大于3.04 μg 时,溶液才产生沉淀。在此氯离子含量下,如果样品称样量为1.000 0 g,则样品中氯离子影响值为0.000 3%,对于石膏矿中氯含量范围为0.002%~0.100%的检测是允许的。为测定微量的氯离子,实验采用50 mL 比色管中加入500 μg 银离子来沉淀氯离子为宜。
2.3 絮凝剂的影响
由于氯化银是胶状沉淀,要使沉淀最大程度的减少吸附,需加入强电解质作为絮凝剂[30]。为了证实絮凝剂对本实验结果的影响,故设计了以下几个比对实验来验证。称取6 份1.000 0 g CaSO4,1 份不加任何电解质,另5 份分别加入4 mL 100 g/L 的KNO3﹑NaNO3﹑CuSO4﹑K3PO4﹑Al2(SO4)3溶液,每份再加入200 μg Cl–标准工作液,然后按1.3 实验方法进行测定,随同做空白试验(无硫酸钙加入)。经原子吸收分光光度计对银离子的测定显示:不加电解质的溶液与加入电解质的溶液所测银离子浓度基本一致,空白试验中银离子含量较以上银离子浓度高。试验表明,不加入絮凝剂条件下银离子浓度偏高;在硫酸钙存在下,絮凝剂的加入对本实验结果影响小,初步认定石膏矿溶液中溶解的大量钙离子和硫酸根离子对氯化银胶体起到一定的絮凝作用,所以本法可不加入其它絮凝剂来凝聚氯化银沉淀。
2.4 加热和陈化时间对氯化银沉淀程度的影响
2.4.1 加热时间对氯化银沉淀程度的影响
在本实验条件下,由于氯化银胶体受温度的影响比较显著,虽然温度的提升对氯化银溶解度有所提高,但同时也加快了氯化银沉淀的生成速度。在50 mL 比色管中加入50 μg 氯离子溶液和500 μg银离子,按1.3.2 实验方法进行加热试验。分别采用一份常温(25 ℃)和四份加热至不同温度的溶液来观察氯离子和银离子反应速度,以银离子吸光度达到波动较小作为计时节点,氯化银完全沉淀的反应温度–时间关系见图2。
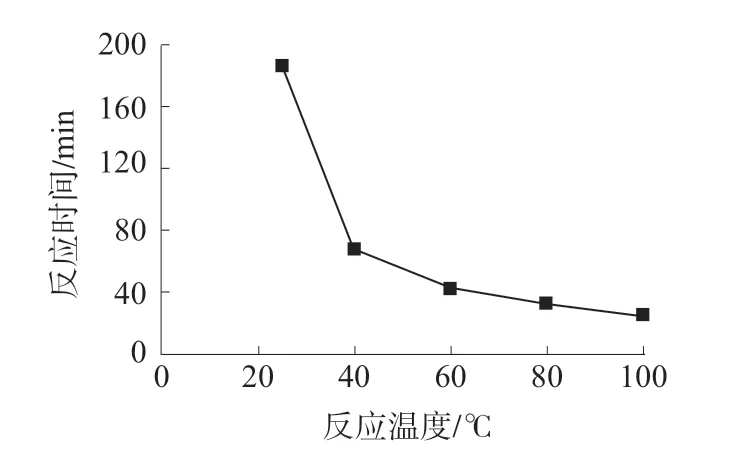
图2 氯化银完全沉淀的反应温度–时间关系
从图2 中可知,常温(25 ℃)下氯离子与银离子生成氯化银沉淀完全程度速度较缓,约180 min;在60~100 ℃加热下,氯离子与银离子生成氯化银沉淀完全程度速度变化不是很明显,在20~40 min之间。为了更好控温,笔者采用水浴(100 ℃)对样品进行加热25 min 来进行氯化银的沉淀反应。
2.4.2 陈化作用对氯化银沉淀完全程度的影响
上述产生的氯化银需继续进行凝聚沉淀,需要一个陈化的过程。实验采用50 mL 比色管中加入50 μg 氯离子溶液和500 μg 银离子,按上述1.3.2实验方法进行加热实验。实验对象分别采用5 份陈化至不同时间来反应氯离子和银离子陈化程度,以银离子吸光度达到波动较小作为计时节点,做陈化时间和银离子吸光度实验图,实验结果见图3。从图3 中可知,陈化6 h 以后,银离子吸光度基本保持不变,说明氯化银已完全沉淀,因此采用陈化6 h 后再对银离子进行测定。
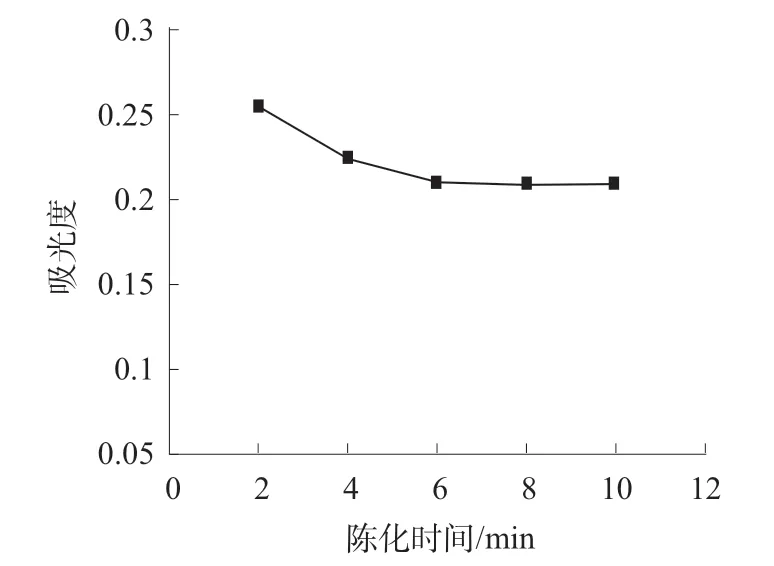
图3 陈化时间与银离子吸光度关系
2.5 标准曲线的绘制
分别准确移取0﹑0.100﹑0.250﹑0.500﹑1.00﹑2.50﹑5.00 mL 银标准工作溶液于7 只50 mL 比色管中,加入2.5 mL 硝酸溶液(1+1),用水定容至标线,摇匀,得到银离子浓度分别为0﹑0.20﹑0.50﹑1.00﹑2.00﹑5.00﹑10.0 μg/mL 系列标准工作溶液。在25 ℃的环境下恒温15 min,用原子吸收分光光度计测量吸光度,以银离子质量浓度为横坐标﹑银离子吸光度为纵坐标绘制标准工作曲线。线性回归计算得线性方程为y=0.029 44x+0.003 394,线性相关系数r=0.999 8。
2.6 精密度试验
按实验方法对建材市场中石膏矿样品进行了氯离子测定,结果见表1。由表1 可知,样品测定结果的相对标准偏差为1.2%~4.2%(n=11),说明该方法具有较高的精密度。

表1 石膏矿样品中氯离子质量分数的测定结果
2.7 准确度试验
按实验方法对三个石膏矿标准样品的进行测定,测定结果如表2。从表2 可知,本法所测石膏矿中氯离子相对误差均小于其相对误差允许限,说明该法准确可靠。
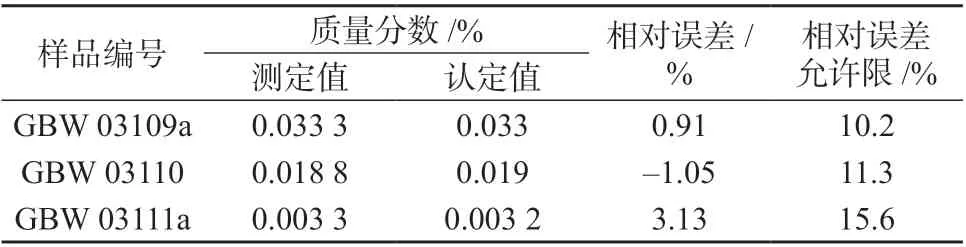
表2 石膏矿标准样品中氯离子的测定结果
3 结论
采用过氧化氢加热法去除S2–﹑Br–﹑I–,根据氯化银溶度积来矫正溶液中的氯离子,使原子吸收法来间接测定石膏矿中氯离子成为可能,并避免了使用高毒试剂的风险,达到安全环保检测石膏矿中氯离子的目的,为建材中氯离子检测提供新的检测方法。但是由于建材的复杂性,还有建材标准样品制作的难度,笔者仅使用石膏矿作为研究对象,这也是本法限制之一。对于下一步检测,希望可以针对更多复杂的检测标准样品做出必要实验。

