基质金属蛋白酶3在舌鳞状细胞癌中的表达及其临床意义
袁硕,高炳菊,李斌,仝越越
(1.东南大学附属中大医院 口腔科,江苏 南京 210048; 2.福建医科大学附属第一医院口腔颌面外科,福建 福州 350004)
每年全世界范围内约有40万人被确诊为口腔癌,20万人死于口腔癌[1]。舌鳞状细胞癌是最常见且致死率最高的口腔癌,目前公认的治疗方案是以手术切除为主的综合序列治疗,但是术后生存率仍然不理想(为40%~50%)[2],因此需要从分子水平更进一步研究舌癌的病理机制,从而对舌癌的治疗提供有效的帮助。基质金属蛋白酶3(matrix metalloproteinase 3,MMP3)属于基质降解酶类,已被证实与多种恶性肿瘤的发生发展、侵袭转移有关,但是其在口腔癌尤其是舌癌中的研究较少。本研究旨在探讨MMP3在舌癌中的作用,以期在分子水平探索舌癌治疗的新方法。
1 材料与方法
1.1 材料
1.1.1 研究对象及标本来源 选择福建医科大学附属第一医院口腔颌面外科手术切除、术后病理证实为舌鳞状细胞癌的标本49例(均未行放疗和化疗),切取新鲜的原发灶及癌旁正常组织,立即保存于液氮中,用于提取RNA。
1.1.2 主要试剂 Trizol试剂(美国Invitrogen公司),逆转录及扩增试剂盒(日本TaKaRa公司),DEPC水(中国天根生化科技有限公司),所有引物均由上海铂尚生物有限公司提供。
1.2 方法
1.2.1 组织总RNA提取 取新鲜组织约200 mg于匀浆管中,加入1 ml Trizol,以5 m·s-1的速率匀浆30 s,间隔5 min并重复以上步骤5次,静置5 min后加入200 μl氯仿,剧烈振荡15 s并静置3 min,12 000 r·min-1离心15 min后吸上层水样液体500 μl于新EP管并加等体积异丙醇,轻摇混匀冰上静置15 min,12 000 r·min-1离心10 min后留沉淀并用预冷的75%乙醇洗涤,7 500 r·min-1离心5 min,弃上清并干燥5 min,加入DEPC水20 μl混匀。取2 μl所得RNA于紫外分光光度计下检测OD260 nm、OD280 nm及其比值(均大于1.9)确定RNA浓度及纯度。
1.2.2 逆转录cDNA 按照逆转录试剂盒操作体系进行cDNA的逆转录并用于扩增模板。
1.2.3 实时荧光定量聚合酶链反应 根据扩增试剂盒操作说明配置反应体系,引物序列见表1。PCR反应参数如下:预变性95 ℃ 1 min;然后95 ℃ 15 s, 60 ℃ 30 s, 共40次循环。每个EP管的荧光信号达到设定的阈值所经历的循环数定义为CT值,采用2-ΔΔCt法计算实验组与对照组的倍数关系并取对数后绘制成柱状图,各组目的基因的表达均以内参基因ACTB校正。
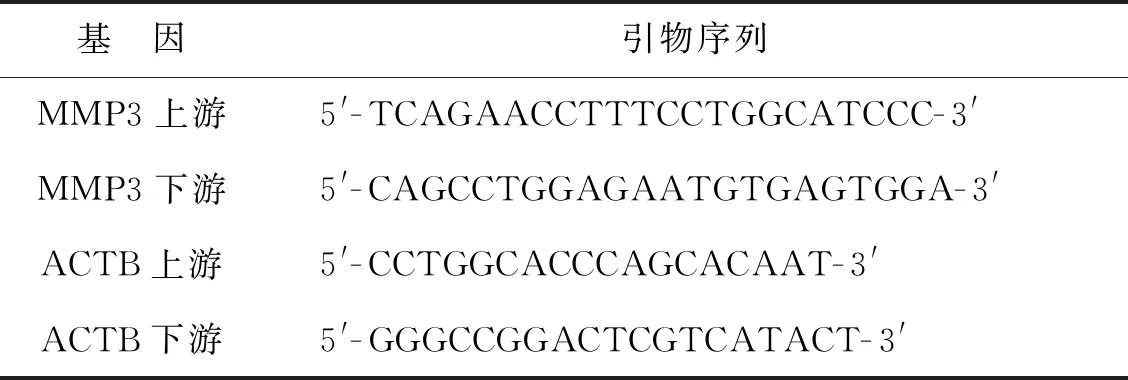
表1 PCR引物序列
1.3 统计学处理
每组实验重复3次,所有数据采用SPSS 20.0软件分析,两两比较采用配对t检验,临床资料分析采用Fisher确切概率法;应用Prism 5.0软件(GraphPad)作图。P<0.05为差异具有统计学意义。
1.4 生物信息学分析
1.4.1 数据资料收集及处理 从TCGA(https:∥cancergenome.nih.gov/)数据库中下载舌癌的基因表达谱数据和相关的临床信息,剔除随访信息和临床参数不完整的病例,共纳入138例舌癌患者,包含13例正常组织和125例舌癌组织,整理样本数据并采用R软件预处理,提取MMP3单基因样本及相对应的临床信息,利用R语言t检验分析MMP3在舌癌及癌旁组织中的差异表达情况。
1.4.2 生存分析 根据样本中MMP3基因表达的中位值将MMP3分为高表达组和低表达组,采用R软件的“survival”软件包进行生存分析并绘制生存曲线。将各个样本MMP3表达量与生存信息相结合,应用Kaplan- Meier生存曲线联合Log- rank检验对数据集进行生存分析,判断MMP3对患者预后的预测价值。
1.4.3 基因集富集分析(gene set enrichment analysis, GSEA) 采用 GSEA 4.0(http:∥software.broadinstitute.org/gsea/index.jsp)进行GSEA,寻找MMP3影响肿瘤发生发展可能的生物信号通路。采用GSEA网站的MsigDB数据库获取c2.cp.kegg.v7.0.symbols.gmt数据集,设置分析置换次数为1 000次,显著富集基因集须满足以下条件:错误发现率(false discovery rates,FDR)<0.25,P<0.05。
2 结 果
2.1 MMP3在舌癌组织中高表达
在选取的49对配对组织中,MMP3 mRNA在癌组织相对高表达的有42对(85.7%),而另外7对在癌旁组织中相对高表达,差异具有统计学意义(t=-8.092,P<0.05)。绘成柱状图如图1,统计结果如图2。
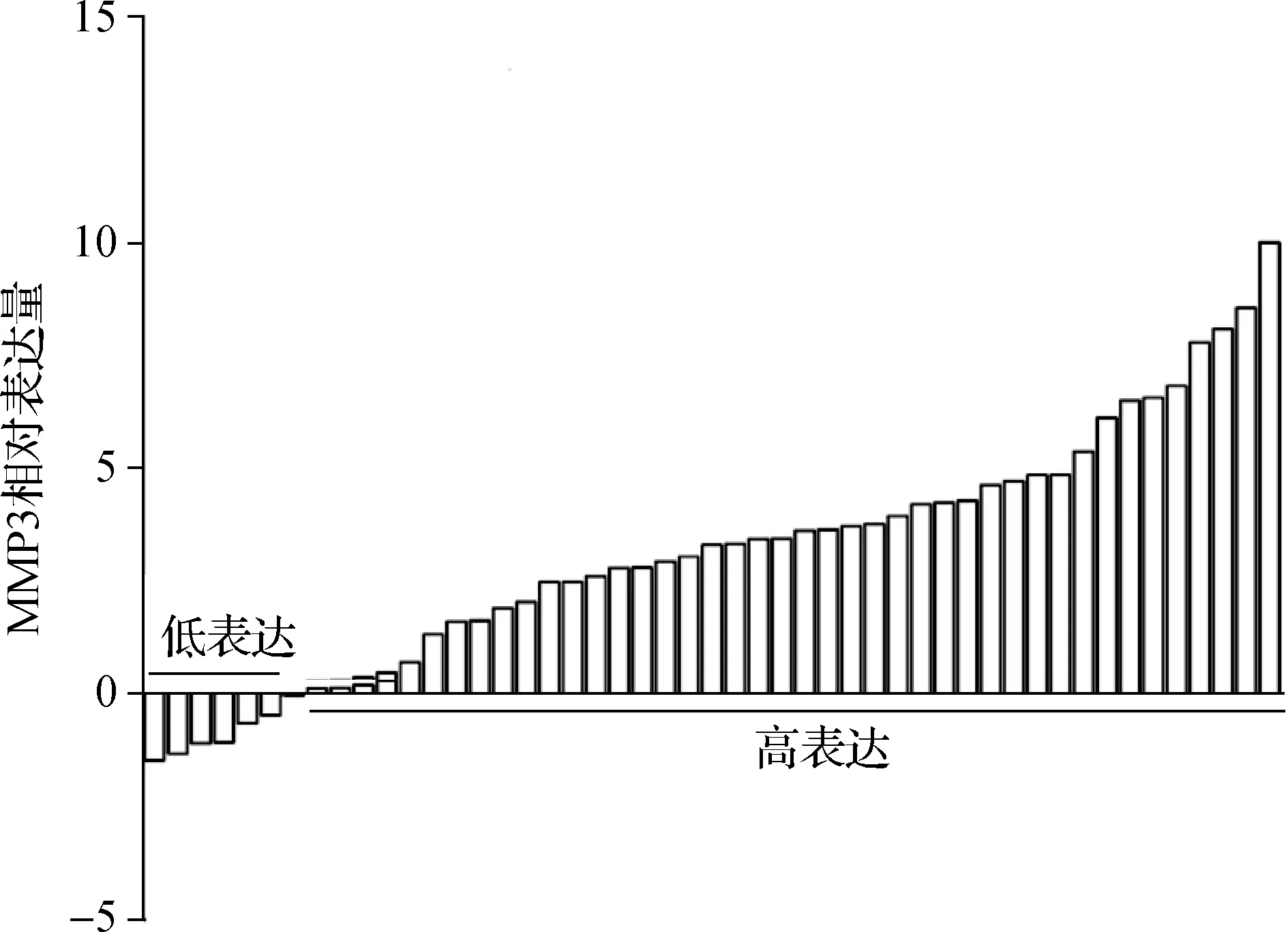
图1 MMP3在舌癌及癌旁组织中相对表达情况

a与癌旁组织比较,P<0.05
2.2 舌癌患者癌组织中MMP3高表达的意义
MMP3高表达与舌癌的淋巴转移有关,而与患者性别、年龄、原发肿瘤大小及肿瘤细胞的分化无明显相关,见表2。MMP3表达与淋巴转移关系的统计结果P<0.05,提示MMP3高表达可促进舌癌的淋巴转移。
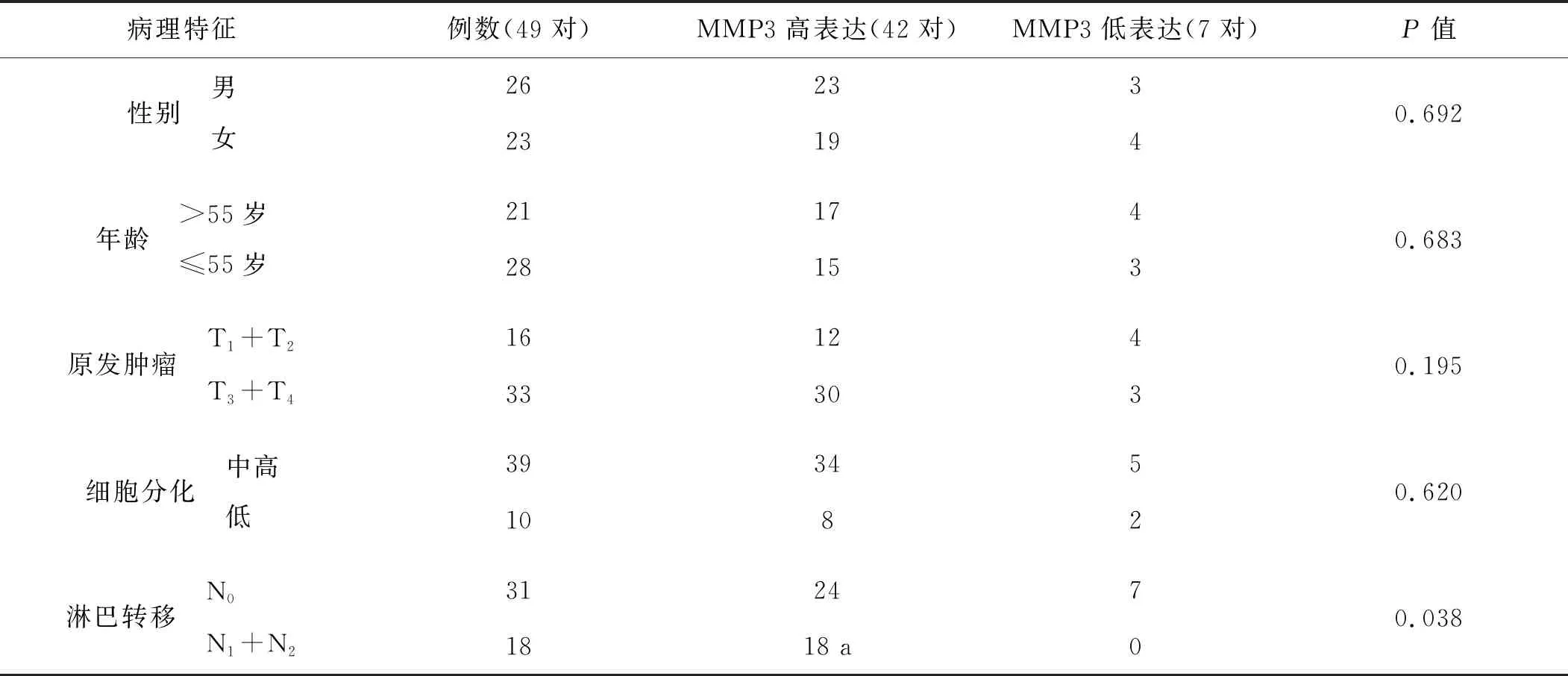
表2 患者癌组织中MMP3表达与临床病理特征的关系
2.3 TCGA数据库中MMP3在舌癌及癌旁组织中的表达情况
对TCGA数据库中MMP3在舌癌组织(125例)及癌旁组织(13例)中的相对表达分析显示,在癌组织中MMP3的表达量上调(t=-18.671,P<0.05),提示MMP3在舌癌中可能是促癌基因,见图3。

a 与癌旁组织比较,P<0.05
2.4 MMP3表达对舌癌预后的影响
根据TCGA数据库样本中MMP3基因的表达中位值将MMP3表达分为高表达组与低表达组,进行生存分析并绘制生存曲线,结果显示,MMP3高表达患者生存周期更短而MMP3低表达患者生存周期更长,差异具有统计学意义(P=0.03),说明高表达MMP3与舌癌的不良预后有关,如图4。

a 与MMP3高表达组比较,P<0.05
2.5 MMP3相关信号通路富集分析
GSEA结果显示,MMP3高表达样本显著富集至细胞因子与细胞因子受体相互作用通路、造血细胞调控信号通路、细胞外基质受体相互作用信号通路、趋化因子信号通路及JAK络氨酸激酶信号通路等基因集,提示MMP3可能通过多种生物信号通路参与肿瘤的发生发展。
3 讨 论
舌癌是最常见的口腔癌,大多是鳞状细胞癌,较常淋巴转移至颈部,这给舌癌的治疗带来了困难。目前舌癌的治疗以外科手术切除为主、放化疗为辅,但是预后仍然不是很理想。因此,寻找与舌癌发生发展相关的分子,并研究其作用机制,以求对舌癌治疗带来新的突破显得十分必要。
MMP是一大类需要Ca2+、Zn2+等金属离子作为辅助因子的分泌型蛋白[3]。目前已研究发现其参与多种肿瘤的病理过程,包括凋亡、免疫、转移及血管再生[4]。
在之前的研究中,本文作者等[5]通过体外分子生物学实验及裸鼠体内高转移模型发现MMP7可促进舌癌的增殖、迁移和侵袭。MMP3是家族中的基质降解酶类,与MMP7具有同源性,被认为是多种肿瘤,包括胃癌[6]、食管癌[7]、肺癌[8]、膀胱癌[9]、宫颈癌[10]等的癌基因。
与全身其他肿瘤的研究结果类似,Tanis等[11]利用二代测序技术证实MMP3在口腔鳞癌组织中显著高表达,可能是口腔癌的癌基因。而Agha- Hosseini等[12]通过ELISA实验对30例口腔扁平苔藓(癌前病变)和20例口腔鳞状细胞癌患者血液及唾液中分泌型MMP3的检测发现,鳞癌患者的MMP3表达量显著增高且更高分级的鳞癌MMP3表达更高,这说明MMP3在口腔鳞癌癌变过程中发挥重要作用。另外有研究发现,MMP3作为mic- 519d的下游基因促进口腔鳞状细胞癌的转移,并且高表达MMP3预示着更差的细胞分化、更高的肿瘤分级及更短的术后生存周期[13],但MMP3在舌癌中的作用较少有人关注。本研究比较癌与癌旁标本中MMP3的表达情况,结果发现,癌组织中MMP3的表达水平明显高于相应的癌旁组织,这与Agha- Hosseini等[12]的研究结果类似,不同的是其选取了癌前病变组织以及测量了MMP3蛋白水平的变化,但结果均说明了MMP3的促癌作用。同时本研究分析MMP3表达的临床意义发现,MMP3表达与舌癌的淋巴转移有关,而与患者的性别、年龄、肿瘤大小及肿瘤细胞的分化无明显相关,但Jin等[13]发现MMP3与口腔癌的细胞分化及淋巴转移均相关,这可能跟研究样本量多少以及标本选择有关,更多的结果有待以后更深入的研究。另外,为了进一步验证本研究结果,我们利用生物信息学方法在TCGA公共数据库中挖掘信息,同样发现MMP3在舌癌组织中高表达且高表达MMP3的患者预后更差,这都说明了MMP3在舌癌中扮演着促癌基因的作用。而关于MMP3如何发挥促癌作用,本研究发现高表达MMP3功能显著富集至细胞因子与细胞因子受体相互作用通路、造血细胞调控信号通路、细胞外基质受体相互作用信号通路、趋化因子信号通路及JAK络氨酸激酶信号通路等基因集,提示MMP3可能通过多种生物信号通路参与肿瘤的发生发展。本研究不足之处是缺少体外细胞分子功能实验和体内动物实验以及MMP3如何调控的分子机制等的相关研究,这也提供了后续研究的思路。

