原发性泪小管泪总管交界处黏膜恶性黑色素瘤一例报道并文献复习
常双双,张晓俊
(1.南京医科大学,江苏 南京 210000; 2.南京医科大学 第二附属医院,江苏 南京 210000)
黏膜黑色素瘤占所有黑色素瘤的1%~2%,其中25%~50%位于头部和颈部[1],来源于泪道的恶性黑色素瘤(以下简称恶黑)更是罕见报道,来自泪囊的黑色素瘤报道不足50例[2],来源于鼻泪管的仅报道了4例[3- 5],来源于泪小管、泪总管的尚未见报道。超低的发病率导致诊治认识的不足。作者报告1例病理诊断为泪小管泪总管交界处恶黑、于局部切除术后7个月后原位复发并远处转移患者的资料,复习相关文献,探讨该病的临床表现、眼科专科检查、影像学特征及最新治疗动态,以期增加临床医生对该病的认识。
1 病例资料
1.1 首次诊疗
患者女,68岁,因“右眼血性分泌物3月余”于2017年8月7日入院,2个月前曾于外院行右眼泪道新生物部分切除术,病理提示圆细胞可能,缺乏免疫组化结果。
专科检查:双眼视力1.0;右眼上睑近内眦部红肿,上泪小点口见肉芽样新生物自泪道突出(图1),球结膜、睑结膜均未见色素沉着;余未见明显异常。泪道冲洗:右眼冲洗针头自上泪小点进入可触及上泪道管腔前上壁肿物,质软、无压痛,探针可触及骨壁,冲洗通畅。泪道内窥镜自右眼上泪小点进入,见上泪道管腔有一肉芽样新生物,质软,暗红色,触之易出血,有蒂,蒂部附着于上泪小管与泪总管交界处,泪囊、鼻泪管结构完整,未见异常;自下泪小点进入,下泪小管管腔光滑,未见明显新生物。鼻旁窦CT平扫:泪囊造影未见明显异常,内眦部软组织增厚。

图1 右眼上泪小点处眼前节照片 见右眼泪小点处伸出来自泪道的肉芽样新生物
同年8月8日予分离、剪除新生物。8月14日病理诊断:黏膜恶黑(图2)。建议患者扩大切除范围,患者拒绝。
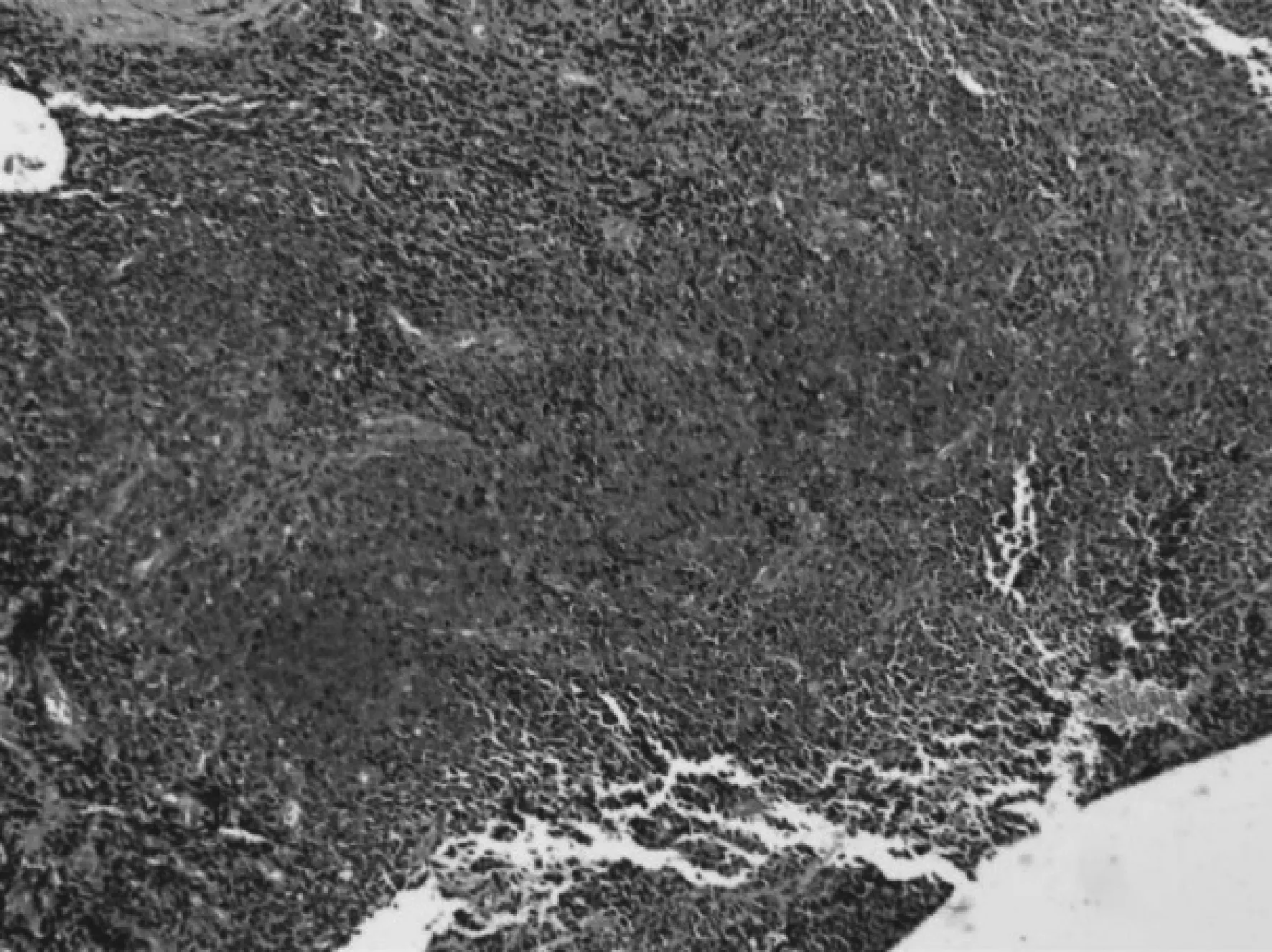
图2 2017年8月14日第1次泪道新生物病理检查结果 HE×200 见小圆细胞;EnVision法免疫组化:S- 100(+),MelanA(+),CKpan(-),CD31(血管+),CD34(血管+),Erg(血管+),CD20(B细胞+),Ki- 67(约80%)
同年9月发现内眦部新生物生长,正电子发射计算机断层显像(positron emission tomography- computed tomography, PET- CT)示右眼内眦部脱氧葡萄糖(fluorodeoxyglucose, FDG)摄取信号略增高,全身未见转移。9月9日于上海交通大学医学院附属第九人民医院眼科行“右内眦新生物切除术”,术后病理提示炎性组织。但医生询问病史后仍建议眼眶内容物剜除,患者拒绝。
同年12月28日于波士顿Dana- Farber癌症研究所就诊,修改诊断为右侧结膜黑色素瘤,医生认为结膜黑色素瘤总体倾向于局部复发,若复发则局部控制即可。并于马萨诸塞州眼耳专科医院行面部磁共振(MR)检查,示右侧鼻泪管软组织增强,残留肿瘤难排除。
1.2 二次诊疗
2018年2月26日患者因“右眼有血性分泌物1 d”再次入院。
专科检查:右眼视力0.6,左眼视力0.8;右眼泪小点在位,泪小点处未见明显新生物;余未见明显异常。泪道冲洗:右眼通畅,冲洗探针未触及软性阻挡,可触及骨壁。MR鼻旁窦平扫:右侧泪囊区软组织增厚及右侧鼻泪管上段黏膜增厚(图3);增强扫描后见该处明显强化(图4)。

图3 2018年3月8日鼻旁窦MR平扫图像 平扫厚度3 mm,仅能见泪囊区,未见泪小管、泪总管处,右侧泪囊区软组织增厚及右侧鼻泪管上段黏膜增厚
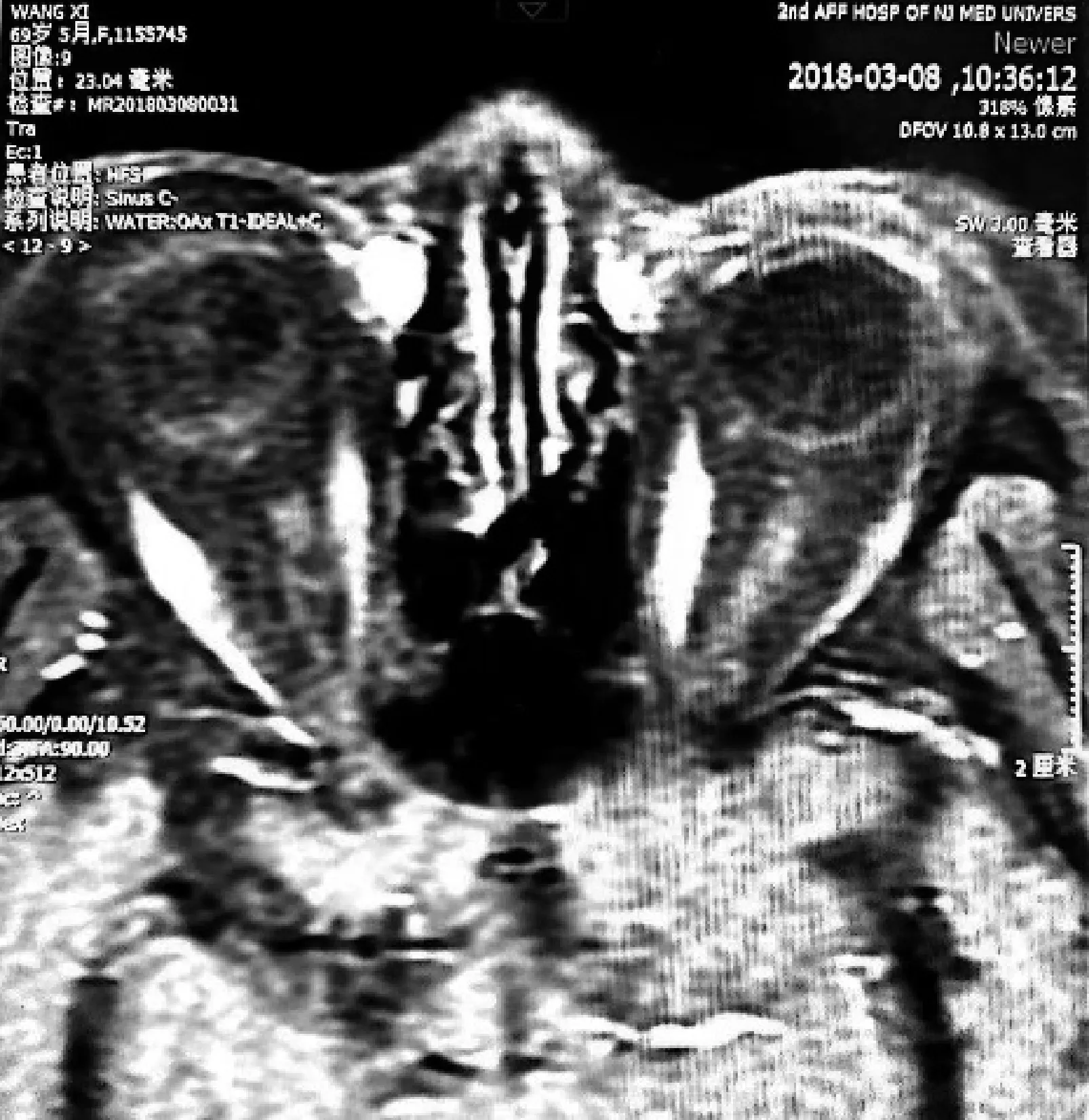
图4 2018年3月8日鼻旁窦MR增强扫描图像 厚度3 mm,仅能见泪囊区,未见泪小管、泪总管处,增强扫描后见黏膜增厚处明显强化,表明血运丰富
2018年3月9日行右眼泪道新生物切除加人工泪道置管置入术,术中见上泪小管和泪总管移行处管壁内组织增生,予切除。术后病理诊断恶黑(图5)。
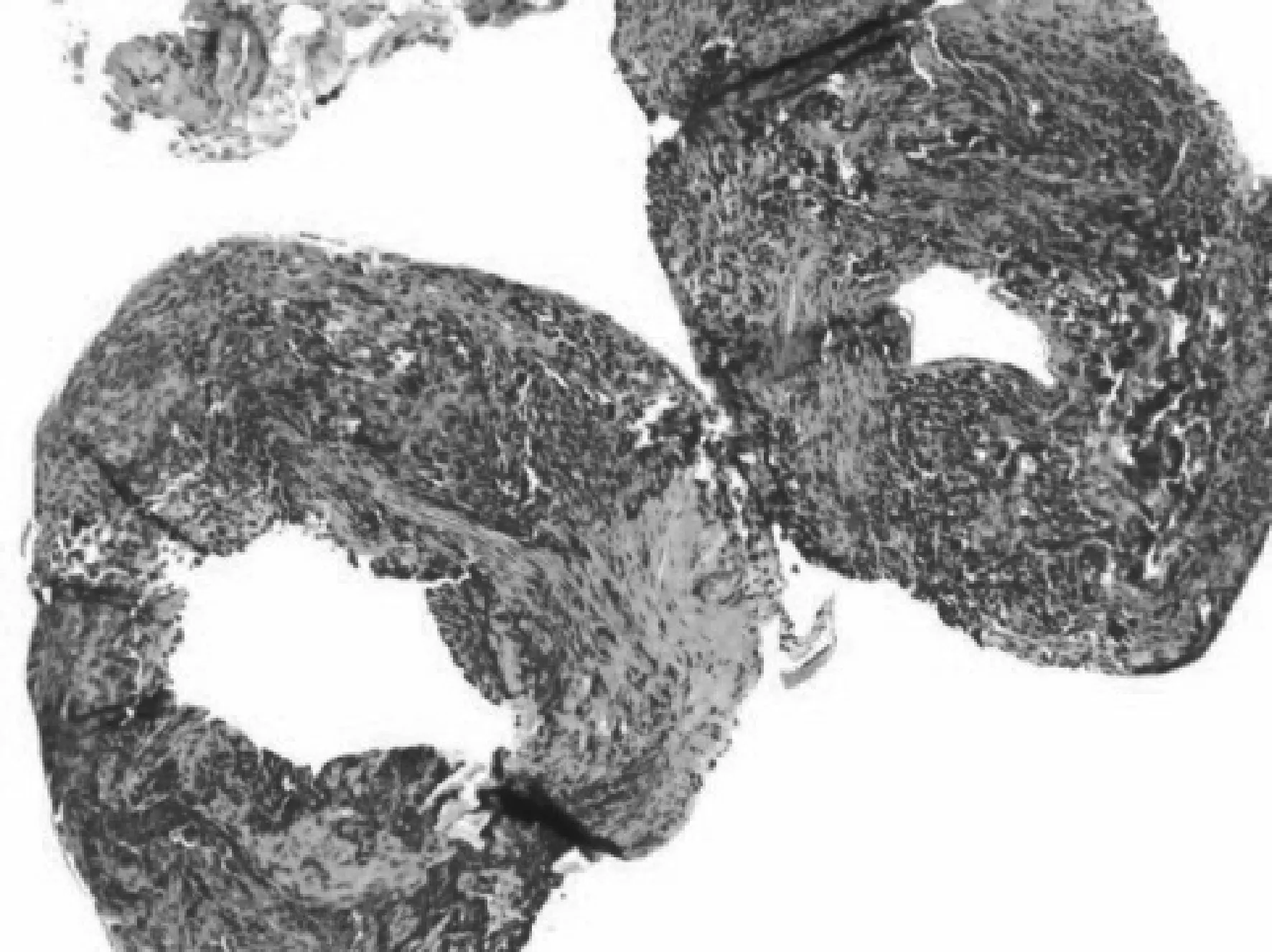
图5 2018年3月13日第2次泪道新生物病理检查结果 HE×200 见多灶挤压变形的异型细胞;EnVision法免疫组化:S- 100(散在+),HMB45(散在+),MelanA(散在+),CKpan(-),LCA(-),Ki- 67(约30%+)
后行扩大切除术,术中完整切除泪小管、泪总管、泪囊、骨性平面以上的鼻泪管。术后病理报告:右泪道病灶区、上泪小管恶黑残留;右眼下泪小管、泪囊及鼻泪管均未见肿瘤残留(图6)。建议眼眶内容物剜除,患者拒绝。复行PET- CT检查:右眼内眦部摄取信号明显增高,球后信号增高,肺部结节信号异常增高。后患者去世失访。

图6 2018年3月23日第3次泪道病灶病理检查结果 HE×200 见小圆细胞;EnVision法免疫组化:S- 100(+),MelanA(散在+),HMB45(+),Ki- 67(散在细胞+)
2 讨 论
普遍认为黑色素瘤细胞系来源于神经外胚层的黑色素细胞迁徙而来[6],但Jakobiec等[7]利用免疫组化生物标志物MARF- 1、MiTF发现泪囊上皮内存在正常的树突状黑色素细胞,暂未有学者研究泪小管、泪总管上皮内、底层间质是否亦存在黑色素细胞。黑色素瘤的发生机制暂未明确,已有研究证明我国部分黏膜恶黑患者存在BRAF基因突变(23.3%)[8]、CKIT基因突变(10.2%)[9],这提供了新的治疗靶点。
泪道引流系统恶黑十分罕见,隐匿性强,转移率高,预后极差。日本报告的15例泪囊恶黑中,局部复发率26.7%,转移率53.3%,术后2年死亡率35.7%[10]。已报告的4例鼻泪管恶黑转移率75.0%,术后9个月死亡率50%[3- 5]。检索关于泪小管泪总管交界处恶黑的国内外文献尚未见报道。极低的发病率、隐匿的发病部位易致误诊、漏诊,错过早期治疗。泪小管泪总管交界处恶黑与泪囊处、鼻泪管处恶黑同系泪道引流系统发生,其血性分泌物、易转移、预后差的特点相似,但体征、影像学检查等辅助检查有较大区别。
泪道引流系统恶黑大都有出血表现,44%有泪囊恶黑出血[11],100%有鼻泪管恶黑间歇性血泪、75%有鼻出血[3- 5];本例泪小管和泪总管交界处恶黑者表现为血性分泌物。这提示肿瘤血运丰富、质脆。
本例肿瘤位置表浅,泪点口即可见肉芽样新生物自泪道内突出,冲洗探针即可触及生长于泪道较浅处的肿瘤,一定程度上有助于早发现,而泪道其它部位如泪囊、鼻泪管等的病变,位置深,病变隐匿性强,不易被发现而致延误诊治;泪道内窥镜下直视下观察病灶大小、质地、颜色、定位,微创下取病灶活检,有助于早期明确诊断。患者虽然早期行部分切除术,但未够彻底,也未能予放化疗等辅助治疗,最终因远处转移死亡。
鼻内窥镜也有助于发现泪道其他部位肿瘤,但有时医生忽视内窥镜检查,导致误诊或延迟诊断。Lewis等[5]经泪道内窥镜发现可疑鼻泪管恶黑时,CT示肿瘤已侵犯窦口鼻道复合体、延伸至筛窦前,而此前患者曾因溢泪2年余而接受过3次局灶切除治疗,缺乏内窥镜、病理诊断描述,最后患者死于骨转移。
影像学检查有极高的辅助诊断价值,提示病灶位置、范围、侵袭周围组织情况。遗憾的是本例患者CT与MR检查均未发现病灶,可能是本例患者MR平扫、加强分层厚度为3 mm,3D DUCT厚度为0.8 mm,CT厚度1 mm,仍不够精细,出现漏诊。如此影像分层扫描对泪小管、泪总管仍显粗略,提示临床医生应提前与影像技术人员沟通,尽可能精细扫描,以减少漏诊。实际上,不仅是泪道肿瘤,泪道的其它疾患如泪小管炎、泪囊炎、泪道阻塞等,临床上即使行泪道造影,也常因为切层不够精细而导致病灶发现的遗漏。CT表现虽然无特异性改变,但骨窗能敏感发现骨质破坏,有助于术前明确分期[12],而恶黑上皮细胞型比非上皮细胞型更易破坏骨质、造成转移[13]。据报道:泪囊、鼻泪管恶黑早期肿块界限分明、密度均匀[14];晚期多不规则,界限不清,可侵犯眼眶、鼻窦[15]。MR是有潜力的特征性影像学检查,由于黑色素有顺磁性,T1加权可表现高信号,T2加权低信号,但黏膜黑色素瘤黑色素本就含量少、不均匀,加之易出血干扰更可致信号不典型[16]。增强MR扫描信号增强,表明病灶有丰富的血运。
病理诊断是肿瘤诊断的金标准。虽然细胞形态上变化丰富、大部分黏膜恶黑的黑色素含量较低甚至无,易误诊、漏诊,但辅助免疫组化、分子检测大大提高了恶黑的检出率[13]。本例患者第1次的外院病理检查仅描述了细胞形态而忽略了免疫组化,导致漏诊,后典型恶黑免疫组化标志物HMB45、S- 100、MelanA、Ki67均阳性,诊断明确。
病理确诊恶黑后无论影像学表现如何,早期行PET- CT检查十分必要,可发现其他影像学检查不能发现的转移灶。本例复发时影像学检查未发现异常,PET- CT检查时已出现右眼球后、肺部结节转移,Subramaniam等[2]亦报告PET- CT检查发现解剖正常但信号活跃的Ⅱ级颈淋巴结。泪道恶黑转移率高,死亡与远处转移密切相关。日本报告15例泪囊恶黑者转移率为53.3%,死于转移者占57.1%,鼻泪管恶黑转移率为75.0%,死于转移者占66.7%[10]。早期行PET- CT检查排除转移,有助于准确评估肿瘤分期、避免多余治疗。
目前公认的头颈部黏膜恶黑分期参照第8版美国癌症联合会(American Joint Committee on cancer, AJCC)癌症分期系统[12],我国的肿瘤分期尚在建立中。2020年颁布的适合我国国情的中国临床肿瘤学会(Chinese Society of Clinical Oncology, CSCO)黑色素瘤诊疗指南提出,可切除的鼻腔、鼻旁窦及鼻咽部黏膜黑色素瘤总的治疗原则为尽量整块切除,禁忌局部挤压和力求切缘阴性,切除范围可包括肿瘤边界外1.5~2 cm外观正常黏膜(包括卫星灶)[17];术后化疗使用替莫唑胺加顺铂可延长无复发生存时间[18];术后放疗可改善局部控制率,但未证实可延长生存期[19]。重离子放射治疗因特有的深度剂量分布,能使大部分吸收剂量沉积于肿瘤部位,有广阔的恶黑治疗应用前景[19- 20]。若测序携带BRAFV600、CKIT突变,可试行相应抑制剂治疗。对不可切除的肿瘤,PD- 1单抗加阿昔替尼方案可获较好疗效[17]。
泪道恶黑发病率极低,因病例报告有限,暂无总结性研究,但预后极差,易发生局部复发、转移,5年生存率低。因此对有可疑临床表现,如出现血性分泌物、泪点处泪道新生物伸出、血泪、内眦部无痛性肿块等,应提高警惕,进行全面的辅助检查、严格的排查,行泪道冲洗、内窥镜检查、影像学检查,术中不能忽略送病理检查,病理活检辅助免疫组化;如病理检查确诊恶黑,需早期行全身PET- CT检查,以早期发现早期治疗,挽救患者生命。
确诊后可依据指南试行合理的手术整块切除,后转至肿瘤科行放化疗,若测序携带BRAFV600、CKIT突变,可试行相应抑制剂治疗。注意定期检测局部复发,定期行泪道内窥镜、鼻内窥镜检查,定期行全身PET- CT检查排除全身转移。

