厨余垃圾厌氧发酵失稳调控及微生物群落分析
王 攀,杨鑫玉,郑 义,任连海
厨余垃圾厌氧发酵失稳调控及微生物群落分析
王 攀,杨鑫玉,郑 义,任连海*
(北京工商大学生态环境学院,国家环境保护食品链污染防治重点实验室,北京 100048)
针对厨余垃圾厌氧发酵过程中容易积累丙酸和丁酸导致反应体系酸化失稳的问题,驯化了富集耐丙酸和耐丁酸厌氧发酵菌群的接种菌泥,探究利用其对厨余垃圾干式厌氧发酵酸化失稳体系进行调控后对甲烷产量和微生物群落的影响.酸化失稳厌氧体系中添加耐丙酸菌泥调控后,与空白对照组相比反应体系中丙酸浓度削减6900.81mg/L,累积甲烷产量提升了259%;添加耐丁酸菌泥调控后,反应体系中丁酸浓度削减5371.56mg/L,累积甲烷产量提高了210%.微生物多样性分析表明,利用耐丙酸和耐丁酸菌群调控后,细菌种群丰富度明显提高.细菌属水平分析表明,投加耐丙酸驯化菌群后有利于和等挥发性脂肪酸降解菌相对丰度增加;投加耐丁酸驯化菌群后,与乙酸型产甲烷菌有协同作用的相对丰度有所增长.古菌属水平分析表明耐丙酸和丁酸菌调控后,氢型产甲烷菌和乙酸型产甲烷菌的相对丰度明显提高.
厨余垃圾;干式厌氧发酵;酸化失稳调控;微生物群落
厨余垃圾是城市生活垃圾的重要组成部分[1],随着全国垃圾分类工作的不断推进,越来越多的厨余垃圾被分离出来需要妥善处理.厨余垃圾富含有机质,易被微生物降解,厌氧发酵技术逐渐成为处理处置厨余垃圾的主流技术[1].厌氧发酵包括湿式和干式发酵[2].干式厌氧发酵技术对原料预处理要求低、沼液产量低、耗能少、产气率较高[3],但由于其高有机负荷运行,容易发生底物浓度过高,水解酸化速率过快,挥发性脂肪酸(VFAs)迅速积累,系统pH值降低,从而抑制产甲烷菌活性,导致厌氧发酵体系酸化失稳等问题[4].
在酸化失稳的厌氧发酵体系中,快速积累的VFAs主要有乙酸、丙酸、丁酸等,由于酸积累抑制微生物生长,从而影响系统稳定性.丙酸、丁酸降解过程中所需的吉布斯自由能较高,不能自发进行[5-6].在目前的许多研究中,丙酸和丁酸被认为是引发酸抑制产生的重要原因[7-8].研究发现丙酸在非常低的浓度下会抑制厌氧发酵过程中甲烷生成,并且丙酸降解过程较为缓慢[8-9].此外,研究发现在厌氧发酵系统出现酸抑制现象时,VFAs主要由丁酸组成,占总VFAs的30%~40%[10].对于厌氧发酵酸化失稳体系的调控手段主要有预处理[11]、酸碱化学调控[12]和生物调控的方法.有研究表明向有机负荷过载的酸抑制发酵体系连续投加丙酸降解菌群能快速降解积累的丙酸并提高产甲烷效率[13].Li等[14]利用耐酸的产甲烷菌对厌氧发酵体系进行生物调控可恢复了过载的厌氧发酵体系,并且加速了累积的VFAs尤其是乙酸和丁酸的降解,该方法增加了和的数量从而重建了厌氧发酵系统的产甲烷菌群.由于厌氧发酵菌群体系的复杂性,耐丙酸微生物菌群和耐丁酸微生物菌群调控改善厌氧酸化失稳体系的微生物学机理需进一步深入探讨.
本研究针对厨余垃圾干式厌氧发酵体系中易积累造成体系酸化失稳问题的丙酸和丁酸,驯化耐丙酸和耐丁酸厌氧发酵菌群,研究其对厨余垃圾厌氧发酵酸化失稳的调控能力,利用高通量测序技术分析调控过程中微生物群落结构的变化,探讨微生物机理,以期为厨余垃圾干式厌氧发酵酸化失稳的调控提供理论基础.
1 材料与方法
1.1 材料
厨余垃圾采集于北京市海淀区某居民小区(厨余垃圾1#)和北京工商大学食堂(厨余垃圾2#),分别确定为1#和2#采样点.为保证厨余垃圾成分的均一性和稳定性,厨余垃圾连续多日取样并在取样前混合均匀;调控所使用的驯化菌泥取自山东省某工厂污水处理厌氧工艺段厌氧颗粒污泥.实验底物的基本理化性质见表1.

表1 实验底物理化参数
1.2 实验装置及运行过程
首先采用序批式厌氧发酵反应装置进行耐丙酸和耐丁酸的产甲烷菌泥驯化实验.分别将700mL厌氧颗粒污泥添加在2个1L的厌氧发酵瓶中.每隔24h加入含丙酸钠或丁酸钠的碳源营养液.
厌氧发酵酸化失稳调控实验采用序批式厌氧发酵反应装置.发酵底物物料配比为厨余垃圾1# : 厨余垃圾2# = 1:3(按TS计).发酵前在120℃ 下加热80min、6000r/min将厨余垃圾脱油,将脱油处理后的厨余垃圾混合物与厌氧污泥颗粒以1:1(按VS计)配比混合,实验设计分组如表2,每组设置2平行实验.
厌氧发酵实验在中温条件(35℃)下进行,每隔24h采集少量发酵底物检测相关性能指标,利用排水法测定沼气的产气量.每日定时采集沼气进行检测,当观察到甲烷含量持续下降时(即酸化失稳),按体积比20%将驯化体系中最佳产气时刻的菌泥加入到酸化失稳的厨余垃圾干式厌氧发酵体系中.连续观察耐丙酸产甲烷菌群调控(PAMR)和耐丁酸产甲烷菌群调控(BAMR)的调控效果和发酵性能.
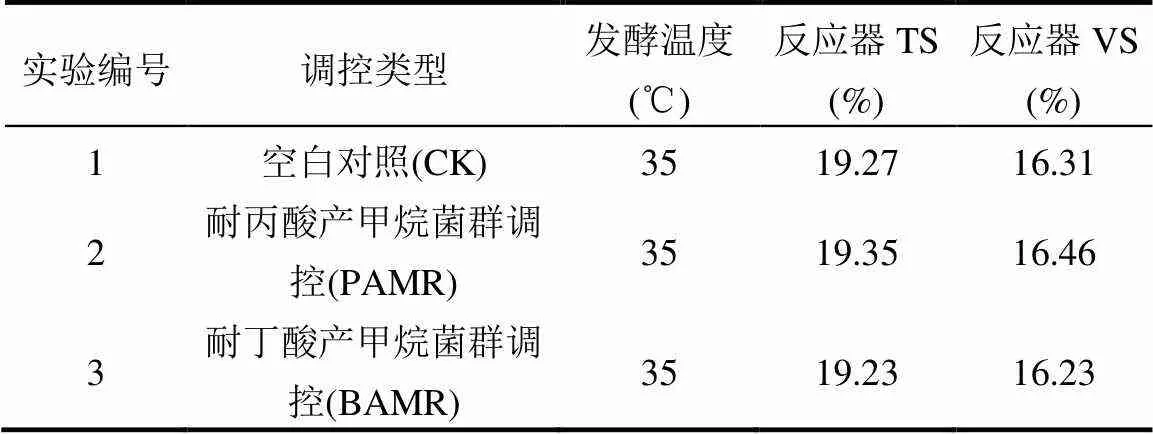
表2 实验设计分组
1.3 分析方法
含水率采用烘干法计算;灰分采用灼烧法测定; pH值采用pH电极法测定,以上方法均参考《水和废水监测分析方法》[15].化学需氧量(COD)采用消解分光光度法[16];氨氮采用纳氏分光光度法[17];粗脂肪采用索氏提取法[18];粗蛋白采用凯氏定氮法[19];粗纤维采用范式洗涤法[20];碳氮比(C/N)采用元素分析仪(Vario EL/micro cube)测定.
沼气组分和挥发性脂肪酸(VFAs)采用气相色谱法进行分析.沼气采用气相色谱法(填充柱,柱温80℃,进样口温度150℃,检测器温度150℃,载气为高纯氩气);挥发性脂肪酸(VFAs)采用气相色谱法(FFAP毛细管柱,柱温160℃,检测器温度250℃,载气为高纯氮气).
1.4 DNA提取及测序
采用FastDNA®土壤DNA提取试剂盒(MP Biomedicals, America)提取DNA.提取后DNA在-20℃下保存,然后进行聚合酶链反应(PCR)扩增,本研究使用Ion Plus Fragment library Kit 48rxns(16S V4)和TruSeq®DNA PCR-Free Sample Preparation Kit(Archaea)构建文库,并通过Qubit和Q-PCR进行定量.利用Thermofisher Ion S5TMXL and HiSeq2500PE250对定量文库进行测序.
1.5 数据分析方法
采用Origin和Excel软件对数据进行分析处理.
2 结果与分析
2.1 耐酸产甲烷菌群驯化过程中厌氧发酵特征
向厌氧发酵颗粒污泥中连续投加丙酸钠驯化耐丙酸产甲烷菌群.如图1(a)所示,在发酵的第1~4d丙酸钠投加浓度为500mg/L,发酵第5~8d为1000mg/L,发酵第9~29d每隔2d提高500mg/L.在驯化过程中,耐丙酸产甲烷菌泥在发酵的第18d日甲烷产量达到最高(893.78mL),此时其pH值为7.76.取用这一时刻的耐丙酸驯化菌泥作为厌氧发酵酸化失稳体系接种菌泥.在驯化的第24d日甲烷产量有所上升,为736.44mL,随后日甲烷产量迅速下降.在此驯化体系中,耐丙酸产甲烷菌群的最高丙酸耐受浓度为35320mg/L,远高于之前研究中4000mg/L的抑制浓度[21].由此,选用第18d、第24d和第30d(结束时)的菌泥(MP18、MP24、MP30)进行高通量测序检测微生物群落分析.
驯化耐丁酸产甲烷菌群采用丁酸钠为碳源,如图1(b)所示,驯化过程的第2~5d投加丁酸钠500mg/ L,第6d开始每隔两日提高500mg/L的丁酸钠.在发酵的第24d达到最高日甲烷产量(1535.02mL),此时耐丁酸产甲烷菌泥的pH值为7.70.选用第24d的耐丙酸驯化菌泥,作为厌氧发酵酸化失稳体系接种菌泥.在驯化第30d日甲烷产量出现产气小高峰,为1320.83mL,丁酸浓度为14455.35mg/L.在此驯化体系中,耐丁酸产甲烷菌群的最高丙酸耐受浓度为17110.39mg/L.由此,选第24d、第30d和第36d(结束时)的菌泥(MB24、MB30、MB36)进行高通量测序检测微生物群落,探究丁酸产甲烷菌群的驯化演替规律.
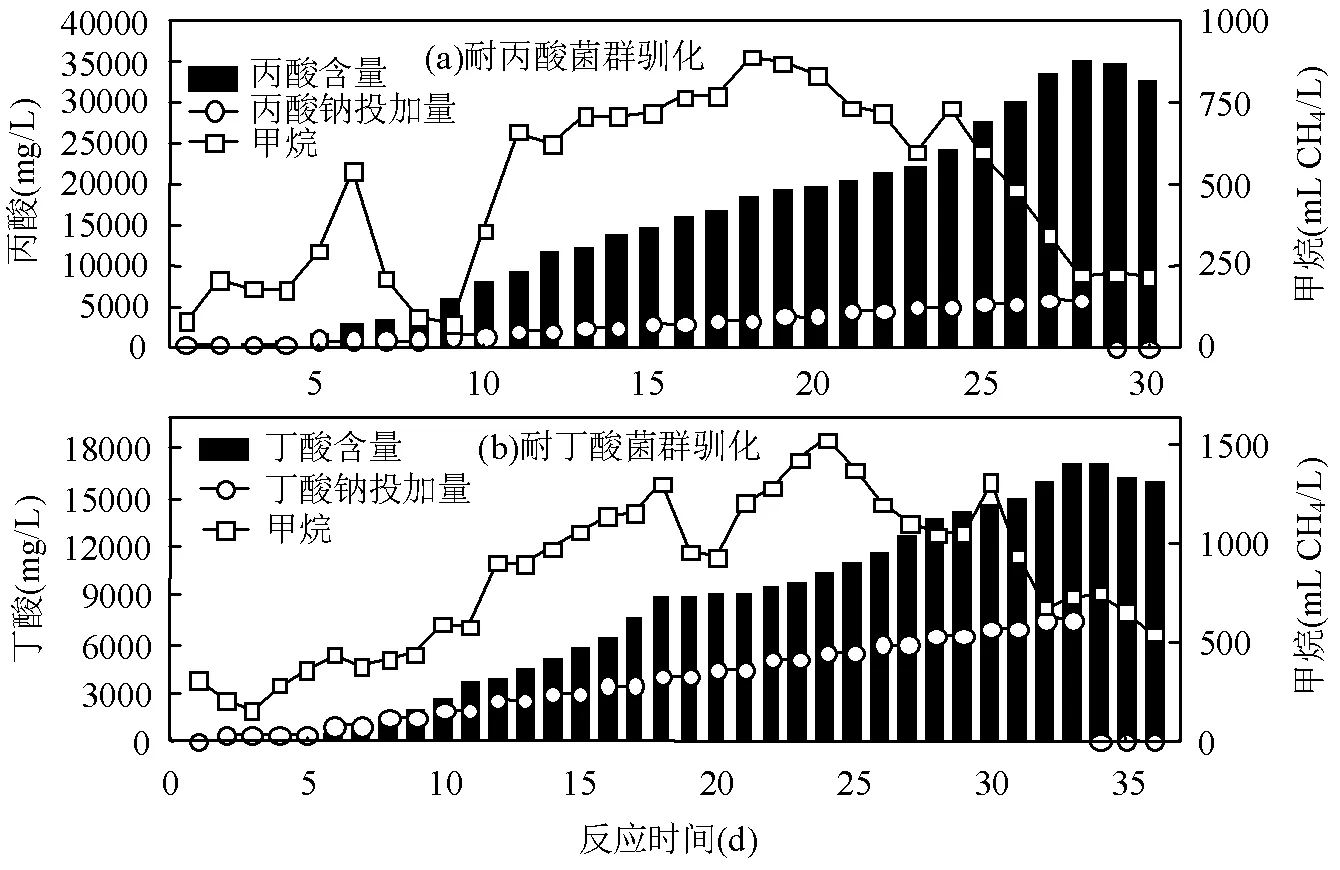
图1 耐酸产甲烷菌群驯化过程中酸投加量、酸浓度及日甲烷产量变化
2.2 酸化失稳体系调控过程中厌氧发酵特征
如图2(a)所示,厨余垃圾干式厌氧发酵过程中日甲烷产量呈降低趋势,在发酵第10d几乎不产气,丙酸浓度达到7112.14mg/L.此时体系 pH值为5.56,因此认为发酵第10d时出现酸化失稳.将耐丙酸产甲烷菌泥加入到此失稳体系中,投加后体系的pH值为5.68,投加驯化耐丙酸菌泥对酸化失稳体系pH值影响较小.随着调控反应的进行,耐丙酸菌群对于酸化失稳体系具有良好的调控效果, 丙酸浓度在第10~15d下降明显,发酵结束时,与空白对照组相比调控组丙酸浓度削减了6900.81mg/L.同时,日甲烷产量明显升高,在发酵第11d,调控组日甲烷产量(17.0± 0.8mL/g VS),比空白对照组(2.8±1.1mL/g VS)高了507%,经过计算得出,在整个调控阶段(第10~15日)调控组累积甲烷产量为46.0mL/g VS,比空白对照组(12.8mL/g VS)提高259%.

图2 厌氧发酵酸化失稳体系调控过程中酸含量及日甲烷产量的变化
如图2(b)所示,厨余垃圾厌氧发酵第10d时酸化失稳,此时丁酸浓度为5009.07mg/L, pH值为5.48.将耐丁酸产甲烷菌泥加入到此失稳体系中,投加后体系的pH值为5.57.随着调控的进行,酸化失稳发酵体系中丁酸浓度明显下降,发酵结束时,与空白对照组相比丁酸浓度削减了5371.56mg/L.在发酵第11d,调控组日甲烷产量(17.1±2.1mL/g VS)与空白对照实验组(2.7±2.1mL/g VS)相比提高了533%(195.76± 9.36mL/g VS),经过计算得出,在整个调控阶段(第10~15d)累积甲烷产量(40.0mL/g VS)比空白对照组(12.9mL/g VS)提高了210%.
2.3 微生物群落特征
2.3.1 微生物群落多样性和丰富度 Alpha Diversity常被用于分析微生物群落多样性和丰富度,利用Observed_Species、Shannon、Simpson、Chao1和ACE等指数,在97%一致性阈值下对不同样本的微生物群落丰富度进行比较分析,观察驯化体系内的种群丰富度变化.表3中为耐丙酸菌群驯化阶段(MP)、耐丙酸菌群调控阶段(mP)、耐丁酸菌群驯化阶段(MB)和耐丁酸菌群调控阶段(mB)的Alpha Diversity指数.
Observed_Species指数数值越高,样品内微生物种群丰富度越高.由表3可以看出,在驯化阶段,随着丙酸和丁酸浓度的升高,无论是细菌还是古菌,其Observed_Species指数都呈现出逐渐降低的趋势,说明体系内微生物种群丰富度明显下降,这证实了在趋于酸化的干式厌氧发酵体系中,挥发性脂肪酸累积使厌氧发酵菌群的丰富度遭到破坏.
由表3可以看出,在耐丙酸酸化失稳调控阶段,细菌种群丰富度明显提高,体系中的Observed_ Species指数由第10d的1171(mP10)提高到第15d的1224(mP15),而在耐丁酸酸化失稳调控阶段,体系中Observed_Species指数先降低后上升,在第15d恢复到了824(mB15),说明细菌种群丰富度虽然有波动,但整体呈现为波动上升.
表3所示,在耐丙酸和耐丁酸产甲烷菌群调控阶段,古菌的Observed_Species指数均呈现出先降低后上升的趋势,说明添加调控菌泥后,系统中古菌的种群丰富度发生了变化,但随着酸抑制的逐渐缓解,体系中古菌丰富度也逐渐增加,并且根据之前的分析由图2可以看出,甲烷产率也随之逐渐增长,间接说明古菌丰富度的高低与甲烷产量之间具有一定的相关性.
Shannon指数越高,说明微生物群落丰富度越高,多样性越高,物种分布越均匀.由表3可以看出,在驯化阶段,耐丙酸产甲烷菌在第18d时Shannon指数最高,为6.785(MP18),耐丁酸产甲烷菌在第24d时Shannon指数最高,为6.404(MB24),说明此时系统内细菌种群分布较均匀,根据Observed_Species指数分析,其细菌种群丰富度也较高,说明此时的两种驯化菌泥都可分别添加到酸化失稳体系中进行调控;在调控阶段,酸化失稳体系在第15d时Shannon指数最高,为7.815(mP15),说明经过调控后,酸化失稳体系中细菌种群的丰富度和多样性都得到了恢复,且细菌种群的分布较为均匀.耐丁酸产甲烷菌群调控的酸化体系在第10d时的Shannon指数最高,为6.455(mB10),说明加入调控菌泥后,瞬时提高了体系中细菌丰富度和多样性.
由表3还可以看出,在调控阶段,体系内古菌的Shannon指数在第10d最高,为3.084(mP10),说明在调控当天,添加耐丙酸产甲烷菌泥迅速提高了酸化失稳体系中古菌种群的丰富度和多样性.表格中各个指数的变化以及图2中沼气对比变化说明耐丙酸、耐丁酸产甲烷菌群调控都有助于恢复酸化条件下菌群的多样性和丰富度,从而促进恢复厌氧干式发酵体系进而提高甲烷产量.
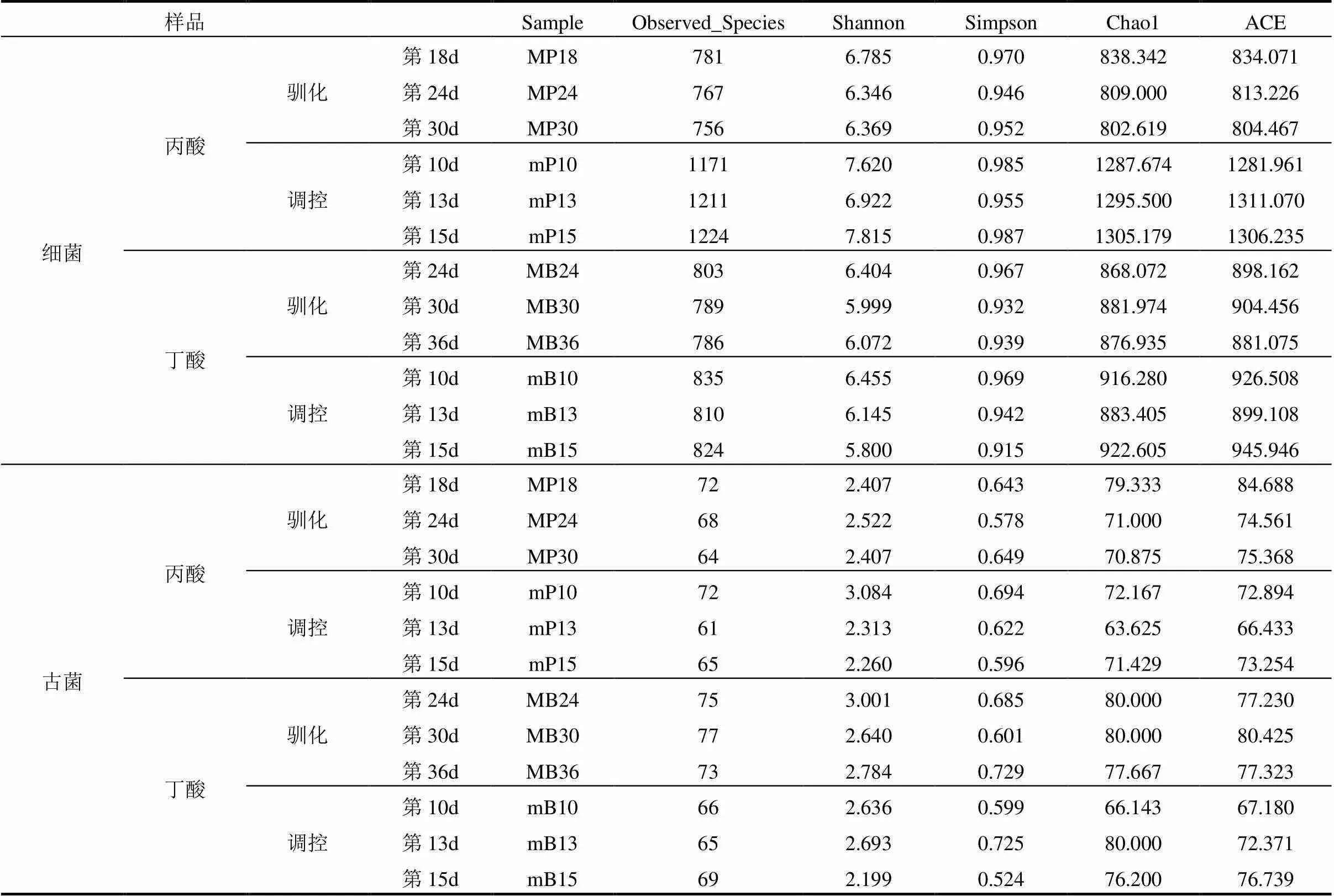
表3 Alpha Diversity指数
2.3.2 微生物细菌门水平分析 由图3(a)可以看出,在耐丙酸菌和耐丁酸菌的驯化过程中,、和等水解酸化菌门占据优势地位.之前有研究表明[22],和菌门是厌氧系统中最常见的细菌.菌门包括多种梭状芽胞杆菌,是促进复杂有机物降解的关键细菌,可以水解纤维素等大分子有机底物并产生VFAs,例如乙酸,是乙酸异养型微生物产甲烷过程中的主要前体物.菌门在生长过程中可以产生各种裂解酶,包括可以降解复杂有机物的水解酶和脂肪酶,从而降解多糖等大分子有机物[23].可以降解有机化合物,并且该菌门中有一些细菌,如和可以通过中间电子转移促进产甲烷菌的生长[24].
在耐丙酸菌的驯化过程中,、和菌门的相对丰度逐渐增长,这些细菌通常与厌氧发酵初级阶段即水解酸化阶段相关.有研究表明菌门可以利用乙酸进行异养生长[25],可以降解各种碳水化合物和氨基酸[24].然而随着丙酸负荷的增加,菌门的相对丰度逐渐降低由70.17% (MP18)降低至19.13%(MP30).Li0等人也研究发现经丙酸钠驯化后的污泥比未经驯化的污泥中菌门的丰度低,说明丙酸负荷的增加扰动了系统的稳定性,导致主要的水解酸化菌的相对丰度开始下降,并且从图1(a)可以看出,在驯化第18d后相应体系内日甲烷产量也有所降低.因此,选取耐丙酸产甲烷菌群驯化体系第18d的驯化菌泥投加到厨余垃圾干式厌氧发酵酸化失稳第10d的体系中进行调控,在调控过程中,菌门的相对丰度先上升后下降,由45.85%(mP10)上升至63.23% (mP13)随后又降低至59.50%(mP15),菌门的相对丰度开始逐渐增加,由4.30%(mP10)增长至8.73%(mP15),同时菌门的相对丰度逐渐降低由28.86%(mP10)降低至14.22% (mP15).由图2(a)可以看出,调控后体系内丙酸浓度得到了削减,体系的酸化失稳状态逐渐解除,菌群的变化同时表明,加入耐丙酸产甲烷菌泥后,缓解了体系中的酸积累,酸化失稳体系水解酸化微生物开始逐渐恢复.
由图3(b)可以看出,在耐丁酸产甲烷菌的驯化过程中,其中和菌门的相对丰度有所增长,随着丁酸钠投加量的增加,菌门的相对丰度由33.63% (MB23)增长至44.07%(MB35),菌门的相对丰度由3.95%(MB23)增长至14.75%(MB35),和菌门可以降解纤维素和半纤维素,也可以降解蛋白质[26].与耐丙酸产甲烷菌驯化过程相比,菌门的增长可能是因为其对丁酸耐受性较强[26].同时,和菌门的相对丰度逐渐降低,菌门的相对丰度由32.54%(MB23)降低至17.69% (MB35),菌门的相对丰度由14.32% (MB23)降低至5.06% (MB35).和菌门都是厌氧过程中主要的水解酸化菌,其相对丰度的降低说明由于丁酸负荷的增加,系统稳定性开始降低,相应地在图1(b)中可以看出,日甲烷产量从驯化第23d后开始下降.因此,将耐丁酸产甲烷菌群驯化体系第23d的菌泥投加到厨余垃圾干式厌氧发酵的酸化失稳体系中进行调控.在细菌门水平分析,菌门的相对丰度在调控过程中逐渐增长由40.41% (mB10)增长至60.38%(mB15),有研究发现,菌门在丁酸的降解中起着重要的作用[27],因此,在耐丁酸产甲烷菌调控过程中逐渐成为优势菌门,并且由图2(b)可以看出,调控体系中丁酸浓度有所削减,说明加入调控菌群后,失稳体系中降解丁酸微生物逐渐增加,逐渐缓解了系统中丁酸积累.

图3 细菌门水平相对丰度
2.3.3 微生物属水平分析 由图4(a)可以看出,在耐丙酸菌群的驯化过程中,随着丙酸负荷的增加菌属的相对丰度逐渐降低,由57.48% (MP18)降低至2.68%(MP30),说明菌属对丙酸的耐受度较低,菌属是乳酸菌的一种,通常在厌氧消化过程中与嗜氢营养型古菌共生,将有机酸分解为乙酸和氢气[28],同时由图1(a)可以看出,在驯化第18d后,体系日甲烷产量逐渐降低,与菌属的降低趋势相同.
酸化失稳体系投加耐丙酸驯化菌泥调控过程中菌属的相对丰度有所增加,由1.36%(mP10)增加至40.11%(mP15).同时,水解酸化菌属在调控过程中得到恢复和富集,投加丙酸驯化菌泥中该菌属的相对丰度为3.05%(MP18),发酵酸化体系中的菌群相对丰度由2.77%(mP10)提高至5.89%(mP15).有研究表明和能够加速 VFAs 向乙酸盐的转化,有助于加速厌氧消化产气进程[29].此外还观察到,菌属的相对丰度在调控过程中逐渐升高,由0.28%(mP10)提高至2.41% (mP15),菌属在调控过程中得到恢复和富集,菌属能够降解丙酸和丁酸转化为乙酸和氢气[30],同时在图2(a)中可以观察到,添加耐丙酸产甲烷菌泥后,体系中丙酸浓度开始下降,说明通过添加耐丙酸产甲烷菌群可以增加体系内降解丙酸的微生物,逐渐缓解了酸化失稳体系中丙酸积累的胁迫效应.
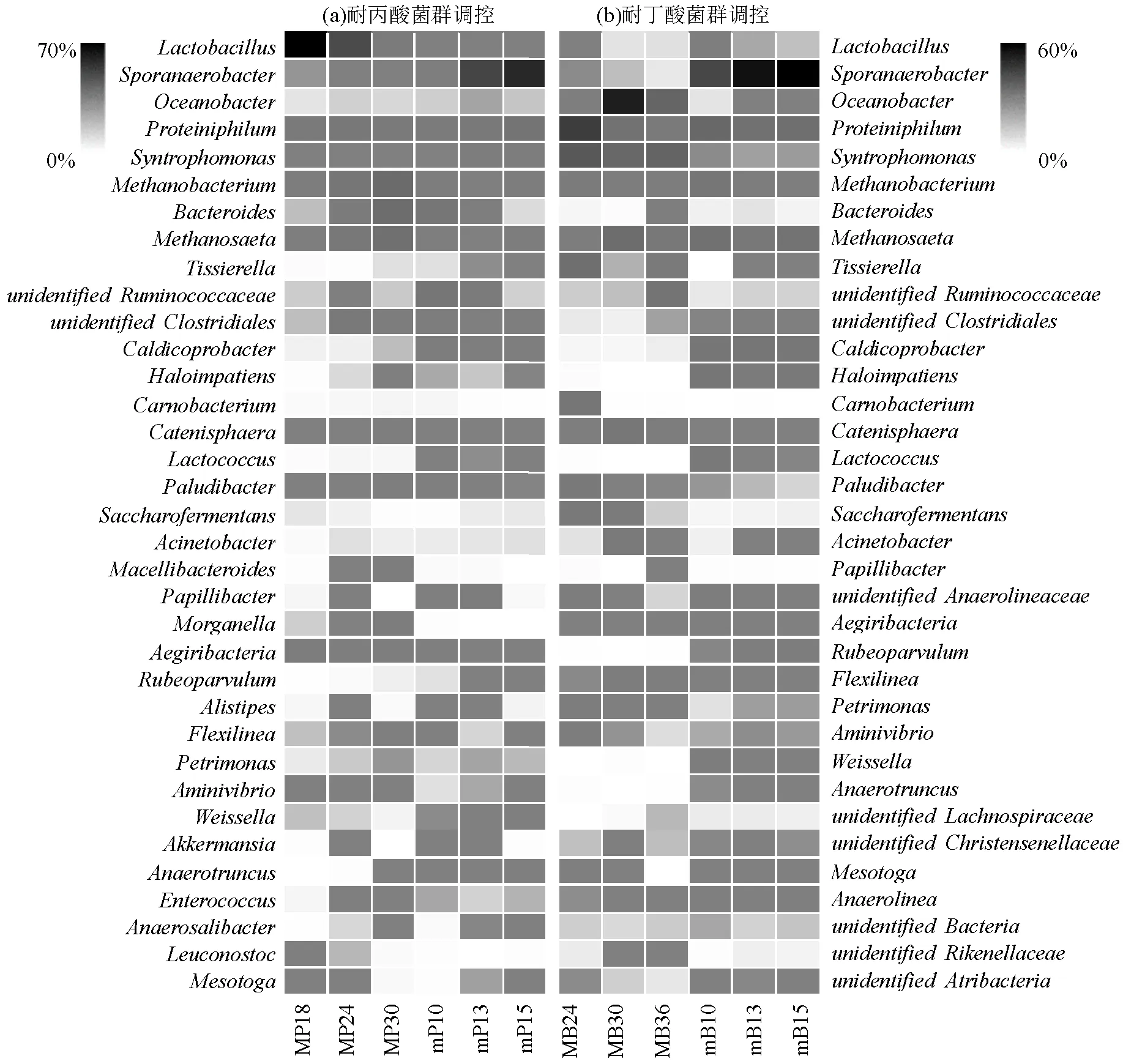
图4 细菌属水平相对丰度
由图4(b)可以看出,在耐丁酸抑制产甲烷菌群驯化体系中,菌群的相对丰度先增长后下降,在驯化第30d,其相对丰度到达最高27.60% (MB30),由图1 (b)可以看出,在驯化第30d,出现产气小高峰,菌群的变化同产气情况相似,和菌属的相对丰度随着丁酸负荷的增加而减少,菌属的相对丰度由0.69%(MB23)降至0.12%(MB35),菌属的相对丰度由0.45%(MB23)降至0.09%(MB35)说明丁酸胁迫会影响和菌属的相对丰度.同时,也观察到菌属的相对丰度随着丁酸负荷的增加而增加,由0.04%(MB23)增加至1.07%(MB35).菌属是一类蛋白质水解菌,也是一类产酸菌,通常它的出现及富集表明系统开始出现酸积累[31].
选取第24d的耐丁酸驯化菌泥投加到酸化失稳体系第10d中进行调控,由图4(b)可以看出,的相对丰度逐渐增加,由16.25% (mB10)增长至36.83%(mB15),说明通过耐丁酸产甲烷菌群调控,酸化失稳体系内得到富集和恢复.同时也观察到在调控过程中的相对丰度维持稳定,中存在互养代谢碳原子数在4~18的脂肪酸的嗜中温菌属,并且可以与产甲烷菌协同作用降解丁酸[32].
由图5(a)可以看出,在耐丙酸菌群的驯化过程中,和菌属占据优势地位.菌属为氢型产甲烷古菌[28].是一种严格的嗜乙酸产甲烷菌[33].驯化阶段日甲烷产量最大时,体系中占据着优势地位,达到了70.05%(MP18),说明在驯化体系内主要为氢型产甲烷菌.在酸化失稳体系中投加耐丙酸驯化菌泥后,体系中氢型产甲烷古菌的相对丰度明显得到提高,由15.76%(mP10)增长至76.02% (mP15),同时菌属的相对丰度在调控过程中逐渐降低,由76.25%(mP10)降低至22.90% (mP15),说明在耐丙酸产甲烷菌群的调控过程中,氢型产甲烷菌逐渐演替为优势菌.

图5 古菌属水平相对丰度
由图5(b)可以看出,古菌属水平上,在耐丁酸菌群驯化过程中和仍然占据优势地位,其相对丰度之和占古菌总数的90%以上.在日甲烷产量最高以及产气小高峰时,菌群的相对丰度达到75.80%(MB24)和89.03%(MB30),此时系统主要以乙酸型产甲烷为主,甲烷的增长可能与菌群的相对丰度相关.将耐丁酸驯化菌泥投加到酸化失稳的体系中,菌属的相对丰度提高到了86.95% (mB10),通过调控瞬时补充了酸化失稳体系中的乙酸型产甲烷菌,并且根据图2(b)可以看出系统内日甲烷产量也在第10d调控后迅速上升,说明菌属可以提高体系中的产甲烷量.有研究表明菌属在高浓度的VFAs环境成为优势菌属,此时体系正处于酸积累状态,VFAs浓度较高[34].在调控结束时,菌属相对丰度为95.71%(mB15).由图4(b)中可以看出,在调控阶段菌属的相对丰度逐渐增加,由16.25%(mB10)增长到了36.83%(mB15),Kurade等[35]发现菌属在产乙酸中具有重要的作用,此时体系中乙酸型产甲烷菌占据主导作用,说明此时可能存在菌属与菌属的协作共生关系,共同促进了甲烷生成0.
3 结论
3.1 经耐丙酸产甲烷菌群调控后,厨余垃圾厌氧发酵失稳体系得到恢复,丙酸削减浓度达到了6900.81mg/L,与空白对照组相比累积甲烷产量提高了259%;
3.2 经耐丁酸产甲烷菌群调控后,厨余垃圾厌氧发酵失稳体系得到恢复,丁酸削减浓度达到了5371.56mg/L,与空白组相比累积甲烷产量提高了210%;
3.3 耐丙酸、耐丁酸产甲烷菌群调控可改变酸化体系微生物群落结构,从而使酸化失稳体系得到恢复.经调控后酸化失稳体系细菌和古菌的多样性和丰富度明显提高.在属水平上耐丙酸产甲烷菌群的投加使有利于加速VFAs降解的和相对丰度增长,氢型产甲烷菌为优势菌群;耐丁酸产甲烷菌群的投加使有利于降解丁酸的和相对丰度增长,乙酸型产甲烷菌为优势菌群.
[1] 邴君妍,罗恩华,金宜英,等.中国餐厨垃圾资源化利用系统建设现状研究[J]. 环境科学与管理, 2018,43(4):39-43.
Bing J Y, Luo E H, Jin Y Y, et al.Current Situation of Food Waste Recycling in China. Environmental Science and Management, 2018,43(4):39-43.
[2] Lee E, Oliveira D S B L, Oliveira L S B L, et al. Comparative environmental and economic life cycle assessment of high solids anaerobic co-digestion for biosolids and organic waste management [J]. Water Research, 2020,171:115443.
[3] 任连海,黄燕冰,王 攀,等.热处理时间对餐厨垃圾高温干式厌氧发酵的影响[J]. 环境工程学报, 2015,9(2):901-906.
Ren L H, Huang Y B, Wang P, et al. Effect of heating time on high-temperature dry anaerobic fermentation of restaurant garbage. Chinese Journal of Environmental Engineering, 2015,9(2):901-906.
[4] Rocamora I, Wagland ST, Villa R, et al. Dry anaerobic digestion of organic waste: A review of operational parameters and their impact on process performance [J]. Bioresource Technology, 2020,299:122681.
[5] Sivagurunathan P, Sen B, Lin C Y. Overcoming propionic acid inhibition of hydrogen fermentation by temperature shift strategy [J]. International Journal of Hydrogen Energy, 2014,39(33):19232-19241.
[6] Chi X, Li J Z, Wang X, et al. Bioaugmentation with Clostridium tyrobutyricum to improve butyric acid production through direct rice straw bioconversion [J]. Bioresource Technology, 2018,263:562-568.
[7] Zhang W, Zhang F, Li Y X, et al. Inhibitory effects of free propionic and butyric acids on the activities of hydrogenotrophic methanogens in mesophilic mixed culture fermentation [J]. Bioresource Technology, 2019,272:458-464.
[8] Han Y, Green H, Tao W D, et al. Reversibility of propionic acid inhibition to anaerobic digestion: Inhibition kinetics and microbial mechanism [J]. Chemosphere, 2020,255:126840.
[9] Zhao J, Westerholm M, Qiao W, et al. Impact of temperature and substrate concentration on degradation rates of acetate, propionate and hydrogen and their links to microbial community structure [J]. Bioresource Technology, 2018,256:44-52.
[10] Kong X, Wei Y H, Xu S, et al. Inhibiting excessive acidification using zero-valent iron in anaerobic digestion of food waste at high organic load rates [J]. Bioresource Technology, 2016,211:65-71.
[11] Zhang J Y, Lv C, Tong J, et al. Optimization and microbial community analysis of anaerobic co-digestion of food waste and sewage sludge based on microwave pre-treatment [J]. Bioresource Technology, 2016, 200(2):253-261.
[12] Gao S M, Huang Y, Yang L L, et al. Evaluation the anaerobic digestion performance of solid residual kitchen waste by NaHCO3buffering [J]. Energy Conversion and Management, 2015,93:166-174.
[13] Tale V P, Maki J S, Zitomer D H. Bioaugmentation of overloaded anaerobic digesters restores function and archaeal community [J]. Water Research, 2015,70:138-147.
[14] Li Y, Yang G X, Li L H, et al. Bioaugmentation for overloaded anaerobic digestion recovery with acid-tolerant methanogenic enrichment [J]. Waste Management, 2018,79:744-751.
[15] 国家环境保护总局.水和废水监测分析方法[M]. 北京:中国环境科学出版, 2009.
State Environmental Protection Administration.Water and waste water monitoring and analysis method [M]. Beijing: China Environmental Science Press, 2009.
[16] HJ/T 399-2007 水质化学需氧量的测定快速消解分光光度法[S].
HJ/T 399-2007 Water quality-Determination of the chemical oxygen demand-Fast digestion-Spectrophotometric method [S].
[17] HJ/T 535-2009 水质氨氮的测定纳氏试剂分光光度法[S].
HJ/T 535-2009 Water quality-Determination of ammonia nitrogen-Nessler’s Reagent spectrophotometry [S].
[18] GB 5009.6-2016 食品安全国家标准食品中粗脂肪的测定[S].
GB 5009.6-2016 National food safety standard—Determination of crude fat in foods [S].
[19] GB 5009.5-2016 食品安全国家标准食品中蛋白质的测定[S].
GB 5009.5-2016 National food safety standard—Determination of protein in foods [S].
[20] GB /T 5009.10-2003 植物类食品中粗纤维的测定[S].
GB /T 5009.10-2003 Determination of crude fiber in vegetable foods [S].
[21] 乔 玮,姜萌萌,赵 婧,等.中温和高温环境下乙酸和丙酸厌氧发酵产甲烷动力学特征[J]. 农业工程学报, 2018,34(21):242-246.
Qiao W, Jiang M M, Zhao J, et al. Methanogenesis kinetics of anaerobic digestion of acetate and propionate at mesophilic and thermophilic conditions [J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018,34(21): 242-246.
[22] Alalawy A, Guo Z D, Almutairi F M, et al. Explication of structural variations in the bacterial and archaeal community of anaerobic digestion sludges: An insight through metagenomics [J]. Journal of Environmental Chemical Engineering, 2021,9(5):105910.
[23] Ma G L, Chen Y T, Ndegwa P. Association between methane yield and microbiota abundance in the anaerobic digestion process: A meta- regression [J]. Renewable and Sustainable Energy Reviews, 2021,135: 110212.
[24] Arelli V, Mamindlapelli N K, Juntupally S, et al. Solid-state anaerobic digestion of sugarcane bagasse at different solid concentrations: Impact of bio augmented cellulolytic bacteria on methane yield and insights on microbial diversity [J]. Bioresource Technology, 2021,340: 125675.
[25] Li J R, Chen T, Yin J, et al. Effect of nano-magnetite on the propionic acid degradation in anaerobic digestion system with acclimated sludge [J]. Bioresource Technology, 2021,334:125143.
[26] Xiao H, Fang D X, Wang Y J, et al. Nymphoides peltatum as a novel feedstock for biomethane production via anaerobic co-digestion with waste sludge [J]. International Journal of Hydrogen Energy, 2021,46 (35):18401-18411.
[27] Bedoya K, Hoyos O, Zurek E, et al. Annual microbial community dynamics in a full-scale anaerobic sludge digester from a wastewater treatment plant in Colombia [J]. Science of The Total Environment, 2020,726:138479.
[28] Li L, Qin Y, Kong Z, et al. Characterization of microbial community and main functional groups of prokaryotes in thermophilic anaerobic co-digestion of food waste and paper waste [J]. Science of the Total Environment, 2019,652:709-717.
[29] Wang P, Wang H T, Qiu Y Q, et al. Microbial characteristics in anaerobic digestion process of food waste for methane production–A review [J]. Bioresource Technology, 2018,248:29-36.
[30] Barua S, Zakaria B S, Dhar B R. Enhanced methanogenic co- degradation of propionate and butyrate by anaerobic microbiome enriched on conductive carbon fibers [J]. Bioresource Technology, 2018,266:259-266.
[31] Malinowsky C, Nadaleti W, Debiasi L R, et al. Start-up phase optimization of two-phase anaerobic digestion of food waste: Effects of organic loading rate and hydraulic retention time [J]. Journal of Environmental Management, 2021,296:113064.
[32] Narihiro T, Nobu M K, Tamaki H, et al. Draft Genome Sequence of Syntrophomonas wolfei subsp. methylbutyratica Strain 4J5T(JCM 14075), a Mesophilic Butyrate- and 2-Methylbutyrate-Degrading Syntroph [J]. Genome announcements, 2016,4(2):e00047-16.
[33] Llamas M, Greses S, Tomás-Pejó E, et al. Tuning Microbial Community in Non-Conventional Two-Stage Anaerobic Bioprocess for Microalgae Biomass Valorization into Targeted Bioproducts [J]. Bioresource Technology, 2021,(337):125387.
[34] Kurade M B, Saha S, Salama E, et al. Acetoclastic methanogenesis led by Methanosarcina in anaerobic co-digestion of fats, oil and grease for enhanced production of methane [J]. Bioresource technology, 2019, 272:351-359.
[35] Ryue J, Lin L, Liu Y, et al. Comparative effects of GAC addition on methane productivity and microbial community in mesophilic and thermophilic anaerobic digestion of food waste [J]. Biochemical Engineering Journal, 2019,146:79-87.
Regulation of acidified dry anaerobic digestion of kitchen waste and microbial community analysis.
WANG Pan, YANG Xin-yu, ZHENG Yi, REN Lian-hai*
(State Environmental Protection Key Laboratory of Food Chain Pollution Control, School of Ecology and Environment, Beijing Technology and Business University, Beijing 10048, China)., 2022,42(4):1770~1779
Aiming at the problems caused by the accumulation of propionic acid and butyric acid during anaerobic digestion, the sludge with propionic acid and butyric acid tolerant microorganism were domesticated, and they were added into the acidified systems of dry anaerobic digestion of kitchen waste to explore the effects on methane production and microbial communities. After treated by the sludge with propionic acid and butyric acid tolerant bacteria, the propionic acid concentration reduced by 6900.81mg/L, and the cumulative methane production increased by 259%, while the butyric acid concentration reduced by 5371.56mg/L, and the cumulative methane production increased by 210%, respectively. The richness of bacteria in the acidified systems was significantly improved after the regulation with propionic acid and butyric acid tolerant bacteria. The analysis of microbial community structure at genus level showed that the relative abundance ofand, having the ability of degrading volatile fatty acids, began to increase in the reactors treated by the sludge with propionic acid tolerant bacteria. After adding the sludge with butyric acid tolerant bacteria, the relative abundance ofincreased.have a synergistic effect with acetic acid methanogens. According to the analysis of archaea, the relative abundance of hydro methanogens and acetic acid methanogens increased in the groups treated with propionic acid and butyric acid tolerant bacteria, respectively.
kitchen waste;dry anaerobic fermentation;regulation of acidified anaerobic fermentation system;microbial community
X705,X703.5
A
1000-6923(2022)04-1770-10
王 攀(1983-),女,河北石家庄人,教授,博士,主要从事固体废弃物资源化方向.发表论文50余篇.
2021-09-13
国家重点研发计划重点专项(2019YFC1906303);国家自然基金资助项目(42007350);北京市自然基金资助项目(8202010);2021年研究生科研能力提升计划项目(202105)
*责任作者, 教授, renlh@th.btbu.edu.cn

