pH值调控对柑橘废渣与污泥厌氧共发酵产酸影响
孙 鸿,肖向哲,罗进财,章 亮,林 朋,董姗燕,2*,朱易春,2
pH值调控对柑橘废渣与污泥厌氧共发酵产酸影响
孙 鸿1,肖向哲1,罗进财1,章 亮1,林 朋1,董姗燕1,2*,朱易春1,2
(1.江西理工大学土木与测绘工程学院,江西 赣州 341000;2.赣江流域水质安全保障工程技术研究中心,江西 赣州 341000)
为提高挥发性脂肪酸(VFA)的产量,探究了柑橘废渣和剩余污泥不同VS(挥发性固体)配比及调控发酵过程pH值对产VFA性能的影响.结果表明:调节共发酵系统pH值为6对VFA的积累有促进作用,柑橘废渣VS/剩余污泥VS为2时的最大VFA产量为11183.12mg/L,是未控制pH值组最高VFA浓度的1.75倍.柑橘废渣中的橘皮精油能抑制产甲烷过程,发酵过程控制pH值则强化这种抑制作用.加入柑橘废渣后,共发酵系统的菌群结构优势显著,产VFA相关微生物种群大量增加,而消耗乙酸的产甲烷菌群减少,从而有利于VFA的积累.研究结果将为优化柑橘废渣与剩余污泥厌氧共发酵产VFA提供理论依据.
剩余污泥;柑橘废渣;厌氧;共发酵;挥发性脂肪酸
剩余污泥是污水生物处理过程的副产物,我国每年约产生3900万t剩余污泥,其中大部分污泥通过堆肥、焚烧及卫生填埋等方式进行处理和处置[1].目前我国剩余污泥资源化较多应用于制作建筑材料、有机肥等方面[2].厌氧发酵是较为稳定和资源化利用剩余污泥的一种技术,剩余污泥通过厌氧发酵会产生挥发性脂肪酸(VFA)、氢气和甲烷等具有利用价值的产物.其中,VFA是一种碳氢化合物,能用作醇、长链脂肪酸和聚羟基烷酸酯等高价值化合物的前体物及易于生物降解的碳源.与甲烷相比,VFA具有更大的利用价值[3].
柑橘是我国第二大水果种类,且产量逐年攀升.除了鲜食,柑橘类加工业每年会产生大量废弃皮渣,其中绝大多数皮渣被随意丢弃或填埋处理.柑橘废渣酸性较强,容易引起霉变发臭,严重污染环境.然而,柑橘废渣中的挥发性固体(VS)约占总固体(TS)的95.25%[4],适宜厌氧发酵生物处理.当柑橘废渣VS和剩余污泥VS以1:2混合厌氧共发酵时,其沼气产率较剩余污泥和柑橘渣单独厌氧消化分别提高了1.6倍和3.04倍[5].
柑橘废渣与剩余污泥均为有效的生物质能源,将二者混合进行厌氧发酵不仅能解决剩余污泥单独厌氧发酵存在的降解周期长、产酸效率低等问题[6],而且可以均衡系统碳氮比、降低有毒化合物浓度和增强微生物的协同作用[7].研究表明,橘皮中的橘皮精油(EO)对厌氧发酵产甲烷过程具有一定的抑制作用[8].橘皮厌氧发酵时发现,当EO浓度为111.2mg/(L∙d)时,产甲烷过程几乎被完全抑制[9].研究EO对污泥毒性的结果表明:当污泥中EO浓度为1350mg/kg时,其比产甲烷活性和辅酶F420活性较对照组降低了98.4%和23.1%[10].EO的主要成分为D-柠檬烯,它是一种单环单萜烯,可以作用于微生物细胞膜抑制微生物的生长繁殖而具有抑菌机制[11].目前关于柑橘废渣与剩余污泥厌氧共发酵促进产酸的研究鲜少报道.鉴于此,本文以柑橘废渣与剩余污泥不同基质比构建了多个厌氧共发酵系统,通过调控厌氧发酵过程的pH值,比较分析了共发酵系统不同基质比及其精油含量对厌氧产酸性能和产甲烷过程的影响,以期对柑橘废渣与剩余污泥厌氧共发酵产酸性能提供理论基础和技术支持,同时实现剩余污泥和柑橘废渣的稳定化及资源化利用.
1 材料和方法
1.1 厌氧发酵装置
厌氧发酵装置由3部分组成:一是厌氧反应器,由10个1000mL厌氧发酵瓶组成,内部盛有800mL发酵底物,放入磁石转子,以橡胶塞密封;二是自制的恒温水浴箱,水浴箱采用加热棒加热,控制温度为(35±1)℃,水浴箱下部配备2台磁力搅拌器;三是集气装置,采用10个盛有2mol/L NaOH溶液的200mL史密斯发酵管,通过压力差将产生的气体导入其中,并记录产气量.图1为厌氧发酵装置简图.

图1 厌氧发酵装置简图
①进料兼取样口 ②厌氧发酵瓶 ③恒温水浴箱 ④潜水泵 ⑤加热棒 ⑥磁力搅拌器 ⑦集气装置
1.2 试验材料
试验用剩余污泥取自赣州市某污水厂的污泥浓缩池,该污水厂采用A/A/O生物处理工艺.所取污泥经1mm×1mm筛网过滤去除杂质后浓缩静置24h,撇去上清液,于4℃冰箱中保存备用.接种污泥为驯化后的剩余污泥,驯化方法与陈思远等[12]研究一致.试验用柑橘为赣南沃柑,将柑橘皮与少量果肉混合,采用榨汁机破碎后与等质量纯水混匀,于4℃冰箱中保存备用.剩余污泥、接种污泥和柑橘废渣理化性质见表1.

表1 污泥和柑橘废渣理化性质
由表1可知,柑橘废渣的有机质含量非常高,其VS/TS是剩余污泥的2.4倍,溶解性COD(SCOD)则是剩余污泥的240倍;柑橘废渣中溶解性多糖(SC)占SCOD的含量约59%,溶解性蛋白质(SP)含量相对较低.
1.3 试验方法
厌氧发酵试验分2组进行,每组试验包含5个反应器,分别为对照组CK(不添加柑橘废渣)及柑橘废渣和剩余污泥的混合厌氧发酵反应器(柑橘废渣VS/剩余污泥VS的比例为0.25、0.50、1.00、2.00).两组试验初始条件均相同,不同在于I组厌氧发酵过程不调节pH值,II组厌氧发酵过程中每2d调节一次pH值至6(I、II组反应器编号分别为CK1、I-0.25、I-0.5、I-1、I-2和CK2、II-0.25、II-0.5、II-1、II-2).每个厌氧反应器有效容积为800mL,反应器加入80mL接种污泥和720mL柑橘废渣和剩余污泥混合物.厌氧发酵前,反应器内充入氮气排空氧气后密封,置于(35±1)℃恒温水浴箱内发酵21d,每12h用磁力搅拌器搅拌15min,磁力搅拌速率为120r/min.每天监测产气量,每2d调节pH值前取样测定VFA、SCOD等相关指标.

表2 柑橘废渣与剩余污泥不同比例下的理化性质
注:指标数据为样品测试3次的平均值(I组和II组除pH值不同外,其余指标均相同;II组的初始pH值均为6).
1.4 检测项目与数据处理
1.4.1 常规及专项指标检测 剩余污泥及柑橘废渣的基本参数如COD、TS、VS、TN等常规指标均采用《水和废水监测分析方法(第四版)》方法测定[13],SP采用考马斯亮蓝G250法,SC采用苯酚-硫酸法;EO采用蒸馏滴定法,与赵其阳等[14]研究一致.
VFA 采用Agilent 7890B气相色谱仪测定.该色谱仪配有氢火焰离子检测器(FID)和DB-FFAP毛细柱(规格为30m×0.25mm×0.25μm,载气为N2,流速为30mL/min).测试条件:FID检测器,温度为280℃,进样口温度为250℃,分流比20:1,单针进样量为1.0 μL;升温程序为初始温度60℃,停留5min,然后以 20℃/min的程序升温至220℃,停留5min.VFA 主要由乙酸、丙酸、正丁酸、异丁酸、正戊酸和异戊酸6种有机酸构成.
厌氧体系中细菌和古菌群落采用16S-rRNA为靶点的高通量测序(HTS)进行分析:细菌DNA使用341F和805R进行扩增;古菌使用巢式PCR进行3轮扩增,第一轮扩增使用340F和1000R引物,第二轮扩增使用349F和806R引物,第三轮扩增引入Illumina桥式PCR兼容引物.
1.4.2 数据处理 VFA数据使用软件Agilent Data Analysis进行处理,分析方法同任晓鸣等[15]一致.细菌及古菌群落结构测序平台为Illumina Miseq,其相对丰度使用软件R进行分析处理,测序结果由生工生物工程(上海)股份有限公司提供.
2 结果与讨论
2.1 柑橘废渣和剩余污泥共发酵对VFA产量的影响及变化
2.1.1 对VFA产量的影响 由图2(a)可以看出, I组各反应器的VFA浓度随厌氧发酵时间总体呈现先增大后减小并逐步趋于稳定的趋势,且各试验组的VFA浓度均高于对照组(CK1).柑橘废渣与剩余污泥共发酵显著促进了VFA的生成,原因是柑橘废渣中含有大量SCOD和SC类物质,且其所含有的天然复合物EO对基质水解酸化过程有促进作用[16].厌氧发酵第7d时,I-1组VFA浓度达到最大(为6398.02mg/L),分别是CK1、I-0.25、I-0.5及I-2组的19.22倍、2.71倍、2.26倍和2.47倍.除I-2组外,其余各组的VFA产量总体随柑橘废渣VS与剩余污泥VS的比值增大而逐渐升高,原因是柑橘废渣增加了厌氧体系中的有机物含量,有利于生成更多的VFA.碳氮比(C/N)是评估厌氧共发酵性能的重要参考指标之一[17-18].I-2组VFA产量总体上低于I-1组,原因可能是I-2组的C/N高于I-1组,其厌氧系统营养不均衡而不利于VFA的生成导致.此外,VFA含量与pH值密切相关,VFA含量越高,相应pH值越低.由图3可以看出,I组中各反应器内pH值变化与VFA变化基本呈相反趋势.其中, I-0.5、I-1和I-2组的pH值在反应前几天迅速下降,达到最小值后又略有回升,随后在pH=5附近趋于稳定;I-0.25和对照组CK1的最终pH值在6.50~6.80之间变化.
图2(b)为II组控制pH值为6时VFA的浓度变化情况.其各反应器的VFA浓度变化与I组变化趋势相同.除了对照组,II组所有反应器内的VFA最大值均高于I组对应反应器内的VFA最大值.厌氧发酵第11d时,II-2组VFA浓度最大值为11183.12mg/L,是I-1组VFA最大浓度的1.75倍.随着柑橘废渣VS和剩余污泥VS比值的增加,II组各反应器内最大产酸量逐渐增多且至最大产酸量的时间逐步推后,一方面是可利用基质增加有利于VFA的生成,另一方面是隔天调节pH值为6促进了VFA的积累,这与Bahriye等[19]研究一致.
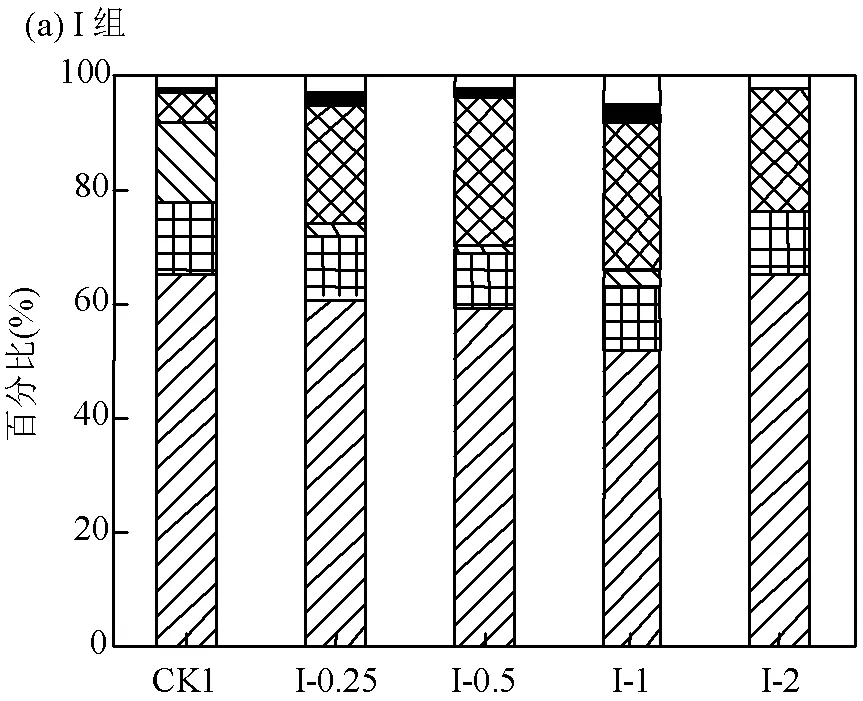
2.1.2 VFA组分的变化 图4为I组第7d和II组第9d时各反应器内VFA的组分变化图.由图4(a)可知,I组主要为乙酸型发酵,丙酸含量次之;各组的乙酸含量约占VFA总量的52%~65%,丙酸含量约占总量的11%.由图4(b)可以看出,相较于I组,II组中各反应器内乙酸含量显著降低,丙酸、丁酸和戊酸含量均有所增加;II组总体表现出以混合酸型发酵为主,其中乙酸含量相对较低,可能被微生物利用转化为其余类型的酸所致.根据以上结果可知,在共发酵过程中控制反应器pH值为6会影响微生物的活性,并改变共发酵系统的产酸类型.
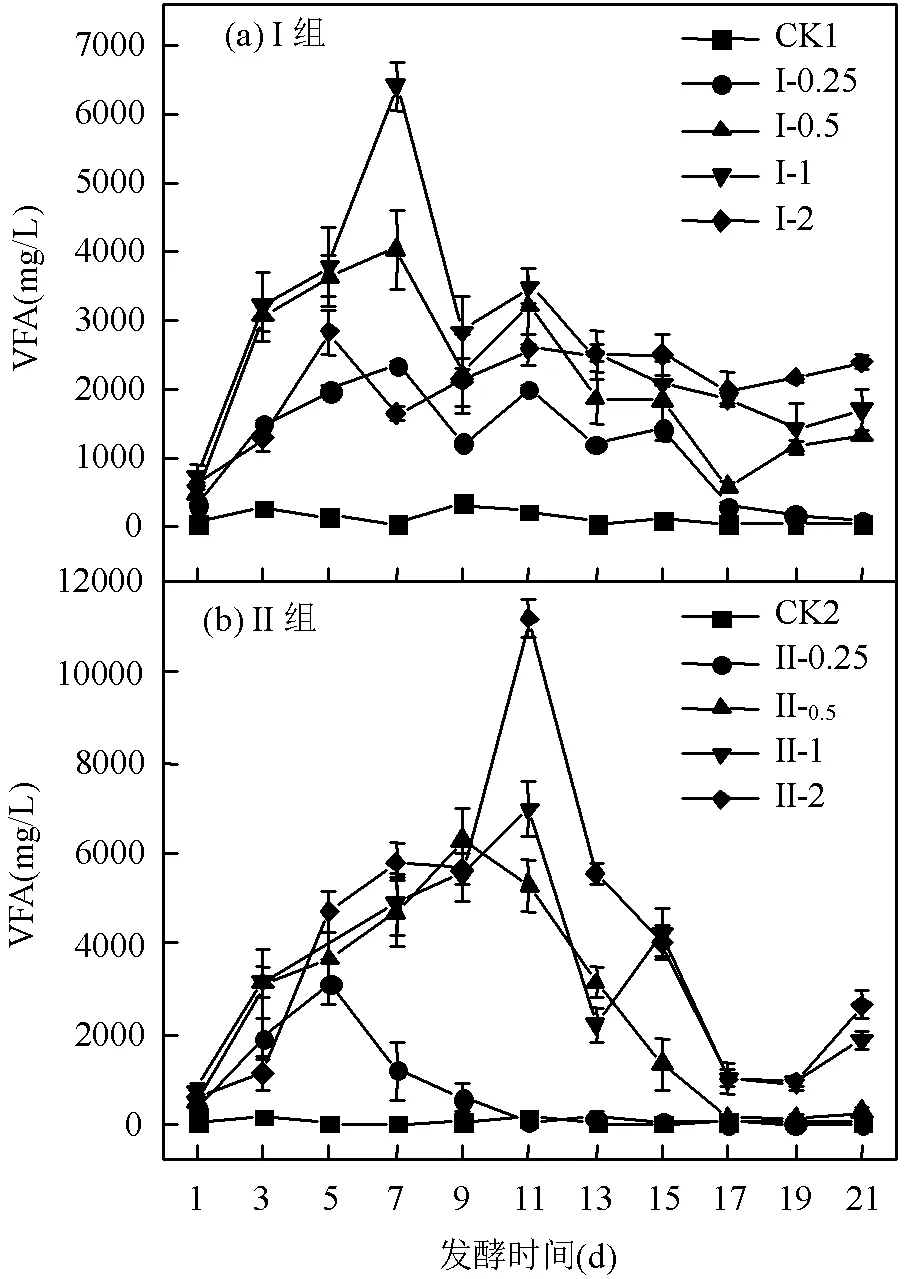
图2 VFA的变化情况
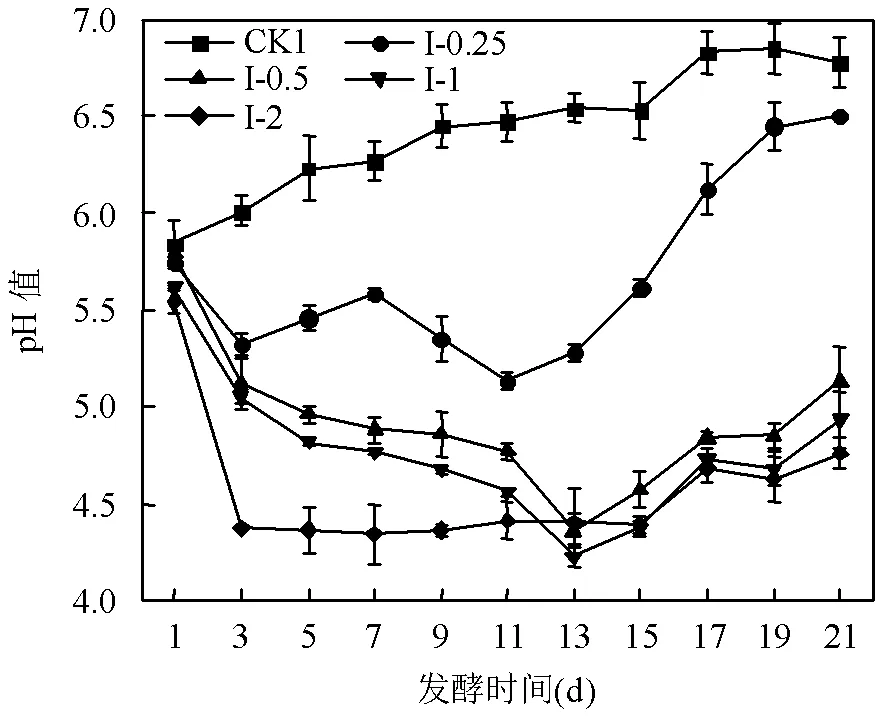
图3 I组共发酵系统中pH值的变化情况
Fig.3 Changes of pH in the co-fermentation system of group I
2.1.3 可溶性有机物产量的变化 SCOD浓度的变化反应了厌氧发酵过程中颗粒态有机物的水解程度及厌氧发酵程度.由图5(a)和5(d)可以看出,各组反应器内的SCOD浓度约在厌氧发酵第5d时达到最大值,随后呈逐渐下降的趋势.这是因为厌氧反应前期混合底物中难溶性有机物经水解细菌分解转化为溶解性有机物,厌氧中后期水解程度减弱,微生物开始大量利用有机物使SCOD下降[20].有研究表明,EO能破坏污泥细胞壁释放胞内基质而不丧失活性[21],因此在水解细菌与EO的共同作用下难溶性有机物更易向可溶性有机物转化.II组中各反应器内(CK2、II-0.25~II-2)最大SCOD浓度分别是I组(CK1、I-0.25~I-2)的1.49倍、1.09倍、1.03倍、1.22倍和1.19倍.但厌氧反应稳定后,II组的最终SCOD浓度均低于I组,这表明控制pH值促进了厌氧发酵的水解和酸化阶段.

SC和SP属于易被微生物利用的溶解性有机物.由图5(b)和5(e)可以看出,I组和II组反应器内的SC在厌氧发酵前期先迅速下降后趋于稳定.由于柑橘废渣中含有大量SC,因此共发酵系统中SC是溶解性有机物的主要成分,在发酵产酸菌的作用下可将其转化为VFA[22].SP在共发酵系统中含量较低,在厌氧前期有一个上升过程,随后下降趋于稳定.由I组和II组中SC和SP的变化可知,厌氧发酵过程控制pH值对其影响不大.
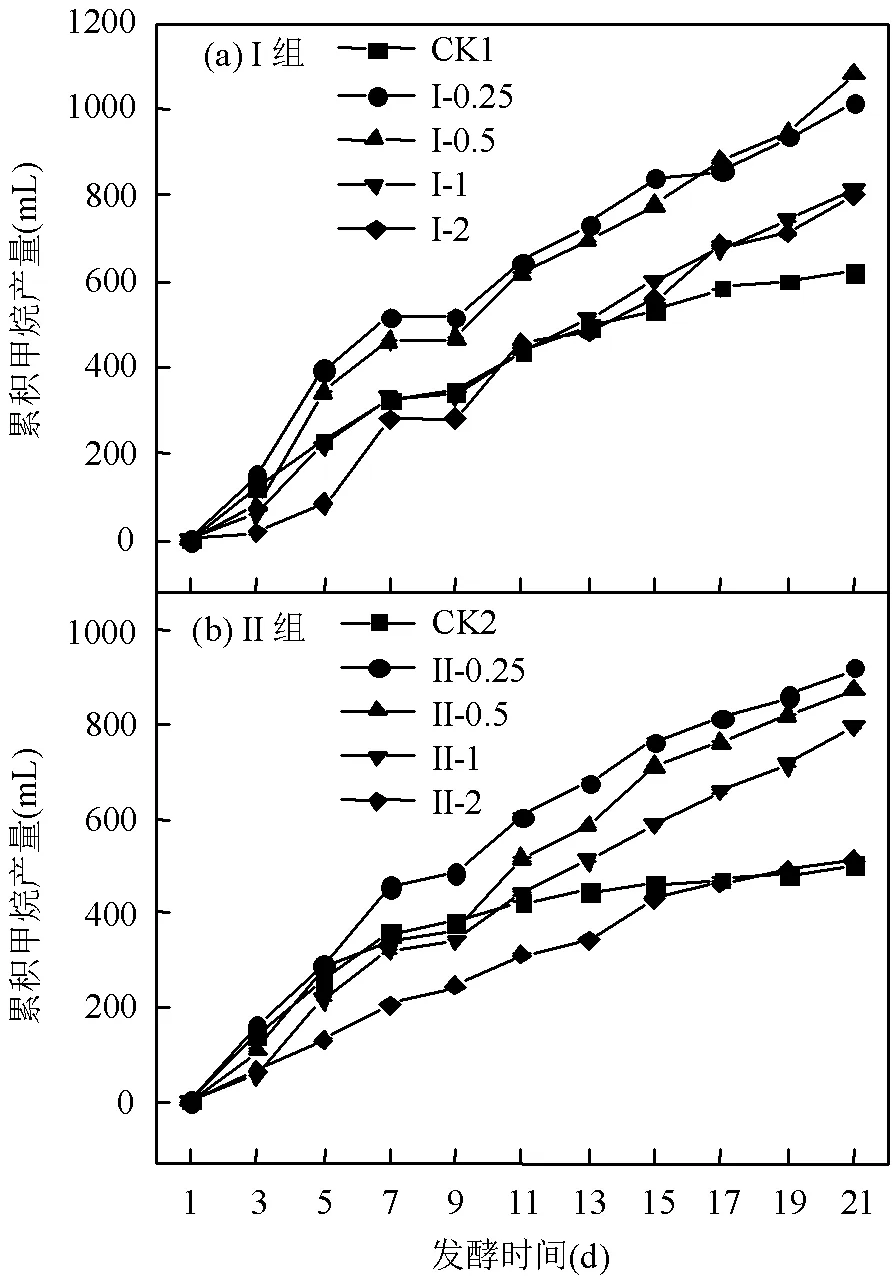
图6 累积甲烷产量的变化情况
2.1.4 甲烷产量的变化 由图6可以看出,随着共发酵系统中柑橘废渣VS和剩余污泥VS比值的增大,各组累积产甲烷量逐渐减小,其中I组中CK1最小,II组中II-2与CK2最终值相差不大.由此可知,柑橘废渣的增加,使得共发酵系统中有机物含量增多,有利于甲烷的产生;但过量的柑橘废渣,则可能对产甲烷过程产生一定的抑制作用,因为柑橘废渣中的柠檬烯能抑制产甲烷过程[23].有研究表明,在亚致死浓度条件下,柠檬烯会使嗜热甲烷八联球菌细胞膜发生明显变化,进而显示出一定的抗菌作用[24-25].由图6(a)可知,I组中柑橘废渣VS/剩余污泥VS的比值分别为1和2时的累积产甲烷量明显低于0.25和0.50时的累积产甲烷量;由图6(b)可以看出,II组中各反应器生成的累积甲烷量显著低于I组.II组中各反应器(CK2、II-0.25~II-2)的累积产甲烷量相比于I组(CK1、I-0.25~I-2)分别下降了20.10%、7.91%、12.83%、3.44%和30.87%,原因是II组中控制pH值促进了VFA的积累,相应甲烷产量有所降低.
2.2 共发酵系统中微生物群落的变化
微生物群落结构和功能微生物的相对丰度与厌氧发酵性能密切相关.通过高能量测序技术,比较分析了CK1、I-1、CK2和II-2四个厌氧反应器稳定运行后的细菌和古菌的群落变化情况.由图7(a)可知,在目水平上, Methanomicrobiales和 Methanosarcinales为CK1和CK2的优势菌目,分别占总古菌目的50%和29%以上;I-1和II-2中Methanomicrobiales仍为优势菌目, Methanosarcinales的相对丰度减少到6%以下, Methanobacteriales则分别占了33%和26%.由图7(b)可知,在属水平上,Methanoregula和Methanothrix为CK1和CK2的优势菌属,分别占总古菌属的30%和29%以上;I-1和II-2中Methanothrix相对丰度降低到5%以下, Methanosphaera的相对丰度分别增加到28%和11%.由此可知,剩余污泥中加入柑橘废渣后,共发酵系统中微生物种群结构发生了变化,利用氢气、甲酸盐等电子供体还原CO2生成甲烷[26]的菌种Methanobacteriales和Methanoregula成为优势菌种,而以乙酸为基质生成甲烷[27]的Methanosarcinales和Methanothrix菌群相对丰度减少,即乙酸消耗量减少,有利于VFA的积累.

图7 古菌的相对丰度
图8为CK1、I-1、CK2和II-2四个反应器内门和纲水平上细菌群落的变化情况.由图8(a)可知,在门水平上, Proteobacteria和Chloroflexi为CK1和CK2的优势菌群,分别占总细菌门的30%和13%以上;I-1和II-2中Firmicutes为优势菌门,分别占总细菌门的52%和59%以上,Proteobacteria和Chloroflexi相对丰度则分别降低到18%和1%以下.Firmicutes门下的许多微生物能在厌氧条件下降解有机物生成VFA[28],而Proteobacteria和Chloroflexi是以消耗乙酸、丙酸和丁酸为主的细菌[29].因此共发酵系统中Firmicutes相对丰度的增加促进了VFA的生成,而Proteobacteria和Chloroflexi的活性降低减少了VFA的消耗,从而促进了VFA的积累.由图8(b)可以看出,CK1和CK2纲水平上的菌群种类较多,无明显优势的菌群,而I-1和II-2中Clostridia为其优势菌种,相对丰度分别为44%和47%.Clostridia中的许多菌种具有较强的水解能力[30],它们提高了共发酵系统中溶解性有机物的水解产酸效率.综上可知,相比于剩余污泥单独厌氧发酵系统,共发酵系统为微生物的生长提供了大量基质和养分,改变了剩余污泥单独厌氧发酵时的菌群结构,形成了有利于VFA积累的微生物菌群,从而可以产生更多的VFA.
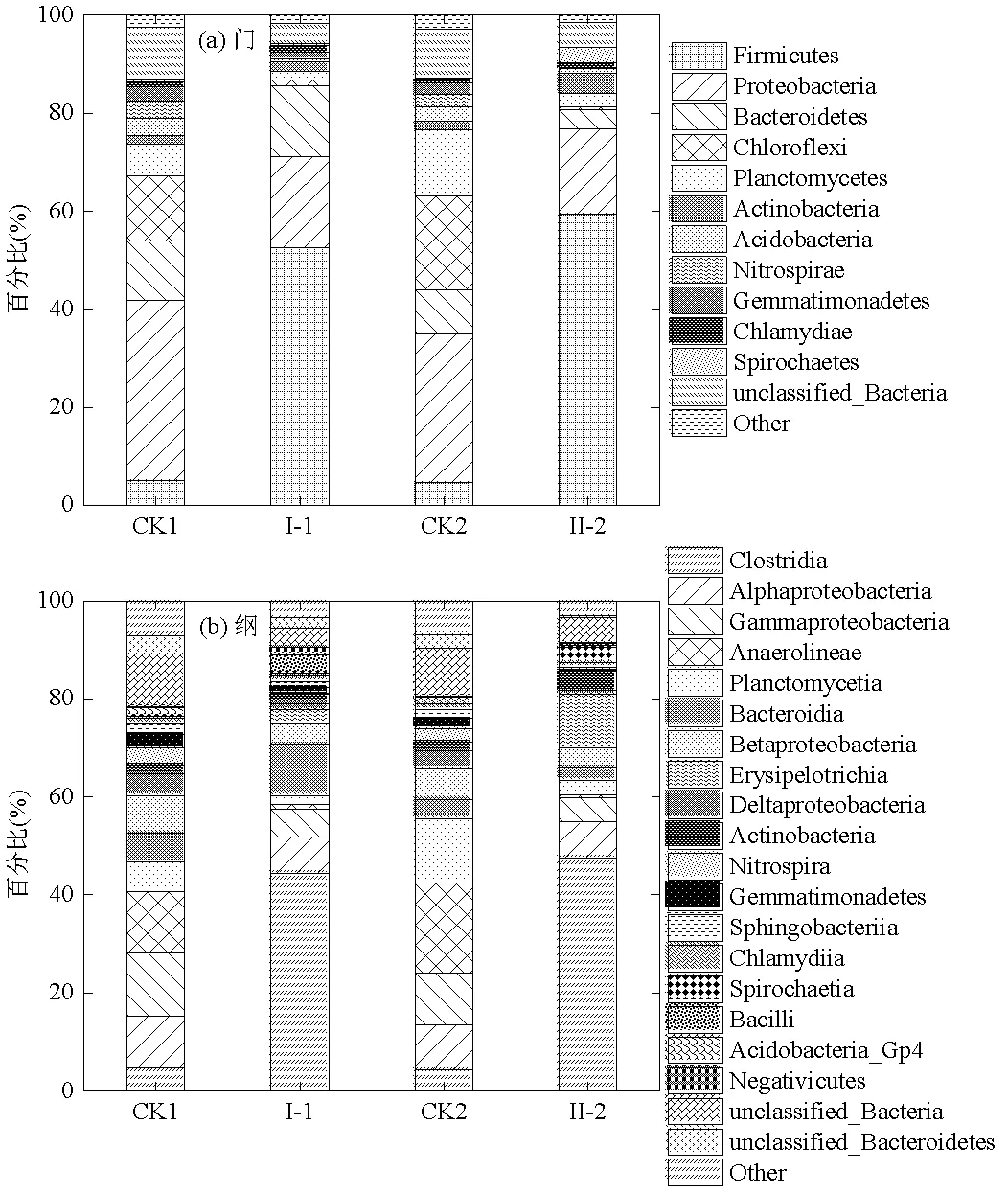
图8 细菌的相对丰度
3 结论
3.1 柑橘废渣与剩余污泥共发酵的产酸量显著提高,且发酵过程中控制pH值有利于VFA的积累.未控制pH值时,柑橘废渣VS/剩余污泥VS为1时产酸效果最好,最高VFA浓度为6398.02mg/L;控制pH值为6时,柑橘废渣VS/剩余污泥VS为2的VFA最大浓度是I-1组的1.75倍,且产酸发酵类型由乙酸型发酵变为混合酸发酵.
3.2 柑橘废渣和剩余污泥共发酵过程增加了系统的SCOD和SC浓度,且柑橘废渣的添加对产甲烷过程具有一定的抑制作用,发酵过程控制pH值为6时加强了这种抑制作用.
3.3 共发酵系统的菌群结构优势显著,有利于VFA的积累.一方面水解发酵过程形成了能促进产酸的优势菌群Firmicutes,另一方面产甲烷过程中消耗乙酸的Methanosarcinale和Methanothrix菌群相对丰度降低,甲烷的积累量减少,而利用氢气的Methanobacteriales和Methanoregula成为优势菌种,即乙酸消耗量减少,能促进VFA的积累.
[1] Wei L, Zhu F, Li Q, et al. Development, current state and future trends of sludge management in China: Based on exploratory data and CO2-equivaient emissions analysis [J]. Environment international, 2020,144:106093.
[2] 王晓利,曾正中,王厚成,等.污泥处理处置及资源化方法探讨[J]. 环境工程, 2014,32(3):150-154.
Wang X L, Zeng Z Z, Wang H C, et al. The disposal technique and comprehensive utilization of sludge [J].Environmental Engineering, 2014,32(3):150-154.
[3] Rao Y, Wan J, Liu Y, et al. A novel process for volatile fatty acids production from syngas by integrating with mesophilic alkaline fermentation of waste activated sludge [J]. Water Research, 2018,139: 372-380.
[4] 李淑兰,刘 萍,宋 立.柑橘皮的基本特性及沼气化处理可行性研究[J]. 中国沼气, 2018,36(3):64-66.
Li S L, Liu P, Song L. The basic characteristics of orange peel and its deasibility for biogas production treatment [J]. China Biogas, 2018, 36(3):64-66.
[5] 赵 婷,姜 鑫,陈永栋,等.剩余污泥与柑橘渣协同厌氧消化特性研究[J]. 环境科学与技术, 2019,42(5):94-100.
Zhao T, Jiang X, Chen Y D, et al. Study on anaerobic co-digestion of excess sludge and citrus pulp [J]. Environmental Science & Technology, 2019,42(5):94-100.
[6] Cheng H, Li Y, Guo G, et al.Advanced methanogenic performance and fouling mechanism investigation of a high-solid anaerobic membrane bioreactor (AnMBR) for the co-digestion of food waste and sewage sludge [J]. Water Research, 2020,187:116436.
[7] Wu Y, Song K. Anaerobic co-digestion of waste activated sludge and fish waste: Methane production performance and mechanism analysis [J]. Journal of Cleaner Production, 2021,279:123678.
[8] Begoña Ruiz, Xavier Flotats. Effect of limonene on batch anaerobic digestion of citrus peel waste [J]. Biochemical Engineering Journal, 2016,109(1):9-18.
[9] Demetrio A Zema, Adele Fòlino, Giovanni Zappia, et al. Anaerobic digestion of orange peel in a semi-continuous pilot plant: An environmentally sound way of citrus waste management in agro- ecosystems [J]. Science of the Total Environment, 2018,630:401-408.
[10] 陈 刚,陈思远,肖向哲,等.橙皮精油对橙渣与剩余污泥厌氧共消化的毒性分析[J]. 中国给水排水, 2021,37(13):77-82.
Chen G, Chen S Y, Xiao X Z, et al. Toxicity of orange peel essential oil to anaerobic co-digestion of orange residue and excess sludge [J]. China Water & Wastewater, 2021,37(13):77-82.
[11] 王佳宇,胡文忠,管玉格,等.柠檬烯抑菌机理及其在果蔬保鲜中应用的研究进展[J]. 食品工业科技, 2021,42(14):414-419.
Wang J Y, Hu W Z, Guan Y G, et al. Research progress on the bacteriostatic mechanism of limonene and its application in fruit and vegetable preservation [J]. Science and Technology of Food Industry, 2021,42(14):414−419.
[12] 陈思远,陈 刚,高彩琪,等.BES对污泥厌氧发酵产酸性能的影响[J]. 江西理工大学学报, 2020,41(1):50-56.
Chen S Y, Chen G, Gao C Q, et al. Effects of BES on acid production by anaerobic fermentation of sludge [J]. Journal of Jiangxi University of Science and Technology, 2020,41(1):50-56.
[13] 国家环境保护总局.水和废水监测分析方法[M]. 北京:中国环境科学出版社, 2004.
State Environmental Protection Administration. Water and wastewater monitoring and analysis methods [M]. Beijing: China Environmental Science Press, 2004.
[14] 赵其阳,焦必宁,付陈梅,等.柑桔皮及其果汁中香精油含量的蒸馏滴定方法研究[J]. 中国南方果树, 2006,35(5):9-11.
Zhao Q Y, Jiao B N, Fu C M, et al. Rapid determination of the essential oil content in peel and juices of citrus [J]. South China Fruits, 2006,35(5):9-11.
[15] 任晓鸣,陆 烽,王 蔚.利用气相色谱测定剩余污泥厌氧消化产生的混合VFA [J]. 环境科技, 2009,22(S1):39-41.
Ren X M, Lu F, Wang W. Determination of VFAs in anaerobic digestion of excess active sludge by gas chromatography [J].Environmental Science and Technology, 2009,22(S1):39-41.
[16] Mahdi Amer Ali, Al-Maqtari Qais Ali, Mohammed Jalaleldeen Khaleel, et al. Enhancement of antioxidant activity, antifungal activity, and oxidation stability of Citrus reticulata essential oil nanocapsules by clove and cinnamon essential oils [J]. Food Bioscience, 2021,43: 101226.
[17] Hema Rughoonundun, Romeela Mohee, Mark T. Influence of carbon- to-nitrogen ratio on the mixed-acid fermentation of wastewater sludge and pretreated bagasse [J]. Bioresource Technology, 2012,112:91-97.
[18] Xue S R, Wang Y B, Lv X, et al. Interactive effects of carbohydrate, lipid, protein composition and carbon/nitrogen ratio on biogas production of different food wastes [J]. Bioresource Technology, 2020, 312:123566.
[19] Eryildiz Bahriye, Lukitawesa Lukitawesa, Taherzadeh J Mohammad. Effect of pH, substrate loading, oxygen, and methanogens inhibitors on volatile fatty acid (VFA) production from citrus waste by anaerobic digestion [J]. Bioresource Technology, 2020,302:10.1016/j.biortech. 2020.122800.
[20] A Carvalho, R Fragoso, J Gominho, et al. Effect of minimizing d-limonene compound on anaerobic co-digestion feeding mixtures to improve methane yield [J]. Waste and Biomass Valorization, 2019, 10(1):75-83.
[21] Sara Burt. Essential oils: their antibacterial properties and potential applications in foods-a review [J]. International journal of food microbiology, 2004,94(3):223-253.
[22] Zhao J, Gui L, Wang Q, et al. Aged refuse enhances anaerobic digestion of waste activated sludge [J]. Water Research, 2017,123: 724-733.
[23] Rosangela Di Pasqua, Nikki Hoskins, Gail Betts, et al. Changes in membrane fatty acids composition of microbial cells by addition of thymol, carvacrol, limonen, cinnamaldhehyde, and eugenol in growing media [J]. Journal of Agricultural & Food Chemistry, 2006,54(7): 2745-2749.
[24] Di Pasqua Rosangela, Betts Gail, et al. Membrane toxicity of antimicrobial compounds from essential oils. [J]. Journal of Agricultural and Food Chemistry, 2007,55(12):4863-4870.
[25] Wikandari Rachma, Nguyen Huong, Millati Ria, et al. Improvement of biogas production from orange peel waste by leaching of limonene [J]. BioMed Research International, 2015,2015:10.1155/2015/494182.
[26] 徐 思.杭州西湖沉积物中产甲烷菌群落结构和多样性研究[D]. 武汉:武汉理工大学, 2015.
Xu S. Study of methanogenic community structure and diversity in the sediments of West Lake, Hangzhou [D]. Wuhan: Wuhan University of Technology, 2015.
[27] 李小兰,周 芸,陈志燕,等.针铁矿强化剩余污泥与烟草废弃物厌氧发酵的研究[J]. 中国环境科学, 2019,39(6):2475-2482.
Li X L, Zhou Y, Chen Z Y, et al. Enhanced anaerobic fermentation of waste activated sludge and tobacco waste using Goethite [J]. China Environmental Science, 2019,39(6):2475-2482.
[28] Wang Y, Wang D, Liu Y, et al. Triclocarban enhances short-chain fatty acids production from anaerobic fermentation of waste activated sludge [J]. Water Research, 2017,127:150-161.
[29] Li J, Chen T, Yin J, et al. Effect of nano-magnetite on the propionic acid degradation in anaerobic digestion system with acclimated sludge [J]. Bioresource Technology, 2021,334:125143.
[30] Qing L W, Wan Q G, Zheng H S, et al. Enhancement of volatile fatty acid production by co-fermentation of food waste and excess sludge without pH control: The mechanism and microbial community analyses [J]. Bioresource Technology, 2016,216:653-660.
Effects of pH on the production of volatile fatty acids from citrus waste and waste activated sludge by anaerobic co-fermentation.
SUN Hong1, XIAO Xiang-zhe1, LUO Jin-cai1, ZHANG Liang1, LIN Peng1, DONG Shan-yan1,2*, ZHU Yi-chun1,2
(1. School of Civil and Surveying & Mapping Engineering, Jiangxi University of Science and Technology, Ganzhou 341000, China;2.Research Center for Water Quality Security Technology at Ganjiang River Basin, Ganzhou 341000, China)., 2022,42(4):1762~1769
In order to improve the production of volatile fatty acids (VFA), the effects of different ratios of volatile solids(VS) from citrus waste and waste activated sludge and regulating pH in fermentation processes were studied. The results showed that adjusting the pH of the co-fermentation system to 6could promote the accumulation of VFA. When the ratio of VS from citrus waste and waste activated sludge reached 2, the maximum VFA yield was 11183.12mg/L, which was 1.75times higher than that without pH control. Furthermore, the essential oil from citrus waste could inhibit the methanogenic process, which was strengthened by controlling pH in the fermentation process. After adding citrus waste, the microbial community structure of the co-fermentation system showed significant advantages. VFA related microbial population increased significantly while methanogenic bacteria consuming acetic acid decreased, which was conducive to the accumulation of VFA. The results of this experiment can provide a theoretical basis for optimizing the performance of VFA production by anaerobic co-fermentation of citrus waste and waste activated sludge.
waste activated sludge;citrus waste;anaerobic;co-fermentation;volatile fatty acids
X705
A
1000-6923(2022)04-1762-08
孙 鸿(1998-),男,贵州遵义人,江西理工大学硕士研究生,主要研究方向为剩余污泥厌氧发酵产酸.
2021-09-19
国家自然科学基金资助项目(51868025);江西省教育厅科技项目(GJJ200835)
*责任作者, 讲师, d_shanyan@126.com

