超声波加湿室内微生物气溶胶浓度与优化方法
陈露安,杨传钧,谷雨倩,刘学虎,杨自力*
超声波加湿室内微生物气溶胶浓度与优化方法
陈露安1,杨传钧1,谷雨倩1,刘学虎2,杨自力1*
(1.东华大学环境科学与工程学院,上海 201620;2.中国轻工业广州工程有限公司,广东 广州 511440)
为明确超声波加湿对冬季供暖室内微生物气溶胶粒径与浓度分布的影响,以及降低暴露风险的有效方法,针对典型办公室环境,基于模拟实验法与正交试验法,探究不同相对湿度(RH=40%、55%、70%)、加湿器水质(蒸馏水、自来水、凉白开)和窗户开度(0、1/6、1/3)下,超声波加湿前后室内细菌、真菌气溶胶按粒径分级的浓度变化,并结合极差分析与层次分析法(AHP)对上述因素的影响权重排序.结果表明,超声波加湿后,细菌、真菌气溶胶的浓度增长率分别高达294%和798%,且分布(0.6~4.7µm)集中在人员可吸入范围.影响加湿室内微生物暴露量的因素权重排序为:水质(45%)>目标湿度(44%)>窗户开度(11%).为最大限度降低暴露风险,建议用户使用超声波加湿器时,优先选用蒸馏水,调节目标湿度至中等水平.
超声波加湿;生物气溶胶;室内空气;正交试验;使用优化
超声波加湿具有雾化能力强、加湿速度快、低耗低噪等优点,广泛用于缓解冬季供暖室内空气干燥的问题.然而,现有研究表明,若使用不当,超声波加湿会增大室内细菌、真菌气溶胶(统称为微生物气溶胶)浓度并诱发人员呼吸疾病[1-6];连续使用加湿器后室内微生物气溶胶的群落结构也会恶化,空气中可吸入性致病微生物的占比增加[7],进一步加剧了人员在加湿室内的微生物气溶胶暴露风险.
影响暴露风险大小的主要因素有:加湿器水质、目标相对湿度(RH)与通风情况.加湿器水里的杂质是加湿空气中气溶胶颗粒的主要来源.当加湿器用水不易孳生微生物时,将缓解微生物气溶胶散发[10-11].而降低加湿的目标相对湿度(RH)也可显著降低室内微生物气溶胶暴露风险,已有研究表明[8-9]:当目标RH=80%时,空气中的细菌浓度高达46000CFU/m3[9],而当目标RH=46%~75%时,可降至23000CFU/m3[8].此外,开窗通风也有助于稀释空气污染物,避免细菌、真菌等污染物堆积,减小室内微生物气溶胶吸入风险[12-13].
然而,现有研究未能明确降低加湿室内微生物气溶胶暴露风险的有效方法.在实际中,用户由于工艺要求或条件限制,往往难以同时实现降低目标加湿量、改善加湿水质、持续开窗通风等条件,这是因为过低的相对湿度或将影响室内人员舒适性或工艺生产,这与其使用加湿器的目的相悖;用户在使用过程中,通常由于蒸馏水等优质水质获取不便,往往贪图方便而更多地使用简单易取的自来水或凉白开等作为加湿器填充水;开窗通风虽可稀释污染物,但在供暖季节,持续通风显然会增加室内供暖能耗.
为此,本文通过模拟实验法与正交试验法,在不同相对湿度(RH=40%、55%、70%)、水质(自来水-TW、蒸馏水-DW、凉白开-CW)及窗户开度(0,1/6, 1/3)等典型工况下,研究超声加湿前后室内微生物气溶胶的分级浓度变化,分析3种因素对降低室内微生物气溶胶浓度的影响作用大小,明确减小加湿房间内微生物暴露风险的最有效组合方式.结果可为保障超声波加湿室内人员呼吸健康提供借鉴.
1 实验材料与研究方法
1.1 实验装置

图1 实验舱设置
为确保实验初始微生物气溶胶浓度等条件的一致性与可控性,本研究采用模拟实验法,以实际办公房间为原型,按1:5等比缩放并依照GB50176- 2016《民用建筑热工设计规范》[14]搭建3个模拟实验舱(长×宽×高:1030mm×825mm×825mm,如图1).在实验过程中,实验舱门常闭,窗户(300mm×300mm)依据实验工况开启或关闭.3个实验舱平行排列在温湿度可控的人工气候实验室中(如图2),以保证实验舱外的温湿度、本底微生物气溶胶浓度等条件一致且稳定(16~19˚C,RH=(35%±5%)).
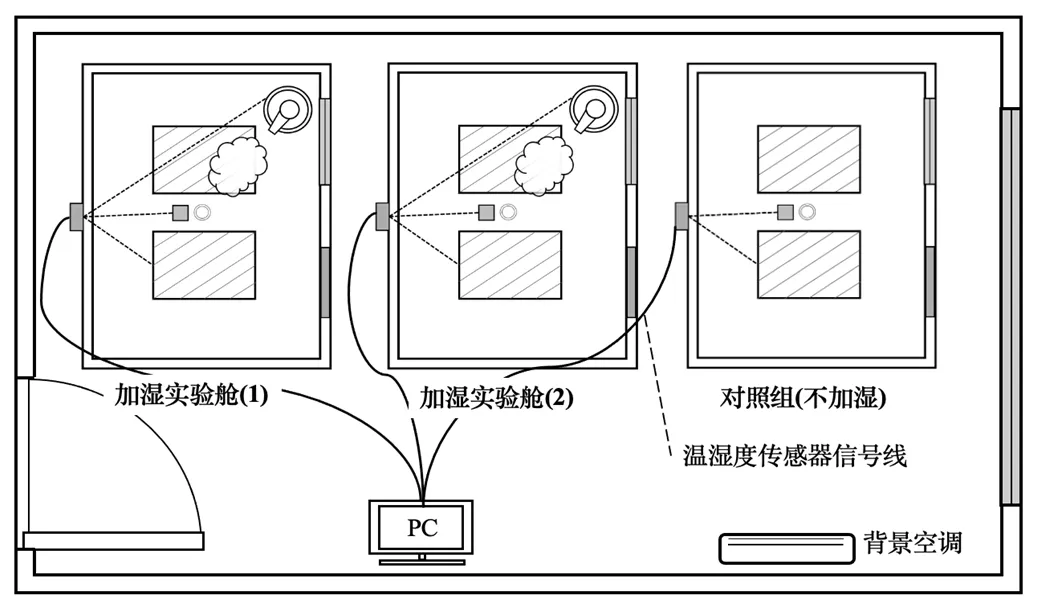
图2 实验舱在人工气候室内布局
经预实验验证,实验舱之间以及对背景实验室中气溶胶的影响微弱,因此实验舱(1)与(2)分别开展不同工况实验(如表1);各实验舱内平铺有电热膜(表面温度<30℃),加热舱内空气并恒温23℃,对照舱内仅供暖不加湿.加湿实验舱内,于对角线顶点处设有1台市面常见的便携式超声波加湿器(1.7MHz)进行加湿.基于雷诺相似准则,调整加湿器喷嘴处流速为0.8m/s,以保证模拟实验舱内加湿器喷雾气流流动状态与实际原型房间内保持一致.
1.2 正交试验设计

表1 实验工况
采用3因素3水平正交试验研究相对湿度(40%,55%,70%),加湿器水质(蒸馏水,自来水,凉白开),窗户开度(0,1/6,1/3)的影响,实验用水来源:自来水接自上海市政管网,在水龙头开启30s后取水;凉白开由相同来源的自来水加热沸腾3min后在密闭容器中冷却至室温获得;实验所用蒸馏水为商用灭菌蒸馏水(屈臣氏,密封瓶装),每次实验使用新开封的蒸馏水,以避免污染.正交试验工况设置及实验方法见表1、图3.
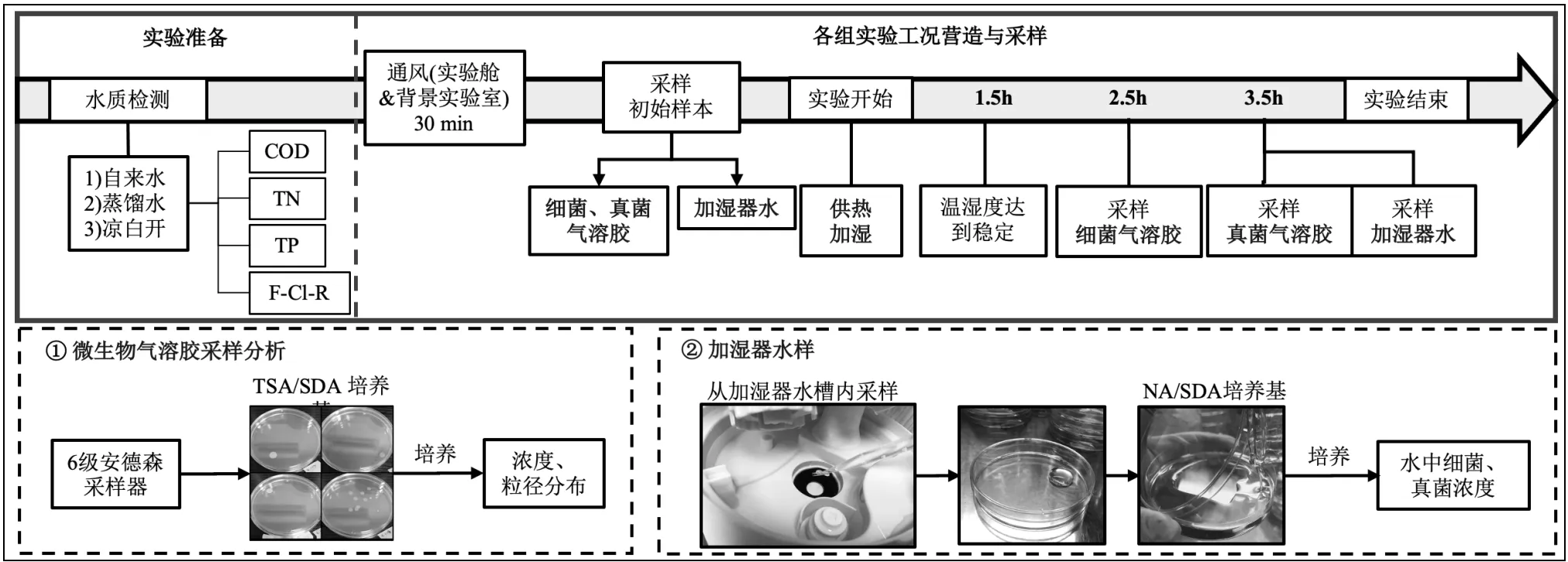
图3 单次实验工况营造及采样流程
1.3 实验步骤
1.3.1 实验主要流程 为保证各工况初始条件一致,每次实验开始前都对各实验舱与背景实验室充分通风,将加湿器加水(1L)后放入实验舱,关闭实验舱舱门,依据工况表1调整窗户开度.加湿器运行前采集各实验舱与背景实验室的初始样本,采样过程如下:使用装有胰蛋白酶大豆琼脂培养基(TSA)的安德森6级空气微生物采样器,在流量28.3L/min下同步采样实验组、对照组及背景实验室中的细菌气溶胶初始样本2min,随后使用装有沙氏葡萄糖琼脂(含氯霉素)培养基(SDA)的空气采样器再次同步采样实验组、对照组与背景实验室中真菌气溶胶初始样本2min,采样得到的细菌与真菌用于后续培养(通风后,背景实验室、各实验舱与对照舱内细菌、真菌气溶胶初始浓度均较低,约80~260CFU/m3).
初始样本采集完毕后启动加热装置与加湿器对实验舱供暖加湿,因目标相对湿度不同,实验时各实验舱温湿度达到目标水平所需时长不等,实际需1~1.5h,此后在继电器(设定有目标温、湿度)的控制下,加湿器与电热膜间歇启停以保证室内温湿度条件稳定.为确保各实验组在采样时系统运行时长一致、温湿度充分稳定,在开始加湿后2.5h(此时各实验组的温湿度已稳定至少1h),采样各实验舱内的细菌气溶胶,待舱内空气温湿度重新稳定1h后再采样真菌气溶胶样品;随后停止加热加湿,并采集实验后加湿器水样.
1.3.2 采样培养与浓度增量计算 所采用的安德森6级采样器的各级分级粒径为:第一级>7.0μm,第二级4.7~7.0μm,第三级3.3~4.7μm,第四级2.1~3.3μm,第五级1.1~2.1μm,第六级0.6~1.1μm[15].采集在TSA上的细菌,经37ºC培养48h后计数.采集在SDA上的真菌,经28°C培养5d后计数,计数时引入空白培养皿作为平行对照并重复计数,以多次计数所得平均值作为结果.细菌或真菌气溶胶浓度增量Δ(CFU/m3).
由式(1)计算:
ΔC=C-0(1)
式中:C为加湿后的细菌或真菌气溶胶浓度,CFU/m3;0为该实验舱的初始浓度,CFU/m3.
每次实验前、后,加湿器水样分别重复采集3组.水中细菌采用平板培养法计算浓度:取1mL水样,在培养皿中与15mL无菌液态营养琼脂培养基(NA)均匀混合;待冷却凝固后,经37℃培养48h计数.水中真菌同样采用液态SDA平板培养法,经28℃培养5d后计数.
1.4 分析方法
采用单因素方差分析加湿实验组与对照组间微生物浓度差异的显著性.当<0.05时,认为存在显著差异.对正交试验所得结果进行极差分析,并基于层次分析法(AHP)[16]得出优势影响因子及其权重并排序.
2 结果与讨论
2.1 超声波加湿对细菌、真菌分级浓度的影响
超声波加湿前后舱内细菌、真菌气溶胶分级浓度变化分别如图4所示.相比于对照舱中空气微生物由于沉降等产生的浓度降低趋势,超声波加湿组中细菌、真菌浓度显著增大(表2,<0.01,单因素方差分析).其中,细菌在短时(2.5h)加湿后浓度增量最高达366CFU/m3(实验组2),相比于对照组增幅达294%;而真菌在加湿后增量最大,可达599CFU/ m3(实验组8),相比对照组增幅达798%.

表2 空气细菌、真菌浓度增量的方差分析
注:*<0.05 **<0.01.

(a) 细菌
(b) 真菌
图4 微生物气溶胶分级浓度变化
Fig.4 Comparison of bioaerosol concentrations and size-distributions before and after humidification
实验组与对照组细菌、真菌气溶胶的分级浓度增量方差分析结果如表3所示.加湿后,0.6~1.1µm粒径范围的细菌浓度大多显著增大(图4(a)中白色部分);而增加的空气真菌中,粒径范围为3.3~4.7µm与1.1~2.1µm的小粒径颗粒占据主导(图4(b)).已有研究指出[17],粒径小于4.7µm的颗粒物可到达人的气管,而粒径为0.6~1.1µm的细微颗粒甚至可进入人体肺泡.Hung等[18]研究表明,超声波加湿器散发的水雾粒径范围为0.2~1.25µm,Sain等[10]对超声波加湿器散发颗粒物的研究也证明加湿器散发的颗粒物粒径集中在亚微米级.Yang等[7]实验结果同样表明,超声波加湿器散发的细菌集中在小粒径范围(0.6~1.1µm).Kooij等[19]研究指出,这与超声波的频率等特性有关.由于常见真菌孢子粒径为1~10µm[20],而超声波雾化特性所释放的主要为亚微米颗粒,因此在超声波加湿下室内空气中0.6~1.1µm粒径段的细菌浓度显著增大,而真菌增量较少,表现了与细菌不同的规律.
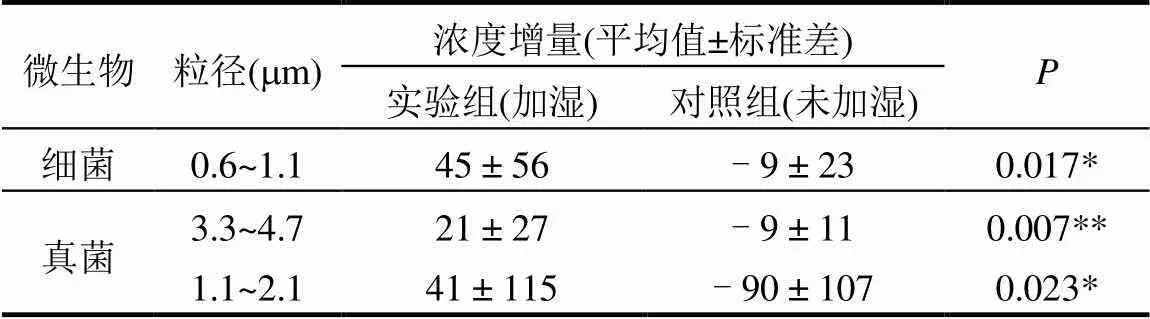
表3 加湿促进细菌、真菌浓度的增长及其粒径范围
注:*<0.05 **<0.01(增长不显著部分未显示).
而实验4(蒸馏水、RH55%、窗户开度1/6)中0.6~1.1µm粒径段细菌减少的可能原因是:一方面, 蒸馏水所含养分极少(表4)、菌体不易增殖,且在室内RH=55%的中等空气相对湿度下微生物不宜存活[21],此时实验舱内微生物气溶胶增量最少;另一方面,超声波加湿器通过水雾促进气溶胶凝并沉降,对空气颗粒具备一定的净化效应[22],且对小粒径颗粒的沉降作用更为显著[23].
上述结果表明:超声波加湿不仅会增大室内细菌、真菌气溶胶浓度暴露风险,而且主要集中在0.6~4.7µm粒径范围,加剧了室内人员的吸入风险.
2.2 加湿条件的影响敏感性
正交实验极差分析结果(图5)显示,目标相对湿度及水质对加湿室内细菌、真菌气溶胶暴露量的影响较大,窗户开度的影响相对较小.本文中,3种因素的最优组合为“RH=55%,蒸馏水,窗户开度1/3”.
由图5可知,微生物气溶胶增量在RH=55%时达到最低,此结果与Sterling等[24]所得结论一致:在室温、中等湿度(RH=40%~60%)条件下,微生物气溶胶的暴露风险最低.这是因为,微生物多依附于液滴等漂浮;而Dunklin等[21]指出,在中等相对湿度下,空气中的载菌液滴易部分蒸发,使液滴中的溶质浓度不断增大而对菌体产生毒性,加剧其衰亡.处于低湿状态的液滴虽容易更快蒸发,但所载细菌自身将因此脱水进入干燥休眠状态,并对外部不利因素(如载菌液滴浓缩后的毒性)产生抵御[25];而在适宜生长的基体(如培养基)上,休眠的细菌将复苏,并表现出更强的增殖力.

图5 3种因素影响的极差分析
DW-蒸馏水;TW-自来水;CW-凉白开
水质对微生物气溶胶浓度的影响较大,为此,对实验所用3种水质的化学需氧量(COD)、总氮(TN)、总磷(TP)及游离氯含量进行了检测,结果如表4所示.
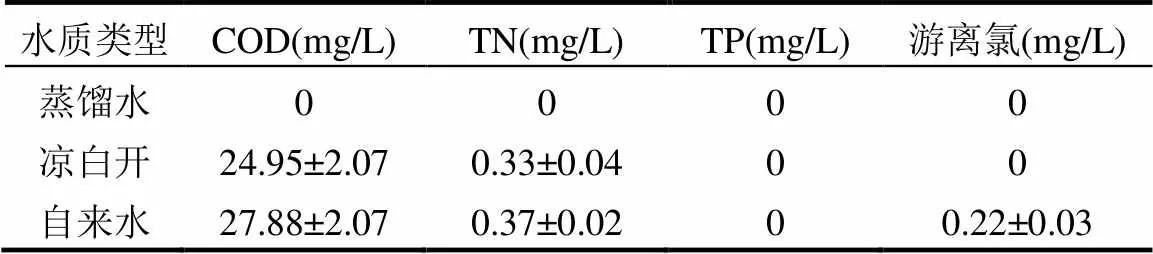
表4 水中COD、TN、TP及游离氯含量
由表4可见,3种水的养分含量均较低,不利于微生物繁殖.但多项究表明低强(<2W/cm2)[26]高频超声波(>580kHz)[27]可有效促进液体中微生物繁殖.其中,高频声波因声学振荡周期更短,形成空化气泡的耗时短、气泡小、气泡空化破裂时能量也更低,仅能够“打散”水中菌体微团,增大了与液体的有效接触及繁殖空间,反而促进微生物繁殖[27-28].本实验使用的是常见超声波加湿器,配备1.7MHz的高频低强超声雾化片,产生的超声波应以对微生物活性的促进作用为主;Yang等[7]也发现经超声波作用后,加湿器水中细菌浓度迅速增大.而3种水中,由于蒸馏水纯净无菌,且所含氮、磷等元素最少,即便超声波作用,细菌与真菌依然不易在蒸馏水中繁殖,因此使用蒸馏水加湿时微生物气溶胶浓度增量最少(图5);自来水通常含有少量余氯,虽然氯能抑制水中细菌与真菌的繁殖[29],但经超声波振荡后将快速挥发而不再具备抑制作用,此时细菌与真菌在超声波作用下凭借水中的氮、磷等养分快速繁殖[30],因此,使用自来水加湿时室内细菌与真菌增量最大;凉白开的增量仅次于自来水,这是因为凉白开所含养分与自来水类似,虽经高温煮沸后其初始含菌量较少,但使用时环境菌体落入(如背景空气)难以避免,也在超声波作用下凭借少量养分快速繁殖,最终向室内释放较高浓度的微生物气溶胶.
而与相对湿度、水质的影响相比,不同窗户开度下的微生物浓度变化最小,不开窗与开窗1/3的差异不明显(>0.05,单因素方差分析).而在实际的冬季供暖房间内,用户由于节能、舒适性等因素,往往很少或较小地开窗(特别是在长江三角洲等冬季具有”阴冷感”的地区),且开启时间短,对室内空气中微生物的稀释作用弱.
进一步使用层次分析法(AHP)定量评价相对湿度、水质、窗户开度等3种因素对空气中细菌、真菌增量的影响大小,比较矩阵如表5所示.重要性标度由对应因素的极差值两两比较得出.

表5 AHP评价3种因素的比较矩阵
层次分析结果显示(表6),本文中目标相对湿度对室内细菌、真菌暴露风险的影响权重为43.63%,加湿水质的权重为45.30%,窗户开度权重仅为11.07%.因此,所研究的3种因素对减小加湿室内细菌、真菌暴露量的影响大小排序为:水质>目标相对湿度>窗户度.这一结果表明,使用蒸馏水等纯净水源作为加湿器用水是改善加湿空气品质的最有效方法.当难以获取蒸馏水时,加湿目标设为中等相对湿度也能降低微生物气溶胶浓度;而开窗的改善作用则相对最弱.

表6 各因素影响大小权重
注:一致性比率CR=CI/RI=0.00<0.1(查得:随机一致性指标RI=0.52),满足一致性检验.
本文研究成果对在加湿房间感到不适的用户具有积极借鉴,建议首先改善加湿水质,选用洁净且不易孳生微生物的水,如蒸馏水;或调节目标相对湿度至中等水平,例如55%左右,以同时保证室内人员的舒适与健康;而仅调节窗户开度对加湿空气中微生物污染的改善作用相对较小,且会引起热量耗散而增加供热能耗.
3 结论
3.1 使用超声波加湿器后,室内微生物气溶胶浓度显著增大,且集中在可吸入(细菌:0.6~1.1µm;真菌: 1.1~2.1µm、3.3~4.7µm)粒径范围内.本文研究中,加湿后细菌最大增幅达294%,真菌最大增幅为798%.
3.2 改善加湿室内细菌、真菌暴露量因素的影响大小按其权重排序为:水质(45%)>目标相对湿度(44%)>窗户度(11%).
3.3 为最大程度地降低供暖加湿室内细菌、真菌暴露风险,超声波加湿器的最佳使用工况为:优先使用蒸馏水、设置中等加湿湿度(如RH=55%),开窗的改善效果相对较弱.
[1] Edwards J H. Microbial and immunological investigations and remedial action after an outbreak of humidifier fever [J]. Occupational and Environmental Medicine, 1980,37(1):55-62.
[2] 人民网.同寝室4名大学生一起出现发热不当使用加湿器得了肺炎[EB/OL].(2021-03-24)[2021-04-01]. http://health.people.com.cn/ n1/2021/0324/c14739-32059080.html.
People's Daily Online. 4college students in the same dormitory developed fever simultaneously, improper use of humidifier lead to pneumonia [EB/OL].(2021-03-24)[2021-04-01]. http://health.people. com.cn/n1/2021/0324/c14739-3205908 0.html.
[3] 央广网.女子紧闭门窗患上真菌性肺炎加湿器是“元凶”[EB/OL]. (2018-12-05)[2021-04-01]. http://health.cnr.cn/jkgd xw/20181205/ t20181205_524439975.shtml.
Central Broadcasting Network. The humidifier is the "culprit" of the woman suffering from fungal pneumonia with closed doors and windows [EB/OL]. (2018-12-05)[2021-04-01]. http://health.cnr.cn/ jkgdxw/20181205/t20181205_524439975.shtml.
[4] 秦 宏,王昌松.某电子组装车间加湿器热事件调查[J]. 环境与职业医学, 2017,34(2):165-168.
Qing H, Wang C S, Investigation of an occupational humidifier fever event in an electronic assembly workshop [J]. Journal of Environmental & Occupational Medicine, 2017,34(2):165-168.
[5] 洪 镭,马 涛.一起车间内疑似军团菌病暴发的调查报告[J]. 职业与健康, 2013,29(23):3142-3143,3146.
Hong L, Ma T. An investigation report of suspected outbreak of legionnaires’ disease [J]. Occupation and Health, 2013,29(23):3142- 3143,3146.
[6] 李 博,王 欣,杨跃峰.一起加湿器传播病原微生物引起室内空气污染事件调查[J]. 现代预防医学, 2014,41(9):1719-1721,1725.
Li B, Wang X, Yang Y F. Investigation on an indoor air pollution incident caused by pathogenic microorganism dispersed in the water fog [J]. Modern Preventive Medicine, 2014,41(9):1719-1721,1725.
[7] Yang Z L, Chen L A, Yang C J, et al. Portable ultrasonic humidifier exacerbates indoor bioaerosol risks by raising bacterial concentrations and fueling pathogenic genera [J]. Indoor Air, 2022,32:e12964.doi:10. 1111/ina.12964.
[8] Sain A E, Zook J, Davy B M, et al. Size and mineral composition of airborne particles generated by an ultrasonic humidifier [J]. Indoor air, 2018,28(1):80-88.
[9] Sain A E, Dietrich A M. Emission of inhalable dissolved drinking water constituents by ultrasonic humidifiers [J]. Environ. Eng. Sci., 2015,32(12):1027–1035.
[10] Tyndall R L, Lehman E S, Bowman E K, et al. Home humidifiers as a potential source of exposure to microbial pathogens, endotoxins, and allergens [J]. Indoor Air, 1995,5(3):171–178.
[11] Lee J H, Ahn K H, Yu I J. Outbreak of bioaerosols with continuous use of humidifier in apartment room [J]. Toxicological Research, 2012, 28:103–106.
[12] 朱晓明.基于连续在线监测的西安市住宅室内空气品质及居民开关窗行为研究[D]. 西安:西安建筑科技大学, 2018.
Zhu X M. The research of the indoor air quality and the behavior of residents’ switching window in residential building in Xi’an based on continuous on online monitoring [D]. Xi’an: Xi’an University of Architecture and Technology, 2018.
[13] 张雷明.西安市居住建筑室内空气品质监测及通风控制策略研究[D]. 西安:西安建筑科技大学, 2020.
Zhang L M, Indoor air quality monitoring and ventilation control strategies for residential buildings in Xi’an city [D]. Xi’an: Xi’an University of Architecture and Technology, 2020.
[14] GB 50176-2016 民用建筑热工设计规范[S].
GB 50176-2016 Thermal design code for civil building [S].
[15] 张松乐,童咏仪,姜 黎,等.国产六级安德森空气微生物采样器的简化使用效果观察[J].中国公共卫生, 1994,10(10):454-455.
Zhang S L, Tong Y Y, Jiang L, et al. Observation of simplified use effect of domestic six-stage Anderson air microbiological sampler [J]. Chinese Journal of Public Health, 1994,10(10):454-455.
[16] 双同科,田佳林,刘 学,等.一种基于改进AHP的指标权重确定方法[J]. 中国西部科技, 2011,10(32):37-38.
Shuang T K, Tian J L, Liu X, et al. A method for determining indicator weights based on improved AHP [J]. Science and Technology of West China, 2011,10(32):37-38.
[17] Russell L, Use of six-stage Andersen sampler in investigating bioaerosol inhalation risks in different environments [C]. Asian Aerosol Conference. 2011.
[18] Hung D V, Tong S, Nakano Y, et al. Measurements of particle size distributions produced by humidifiers operating in high humidity storage environments [J]. Biosystems Engineering, 2010,107(1):54- 60.
[19] Kooij S, Astefanei A, Corthals G L, et al. Size distributions of droplets produced by ultrasonic nebulizers [J]. Sci. Rep., 2019,9(1):6128.
[20] Yamamoto N, Bibby K, Qian J, et al. Particle-size distributions and seasonal diversity of allergenic and pathogenic fungi in outdoor air [J]. ISME J, 2012,6(10):1801-1811.
[21] Dunklin E W, Puck T T. The lethal effect of relative humidity on air-borne bacteria [J]. The Journal of Experimental Medicine, 1948,87(2):87-101.
[22] Feng Z, Zhou X, Xu S, et al. Impacts of humidification process on indoor thermal comfort and air quality using portable ultrasonic humidifier [J]. Building and Environment, 2018,133:62-72.
[23] Wang Y, Chen L, Chen R, et al. Effect of relative humidity on the deposition and coagulation of aerosolized SiO2nanoparticles [J]. Atmospheric Research, 2017,194:100-108.
[24] Sterling E M, Arundel A, Sterling T D. Criteria for human exposure to humidity in occupied buildings [J]. ASHRAE Transactions, 1985, 91(1):611-622.
[25] Arundel A V, Sterling E M, Biggin J H, et al. Indirect health effects of relative humidity in indoor environments [J]. Environ. Health Perspect, 1986,65:351-361.
[26] Pitt W G, Ross S A. Ultrasound increases the rate of bacterial cell growth [J]. Biotechnol. Prog., 2003,19(3):1038-1044.
[27] Joyce E, Al-Hashimi A, Mason T J. Assessing the effect of different ultrasonic frequencies on bacterial viability using flow cytometry [J]. J. Appl. Microbiol., 2011,110(4):862-870.
[28] 姚楚水,杨 燕,丁兰英,等.超声波加湿器内水中自然菌生长情况及其对空气污染的研究 [J]. 中国消毒学杂志, 2005,(4):442-444.
Yao C S, Yang Y, Ding L Y, et al. Study on growth of natural bacteria in water in ultrasonic humidifier and contamination of air [J]. Chinese Journal of Disinfection, 2005,(4):442-444.
[29] 徐向前.地下水中丝状真菌生长繁殖特性及二氧化氯灭活机制[D]. 西安:西安建筑科技大学, 2018.
Xu X Q. The growth and outbreak of filamentous fungi in groundwater and its inactivation using chlorine dioxide [D]. Xi’an: Xi’an University of Architecture and Technology, 2018.
[30] Redfield A C. The biological control of chemical factors in the environment.[J]. American Scientist, 1958,46:205-221.
Impacts of ultrasonic humification on size-distribution and concentration variations of indoor bioaerosol and its optimization strategy.
CHEN Lu-an1, YANG Chuan-jun1, GU Yu-qian1, LIU Xue-hu2, YANG Zi-li1*
(1.College of Environmental Science and Engineering, Donghua University, Shanghai 201620, China;2.China GDE Engineering CO., LTD., Guangzhou 511440, China)., 2022,42(4):1594~1600
This work experimentally investigated the size-distribution and concentration changes of indoor bioaerosol before and after ultrasonic humidification via the orthogonal experiment methods in three heated experimental chambers (23°C) to clarify the exposure risk of indoor airborne bacteria and fungi during ultrasonic humidification. Effectiveness of three well-recognized influencing factors, i.e., target relative humidity (RH=40%, 55%, 70%), humidifier water type (distilled water, tap water, cooled boiled water), and window opening degree (0, 1/6, 1/3) on mitigating the exposure risks was also rated according to Range Analysis and Analytical Hierarchy Process (AHP). The results showed a substantial increase of indoor bacterial and fungal aerosol concentrations, by 294% and 798%, respectively, after ultrasonic humidification; the surged microbes were concentrated in the inhalable ranges. The three factors varied in their effectiveness in mitigating the bioaerosol exposure during humidification, which was ranked by AHP as: humidifier water quality (45%)> target relative humidity (44%)>window opening (11%). To minimize the exposure risks, distilled water and a medium humidification level (such as RH=55%) should be prioritized for ultrasonic humidification, while the effect of window opening degrees is relatively insensitive.
ultrasonic humidification;bioaerosol;indoor air;orthogonal experiment;optimization
X513,X172
A
1000-6923(2022)04-1594-07
陈露安(1996-),女,浙江台州人,东华大学硕士研究生,主要从事室内空气品质研究.发表论文2篇.
2021-09-22
国家自然科学基金资助项目(52008078);上海市科技英才扬帆计划项目(19YF1401800)
*责任作者, 副教授, ziliy@dhu.edu.cn

