基于EEMs和DOM分离的荧光特征及DBPsFP研究——以南方某市水源水为例
蔡力童,李青松,2*,马晓雁,李国新,陈国元,王吉苹,赖成然,梁馨蕊
基于EEMs和DOM分离的荧光特征及DBPsFP研究——以南方某市水源水为例
蔡力童1,李青松1,2*,马晓雁3,李国新1,陈国元1,王吉苹1,赖成然1,梁馨蕊1
(1.厦门理工学院水资源环境研究所,福建 厦门 361024;2.厦门理工学院,厦门市水资源利用与保护重点实验室,福建 厦门 361024;3.浙江工业大学土木工程学院,浙江 杭州 310014)
以南方某市饮用水源地源水为研究对象,利用三维荧光-区域积分法(3D-EEMs-FRI)和DAX-8树脂富集分离技术,研究了水样各组分的溶解性有机物(DOM)组成特征、三维荧光光谱(3D-EEMs)特征;采用生成潜能测试,考察了典型消毒副产物三卤甲烷(THMs)和卤代乙酰胺(HAcAms)生成势以及其与水质指标和荧光强度之间的相关性.结果表明:DOM中疏水性有机物(以UV254表征)的比例超过70%.HOB(疏水碱性物质)组分主要含有酪氨酸类蛋白质和色氨酸类蛋白质,而HOA(疏水酸性物质)和HIS(亲水性物质)组分相对于HOB组分则含有较多的紫外区类富里酸.调查水样HOA、HOB、HON和HIS组分的三卤甲烷生成势(THMsFP)分别为151.5~194.1,60.6~65,123.4~189.9和104.1~187.1μg/L,而卤代乙酰胺生成势(HAcAmsFP)分别为2.7~3.7,n.d.~0.1,1.3~3.9和2.2~8.4μg/L,THMs和HAcAms前体物在HOA、HON和HIS组分中的分布比较均匀.UV254(2为0.93)、腐殖化指数(HIX)(2为0.59)与THMsFP有良好的线性关系,可作为预测组分间THMsFP的指标.UV260(2为0.80)、溶解性有机氮(DON)(2为0.74)与HAcAmsFP有较强的线性关系,可作为预测HAcAmsFP的参数.Pearson相关性分析显示,类富里酸物质区域(III、V)与THMsFP显著相关,该类物质为组分间THMs的重要前体物.荧光的区域积分可以有效预测组分间THMs和HAcAms的生成势.
溶解性有机物;HAcAms前体物;三维荧光光谱;荧光区域积分;消毒副产物生成势
原水中的天然有机物(NOM)是消毒副产物的重要前体物[1].净水工艺中NOM会与含氯消毒剂反应,生成一系列具有“三致”作用的消毒副产物(DBPs),如三卤甲烷(THMs)、卤乙酸(HAAs)等含碳消毒副产物(C-DBPs)和卤乙腈(HANs)、卤代乙酰胺(HAcAms)、二甲基亚硝胺(NDMA)等含氮消毒副产物(N-DBPs).THMs、HAcAms分别为典型的C-DBPs和非受管控的N-DBPs.THMs、HAcAms的前体物分别为水中含有的NOM和溶解性有机氮(DON).为了进一步探究溶解性有机物(DOM)与DBPs间的联系,研究者往往通过分子量大小、极性等特性对DOM进行组分分离,确定各组分对DBPs的贡献[2].
目前DBPs检测的方法主要集中在气相色谱(GC)等化学检测手段,并常与液液萃取等前处理技术相结合.但这些检测法操作复杂、成本较高,因此亟需寻找便捷的水质指标预测消毒副产物前体物浓度,完成对消毒副产物前体物的追踪.随着荧光光谱技术的不断发展,三维荧光光谱(3D-EEMs)可以快速、高效的记录水体或土壤DOM的结构和浓度信息[3-4].DOM的3D-EEMs-FRI(三维荧光-区域积分法)[5]可以克服传统寻峰法的缺点,被广泛用于定量分析3D-EEMs及解析DOM的组成和结构,该方法对于消毒副产物前体物的识别和追踪有着重要意义.
目前,对于水样中不同DOM组分与DBPs的联系尚不明确,对于水体中DBPs生成势的研究大多数集中在各个DOM组分的DBPs贡献和3D-EEMs表征[6],鲜有学者研究DOM组分的DBPs生成势与3D-EEMs、水质理化指标的联系.本文通过DOM分离和3D-EEMs-FRI,考察了南方某3个水库中DOM的组成,研究了其各组分的荧光光谱特征,确定了4种THMs和3种HAcAms的生成潜能及主要前体物,揭示了疏水酸性物质(HOA)、疏水碱性物质(HOB)和亲水性物质(HIS)组分间的DBPs生成势与3D-EEMs、相关水质指标间的关系,为揭示前体物与DBPs生成潜能的联系以及有效控制氯、氯胺消毒过程中C-DBPs和N-DBPs的生成提供理论依据.
1 材料与方法
1.1 水样
所用水样于2021年5月上旬分别取自水源地的S1水库(LH)、S2水库(BT)和S3水库(TX).其中S1水库为新建水源地,与S2、S3水库一同作为南方某市重要的饮用水源.水样采集后用棕色玻璃瓶运回实验室,经0.45μm玻璃纤维滤膜过滤后放置于4℃环境保存,并尽快进行水质参数的分析测定.溶解有机氮(DON)采用差量法[7]进行测定,即DON=TDN-NH4+-NO2--NO3-(由于采用玻璃纤维膜过滤,可视TN为TDN).总氮(TN)采用TOC-VCPH岛津TOC测定仪结合TNM-1单元测量,对于各组分的TN、NH4+-N、NO2--N、NO3--N均采用国家水质检测标准方法测定.
1.2 仪器与试剂
仪器:总有机碳分析仪(TOC-VCPH,日本岛津),总氮测定单元(TNM-1,日本岛津),气相色谱-质谱联用仪(GCMS-QP2010,日本岛津),顶空自动进样器(AOC-5000,日本岛津),气相色谱(GC-2010Plus,日本岛津),三维荧光光谱仪(HORIBA Aqualog®,美国),多参数水质分析仪(厦门斯坦道STD-9200,中国),旋转蒸发仪(上海亚荣RE-52A,中国),纯水机(Milipore,美国),蠕动泵(保定雷弗YZ15,中国),pH计(Eutevch,美国).
试剂药品及耗材:DAX-8树脂(Amberlite,美国),THMs混标样品(三氯甲烷(TCM)、一溴二氯甲烷(BDCM)、二溴一氯甲烷(DBCM)和三溴甲烷(TBM),中国计量院),二溴乙酰胺(DBAcAm)、2,2-二氯乙酰胺(DCAcAm)和三氯乙酰胺(TCAcAm)均购自广州佳途科技股份有限公司(CATO),玻璃纤维微滤膜(<0.45μm),甲醇、甲基叔丁基醚(MTBE) (GC级,CNW),次氯酸钠(CP,活性氯³5.2%), Na2S2O3·5H2O、抗坏血酸、NH4Cl、HCl和NaOH均为分析纯,实验室用水均为Mili-Q超纯水(£18.2MΩ).
1.3 仪器分析条件
THMs:液液萃取-气相色谱法,参照文献方法[2],以MTBE萃取.检测仪器为GC-MS(QP2010,日本岛津),色谱柱为RIX-5MS毛细管柱(30.0m×0.25mm, 0.25μm).检测条件高纯氦气,进样口温度160℃,检测器280℃,离子源为电子轰击离子源(EI),检测模式为选择离子检测(SIM).升温程序为35℃保持3min,然后以30℃/min升温至110℃并保持3min.
DBAcAm、DCAcAm、TCAcAm:液液萃取-气相色谱法,以MTBE萃取.检测仪器为GC(2010Plus,日本岛津),ECD检测器,色谱柱为HP-5毛细管柱(30.0m×0.25mm,0.25μm).检测条件高纯氮气,进样口温度220℃,检测器290℃.升温程序为45℃保持2min,然后以17℃/min升温至220℃并保持1min.
1.4 有机物的树脂吸附与分离
采用填充DAX-8树脂的玻璃层析柱对DOM的亲、疏水组分进行分离,参照文献方法[8],水样中DOM分离成亲水性物质(HIS)、疏水酸性物质(HOA)、疏水碱性物质(HOB)、疏水中性物质(HON)等4个组分.最终将所得组分稀释至与初始DOM相同的体积,并使用NaOH或HCl溶液将pH值调至(7.0±0.1).之后测定相关水质指标并进行后续实验.考虑到HON组分中所含的甲醇可能会干扰荧光,本研究未对该组分的荧光性质进行分析.
1.5 三维荧光光谱分析及数据处理
荧光光谱采用HORIBA Aqualog荧光光谱仪测定,激发光源为150W氙灯.激发波长(x)范围220~450nm,间隔2nm.发射波长(m)范围280~550nm,间隔2nm,狭缝5nm,扫描速度1200nm/min.采用Matlab2017去除一、二级拉曼散射和瑞利散射,并进行插值和内率校正.根据Chen等[5]提出的荧光区域积分法(FRI),将荧光区域按照不同范围的激发、发射波长划分为5个部分,分别为:代表酪氨酸类蛋白的区域I (x=220~250nm/m=280~330nm)、代表色氨酸类蛋白的区域II(x=220~250nm/m=330~380nm)、代表紫外区类富里酸的区域III(x=220~250nm/m=380~550nm)、代表溶解性微生物代谢副产物的区域IV(x=250~450nm/m=280~380nm)以及代表可见区类富里酸的区域V(x=250~450nm/m=380~550nm).荧光指数(FI)[9]、生物指数(BIX)[10]通常用于表征DOM的来源,而腐殖化指数(HIX)[11]用于表征DOM的腐殖化程度.此外,使用Origin软件将这5个区域分别计算对应波长范围内的区域积分,并利用R软件完成相关数据分析.
1.6 氯、氯胺化生成潜能测试
氯化THMs生成潜能测试[2]:取200mL水样,放入磨口棕色玻璃瓶中,将水样的pH值调至(7.0±0.1).取4mL磷酸盐缓冲溶液(pH=7)加入200mL水样中.向水样中加入NaClO溶液(³20mg/L).控制温度在20℃,避光条件下反应72h.反应72h后用过量抗坏血酸终止反应,对THMsFP(4种THMs)进行测定.
氯胺化HAcAms生成潜能测试[12]:水样的处理方法同氯化THMs生成潜能测试实验.不同的是消毒剂为NH2Cl溶液(³20mg/L).控制温度在20℃,避光反应.7d后用过量NH4Cl溶液终止反应,对HAcAmsFP(3种HAcAms)进行测定.
2 结果与讨论
2.1 水库源水中DOM的组成特性
源水中DOM树脂分离组分HOA、HOB、HON和HIS的UV254比例如图1所示,可以看出,S1水库(LH)水样中不同组分的UV254含量大小顺序为HOA> HON>HIS>HOB,所占比例依次为45%,26%,25%和4%;S2水库(BT)水样中的HOA组分的UV254含量大小顺序为HOA>HIS>HON>HOB,所占比例依次为36%,30%,28%和6%;S3水库(TX)水样中的HOA组分的UV254含量大小顺序与S1水库一致,所占比例依次为36%,32%,21%和11%.3个调查水样中HOA、HON和HIS在源水UV254中占89%以上,而HOB含量小于水源水UV254的11%.此外,调查水样HOA、HON和HOB在源水UV254中占70%以上,表明水库水源的水质较好[13].水样HIS组分UV254含量(21%~30%)低于丹江口水库源水在该组分的UV254含量[14].

图1 水库源水各组分所占的UV254比例
2.2 DOM中各组分的荧光光谱特征
由图2可知,荧光峰主要分布在5个区域,荧光中心I区:x/m=220nm/308nm和220nm/325nm附近、II区:x/m=220nm/364nm附近、III区:x/m= 224nm/396nm和224nm/410nm附近、IV区:x/m= 270nm/322nm附近、V区:x/m=310nm/396nm附近.根据荧光峰位和先前的研究[15]可知,I、II和IV区的荧光物质和类蛋白物质相关,III、V区的荧光物质和类腐殖质相关.各水样HOB的主要荧光发光区域为酪氨酸类蛋白区(I区)和色氨酸类蛋白区(II区),表明该组分以类蛋白质(氨基酸)为主要成分.各水样DOM组分HOA和HIS的3D-EEM相似,主要集中于酪氨酸类蛋白区(I区)、色氨酸类蛋白区(II区)和紫外区类富里酸区(III区),且在可溶性微生物代谢物区(IV区)和可见区类富里酸区域(V区)均有微弱的荧光信号,表明HOA和HIS组分比HOB组分含有更多的紫外区类富里酸(III区).所研究水样的HOA、HOB、HIS组分中,均发现有大量类蛋白质(氨基酸),且HOB组分几乎不含有可见区类富里酸物质,这一点可与表1互相印证.
2.3 DOM组分对THMs、HAcAms生成势贡献
由图4可以看出,调查水样DOM分离组分氯消毒生成的THMs有TCM、BDCM、DBCM和TBM,其中TCM为主要产物,其次为BDCM和DBCM. HOA、HOB、HON和HIS组分的THMsFP分别为151.5~194.1,60.6~65,123.4~189.9和104.1~187.1μg/ L,相应组分生成的TCM分别占总THMs的80.2%~84.9%,78.3%~84.9%,99.7%~100.0%和75.4%~82.9%.调查水样DOM分离组分氯胺消毒生成的HAcAms有DCAcAm和TCAcAm,其中TCAcAm为主要产物,但各组分均未检出DBAcAm,这与Chu等[18]发现水厂出水的HAcAms中的DCAcAm含量最高不同.HOA、HOB、HON和HIS组分的HAcAmsFP分别为2.7~3.7,n.d.~0.1,1.3~3.9和2.2~8.4μg/L.


表1 各组分DOM三维荧光光谱区域积分分析
实验表明HOA、HON和HIS组分为THMs和HAcAms的主要前体物,这与王志康等[6]在阿哈水库源水中发现HOA、HON组分有较高的C-DBPs生成潜能类似.所研究水样HOA、HON和HIS组分在氯、氯胺消毒消毒过程中生成大量的THMs和HAcAms,可能是因为DOM中的类腐殖质、芳香族类蛋白质和可溶性微生物代谢物是氯、氯胺消毒副产物的主要前体物[2].从表1可以看出,尽管组分HOB中含有大量类蛋白质,但其III区的类腐殖质含量较少,而类腐殖质具有较强芳香性的电子受体基团[19-20],是最重要的THMs前体物,导致HOB组分生成的THMsFP均小于HOA、HON和HIS组分.

图3 各组分荧光指标分布的雷达图
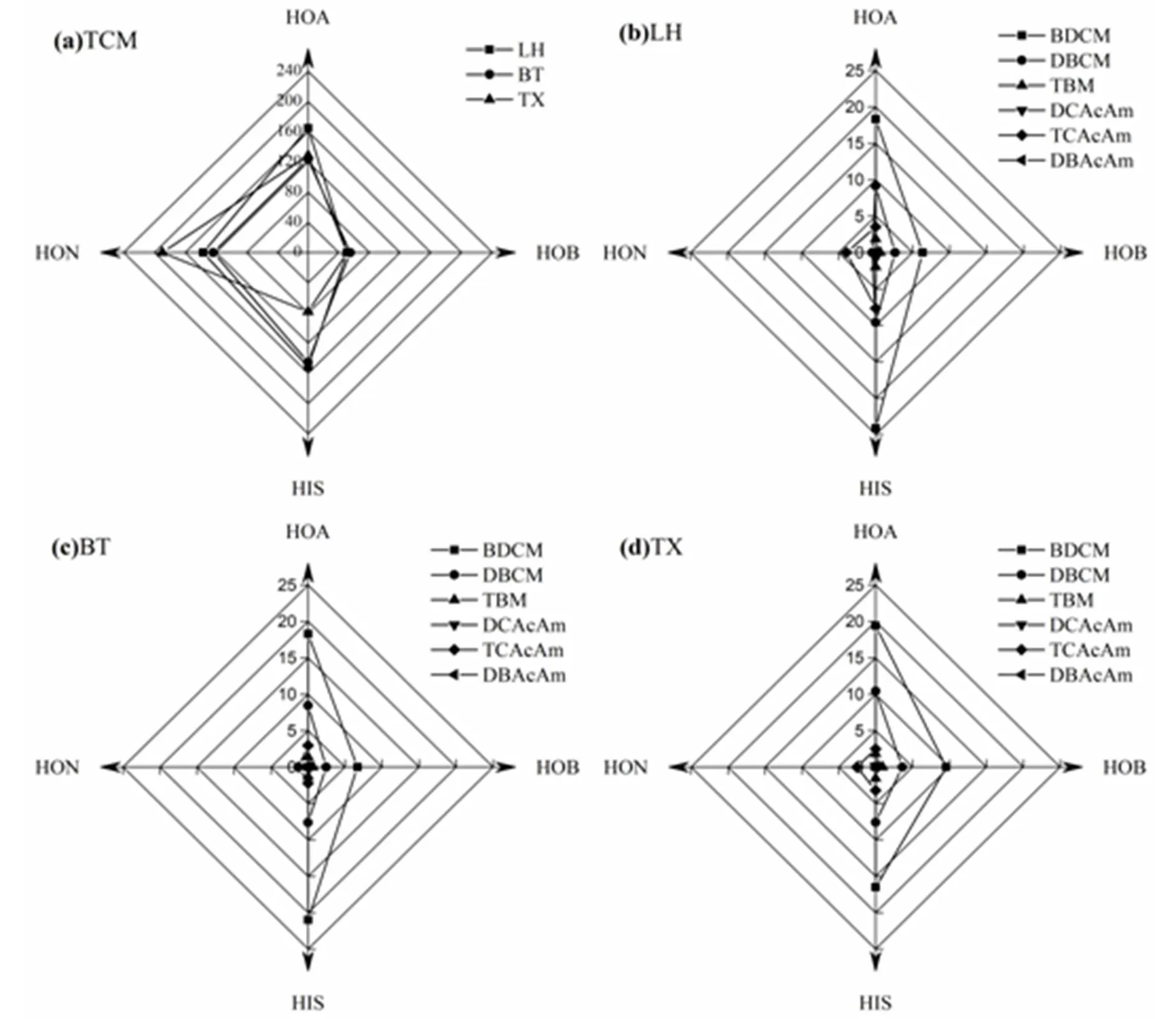
图4 各组分消毒副产物生成势分布的雷达图
2.4 THMs、HAcAms生成势与相关水质指标的关系
如图5所示,THMsFP、TCM、BDCM、DBCM、TBM与UV254的2分别为0.93、0.92、0.07、0.01和0.07,其中THMsFP、TCM 和UV254的相关性显著(2>0.9),UV254反映水体中天然存在C=C双键和C=O双键的芳香族化合物的含量,表明DOM各组分间芳香族化合物和腐殖类大分子在氯消毒的过程中倾向形成TCM,即UV254可以作为预测DOM组分氯化生成THMsFP和TCM浓度的替代参数.各组分THMs和HIX之间相关性,表明DBCM、TBM的生成潜能与HIX显著相关(2>0.8),且THMsFP、TCM和BDCM的生成潜能与HIX有较好相关性(2=0.54~0.68),表明随着DOM的腐殖化程度升高,组分中的有机质越容易生成THMs.

研究中发现DOM不同组分的HAcAmsFP、DCAcAm和TCAcAm与UV260均呈较强的相关性(2>0.7),2分别为0.80、0.78和0.76,因此UV260可以反映HAcAms的前体物特征[21],即UV260可以作为不同组分HAcAmsFP的预测指标.通常利用DON预测NDMA等N-DBPs的生成潜能[22].本研究发现不同组分生成的HAcAmsFP、DCAcAm和TCAcAm与DON均有较强的相关性(2>0.6),即DON是HAcAms的重要前体物,这与李冕等[23]的结论类似.有研究表明HAcAms前体物主要为非芳香族和氮芳族化合物[24],但本研究发现某些未检出DON的组分也会生成HAcAms,这可能与某些非含氮前体物在氯胺的作用下转化为N-DBPs有关[25].
2.5 THMs、HAcAms生成势与DOM浓度的关系
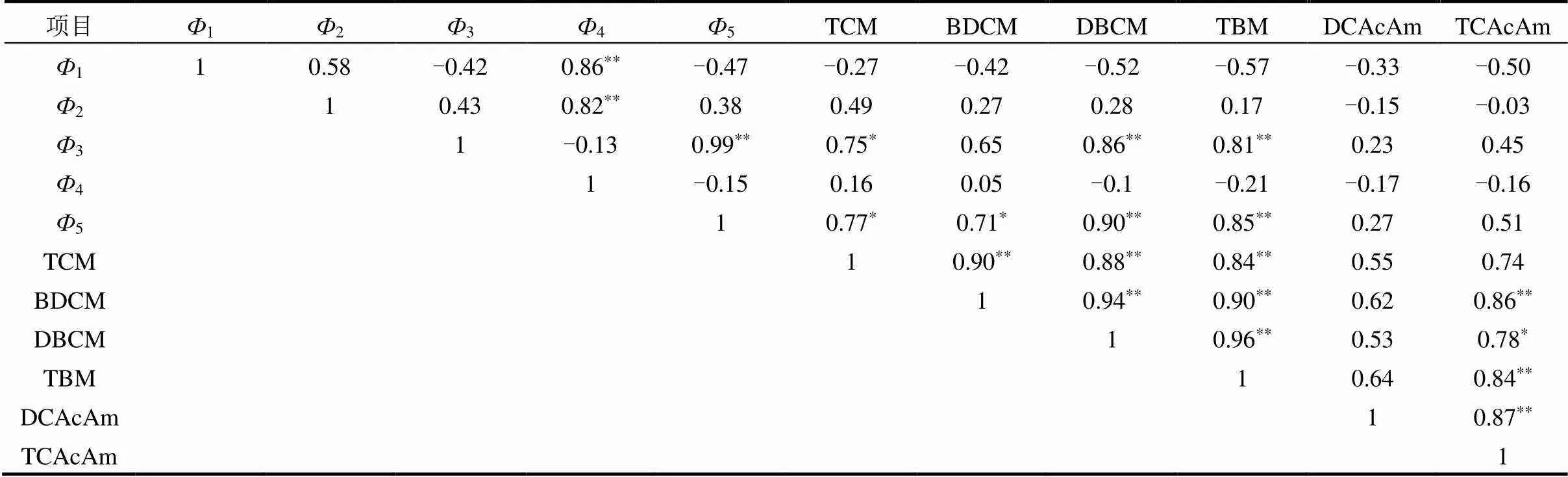
表2 消毒副产物生成势与DOM浓度Pearson 相关性
注:**表示极显著相关(<0.01,双尾检验),*表示显著相关(<0.05,双尾检验).
由表2可知,结果表明DOM中III区和V区类富里酸与THMsFP,尤其是TCM、DBCM和TBM呈现显著相关,这可能是由于III、V区类富里酸含有较多的恰好是THMs主要前体物的芳香类物质[26].实验中DOM不同组分1、2与4的相关性显著,表明研究水样的类蛋白质(氨基酸)组分和可溶性微生物代谢副产物之间具有同源性.3与5的相关性极显著,表明DOM同一组分中两种类富里酸物质浓度呈现同步变化趋势.
TCM、BDCM、DBCM和TBM的生成潜能之间、DCAcAm和TCAcAm的生成潜能之间显著相关,表明其(THMs或HAcAms)前体物具有同源性,这可能与Chu等[27]发现HAcAms的前体物源于游离的氨基酸和低聚肽相关.值得注意的是THMsFP较高的组分同样具有较高的HAcAmsFP,且THMsFP和HAcAmsFP相对均匀的分布在3个组分中(HOA、HON和HIS).为了采用荧光区域积分预测DOM不同组分DBPs的生成潜能,对4种THMs、2种HAcAms和5个荧光区域的积分进行多元线性回归拟合(表3),结果表明多元线性回归关系良好(2>0.89).在实际的水源水污染控制中,可以用荧光的区域积分预测组分间氯、氯胺化生成潜能测试后的DBPs生成势.

表3 消毒副产物生成势与荧光区域积分的线性回归关系
注:均为9.
3 结论
3.1 源水中HOA组分含量最高,HOB组分含量最低.疏水性有机物组分含量(以UV254表征)超过70%.DOM中HOB组分主要含有酪氨酸类蛋白质和色氨酸类蛋白质,而HOA和HIS组分相比HOB组分含有较多的紫外区类富里酸.
3.2 调查水样HOA、HOB、HON和HIS组分的THMsFP分别为151.5~194.1,60.6~65,123.4~189.9和104.1~187.1μg/L,而卤代乙酰胺生成势(HAcAmsFP)分别为2.7~3.7,n.d.~0.1,1.3~3.9和2.2~8.4μg/L,HOA、HON和HIS组分是THMs和HAcAms的主要前体物.
3.3 UV254、HIX与THMsFP有良好的线性关系,可作为预测组分间THMsFP的指标.UV260、DON与HAcAmsFP有较强的线性关系,可作为预测HAcAmsFP的参数.类富里酸物质区域与THMsFP显著相关,该类物质为组分间THMs的重要前体物.可以拟合出i与DBPs生成潜能的方程,用荧光的区域积分预测组分间消毒副产物的生成势.
[1] Chu W, Gao N, Krasner S W, et al. Formation of halogenated C-, N-DBPs from chlor(am)ination and UV irradiation of tyrosine in drinking water [J]. Environmental Pollution, 2012,161:8-14.
[2] 孙迎雪,吴乾元,田 杰,等.污水中溶解性有机物组分特性及其氯消毒副产物生成潜能[J]. 环境科学, 2009,30(8):2282-2287.
Sun Y X, Wu Q Y, Tian J, et al. Characteristics and chlorinated disinfection by-products formation potential of dissolved organic matter fractions in treated wastewater [J]. Environmental Science, 2009,30(8):2282-2287.
[3] 秦纪洪,王 姝,刘 琛,等.海拔梯度上川西高山土壤溶解性有机质(DOM)光谱特征 [J]. 中国环境科学, 2019,39(10):4321-4328.
Qin J H, Wang S, Liu C, et al. Spectroscopic characteristics of soil dissolved organic matter(DOM) along the altitudinal gradient of alpine in western Sichuan [J]. China Environmental Science, 2019,39(10): 4321-4328.
[4] 张思宇,岳正波,佘智祥,等.某酸性矿山排水中溶解性有机物的特征分析 [J]. 中国环境科学, 2020,40(8):3401-3407.
Zhang S Y, Yue Z B, She Z X, et al. Characteristics analysis of dissolved organic matter in the acid mine drainage [J]. China Environmental Science, 2020,40(8):3401-3407.
[5] Chen W, Paul W, Jerry L, et al. Fluorescence excitation - emission matrix regional integration to quantify spectra for dissolved organic matter [J]. Environmental Science & Technology, 2003,37(24):5701- 5710.
[6] 王志康,韩 月,苟 攀,等.阿哈水库DOM的分离及其对消毒副产物的贡献[J]. 环境科学研究, 2018,31(6):1088-1095.
Wang Z K, Han Y, Gou P, et al. The fraction of DOM and their contribution to the disinfection by-products formation: a case study in Aha Reservoir [J]. Research of Environmental Sciences, 2018, 31(6):1088-1095.
[7] 李 伟,徐 斌,夏圣骥,等.DON的水处理特性及生成NDMA潜能的分析[J]. 中国给水排水, 2009,25(17):35-38.
Li W, Xu B, Xia S J, et al. Characteristics of DON and NDMA formation potential in water treatment [J]. China Water & Wastewater, 2009,25(17):35-38.
[8] Xiao K, Han B, Sun J, et al. Stokes shift and specific fluorescence as potential indicators of organic matter hydrophobicity and molecular weight in membrane bioreactors [J]. Environmental Science and Technology, 2019,53(15):8985-8993.
[9] Lavonen E E, Kothawala D N, Tranvik L J, et al. Tracking changes in the optical properties and molecular composition of dissolved organic matter during drinking water production [J]. Water Research, 2015,85: 286-294.
[10] Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary [J]. Organic Geochemistry, 2009,40(6):706-719.
[11] 虞敏达,张 慧,何小松,等.河北洨河溶解性有机物光谱学特性[J]. 环境科学, 2015,36(9):3194-3202.
Yu M D, Zhang H, He X S, et al. Spectral characteristic of dissolved organic matter in Xiaohe River, Hebei [J]. Environmental Science, 2015,36(9):3194-3202.
[12] Chu W H, Gao N Y, Yin D Q, et al. Formation and speciation of nine haloacetamides, an emerging class of nitrogenous DBPs, during chlorination or chloramination [J]. Journal of Hazardous Materials, 2013,260:806-812.
[13] Yan M Q, Wang D S, You S J, et al. Enhanced coagulation in a typical North-China water treatment plant [J]. Water Research, 2006,40(19): 3621-3627.
[14] 程 拓,徐 斌,朱贺振,等.南水北调丹江口水库原水有机物分子组成规律及其强化混凝处理的效能对比[J]. 环境科学, 2015,36(3): 898-904.
Cheng T, Xu B, Zhu H Z, et al. Composition of NOM in raw water of Danjiangkou Reservoir of South-to-North Water Diversion Project and comparison of efficacy of enhanced coagulation [J]. Environmental Science, 2015,36(3):898-904.
[15] 吕晶晶,龚为进,窦艳艳,等.PARAFAC和FRI解析ISI中DOM分布[J]. 中国环境科学, 2019,39(5):2039-2047.
Lü J J, Gong W J, Dou Y Y, et al. The distribution of DOM in aeration pretreatment improved soil infiltration system based on FRI and PARAFAC [J]. China Environmental Science, 2019,39(5):2039-2047.
[16] 陈彦洁,崔育倩,李青松,等.厦漳地区原水DOM的3-DEEM-FRI表征与分析研究[J]. 光谱学与光谱分析, 2021,41(2):499-504.
Chen Y J, Cui Y Q, Li Q S, et al. Characterization and analysis of DOM in raw water in Xiamen and Zhangzhou by 3-DEEM-FRI [J]. Spectroscopy and Spectral Analysis, 2021,41(2):499-504.
[17] 周石磊,张艺冉,黄廷林,等.周村水库汛期暴雨中溶解有机物(DOM)的光谱特征及来源解析[J]. 湖泊科学, 2019,31(2):493-506.
Zhou S L, Zhang Y R, Huang T L, et al. Spectral characteristics and sources of rainstorms dissolved organic matter in Zhoucun Reservoir during flood season [J]. Journal of Lake Sciences, 2019,31(2):493- 506.
[18] Chu W, Gao N, Yin D, et al. Trace determination of 13haloacetamides in drinking water using liquid chromatography triple quadrupole mass spectrometry with atmospheric pressure chemical ionization [J]. Journal of Chromatography A, 2012,1235:178-181.
[19] Uyguner C S, Bekbolet M. Evaluation of humic acid photocatalytic degradation by UV-vis and fluorescence spectroscopy [J]. Catalysis Today, 2005,101(3):267-274.
[20] 赵庆良,贾 婷,魏亮亮,等.污水厂二级出水中THMs前体物卤代活性荧光光谱分析 [J]. 中国环境科学, 2009,29(11):1164-1170.
Zhao Q L, Jia T, Wei L L, et al. Fluorescence characterization of the reactivity of THMs precursors in secondary effluent [J]. China Environmental Science, 2009,29(11):1164-1170.
[21] Kosaka K, Iwatani A, Takeichi Y, et al. Removal of haloacetamides and their precursors at water purification plants applying ozone/ biological activated carbon treatment [J]. Chemosphere, 2018,198: 68-74.
[22] 林 琳,徐 斌,覃 操,等.黄浦江原水NDMA前体物的组成规律及其在常规净水工艺中的削减特性[J]. 给水排水, 2013,49(2):61-65.
Lin L, Xu B, Qin C, et al. Composition of NDMA precursors in Huangpu River and its removal characteristics in conventional water treatment processes [J]. Water & Wastewater Engineering, 2013,49(2): 61-65.
[23] 李 冕,徐 斌,夏圣骥,等.含氮消毒副产物卤代酰胺的生成特性与控制研究进展[J]. 中国给水排水, 2011,27(14):31-34.
Li M, Xu B, Xia S J, et al. State-of-the-Art of Formation and control of nitrogenous disinfection by-products:Haloamides [J]. China Water & Wastewater, 2011,27(14):31-34.
[24] Chu W, Krasner S W, Gao N, et al. Contribution of the antibiotic chloramphenicol and its analogues as precursors of dichloroacetamide and other disinfection byproducts in drinking water [J]. Environmental Science & Technology, 2016,50(1):388-396.
[25] Chu W, Li X, Bond T, et al. The formation of haloacetamides and other disinfection by-products from non-nitrogenous low-molecular weight organic acids during chloramination [J]. Chemical Engineering Journal, 2016,285:164-171.
[26] Hua G, Reckhow D A. Characterization of disinfection byproduct precursors based on hydrophobicity and molecular size [J]. Environmental Science & Technology, 2007,41(9):3309-3315.
[27] Chu W, Xin L, Gao N, et al. Peptide bonds affect the formation of haloacetamides, an emerging class of N-DBPs in drinking water: free amino acids versus oligopeptides [J]. Scientific Reports, 2015,5: 14412.
Study on the fluorescence characteristics and DBPsFP based on EEMs and fraction of DOM—— a case of source water in a southern city.
CAI Li-tong1, LI Qing-song1,2*, MA Xiao-yan3, LI Guo-xin1, CHEN Guo-yuan1, WANG Ji-ping1, LAI Cheng-ran1, LIANG Xin-rui1
(1.Water Resource and Environment Institute, Xiamen University of Technology, Xiamen 361024, China;2.Key Laboratory of Water Resources Utilization and Protection of Xiamen, Xiamen University of Technology, Xiamen 361024,China;3.College of Civil Engineering and Architecture, Zhejiang University of Technology, Hangzhou 310014, China)., 2022,42(4):1745~1753
The characteristics of dissolved organic matter(DOM) and three-dimensional fluorescence spectroscopy(3D-EEMs) of each component of source water in South-China reservoir were analyzed by fluorescence regional integration(FRI) and Supelite DAX-8 Macroporous Resin. the relationship between disinfection by-products formation potential, water quality indicators and fluorescence intensity were also determinated. The proportion of hydrophobic substances in the reservoir was more than 70% of UV254. The fraction of HOB(hydrophobic bases) mainly contained tyrosine-like proteins and tryptophan-like proteins, while the fraction of HOA(hydrophobic acids) and HIS(hydrophilic substances) contained more fulvic acid. The trihalomethane formation potentials (THMsFP) of HOA, HOB, HON and HIS fractions were 151.5~194.1μg/L, 60.6~65μg/L, 123.4~189.9μg/L and 104.1~187.1μg/L, respectively, and the haloacetamide formation potential(HAcAmsFP) were 2.7~3.7μg/L, nd~0.1μg/L, 1.3~3.9μg/L and 2.2~8.4μg/L, respectively. The precursors of THMs(trihalomethane) and HAcAms(haloacetamide) were distributed uniformly in HOA, HON and HIS fractions. UV254(2=0.93), HIX(2=0.59) presented a good linear relationship with THMsFP, which can be used as an indicator for predicting THMsFP among fractions. UV260(2=0.80) and DON(2=0.74) showed a relatively good linear relationship with HAcAmsFP, which can be used as the parameters for predicting HAcAmsFP. Pearson correlation analysis manifested that the two humus-like regions(III,V) were significantly correlated with the formation potential of THMs, which meant that these substances were important precursors of THMs of source water in the reservoir. The formation potential of THMs and HAcAms can be predicted by the fluorescence regional integration among the fractions.
dissolved organic matter;HAcAms precursors;three-dimensional fluorescence spectroscopy;fluorescence regional integration;disinfection by-products formation potential
X502,X524
A
1000-6923(2022)04-1745-09
蔡力童(1997-),男,福建福州人,厦门理工学院硕士研究生,主要研究方向为水处理理论与技术.发表论文1篇.
2021-08-25
国家自然科学基金资助项目(51878582,41801219);福建省科技计划引导性资助项目(2021Y0041);福建省自然科学基金资助项目(2020J01256,2019J01849);福建省高校新世纪优秀人才支持计划项目(JA14227)
*责任作者, 研究员, leetsingsong@sina.com

