Mn1-yNiyOx的制备及其催化燃烧甲苯性能的研究
周媛媛,刘 晗,邓 琳*,吴功德,万 杰,王晓丽,胡纯政,于先坤,杨晓军
Mn1-yNiO的制备及其催化燃烧甲苯性能的研究
周媛媛1,2,刘 晗1,邓 琳1*,吴功德2**,万 杰2,王晓丽2,胡纯政3,于先坤4,杨晓军4
(1.东南大学市政工程系,江苏 南京 211189;2.南京工程学院能源研究院,江苏 南京 211167;3.江苏苏北环保集团有限公司,江苏 沭阳 223624;4.中钢集团马鞍山矿山研究总院股份有限公司,安徽 马鞍山 243000)
通过水热共沉淀法制备了Mn1-yNiO复合氧化物催化剂(=0.1~0.5),考察掺杂Ni对Mn基氧化物在甲苯燃烧中的影响,在获得最优锰镍比例后,对其热稳定性与耐久性进行测试,然后通过XRD、N2吸脱附、SEM、H2-TPR以及XPS对其物理结构和氧化还原性能进行表征.结果表明,Mn和Ni在甲苯吸附和活化中产生相互作用,生成更多的Mn4+以及表面吸附氧,提供大量的反应活性位点,增强了催化氧化性能.Mn0.8Ni0.2O在甲苯催化燃烧中表现出的催化性能最好,其热稳定性与耐久性也表现优异,与MnO在甲苯催化燃烧中相比,其50、90分别下降12和11 ℃,在238℃即可将甲苯完全氧化,并且碳平衡值约为99%,无二次污染产生,该研究成果可为挥发性有机化合物(VOCs)催化燃烧提供更好的方式和材料.
甲苯;锰镍催化剂;催化氧化;热稳定性
甲苯是一种典型的VOCs,在热处理、印染、喷涂等工业生产中被大量排放[1],在我国现行的多项标准中一直被列为主要限排对象[2-3],因此常被用作探针因子[4].目前,VOCs的去除方法有生物降解法[5]、光催化降解法[6]、等离子体降解法[7]等,而低温催化燃烧法因其能耗少、效率高、无二次污染等优势,被认为具有广泛的应用前景.在实际催化环境中,由于气体成分复杂,例如甲烷、丙烷等结构稳定的物质存在易造成催化剂床层热值较高[8].因此,良好的低温催化活性以及热稳定性对于催化燃烧VOCs的效果极为关键.
目前,贵金属基材料的催化性能最佳,但价格昂贵、热稳定性较差[9];非贵金属基材料,如Mn[10]、Co[11]、Ce[12]等因拥有多种可变的氧化态,而具有很好的氧储存能力和氧迁移率、其中的Mn氧化物应用范围最广,因为其具有易获得、低成本、抗烧结、高活性等优点.MnO2和Mn2O3等在甲苯低温催化氧化中都表现出较高的活性和稳定性[13].研究表明,通过其它过渡金属掺杂可以改善催化剂表面活性中心分布,调节Mn氧化物的微观结构(如比表面积、结晶度和形貌等),并且能通过金属间的相互作用提高催化活性[1,14-16].近年来,Cu-Mn[14]、Co-Mn[16]和Ce-Mn[12]氧化物催化剂在VOCs催化氧化方面都得到了广泛研究.除此以外,含Ni氧化物也具有较强的催化氧化能力.Lim[17]等制备Co-Ni复合氧化物催化剂用于甲烷氧化,发现mol(Co:Ni)=1:1时催化剂活性最高,Co-Ni复合氧化物的无序结构提高了对甲烷燃烧的催化性能,90达到466℃.Naghel-Danaei等[18]制备一系列双金属LDHs用于甲苯氧化,发现Ni-Al复合催化剂的80为277℃,并且具有较好的热稳定性.目前,关于Ni-Mn复合氧化物催化剂在甲苯等VOCs去除方面的研究较少.
本研究采用水热共沉淀法制备了Ni-Mn复合氧化物催化剂,选取甲苯作为探针分子,考察催化剂对甲苯的催化活性及CO2选择性,并对多种影响因素(Ni-Mn比例、煅烧温度、空速)进行了探究,对效果最优的催化剂进行40h稳定性测试.并通过对催化剂结构和氧化还原性能进行表征,探究Mn与Ni之间的相互作用对催化剂氧化还原能力以及催化活性的影响,以期为VOCs催化燃烧提供更好的方式和材料.
1 材料与方法
1.1 催化剂制备
按比例将4.65mL的50% Mn(NO3)2溶液(0.02mol)和0.02mol Ni(NO3)2×6H2O配成40mL的溶液,保持总阳离子浓度在1mol/L.在持续的搅拌下,将上述溶液与NaOH(1.0mol/L)溶液同时滴加至40mL的Na2CO3(0.05mol/L)溶液中,控制pH值在10左右.滴加完成后,继续搅拌0.5h.随后进行水热处理,将得到的沉淀物与母液置于聚四氟乙烯晶化釜中,密封后在100℃下静态处理24h,再用水和无水乙醇抽滤洗涤数次,并于100℃下烘干.最后将烘干样品置于马弗炉,以10℃/min的速率升温至400℃焙烧4h.取出样品,待其冷却至室温后,研磨并过筛,制得Mn0.5Ni0.5O催化剂.其他Mn1-yNiO(=0.1~0.4)催化剂按计量比依照上述方法制备.其他煅烧温度(500, 600℃)的催化剂制备同上.单独添加9.30mL的50% Mn(NO3)2溶液或0.04mol Ni(NO3)2×6H2O,依照同样方法制备得到MnO和NiO催化剂.MnO/NiO为机械混合催化剂,采用机械混合法将质量比为4:1的MnO与NiO进行混合,均匀研磨.用作对比的商品MnO2为分析纯,国药集团化学试剂有限公司.
1.2 催化剂表征
采用Rigaku-Dmax-rA型固体衍射仪(日本理学公司)进行X射线衍射(XRD)测试.测试过程中使用的技术条件为:铜靶(=1.48nm),管压40kV、管流30mA,扫描范围为7°~70°,扫描速度为10°/min,扫描分辨率为0.02°.
采用Hitachi S-4800型场发射扫描电子显微镜(SEM)(日本日立公司)对催化剂表面形貌进行了观察和分析,加速电场为5kV.
采用Kubo-x-1000型比表面积和孔径分析仪(北京彼奥德公司),使用N2吸附-脱附法检测催化剂比表面积和孔结构.分析前催化剂在300℃下真空抽气2h,以去除催化剂中吸附的水分,避免影响分析结果.
采用FINESORB-3010化学吸附仪(FINETEC公司)进行氢气程序升温还原(H2-TPR)测试,测试样品约100mg,测试前在20℃下,在Ar气氛中预处理20min,再以体积分数为10% H2/Ar的混合气对催化剂进行吹扫,待信号与基线平行后,以10℃/min升温至700℃进行程序升温还原.
采用PHI5000型X射线光电子仪(日本ULVAC-PHI公司)进行X射线光电子能谱(XPS)分析,对催化剂表面的O种类和Mn、Ni价态进行定量及定性分析.
1.3 催化剂活性测试




图1 催化剂活性评价装置
2 结果与讨论
2.1 催化剂活性测试效果
如图2(a)和表1所示,不同催化剂的催化活性由高到低依次为:Mn0.8Ni0.2O>Mn0.9Ni0.1O>Mn0.7Ni0.3O> Mn0.6Ni0.4O>MnO>Mn0.5Ni0.5O>NiO.随着Ni含量的增加(0.1££0.5),催化活性先升高后开始降低,当=0.2时,Mn0.8Ni0.2O表现出最低的50、90,分别为231和238 ℃;当=0.5时,Mn0.5Ni0.5O的催化活性比MnO更差.结合表1,各催化剂在240 ℃时的甲苯与CO2产率,Mn0.8Ni0.2O均是最优,达到99%与98%以上.这说明在Mn基氧化物中掺杂适量的Ni(0.1££0.4)可以提高其催化活性 ,但若掺杂的Ni过量,对催化活性则有所抑制.而NiO的催化活性明显远低于MnO,50已超过300 ℃.MnO与NiO按4:1机械混合后的催化剂,催化活性大幅下降,说明Ni-Mn复合氧化物催化活性的提高,不是两种金属活性的叠加,而是依赖于Mn-Ni间的强相互作用.如图2(b),催化剂的CO2产率与甲苯成正比,表现出最优活性的Mn0.8Ni0.2O催化剂CO2产率也最快达到90%.

根据规范[19],催化燃烧法治理工业有机废气时,催化燃烧装置的设计空速宜在10000~40000h−1之间,为探究催化剂的有效工作范围,研究了空速(WHSV)对催化剂活性的影响(图3a).Mn0.8Ni0.2O的催化活性随WHSV的降低而增加,当WHSV从40000h−1降到30000h−1,50和90分别由231和238 ℃下降为228和236℃.当WHSV降至20000h−1时,甲苯转化率50和90分别降至223和228℃(表2).结果表明,降低空速、增加催化剂与反应气体的接触时间可以提高催化剂的催化性能.

表1 在240 ℃时各催化剂的甲苯转化率及CO2产率
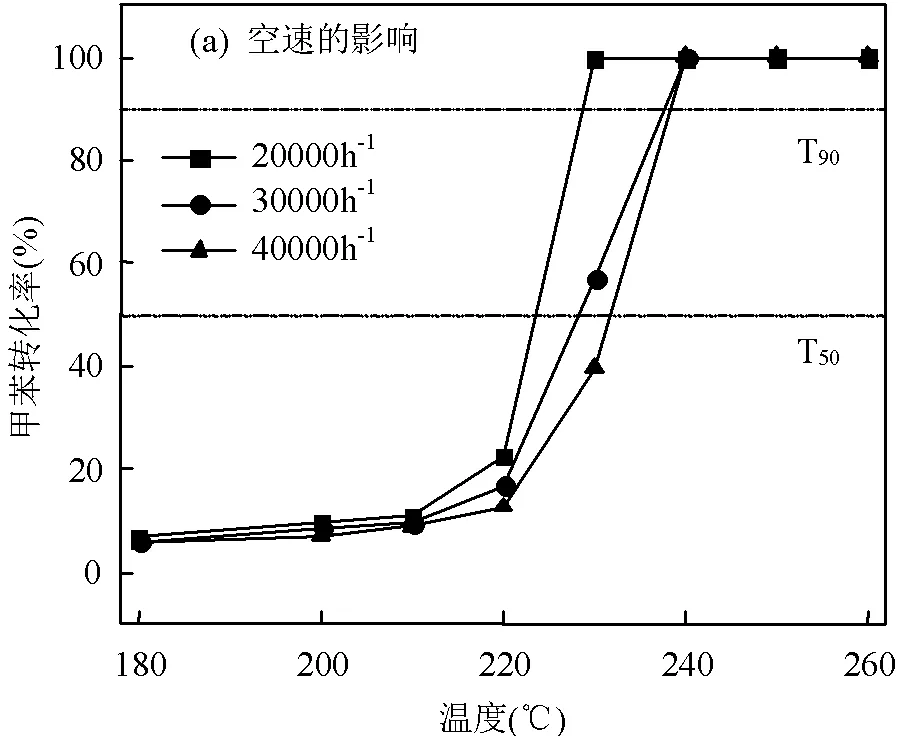
催化剂的热稳定性和耐水性也是衡量其综合性能的重要指标[20],因此,设计实验研究了煅烧温度对Mn0.8Ni0.2O催化性能和40h稳定性的影响,根据规范[19],催化燃烧法处理工业废气时,催化剂的工作温度应低于700℃,故选择400~700℃作为研究范围.如图3(b)所示,随着煅烧温度的升高,催化性能显著下降,但在所有煅烧温度下,Mn0.8Ni0.2O催化剂的90均小于300℃,体现了良好的热稳定性.图3(c)为稳定性测试,可以看出Mn0.8Ni0.2O催化剂的甲苯均保持在98%以上,40h没有观察到明显失活的现象,CO2产率维持在95%~97%,这表明Mn0.8Ni0.2O催化剂具有较好的耐久性.同时,根据产物CO2产率和甲苯,确定了本催化剂的碳平衡值约为99%,说明具有良好的完全氧化产物CO2选择性,无二次污染.通常工业VOCs中含有水.因此,在240℃条件下,对Mn0.8Ni0.2O催化剂进行了H2O(5vol.%)稳定性试验(图3d).结果显示,在加入5vol.% H2O后,甲苯在5h后下降至40%左右.从进气中去除水蒸气后,甲苯又恢复至原本的97%.这表明,水蒸气对于Mn0.8Ni0.2O催化剂具有负面影响,这可能是因为水蒸气吸附于催化剂表面占据了部分活性位点,降低了催化活性,而这种影响随着水蒸气的去除是可逆的.
2.2 催化剂物理结构表征
2.2.1 XRD表征 如图4(g),在2θ=18°、28.9°、32.3°、36.4°和65.4°处有明显的衍射峰,归属于Mn3O4的特征峰(JCPDS No.24-0734),说明MnO表现出四方相Mn3O4的物相结构.Mn1-yNiO样品与MnO不同,图4(b)-(f)在36.5°、38.1°、53.8°和65.7°处有明显的衍射峰,归属于六方相MnO2的特征峰(JCPDS No.30-0820),并且未观察到额外的NiO晶相,这是因为Ni高度分散在MnO2晶格中,形成了MnNi固溶体,故只表现出一种MnO2的晶型.与其他Mn/Ni比例的样品相比,Mn0.8Ni0.2O样品的峰强度较弱,说明按此比例掺杂后MnO2结晶度较低,形成更小的晶体.此外,Ni的掺杂使Mn的价态较MnO有所升高,从而促进对甲苯的催化氧化性能[21-22].为探究MnO2晶相在Mn1-yNiO催化甲苯中的作用,本文在同等测试条件下,检测了纯MnO2的催化活性(图2a).结果表明,纯MnO2的催化性能没有Ni-Mn复合氧化物好,这说明在催化甲苯过程中,不仅需要单一Mn4+作为氧化剂,也需要Mn的其他价态存在,使催化剂表面具有丰富的氧空位与不饱和化学键,才有利于催化反应的进行.
2.2.2 BET表征 如表2与图5所示,Mn1-yNiO与NiO催化剂的N2吸附-脱附等温线与IUPAC分类的H3型滞后环的IV型相似,表明Ni-Mn复合氧化物具有由聚合物片状颗粒形成的狭缝状介孔结构[21].Mn0.9Ni0.1O,Mn0.8Ni0.2O,Mn0.7Ni0.3O, Mn0.6Ni0.4O和Mn0.5Ni0.5O的比表面积分别为35.45,45.21,40.57,47.76和40.23m2/g,相应的总孔隙体积分别为0.38,0.39,0.39,0.41和0.34cm3/g,都明显高于MnO.掺杂Ni的样品的平均孔隙尺寸大约在18.51nm,略大于MnO(17.75nm).这说明Ni掺杂对Mn基氧化物的结构有明显的影响,在MnO骨架中适量引入Ni原子可增加其表面积,为甲苯的吸附和氧化提供更多的活性位点,提高催化活性[21].但Mn0.6Ni0.4O催化剂的比表面积最大,而催化活性却不及Mn0.8Ni0.2O,说明其相对较小孔径不利于催化活性的提升.

图4 催化剂XRD图谱

表2 催化剂的结构特性及对甲苯的催化活性

图5 催化剂的N2吸脱附等温线

2.2.3 SEM表征 如图6(a)所示,单金属氧化物NiO由无固定形貌的片状结晶结构组成,MnO(图6b)由细小颗粒堆叠组成,结晶较弱;掺杂Ni后, Mn0.8Ni0.2O(图6c)的形貌发生变化,呈现出与前两者不同的规则六边形片状结构.在片状晶粒的表面还附着球状颗粒,与MnO颗粒形貌类似,这可能是催化剂合成中过量的Mnx+形成了MnO,负载在Mn0.8Ni0.2O表面[1];此外,片状结构中存在明显孔隙,这可能是负载于表面的MnO颗粒较大,造成中心凹陷.结合表2,可以看出因为Ni金属的掺杂,催化剂晶粒变大,但随着Ni掺杂量的增加,晶粒粒径减小,且活性降低,这可能是由于Ni的活性低于Mn,而过量的Ni在与Mn形成MnNi固溶体之外,形成NiO附着在表面,占据Mn的活性位点,使催化性能下降.
2.3 催化剂氧化还原性能分析

图7 催化剂的H2-TPR谱图
2.3.1 H2-TPR 由图7可以看出,MnO在低温区(200~500℃)有两个强烈的还原峰:250~330℃的峰对应于MnO2被H2还原为Mn3O4,330~500℃的峰对应于Mn3O4被还原为MnO[23].掺杂Ni后, Mn1-yNiOx在高温区(500~700℃)新出现一个还原峰,根据文献[24],这是与Mn相互作用的NiO的还原峰,验证了MnNi固溶体的存在.与MnO相比,Mn1-yNiO样品在低温区的峰强度有所增强,峰展更宽,峰面积扩大,耗氢量也明显增加(表2),说明Ni的掺杂促进了氧在低温区的迁移率,并使Mn4+和Mn3+增多,与XRD结果相吻合.这一现象与Mn-Ni之间的电子相互作用有关,由于两者电负性的差异,Mn的电子云会向临近的Ni偏移,从而使部分Ni处于较低的Ni2+价态,而Mn自身则处于高价的Mn4+,使得Mn的总体价态提升[25]. Mn0.8Ni0.2O在低温区有较大的还原峰面积,且高温区的还原峰温度较低(553℃),表明Mn0.8Ni0.2O具有良好的氧化还原能力.

图8 催化剂的XPS谱图

表3 各类催化剂对甲苯催化氧化性能
2.3.2 XPS 如XPS图谱所示(图8a),可以观察到对应于Mn、O和C物种的峰.在Ni掺杂后, Mn0.8Ni0.2O图谱中853.6eV附近明显存在Ni 2p的附加峰,意味着Ni结合到MnO基质中.如Ni 2p (图8b)的图谱所示,853.6eV处的主峰伴随着861.4eV处的宽卫星峰以及871.5eV处的主峰和879.13eV处的宽卫星对应于Ni2+[21,26],而在858.8V处的强峰对应于Ni3+,Ni2+/Ni3+比率约为1.42,表明催化剂中掺杂的Ni主要以Ni2+状态存在.Mn 2p3/2的XPS光谱如图8c所示,可以看出光谱可拟合为3个峰,640.6、641.6和642.7eV分别对应于Mn2+、Mn3+和Mn4+[13,27].与MnO样品相比,Mn0.8Ni0.2O的Mn4+物种的结合能向更高值方向移动,意味着Mn与掺杂金属Ni之间的强相互作用[26].并且,Mn0.8Ni0.2O的Mn4+的峰面积有所增加,而Mn3+的峰面积显著下降,表面Mn4+/(Mn2++Mn3++Mn4+)的比值为0.32,远大于MnO(0.16),说明Ni的掺杂使部分Mn3+向Mn4+发生转化,Mn4+含量增多,可提供大量的反应活性位点,导致催化活性提高,这也与之前XRD测试结果一致.此外,O 1s光谱经过分峰拟合后存在3个峰(图8d),分别位于528、531和532eV左右.528.5eV处的强峰对应于晶格氧O2-(表示为Oα)[22,28].结合能较高的2个肩峰(530.6~532.5eV)对应于如O2-、O-、OH-等表面吸附氧(表示为Oβ).根据文献[27,29],约532eV的峰值与表面吸附的OH-有关,而531eV附近的峰值对应于吸附在氧空位上有缺陷的氧化物或表面氧离子(O2-、O-).Ni掺杂后,表面吸附氧含量明显增加,MnO与Mn0.8Ni0.2O的Oβ/Oα的摩尔比分别为0.43和0.60.这可能是由于Ni2+掺杂到MnO中,导致MnO表面电荷不平衡,出现更多的氧空位和不饱和化学键,产生更多表面吸附氧[25],提升催化剂的活性.
2.4 甲苯氧化机理
VOCs催化氧化机理通常有3种反应动力学模型:Langmuir-Hinshelwood (L-H)、Eley-Rideal (E-R)和Mars-van Krevelen (MvK).在混合氧化物上,由于其表面具有丰富的活性氧物种,最常用来解释的机制是MvK机制[18].它主要基于反应物分子与氧物种的反应.结合之前的XPS与XRD结果,对甲苯氧化过程做出如下推理(图9):首先,催化剂的活性组分Mn4+、Mn3+以及表面吸附氧O-溢出,氧化甲苯生成CO2,同时产生氧空位,Mn离子价态降低.其次,部分晶格氧O2-转化为表面氧O-,以及空气中的O2不断吸附到氧空位上,生成表面氧O-和晶格氧O2-,源源不断提供活性氧并提升Mn离子价态,保证反应的持续进行.所以催化剂的氧空位有利于吸附甲苯和O2,从而提高催化性能.实验结果证实Ni-Mn复合氧化物可以增加催化剂表面氧空位,Zhao[31]等通过原位漫反射红外光谱(in situ DRIFTS)发现甲苯在无氧条件下被活化为苯甲醛或苯甲酸盐,加入氧气后被迅速氧化为CO2,决定反应速率快慢的是第一步的活化过程.故推测Ni-Mn复合氧化物丰富的表面氧物种加快了催化剂对甲苯的活化,使甲苯更多的一步转化为苯甲酸盐,从而减少氧化步骤,降低催化温度.
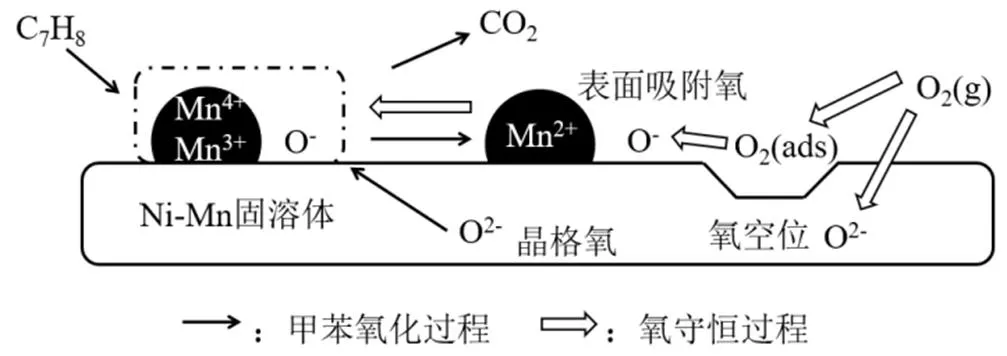
图9 甲苯在Mn1-yNiyOx催化剂的MvK机制反应路径
综上所述,Mn0.8Ni0.2O低温催化性能的增强可能是由于Mn和Ni物种在甲苯吸附和活化中的相互作用,生成更多的Mn4+物种以及表面氧空位和不饱和化学键,促进对甲苯的活化,降低反应温度.通过相关文献和本文的催化剂在甲苯催化燃烧中催化活性的比较,可以看出水热共沉淀法制备的非贵金属复合氧化物效果不及负载型贵金属催化剂,但从成本角度考虑,Pt、Pb等贵金属价格昂贵,不易于生产中批量使用;与其它Mn基复合氧化物催化剂相比,Ni-Mn复合氧化物的性能效果明显更优.
3 结论
3.1 通过水热共沉淀法制备了Mn1-yNiO催化剂,对比不同Ni掺杂量对催化活性的影响,分析了掺杂Ni对Mn基氧化物的物理结构与氧化还原性能造成的变化.结果表明,Mn-Ni物种形成了固溶体,并且在甲苯吸附和氧化中相互作用,对催化剂活性有益.
3.2 Mn0.8Ni0.2O在甲苯催化燃烧中表现出最优的催化性能以及热稳定性,与MnO相比,50、90分别下降12和11 ℃,在238 ℃将甲苯完全氧化,且CO2产率在40h内保持在95%以上,碳平衡值约为99%.
3.3 Mn0.8Ni0.2O催化性能的提高是由于Mn和Ni物种在甲苯氧化中的相互作用,生成更多Mn4+物种和表面吸附氧,提供大量活性位点,增强催化性能.
[1] Ahmadi M, Haghighi M, Kahforoushan D. Influence of active phase composition (Mn, Ni, MnNi10−) on catalytic properties and performance of clinoptilolite supported nanocatalysts synthesized using ultrasound energy toward abatement of toluene from polluted air [J]. Process Safety and Environmental Protection, 2017,106:294-308.
[2] GB 16297.1996 国家环保局. 大气污染物综合排放标准[S].
GB 16297.1996 Integrated emission standard of air pollution [S].
[3] GB3095-2012 环境空气质量标准[S].
GB3095-2012 Ambient air quality standards [S].
[4] 任思达,梁文俊,王昭艺,等. Ce掺杂对Pd/γ-Al2O3催化燃烧甲苯性能的影响[J]. 中国环境科学, 2019,39(7):2774-2780.
Ren S D, Liang W J, Wang Z Y, et al. Effect of Ce doping on the performance of Pd/γ-Al2O3catalytic combustion of toluene [J]. China Environmental Science, 2019,39(7):2774-2780.
[5] Sbardella L, Comas J, Fenu A, et al. Advanced biological activated carbon filter for removing pharmaceutically active compounds from treated wastewater [J]. Science of The Total Environment, 2018,636: 519-529.
[6] Wang L, Xu X, Wu S, et al. Nonstoichiometric tungsten oxide residing in a 3D nitrogen doped carbon matrix, a composite photocatalyst for oxygen vacancy induced VOC degradation and H2production [J]. Catalysis Science & Technology, 2018,8(5):1366-1374.
[7] Mengyu L, Dandan L, Ziqi Z, et al. Study on the performance and mechanism of degradation of toluene with non-thermal plasmas synergized supported TiO2/γ-Al2O3catalyst [J]. Journal of Environmental Chemical Engineering, 2021,9(4):105529.
[8] Zhang S, Liu S, Zhu X, et al. Low temperature catalytic oxidation of propane over cobalt-cerium spinel oxides catalysts [J]. Applied Surface Science, 2019,479:1132-1140.
[9] Hu J, Li W B, Liu R F. Highly efficient copper-doped manganese oxide nanorod catalysts derived from CuMnO hierarchical nanowire for catalytic combustion of VOCs [J]. Catalysis Today, 2018,314.
[10] Ghavami M, Soltan J, Chen N. Synthesis of MnO/Al2O3catalyst by polyol method and its application in room temperature ozonation of toluene in air [J]. Catalysis Letters, 2020,151(5):1418-1432.
[11] Xu W, Chen X, Chen J, et al. Bimetal oxide CuO/Co3O4derived from Cu ions partly-substituted framework of ZIF-67 for toluene catalytic oxidation [J]. Journal of Hazardous Materials, 2021,403:123869.
[12] Du J, Qu Z, Dong C, et al. Low-temperature abatement of toluene over Mn-Ce oxides catalysts synthesized by a modified hydrothermal approach [J]. Applied Surface Science, 2018,433:1025-1035.
[13] Zhao L, Zhang Z, Li Y, et al. Synthesis of CeaMnOhollow microsphere with hierarchical structure and its excellent catalytic performance for toluene combustion [J]. Applied Catalysis B: Environmental, 2019,245:502-512.
[14] Xiaobo Y, Zhihong Z. Study on the Performance of Copper- Manganese Composite Oxide Catalysts for Toluene [J]. Chemistry Select, 2021,6(19):4837-4843.
[15] Wang P, Wang J, An X, et al. Generation of abundant defects in Mn-Co mixed oxides by a facile agar-gel method for highly efficient catalysis of total toluene oxidation [J]. Applied Catalysis B: Environmental, 2021,282:119560.
[16] Xue T, Li R, Zhang Z, et al. Preparation of MnO2decorated Co3Fe1Opowder/monolithic catalyst with improved catalytic activity for toluene oxidation [J]. Journal of Environmental Sciences, 2020,96: 194-203.
[17] Lim T H, Cho S J, Yang H S, et al. Effect of Co/Ni ratios in cobalt nickel mixed oxide catalysts on methane combustion [J]. Applied Catalysis A: General, 2015,505:62-69.
[18] Naghel-Danaei S, Hosseini S A, Niaei A. Layered double hydroxides: Novel nanocatalysts for combustion of gaseous toluene from polluted air [J]. Iranian Journal of Catalysis, 2020,10(3):227-233.
[19] HJ 2027-2013 催化燃烧法工业有机废气治理工程技术规范[S].
HJ 2027-2013 Technical specifications of catalytic combustion method for industrial organic emissions treatment project [S].
[20] Kim K, Ahn H. Complete oxidation of toluene over bimetallic Pt-Au catalysts supported on ZnO/Al2O3[J]. Applied Catalysis B: Environmental, 2009,91(1):308-318.
[21] Dong Y, Zhao J, Zhang J, et al. Synergy of Mn and Ni enhanced catalytic performance for toluene combustion over Ni-doped α-MnO2catalysts [J]. Chemical Engineering Journal, 2020,388:124244.
[22] 张 烁,吴卫红,杨 洋,等.老化对钴铈基催化剂催化氧化丙烷的影响[J]. 中国环境科学, 2021,41(2):614-621.
Zhang S, Wu W H, Yang Y, et al. Effect of aging on propane catalytic oxidation over Co-Ce catalyst. China Environmental Science, 2021,41 (2):614-621.
[23] Lu S, Li K, Huang F, et al. Efficient MnO-Co3O4-CeO2catalysts for formaldehyde elimination [J]. Applied Surface Science, 2017,400: 277-282.
[24] Xu Y, Du X, Li J, et al. A comparison of Al2O3and SiO2supported Ni-based catalysts in their performance for the dry reforming of methane [J]. Journal of Fuel Chemistry and Technology, 2019,47(2): 199-208.
[25] Xiao Y, Wu X, Liu S, et al. Modification of PdO/CeO2-ZrO2catalyst by MnOfor water-gas shift reaction: redox property and valence state of Pd [J]. Journal of Materials Science, 2016,51(11):5377-5387.
[26] Zhou F, Pan N, Chen H, et al. Hydrogen production through steam reforming of toluene over Ce, Zr or Fe promoted Ni-Mg-Al hydrotalcite-derived catalysts at low temperature [J]. Energy Conversion and Management, 2019,196:677-687.
[27] Xia Y, Xia L, Liu Y, et al. Concurrent catalytic removal of typical volatile organic compound mixtures over Au-Pd/α-MnO2nanotubes [J]. Journal of Environmental Sciences, 2018,64:276-288.
[28] Du J, Qu Z, Dong C, et al. Low-temperature abatement of toluene over Mn-Ce oxides catalysts synthesized by a modified hydrothermal approach [J]. Applied Surface Science, 2018,433:1025-1035.
[29] Huang N, Qu Z, Dong C, et al. Superior performance of α@β-MnO2for the toluene oxidation: Active interface and oxygen vacancy [J]. Applied Catalysis A: General, 2018,560:195-205.
[30] Ye Z, Giraudon J M, Nuns N, et al. Influence of the preparation method on the activity of copper-manganese oxides for toluene total oxidation [J]. Applied Catalysis B: Environmental, 2018,223:154-166.
[31] Zhao L, Zhang Z, Li Y, et al. Synthesis of CeaMnOhollow microsphere with hierarchical structure and its excellent catalytic performance for toluene combustion [J]. Applied Catalysis B: Environmental, 2019,245:502-512.
Synthesis of Mn1-yNiyOxcatalyst and its high efficient performance for toluene catalytic combustion.
ZHOU Yuan-yuan1,2, LIU Han1, DENG Lin1*, WU Gong-de2**, WAN Jie2, WANG Xiao-li2, HU Chun-zheng3, YU Xian-kun4, YANG Xiao-jun4
(1.School of Civil Engineering, Southeast University, Nanjing 211189, China;2.Energy Research Institute, Nanjing Institute of Technology, Nanjing 211167, China;3.Jiangsu Subei Environmental Protection Group Co., Ltd, Shuyang 223624, China;4.Sinosteel Maanshan Mining Research Institute Co., Ltd, Maanshan 243000, China)., 2022,42(4):1601~1609
Series of dual meta oxides Mn1-NiO(=0.1~0.5) catalysts were prepared by hydrothermal co-precipitation to investigate the effect of nickel doping on manganese-based oxides for toluene catalytic combustion reaction. Manganese to nickel ratio was optimized and the corresponding thermal stability as well as durability performances were also evaluated. The physical structure and redox performance of the obtained catalysts were characterized through XRD, N2adsorption/desorption, SEM, H2-TPR and XPS. Results revealed that strong interaction exists between Mn and Ni, which results in the generation of more high valent Mn4+and surface adsorbed oxygen species, thus providing more reactive sites and enhancing the catalytic oxidation performance. Mn0.8Ni0.2Oproposed the best toluene removal efficiency in the catalytic combustion, as well as excellent thermal stability and durability. Compared with MnO, its50and90were reduced by 12 and 11℃, respectively, demonstrating complete toluene elimination at 238°C, and the carbon balance was about 99% without secondary pollution. This work provides promising materials with practical potentials for the catalytic combustion of volatile organic compounds (VOCs) as well as new insights regarding catalyst design principles.
toluene;Mn-Ni catalysts;catalytic oxidation;thermal stability
X701.7
A
1000-6923(2022)04-1601-09
周媛媛(1997-),女,江苏南京人,东南大学硕士研究生,主要从事VOCs催化材料研究.发表论文2篇.
2021-09-18
国家自然科学基金资助项目(22076023);安徽省重点研发计划项目(202104g01020006);江苏省重点研发计划项目(BE2018718);江苏省基础研究计划(自然科学基金)项目(BK20201037);江苏省高等学校自然科学研究面上项目(20KJB610005);南京工程学院引进人才科研启动基金资助项目(YKJ2019111)
*责任作者, 邓琳, 副教授, dlwhu@163.com; *吴功德, 教授, wugongde @njit.edu.cn

