应用同步辐射X射线多模态成像研究死亡延迟时间对脑组织染色的影响
燕 鑫 蔡小青 汤乔伟 周 峰 诸 颖 王丽华 胡 钧,3,4
1(中国科学院上海应用物理研究所中国科学院微观界面物理与探测重点实验室 上海 201800)
2(上海科技大学 上海 201210)
3(中国科学院上海高等研究院基础交叉研究中心张江实验室 上海 201210)
4(中国科学院大学 北京 100049)
人类大脑是一个庞大的复杂体系,有近千亿神经元,神经元之间如何连接以及错误连接如何导致严重的神经性疾病,人类迄今仍未探明其中奥秘。阿尔茨海默综合征、帕金森综合征以及亨廷顿综合征等神经退行性疾病已严重危害人类健康,因此探索大脑运行机制、寻找相应的治疗方法迫在眉睫[1]。国际上美国脑科学计划(BRAIN Initiative)、欧洲脑计划(The Human Brain Project)以及日本脑计划(Brain/Minds Project)均致力于此[2]。中国的脑计划(China Brain Project)研究也已启动,该计划有望帮助我们理解大脑不同区域的细胞类型和神经元细胞之间的连接方式,同时对脑功能的神经环路基础也将有一个全方位的认识[3]。目前人脑的结构及其功能主要依赖于光学、核磁等商业化技术来解析。然而,受限于成像技术的视场、分辨率、速度等,目前仍难以在单细胞水平上对人脑组织进行快速高分辨成像来获得人脑的精细结构图像,从而无法进一步了解脑相关疾病与神经细胞变化之间的相互关系[4]。近年来,基于大科学装置的先进成像方法——同步辐射X射线成像技术或将成为绘制人脑介观尺度连接组图谱的重要手段。相较于光学成像来说,同步辐射X射线成像拥有各向同性分辨率,成像分辨率不受Z轴限制;穿透深度高,可满足mm3体积大小的组织块成像;成像速度快(1 mm3·min-1)等特点。上述优点使其大大降低了多组数据配准的工作量和难度,针对于人脑成像,可大大节省数据获取的时间,这也是目前成像速度最快的三维成像手段[5]。
对人脑来说,一些常规的荧光标记技术,如转基因动物,基于腺病毒(Adeno-Associated Virus,AAV)、狂犬病毒(Rabies Virus,RV)等病毒标记技术无法用于活体人脑组织标记,这极大地限制了荧光成像技术在人脑连接图谱研究上的应用。高尔基染色法是基于重金属Cr、Hg和Ag的脑组织神经细胞的染色标记方法,适用于同步辐射X射线脑组织成像。但捐赠的人脑组织存在死亡延迟时间(Postmortem Delay,PMD),大部分捐赠的人脑PMD在6~8 h,有些甚至在数天之久[6]。脑组织的死后变化是不可避免的,导致难以辨别大脑中精细结构的变化是死前的生理性改变还是PMD造成的改变[6]。因此,PMD是影响人脑组织高尔基染色的一个关键因素,但PMD如何影响人脑组织神经元的高尔基染色尚不明确。此外,对比未经灌注与0.9%NaCl溶液灌注过的大脑染色情况,未经灌注的大脑染色后血管会影响神经元染色后成像的信噪比,同时,经过福尔马林或4%多聚甲醛溶液固定过的脑组织也会导致胶质细胞染色,影响高尔基染色的效果[7]。
本工作采用离体后不同放置时间的小鼠脑组织来模拟人死亡后脑神经细胞的变化,设置不同的时间间隔,采用高尔基染色、尼氏染色对取脑后不同放置时间的小鼠大脑皮层区域进行染色和光学显微镜成像,利用上海光源BL13HB成像线站的同步辐射X射线微米CT成像技术对小鼠大脑皮层区域的锥体神经元进行高分辨率的X射线成像,获得取脑后不同放置时间小鼠大脑皮层区域的同步辐射X射线三维成像图,探究小鼠大脑皮层区域锥体神经元的形态结构随时间的变化规律[8]。该工作有望对人脑组织高尔基染色方法的建立和同步辐射X射线人脑成像奠定基础。
1 实验材料
1.1 实验试剂
HITO Golgi-cox Optimstain Kit(高尔基试剂盒),Hito Dual-safe Gelatin-coated Slide购自上海南科生物科技有限公司;二甲苯,无水乙醇,多聚甲醛,蔗糖购自国药集团化学试剂有限公司;尼氏染液购自碧云天生物技术有限公司。
1.2 实验器材
直立式显微镜Axio Imager 2,德国ZEISS公司;石蜡包埋机EG 1150,德国徕卡公司;冷冻切片机Leica CM1950,德国徕卡公司。
1.3 实验动物
8周龄C57小鼠,雌性,购自上海斯莱克实验动物有限责任公司,SPF级,许可证号:SCXK(沪)2017-0005。实验符合动物实验的伦理学标准,并经上海中医药大学伦理委员会批准(批准号:ACSHU-2014-200,2014年7月15日批准)。
2 实验方法
2.1 样品制备
8周龄的成年C57雄性小鼠饲养在动物实验室恒温层流架中,合笼饲养,每笼随机分配5~6只,给予足够的水和饲料供它们自由摄取。所有小鼠随机分为7组,用于不同需求的染色。腹腔注射过量的1%戊巴比妥钠麻醉小鼠,使其失去知觉,仰卧位置于解剖台上。由腹部开口直至打开胸腔,剥离心包膜暴露出心脏,将针头插入心尖处,固定好灌注所需针头,剪断左心室,持续匀速缓慢灌注40 mL生理盐水,确保小鼠体内血液得到充分置换,直至肝脏由棕褐色变为淡白色,停止灌注。小鼠灌注后,立即手术剥离小鼠的整个脑组织并保持其完整性,用生理盐水洗涤后,浸入其中,置于室温中保存。
2.2 Golgi-Cox染色
全脑组织室温下放置0 h、12 h、60 h后取出,置于新配制的Golgi-Cox染色液中,铝箔纸遮光,在25℃培养箱中染色96 h。染色完成后将其沉入30%蔗糖溶液中,4℃低温脱水3 d,每24 h换液一次。用于光镜观察的样品用冷冻包埋剂包埋,使用冷冻切片机获得100μm脑组织薄切片置于载玻片上,依次浸入超纯水,还原显色剂,50%、70%、100%乙醇中脱水,然后在二甲苯中透明,最后封片低温保存。该实验主要采用蔡司光学显微镜,获取脑组织样本切片的皮层区5×、10×、20×、40×和100×(油镜)的图像。实验中得到的原始图像经过ImageJ处理,实现神经元的Sholl analysis和神经元树突棘的密度统计,并对神经元树突棘的统计结果进行Ordinary单因素方差分析(One-way ANOVA)。
2.3 尼氏染色
冷冻切片机将冷冻包埋的脑组织切成50μm的薄片,置于培养皿中进行浮片染色。超纯水洗涤3~5 s后,加入尼氏染液进行染色,放置在37°C培养箱中恒温染色15~20 min,使其染色更均匀。染色完成后用超纯水洗涤两次,再分别用50%、75%、100%乙醇脱水,将浮片转移至载玻片,浸泡在充满二甲苯的染色缸中透明后封片,采用蔡司光学显微镜拍摄40×图像以观察染色情况,使用ImageJ对原始图像进行二值化以获得染色细胞所占面积比,对其结果进行Ordinary单因素方差分析。
2.4 同步辐射X射线微米CT成像
本实验在上海同步辐射光源(Shanghai Synchrotron Radiation Facility,SSRF)的X射线生物医学成像光束线BL13HB完成,主要通过局部CT、相衬成像等实现在生物医学、材料科学和古生物学的应用研究,可以实现0.8µm的空间分辨率和1 ms的时间分辨率[9]。通过X射线微米CT成像实现低剂量、无损、高分辨率、动态和三维的X射线成像,以了解软组织的内部微观结构[10-11]。
用于同步辐射X射线成像的脑组织样品采用Golgi-Cox染色,染色后将全脑依次浸入超纯水,还原显色剂,30%、50%、75%、90%、95%、100%酒精、无水乙醇-二甲苯(1:1)、二甲苯和石蜡中依次脱水后,将全脑包埋在石蜡中并在室温下储存,成像之前将其切成1 mm的厚切片。
在实验过程中,对皮层区脑组织的局部区域进行了断层显微成像,将样品固定在样品台的中央,并保证其与光路垂直。为了获得最佳的神经元相位对比图像,采用单色光X射线进行成像,最佳能量为20.0 keV。进行局部CT扫描时,样品到探测器的距离为5 cm,旋转台每隔0.1°旋转180°,曝光时间为200 ms,获取1 800张图像。在拍摄过程中需要同时采集光路中无样品时的白场图像和无光照射时的暗场图片。
所有二维原始投射图像使用ImageJ和ImageJ Plus图像处理软件进行处理,考虑到脑组织中不同的结构特征和灰度分布,通过调整对比度、设置适当的滤波参数等方法,降低图像背景噪声获取最佳的投影图像,利用Octopus实现神经元的重构,结合可视化软件Amira可视化小鼠脑中神经元的分布[12],显示小鼠脑矢状面中不同层次的神经网络的渲染。
3 实验结果与讨论
3.1 Golgi-cox染色光学成像
1873年,卡米洛·高尔基发明了高尔基染色法,可以观察完整神经组织的神经元细胞形态和组织结构,高尔基也因此在1906年获得诺贝尔医学奖。高尔基染色至今仍是神经元染色的金标准,为神经科学的发展作出了巨大贡献。目前普遍认为,高尔基染色法作为经典的神经元染色方法,能够随机标记3%~5%的神经元,但可以显示出神经元的完整形态结构[13-14]。高尔基染色法经过自诞生以来一百多年的改进和发展,主要发展为三大类:快速高尔基染色、Golgi-Kopsch染色和Golgi-Cox染色[15]。Golgi-Cox染色神经元的基本原理尚不完全清楚[16],改善染色方法的因素也不确定,如灌注方式、温度和时间等均会影响染色效果,因此优化条件以改进Golgi-Cox染色。Golgi-Cox染色[17]的效果会受到未灌注脑组织中血管的影响,染色的血管与神经元交织在一起,增加了图像的背景噪声。通过改良Golgi-Cox染色法的时间,大大降低血管被标记的概率,提高光镜下图像的信噪比。该实验采用HITO染色试剂盒,改进后的Golgi-Cox染色方便、高效。
对取脑后间隔不同时间的脑组织进行Golgi-Cox染色(图1(a))切片后,用光镜对脑组织切片中的皮层区进行光学显微成像,获得小鼠大脑皮层区域锥体神经元成像图(图1(b)),并对其神经元形态的变化画出了示意图,以便更加清晰直观地观察神经元的形态变化。由此可见,取脑后间隔不同时间对其进行神经元染色,在12 h后被浸染的神经元明显减少、形态逐渐不完整,60 h后神经元浸染多为胞体,神经元形态不完整。神经元随着脑组织离体时间增加逐渐凋亡和消失,且神经元的消失是从末端开始的,胞体最后消失。

图1 小鼠死亡延迟后的大脑Golgi-Cox染色及光学成像(a)小鼠死亡延迟后的大脑进行Golgi-Cox染色的示意图,(b)高尔基染色后的脑组织光学显微成像图及对应神经元简图Fig.1 Golgi-Cox staining and light microscopy of postmortem mouse brain(a)Schematic diagram of Golgi-Cox staining of post-mortem mouse brain,(b)Light micrographs of brain tissue after Golgi staining and sketch of corresponding neurons
3.2 小鼠大脑皮层锥体神经元形态分布
树突和轴突的形态决定了神经元如何处理和传递信息。多年来,Sholl analysis[18]一直被用来分析神经元的形态、树突分支和复杂性。Sholl analysis是一种通过研究神经元的轴突和树突形态来定量分析神经元复杂度的方法,以神经元胞体为圆心(不包括胞体)间隔相同距离作同心圆,获得与神经元分支交点的个数,以此来反映神经元的复杂程度。为了验证离体时间对神经元结构完整性的影响,对Golgi-Cox染色的脑组织切片中神经元的光学显微图像进行了Sholl analysis定量分析大脑神经元的复杂性变化(图2(a))。通过对神经元进行Sholl analysis,量化了神经元离体后形态复杂性的变化程度,更直观地观察神经元形态的变化趋势,神经元的复杂性随着时间的增长而降低,完整性也随之降低。
近几十年来,老年人口不断增加,随之而来的是神经退行性疾病(如阿尔茨海默病、帕金森病等)患者增多。突触可塑性被认为是学习和记忆的基础,在突触重塑过程中,树突棘的数量和形状经历了动态重组[19]。突触的形成和消除对于建立神经元回路和执行大脑功能至关重要。树突棘大多位于中枢神经系统中兴奋性神经传递的突触后膜,通常被认为是突触形成的标志[20]。树突棘是位于神经元树突上的一个突触部位,与学习记忆密切相关。高尔基染色利用了神经元的嗜银特性展现神经元和树突棘的形态。虽然树突棘的数量与突触活动量并不直接相关,但树突棘密度统计可用于评估突触连接和突触可塑性变化的过程[21]。因此,树突棘密度统计在神经科学研究中被广泛使用,人工统计树突棘是很耗时的,但很准确。
通过使用蔡司光学显微镜对Golgi-Cox染色的脑组织切片中的树突棘进行100×油镜景深拍摄,获取皮层区域的树突棘成像。树突棘的染色数量随着时间的增加而减少(图2(b)),这一趋势与Sholl analysis一致。同时对树突棘密度统计结果进行Ordinary单因素方差分析(One-way ANOVA),p<0.000 1,证明组间差异具有统计学意义。
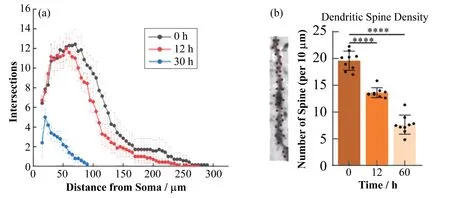
图2 室温下皮层区神经元Golgi-Cox染色的Sholl analysis和树突棘密度统计(a)室温下Golgi-Cox染色后的死亡延迟大脑的皮层区神经元Sholl analysis,(b)树突棘密度统计(****p<0.000 1)Fig.2 Sholl analysis and dendritic spine density statistics of Golgi-Cox staining of cortical neurons at room temperature(a)Sholl analysis of cortical neurons of post-mortem mouse brain after Golgi-Cox staining at room temperature,(b)Dendritic spine density statistics(****p<0.000 1)
3.3 同步辐射X射线成像
图像采集和处理时间长导致绘制大脑神经网络连接图谱成为一项极具挑战性的工作,但是利用同步辐射X射线成像可以克服以上挑战。同步辐射X射线成像具有各向同性的空间分辨率,能够实现高分辨率和高通量的神经元成像,加速了全脑神经元的三维可视化,通过对小鼠大脑中的神经元进行成像验证了这一点。实现全脑图谱的构建不仅需要提高分辨率,还需要减少数据采集和处理的时间,包括两个方面:快速图像采集和快速图像处理,使图像处理的时间与原始图像采集的时间相当。
同步辐射X射线成像利用物质密度不同产生不同的X射线吸收对比度来产生图像衬度。未被染色的脑组织对X射线的吸收程度相似,不能产生有效的吸收对比度来实现神经元成像。Golgi-Cox染色液含有重金属元素汞,被用来特异性的稀疏标记神经元以及树突棘等精细结构且不会干扰背景,确保了适当的X射线吸收成像对比度来成像神经元及其精细结构,同时也缓解了神经元高密度染色造成的成像信噪比降低的问题,以此获得具有高对比度和高时空分辨率的图像。但是,每个脑组织样品只能获得部分神经元及其连接的图像,因此获取完整的神经元成像需要更多的样品。
大脑皮层是高级神经活动的物质基础,也是锥体神经元密集分布的地方。在本实验中对小鼠大脑皮层区域进行了同步辐射X射线微米CT成像,用Amira软件进行三维可视化并获得了小鼠大脑皮层区域锥体神经元三维成像图(图3)。同步辐射X射线成像所获得的结果与光镜下所得结果相同,随着脑组织死亡延迟时间的增长,神经元细胞随之发生溶解,神经纤维逐渐变短直至消失。
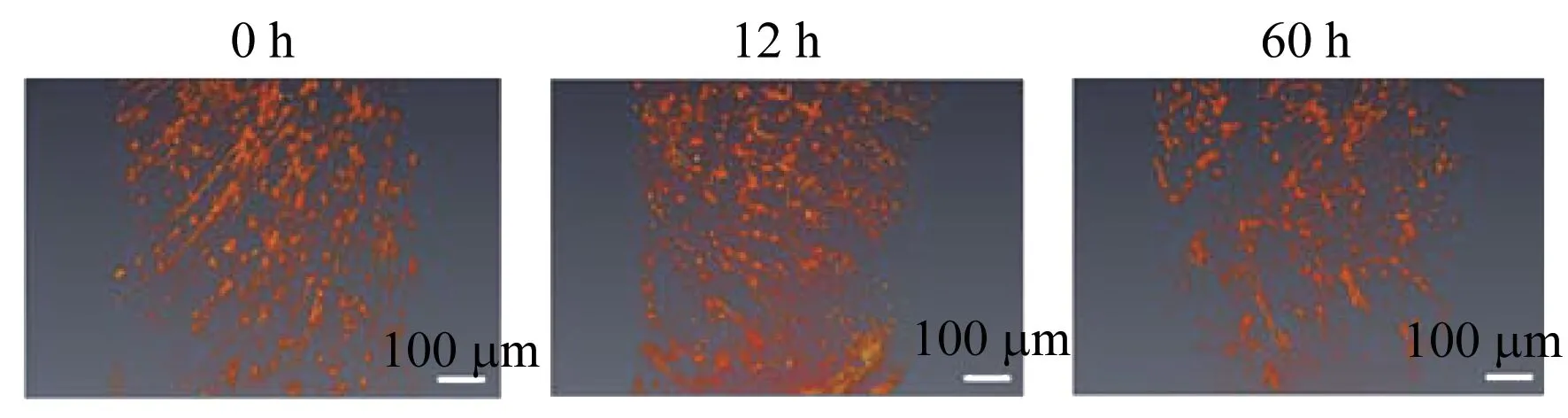
图3 大脑皮层区矢状面不同时间的三维神经网络成像Fig.3 Three-dimensional neural network imaging at different time nodes in the sagittal plane of brain cortical
3.4 尼氏染色
尼氏体作为神经元的特征结构广泛分布于神经细胞中,可以被碱性染料染色,在光学显微镜下呈小颗粒或块状,电镜下可观察到粗糙的内质网和核糖体。尼氏体主要负责合成神经元正常生理活动所需的蛋白质,尼氏体的存在与消失可以判断神经细胞是否受损。当神经元受损时,尼氏体会溶解甚至消失,数量也会明显减少[22]。当对小鼠脑组织进行尼氏染色,尼氏染色液中的有效成分甲酚紫与RNA或DNA结合,将尼氏小体染成蓝紫色。光镜得到的实验数据分析表明,随着取脑间隔时间的增加,尼氏小体的数量减少并消失(图4)。同时对其结果进行Ordinary单因素方差分析(One-way ANOVA),p<0.000 1,证明组间差异具有统计学意义。实验结果表明:随着时间的增加,神经细胞受到破坏和溶解,与Golgi-cox染色和同步辐射X射线成像的结果相吻合。同时验证了神经元细胞特别是神经纤维随着死亡延迟时间的增加逐渐减少甚至消失,但Golgi-Cox染色液对神经元的染色效率不会随着细胞凋亡而降低。
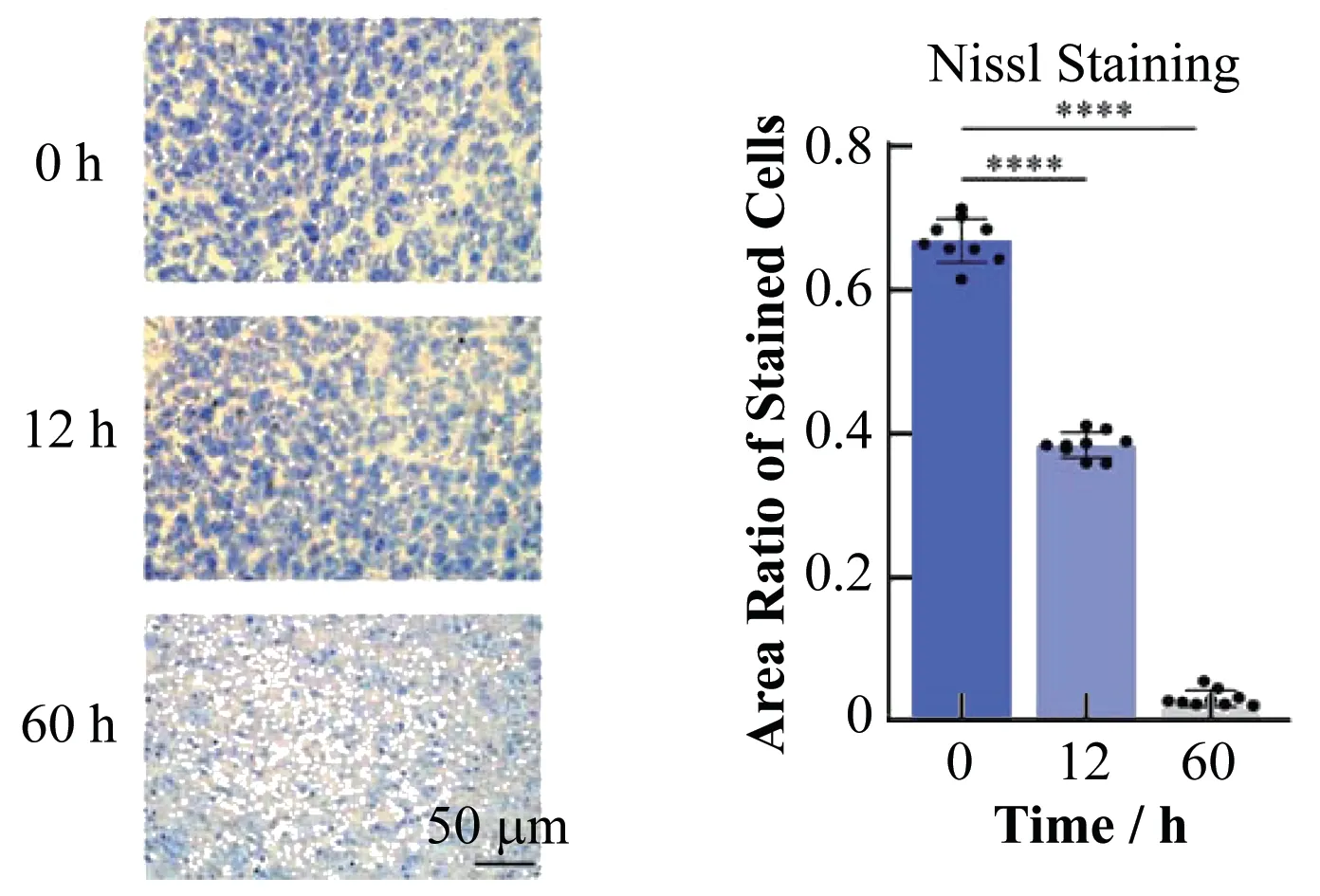
图4 死亡延迟的脑皮层区尼氏染色的光学成像及统计数据(****p<0.000 1)Fig.4 Light microscopic imaging and statistical data of Nissl staining in cortical of post-mortem mouse brain(****p<0.000 1)
4 结语
本工作用放置不同时间的鼠脑样品来模拟死亡的人脑,探讨死亡延迟时间对鼠脑高尔基染色的影响。采用光学显微成像与同步辐射成像相结合的方法,同时获取二维与三维的神经元形态信息进行统计并对比分析。实验结果表明:放置不同时间后的鼠脑样品,随着时间的增长,神经元逐渐降解消失,其复杂性和完整性逐渐降低,但对Golgi-Cox染色液的吸收程度不会降低。该工作对探究人脑神经网络的超微结构染色分析提供了新的思路,有助于更好地了解神经元的连接方式,对神经性疾病的研究也是至关重要。
作者贡献说明燕鑫负责完成实验的主体部分,包括Golgi-Cox染色、尼氏染色的光镜成像和同步辐射X射线微米CT成像实验;周峰负责小鼠随机实验分组和小鼠脑组织冷冻切片;汤乔伟和燕鑫负责成像数据处理和三维重构;燕鑫和蔡小青撰写文稿;蔡小青设计和指导实验;诸颖、王丽华、胡钧构思文稿主体思路并全程指导文稿修改。所有作者都参与了文稿的多次讨论和修改。

