热带无爪螨主要变应原Blo t 5和Blo t 21融合表达质粒诱导小鼠产生IgG和调节性T细胞
罗 应,彭美琪,肖正泮,罗承慧,王大勇,裴业春*
(1.海南大学生命科学学院,海口570228;2.海南大学全健康研究院,海口 570228)
螨类变应原在过敏性疾病中扮演了重要的角色[1]。热带无爪螨(Blomiatropicalis,Bt)也称热带螨,属于无爪螨属[2],是尘螨中最主要的螨种之一,尤其是在热带以及亚热带地区,热带螨是热带地区最为常见的优势螨种[3],热带地区的家居环境中普遍发现分布有热带螨或其变应原。尘螨能够引起强烈的过敏反应,包括过敏性皮炎、过敏性鼻炎、过敏性哮喘等[4]。尘螨不仅是人类的变应原,同样也是动物(尤其是宠物)的重要变应原,在人类和犬类过敏性皮炎相关的众多环境变应原中,尘螨变应原是最常见的变应原之一[5]。例如,有研究表明过敏的犬类对粉尘螨提取物的特异性检测呈阳性[6],而热带螨同样可以诱导动物产生过敏反应,如通过皮试试验证实,过敏犬皮试阳性的致敏原中最主要的是热带螨[7]。通过比较两类犬,第一类是非食物引起的特应性皮炎(non-food-induced atopic dermatitis,NFIAD)的犬,第二类是食物诱发的特应性皮炎(food-induced atopic dermatitis,FIAD)的犬,研究发现第一类犬对屋尘螨提取物的皮内试验反应更强烈,这可能是由于屋尘螨蛋白酶抗原、或其主要变应原Der p 1、蛋白酶活动相关的表皮皮肤屏障缺陷而发生共同致敏[8]。研究人员使用皮内试验和免疫斑点法检测16只过敏性犬对螨的粗提变应原的反应性,发现这16只过敏性犬均对螨变应原敏感,均表达抗粉尘螨变应原的IgE抗体[9]。英国过敏性犬的血清样本中同样发现了粉尘螨特异性IgE抗体[10]。国内兽医临床上也有犬过敏案例报道[11]。目前,兽医临床上缺乏防治尘螨过敏,尤其是热带螨过敏的动物疫苗。研究表明,Blo t 5是热带螨的主要变应原[12],有高达92%的过敏患者对其过敏[13]。Blo t 21是近些年新发现的热带螨的变应原,用核磁共振方法研究Blo t 21的结构和IgE表位,发现Blo t 21是具有相似结构和致敏性的Blo t 5变应原的旁系同源物,和Blo t 5有40.7%的序列相似性,但两者之间有较低的交叉反应性[14]。大部分热带螨过敏的病患对Blo t 5和Blo t 21显示出共同致敏化[15]。过敏反应与变应原特异性Th1和Th2细胞平衡失调有关,主要表现为Th2细胞反应性过强,过敏患者表达高水平的Th2细胞及其相关细胞因子[16]。变应原特异性免疫疗法(allergy specific immunotherapy,AIT)是基于对致病变应原的管理,以诱导由变应原特异性IgG抗体组成的“反免疫反应”,IgG可减缓IgE与变应原的结合,以及细胞免疫反应的改变,特别是减少变应原特异性Th2反应[17]。许多变应原具有间接支持Th2细胞分化的酶活性。例如,来自屋尘螨的主要变应原Der p 1是一种蛋白水解酶,可分解B细胞上的CD23。由于CD23通常抑制IgE的合成,因此,CD23的分解,可间接促进IgE合成的上调。IgE可以与肥大细胞和嗜碱性粒细胞上的IgE高亲和力受体(IgE-FcεRI)结合,当细胞结合的IgE识别变应原后,导致肥大细胞和嗜碱性粒细胞脱颗粒,释放组胺、白三烯等过敏介质,诱发过敏[17-18]。
免疫刺激DNA序列(immuncostimulatar DNA sequence, ISS)为非甲基化的胞嘧啶鸟嘌呤二核苷酸重复序列,即CpG基序,是一种强有力的非特异性免疫刺激DNA序列[19]。非甲基化CpG基序可直接刺激人B细胞和浆细胞样树突状细胞(plasmacytoid dendritic cell, pDC),从而促进1型T辅助细胞(Th1)和抗原递呈细胞的成熟/激活[20]。因此,非甲基化的CpG基序可以作为免疫佐剂,通过保持CpG DNA和变应原之间的紧密物理接触来优化这些效果。将CpG DNA与多种疫苗共同使用,可改善动物感染模型中的保护性免疫力[20]。临床试验表明,CpG具有良好的安全性,并可以提高共同接种疫苗的免疫原性[21]。
疫苗是预防和控制传染病的最成功的公共卫生干预措施之一,DNA疫苗又称为第三代疫苗,可以诱导有效的体液和细胞免疫反应,而无需任何额外的佐剂,DNA疫苗稳定易保存、方便运输,成本低等优势使其成为近年来研究较热的基因工程疫苗。DNA疫苗是编码免疫原或与免疫原相关的真核表达质粒 DNA(有时也可能是 RNA),在强大的组成活性启动子[如巨细胞病毒(CMV)]的控制下,通过注射器或推进装置(如基因枪)将DNA疫苗接种到宿主的肌肉或皮肤中,使DNA被吸收到细胞中,目的基因在细胞内转录和翻译,此蛋白能刺激机体产生非特异性和特异性两种免疫应答反应,从而起到免疫保护作用[22]。DNA疫苗除了能够引发体液免疫反应和细胞免疫反应外,还被认为比传统疫苗更安全。它相对更稳定,并且在制造和存储方面可能更具成本效益。可以将多种抗原组合成一个质粒,以靶向多种病原体或单一病原体的多种组分[23]。编码过敏原的DNA疫苗有望通过诱导过敏原特异性Th1反应来预防或治疗过敏症。编码屋尘螨变应原Der p 2的DNA疫苗对未处理小鼠进行免疫接种,研究发现通过偏向Th1免疫反应阻止屋尘螨过敏的发生,其特征是变应原特异性IgE、IL-5和肺部炎症显著降低,同时诱导高滴度特异性IgG2a[24]。编码屋尘螨变应原Der p 2的DNA疫苗pVAX1-Der p 2-A20免疫小鼠后,小鼠血清 Der p 2特异性IgE、IL-4和IL-13表达水平受到抑制,而Der p 2 特异性IgG2a和IFN-γ表达水平升高,血清和脾CD4+CD25+Foxp3+Treg细胞群增加,明显改善了Der p 2引起的过敏鼻炎[25]。
目前,热带螨引起的过敏性疾病的应对方法主要有3种:(1)规避变应原,(2)药物抑制过敏反应,(3)特异性免疫治疗。规避变应原最为有效,但是也最难实现,因为环境中的热带螨无处不在。药物抑制过敏反应,主要是采用抗组胺药、减充血剂或者其他一些药物。但是这些药物只能缓解过敏症状,并不能从机体免疫系统角度去抑制过敏反应。特异性免疫疗法是可以通过少量逐步摄入特异性变应原,诱导部分患者对原本过敏的变应原发生免疫耐受,从而减轻病痛,提高生活质量,该方法的缺点是治疗时间长,往往需要持续较长的时间才能达到理想的效果[26],另外热带螨的粗提物不是单一物质,容易诱发过敏。DNA疫苗安全可靠,制备简便,便于运输等优点,使得DNA疫苗的前景更加广阔。基于以上原因,作者构建了融合热带螨主要变应原Blo t 5和Blo t 21融合基因的真核表达质粒,该质粒还包含CpG基序和Th通用抗原表位PADRE,将其免疫小鼠,检测其免疫效果,为进一步开发防治热带螨过敏性疾病的动物疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 4~8周龄健康的雌性BALB/c小鼠从广东省医学实验动物中心购买,饲养于海南大学动物房,保持在特定的无病原体条件下饲养,食物和垫料均为SPF级。所有动物试验均严格按照海南大学实验动物福利与伦理要求,并经海南大学动物伦理委员会批准。
1.1.2 菌株、载体和试剂 大肠杆菌(E.coli)DH5α感受态细胞购自生工生物工程(上海)股份有限公司;pVAX1真核表达载体和HEK293细胞均由海南大学生命科学与药学院生物技术与分子药理实验室保存;质粒小提试剂盒购自生工生物工程(上海)股份有限公司;无内毒素质粒提取试剂盒(货号:A2492)和T4 DNA连接酶购自Promega公司;HindⅢ和XbaⅠ限制性内切酶均购自NewEnglandBiolabs公司;Biotin 4D9 Anti Blo t 5抗体(货号:MA-4D9)购自Indoor Biotechnologies公司;山羊抗小鼠IgG H&L(Alexa Fluor® 488),(Abcam,货号:AB150113);HRP标记兔抗小鼠IgG(Sangon Biotech,货号:D110098)、HRP标记山羊抗小鼠IgG1(ThermoFisher,货号:TL2682370)、HRP标记山羊抗小鼠IgG2a(ThermoFisher,货号:A-10685);细胞转染试剂LipofectamineTM2000 Reagent购自 Invitrogen 公司;流式抗体和胎牛血清均购自Biolegend公司;DMEM培养基和Opti-MEMI培养基均购自Gibco公司;其他试剂均为国产分析纯。
1.2 方 法
1.2.1 pVAX1-PADRE-Blo t 5-21-CpG真核表达载体的构建 热带螨主要变应原Blot5(U59102)、Blot21(DQ788677.1)基因序列来自NCBI GenBank库,进行密码子优化后的序列两端分别加入HindⅢ和XbaⅠ酶切位点,并在N端加上Th通用抗原表位PADRE(AKFVAAWTLKAAA, 序列:5′-GCCAAGTTCGTGGCCGCCTGGACCCTGAAGGCCGCCGCC-3′),在C端加上CpG(TCTCCCAGCGTGCGCCAT)序列,由生工生物工程(上海)股份有限公司(Sangon)进行合成,利用HindⅢ和XbaⅠ酶切回收,连接至经HindⅢ和XbaⅠ酶切回收的pVAX1质粒载体上,最终构建pVAX1-PADRE-Blo t 5-21-CpG真核表达载体(质粒图谱见图1A)。
1.2.2 重组质粒 pVAX1-PADRE-Blo t 5-21-CpG转染 HEK293 细胞的鉴定
1.2.2.1 瞬时转染细胞的准备:转染前 24 h,将培养状态良好的HEK293细胞传代培养于含10%FCS 的 DMEM培养基的培养皿中,次日细胞密度达到70%~80%,更换为Opti-MENI培养基(添加量比平时所加培养基的量少)。
1.2.2.2 转染试剂的配制:采用脂质体转染法,将细胞分成3组进行转染试验,分别为对照组(pVAX1空载体组)、试验组(pVAX1-PADRE-Blo t 5-21-CpG质粒转染组)和空白组(没有转染任何质粒的HEK293细胞组)。将130 μL Opti-MEN培养液分别用于稀释 10 μL 的LipofectamineTM2000 Reagent 和2 μg 的重组质粒,室温放置5 min,将两液体混合,室温静置 20 min,使其形成 DNA 转染复合物,从而完成转染液的配制。
1.2.2.3 重组质粒转染细胞:将DNA-LipofectamineTM2000 Reagent 复合物添加到HEK293细胞中,5%CO2,37 ℃培养 4~6 h。转染 5~6 h 后,轻柔吸取细胞上层的液体换成含10%FCS的DMEM培养基,每皿3 mL,继续培养48 h。
1.2.2.4 重组质粒转染细胞总蛋白的提取:转染48 h后,细胞密度达80%~90%,收集细胞。弃去培养基,加入预先预冷的PBS轻轻晃动清洗培养皿3次,以除去培养基,然后将培养皿置于冰上。每个培养皿中加入150 μL的细胞裂解液,用干净的刮棒将细胞刮至培养皿一侧(动作要快),置于冰上裂解30 min后(为使细胞裂解充分,要经常晃动培养皿,此过程均置冰上进行),用注射器吹打细胞10~12次。裂解完成后,将细胞碎片和裂解液移至1.5 mL EP管中。于4 ℃ 12 000 r·min-1离心15 min,将上清液转移到新的EP管中,-80 ℃保存待用。
1.2.2.5 细胞裂解液配制:细胞裂解液RIPA裂解体系[150 mmol·L-1NaCl,10 mmol·L-1Tris(pH 7.4),1% NP-40,2 mmol·L-1的 EDTA、EGTA和0.1% SDS溶解于80 mL超纯水中,待溶解后加入HCl调pH至7.4.定容至100 mL]。10 mmol·L-1PMSF(称量17.419 g PMSF,溶解于10 mL的无水乙醇)。使用前加入30 mL RIPA+3 mL PMSF+1片复合试剂(含终浓度为2 μg·μL-1的aprotintin和2 μg·μL-1的Leupetin)。
1.2.2.6 Western blot检测重组质粒pVAX1-PADRE-Blo t 5-21-CpG的真核表达:将收集到的细胞裂解液进行SDS-PAGE电泳,将胶条裁至适合大小,与胶条大小一致的NC膜和滤纸浸入转膜液中浸透。按滤纸-NC膜-胶-滤纸(自下而上)的顺序放置在半干转膜仪上,用玻璃棒轻轻滚压滤纸以除去气泡。20 V恒压,转膜30 min。结束后,用5%的脱脂奶粉37 ℃封闭2 h,用1×TBST洗膜5次,每次5 min;用自制的羊抗兔的anti-rBlo t 5-21的一抗(1∶210稀释)和鼠源的anti-Blo t 5一抗(1∶3 000稀释)4 ℃孵育过夜;1×TBST漂洗5次,每次5 min;用辣根过氧化物酶偶联的二抗(1∶5 000稀释)室温避光孵育2 h;1×TBST漂洗5次,每次5 min。TyphoonFLA9500荧光扫描成像系统进行检测。
1.2.3 pVAX1-PADRE-Blo t 5-21-CpG疫苗免疫小鼠 为了检测pVAX1-PADRE-Blo t 5-21-CpG核酸疫苗的免疫效果,选择小鼠进行免疫试验,设置pVAX1-PADRE-Blo t 5-21-CpG疫苗组(n=6),同时设未免疫对照组(n=6)。分别在第0、14天时,通过耳颈后皮下多点注射(100 μL,1 mg·mL-1)两次,然后在第28天通过眼框采血,离心,取血清,存于-20 ℃待用。
1.2.4 ELISA法检测小鼠血清中IgG、IgG1和IgG2a的水平 用包被缓冲液将Blo t 5-21(作为抗原)稀释至10 μg·mL-1(100 μL·孔-1),4 ℃包被96孔酶标板,过夜后弃去液体,吸水纸上拍干,每孔加满洗涤液,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。然后用5%脱脂奶粉封闭酶标板,37 ℃孵育1 h后,同样使用洗涤液洗涤5次,将得到的小鼠血清进行适当的稀释,100 μL·孔-1加入到酶标板中在37 ℃孵育2 h,洗涤步骤如上。然后每孔中加入辣根过氧化物酶(HRP)标记的检测抗体,检测血清中相应的IgG、IgG1和IgG2a的水平,在37 ℃中孵育2 h,同样洗涤5次后,每孔加入底物A、B各50 μL,37 ℃避光孵育15 min。每孔加入终止液50 μL,15 min内,在450 nm波长处测定各孔的OD值。
1.2.5 流式细胞术 免疫小鼠完成后,第28天取小鼠脾,制备脾淋巴细胞悬液,通过流式细胞术检测调节性T细胞。
1.2.5.1 脾淋巴细胞悬液的制备:无菌条件下分离小鼠脾,根据小鼠淋巴细胞分离液说明书制备脾单细胞悬液,具体步骤,①将脾置于含有 PBS 的试管中,加入1 mL小鼠淋巴细胞分离液,用注射器研磨脾(时间控制在5 min内)完全后;立即将脾细胞混悬液转移到离心管中,用尼龙网过滤细胞,再取3 mL分离液清洗尼龙网上残余的淋巴细胞。②添加0.5~1 mL RPMI1640培养基,保持液面分界明显,室温下800 r·min-1离心30 min。设置较慢的加速度和减速度。离心后上层为RPMI1640,次为淋巴细胞层,分离液层,红细胞及其他细胞和死细胞碎片;③吸出淋巴细胞层,转移到新的离心管中,加入 1640 培养基,混匀,室温250 r·min-1离心10 min收集细胞;④弃上清,加入1640 完全培养基(含100 μg·mL-1胎牛血清,100 μg·mL-1链霉素和 100 U·L-1青霉素)重悬细胞,将细胞数调整为(1~5)×106后,待流式细胞仪检测。
1.2.5.2 细胞表面荧光抗体染色:①收集细胞,即取部分细胞,总数1×106~2×106脾淋巴细胞置于1.5 mL EP管中,350 r·min-1离心5 min,弃上清。②染色,去除上清,加入预混抗体的PBS(10%胎牛血清),将细胞混匀,避光,4 ℃或冰上,染色30~60 min,反应总体积100 μL。③清洗,加入至少2 mL的PBS洗涤,350 r·min-1离心5 min,弃上清,洗涤2次。④检测,去除上清,再加入500 μL PBS,吹打混匀后置于冰上,待流式仪检测。
1.2.5.3 细胞内染色方案:使用Fix/permeabilizatioin Buffer(biolegend)固定破膜剂。①固定,进行细胞表面抗原染色后,在黑暗中在室温下于0.5 mL·管-1固定缓冲液中固定细胞20 min。以350 r·min-1离心5 min,弃去上清液,使用PBS将细胞洗涤1次。将细胞重悬于细胞染色缓冲液中。②细胞膜透化作用,即用去离子水中将10×细胞内染色透化缓冲液(intracellular staining permeabilizatioin wash buffer,简写为Perm buffer)稀释至1×。将固定的细胞重悬于1×Perm buffer中,并以350 r·min-1离心5~10 min。重复清洗两次。③细胞内染色,即将上述细胞重悬于1×Perm buffer,并在室温下于避光加入目标荧光基团偶联抗体或适当的阴性对照30~60 min。用2 mL 1×Perm buffer洗涤2次,并以350 r·min-1离心5 min。将细胞重悬于0.5 mL PBS中,并用适当的对照进行流式细胞检测。
2 结 果
2.1 载体构建
纯化后的PCR产物经HindⅢ和XbaⅠ双酶切后,插入到pVAX1表达载体中,构建成功的表达质粒pVAX1-PADRE-Blo t 5-21-CpG经HindⅢ和XbaⅠ双酶切,电泳结果表明,PADRE-Blo t 5-21-CpG基因片段与目的条带大小(801 bp)一致(图1B)。将质粒测序,测序结果与原始序列比对完全一致,表明,pVAX1-PADRE-Blo t 5-21-CpG真核表达载体构建成功。
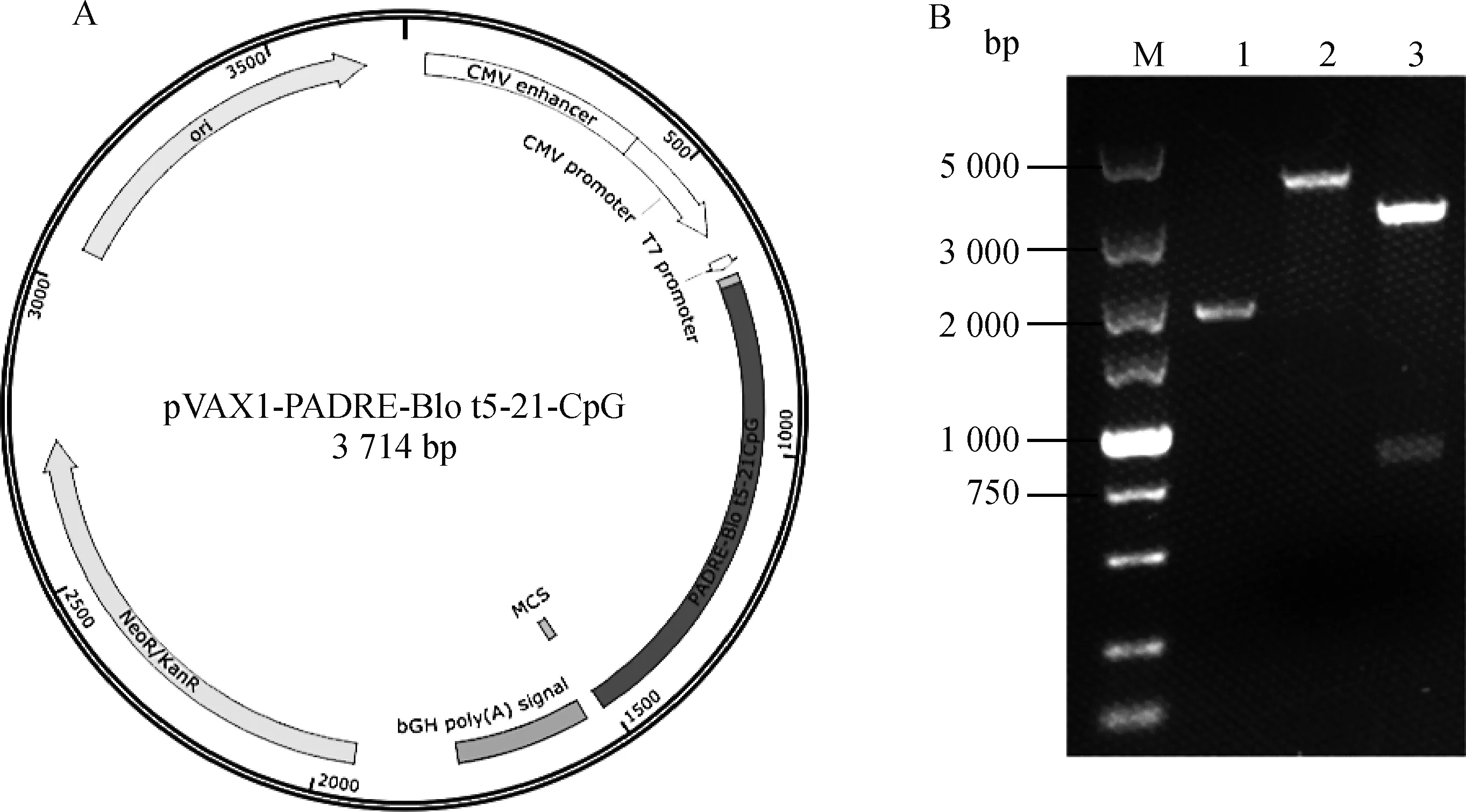
A.pVAX1-PADRE-Blo t 5-21-CpG 质粒图谱;B.pVAX1-PADRE-Blo t 5-21-CpG重组质粒双酶切鉴定(M.DL5000 DNA相对分子质量标准;1.重组质粒对照;2.重组质粒经HindⅢ单酶切产物;3.重组质粒经HindⅢ和XbaⅠ双酶切产物)
2.2 Western blot 检测重组质粒PADRE-Blo t 5-21-CpG蛋白的真核表达
重组质粒pVAX1-PADRE-Blo t 5-21-CpG和空载体pVAX1瞬时转染HEK293细胞,分别收取转染48 h后的2组细胞,进行Western blot检测PADRE-Blo t 5-21-CpG蛋白的表达。经鼠源Biotin4D9 Anti Blo t 5抗体(货号:MA-4D9)为一抗,辣根过氧化物酶(HRP)标记的兔抗鼠二抗进行免疫检测,结果如图2所示,转染pVAX1-PADRE-Blo t 5-21-CpG重组质粒的细胞可以看见特异性条带,大小符合预期。而转染空载体pVAX1组和HEK293细胞对照组没有特异性条带的出现,表明所构建的pVAX1-PADRE-Blo t 5-21-CpG重组质粒可以在体外细胞内正确表达。

M.预染蛋白质相对分子质量标准;1.HEK293细胞裂解物;2.转染pVAX1质粒的HEK293细胞裂解物;3.空白泳道;4.转染质粒pVAX1-PADRE-Blo t 5-21-CpG的HEK293细胞裂解物
2.3 小鼠血清中特异性IgG、IgG1和IgG2a的水平变化
小鼠经两次免疫后,在第28天采血,采用ELISA法检测小鼠血清中特异性IgG、IgG1和IgG2a水平,结果如图3A所示,与正常小鼠未免疫对照组(naïve)相比,pVAX1-PADRE-Blo t 5-21-CpG免疫后小鼠血清中特异性IgG和IgG2a水平显著升高(P<0.05),特异性IgG1水平显示升高趋势,但是和正常小鼠组相比没有统计学差异。统计IgG2a/IgG1的比值发现,与正常小鼠组相比,pVAX1-PADRE-Blo t 5-21-CpG免疫后小鼠的血清IgG2a/IgG1的比值显著升高(图3B,P<0.05),这暗示了pVAX1-PADRE-Blo t 5-21-CpG质粒免疫小鼠后,小鼠体内免疫偏向Th1型反应。

A.小鼠血清中特异性IgG、IgG1、IgG2a水平;B.小鼠血清中特异性IgG2a和IgG1的比值。两个试验组间比较(n=6),*.P<0.05;**.P<0.01;ns.P>0.05
2.4 小鼠脾淋巴细胞中调节性T细胞的检测
小鼠经两次免疫后,在第28天分离小鼠脾制备脾淋巴细胞悬液,流式细胞术检测小鼠脾淋巴细胞中调节性T细胞变化。结果如图4所示,与正常小鼠组(naïve)相比,pVAX1-PADRE-Blo t 5-21-CpG免疫后小鼠脾淋巴细胞中CD4+CD25+Foxp3+T细胞水平显著升高(图4C,P<0.05),这表明pVAX1-PADRE-Blo t 5-21-CpG核酸疫苗可以诱导小鼠产生较高水平的CD4+CD25+Foxp3+调节性T细胞。
3 讨 论
热带螨(Blomiatropicalis)变应原是热带地区最重要的螨变应原,海南岛因其独特的地理位置和气候条件,年平均温度22~26 ℃,相对湿度在76%~86%,是我国最适宜热带螨孳生地之一。研究已经证实Blo t 5是主要的变应原[27]。Blo t 21是具有相似致敏性的第5组变应原(Blo t 5)的旁系同源物[14]。大部分的过敏患者对Blo t 5和Blo t 21这两个变应原同时敏感[28]。Blo t 5和Blo t 21被认为是热带螨的主要变应原[29],而随着城市化的发展,在热带和亚热带地区,由热带螨变应原诱发的过敏性疾病日益增多,包括宠物和人群。因此迫切需要开发能够防治热带螨过敏症的候选疫苗。
本试验成功构建了包含热带螨主要变应原Blo t 5和Blo t 21的真核表达载体pVAX1-PADRE-Blo t 5-21-CpG,并将该重组质粒转染HEK293细胞,Western blot验证该重组质粒能在体外真核细胞内表达出相应的蛋白质,证明该核酸疫苗构建成功,为进一步小鼠免疫试验奠定基础。ELISA试验表明,pVAX1-PADRE-Blo t 5-21-CpG核酸可以诱导小鼠产生高水平IgG,而有研究表明,使用针对特异性皮炎犬的病毒样颗粒疫苗治疗时,可以诱导犬产生高滴度的IgG,从而消除了屋尘螨致敏和诱导犬致敏产生的瘙痒症状[30]。在本试验中,IgG2a/IgG1的比值升高,提示pVAX1-PADRE-Blo t 5-21-CpG核酸可能诱使小鼠体内偏向Th1型的免疫反应。而Mousavi 等[31]的研究表明,使用变应原和CpG的变应原免疫疗治疗时,显著地提高了过敏模型小鼠血清中IgG2a/IgG1的比值,阻止了Th2介导的过敏反应[31]。
支气管哮喘是一种典型的Ⅰ型超敏反应引起的疾病,支气管哮喘发病的T细胞和肥大细胞/嗜碱性粒细胞联合致病,即抗原递呈细胞(APC)加工后的抗原片段与MHC Ⅱ类分子形成复合物,呈递给CD4+T细胞被活化。嗜酸性粒细胞、嗜碱性粒细胞和肥大细胞分泌的IL-4 促进Th0向Th2分化,后者在受到变应原刺激后分泌IL-4、IL-5和IL-13等Th2型细胞因子,通过与相应受体结合介导转导,促进IgE受体(FcεR Ⅰ)结合诱发支气管哮喘的发生。当机体处于正常状态时,Th1和Th2处于动态平衡状态。一旦机体受到外来抗原的刺激,Th1和Th2的表达水平就会发生变化,导致特定类型的免疫反应显示出优势,导致Th1/Th2失衡[32-33],这种失衡是变态反应性疾病的发病机制[34]。研究表明,偏向Th1的Th1/Th2失衡可降低过敏性野生型小鼠的气道高反应性和Th2介导的肺部炎症[35]。在CpG基序与变应原相结合的免疫疗法治疗哮喘的马中发现,该免疫疗法通过下调IL-4等Th2细胞因子的免疫反应,改善了马哮喘的临床反应[36]。Th1细胞通过产生IL-2、TGF-β和IFN-γ,可以抑制过敏反应,在细胞免疫的发展中起关键作用[37-38]。IL-4 和 IL-13 与过敏性哮喘患者血清 IgE 产生的调节密切相关,这两种细胞因子在Th2 哮喘的病理生理学中的相关性使它们成为治疗哮喘的合适目标[39],因此可以通过下调Th2的细胞因子的表达量来抑制过敏反应。本试验构建的真核表达质粒pVAX1-PADRE-Blo t 5-21-CpG核酸疫苗免疫小鼠,其血清中IgG2a、IgG2a/IgG1比例均升高,这暗示了小鼠体内偏向Th1细胞免疫反应。而IgG2a在抑制支气管哮喘发生方面比IgG1更有效[40]。因此,当pVAX1-PADRE-Blo t 5-21-CpG质粒免疫小鼠后,小鼠体内免疫偏向Th1型细胞反应,具有抑制热带螨过敏反应的发生的潜力。此外,在构建的真核表达质粒pVAX1-PADRE-Blo t 5-21-CpG中,作者引入了CD4+T辅助细胞的通用抗原表位PADRE和一段CpG序列。研究表明PADRE可以有效地诱导Th1型反应,且细胞因子IFN-γ呈高表达[41]。CpG寡脱氧核苷酸与变应原特异性免疫疗法结合可以抑制Th2 偏向的超敏反应。例如,含有寡脱氧核苷酸的免疫刺激性CpG被证明可以抑制小鼠过敏性结膜炎和哮喘的发展[42-43]。这可能与CpG基序能激活包括B淋巴细胞和类浆细胞在内的多种免疫细胞,并诱导产生以Th1型细胞免疫反应为主的免疫应答有关[44]。因此,CpG基序可以添加到DNA或常规蛋白质疫苗,以提高Th1免疫反应[45]。DNA疫苗为Ⅰ型过敏的保护性和治疗性治疗开辟了广阔的范围。与传统的免疫疗法(SIT)相比,DNA疫苗的抗过敏作用可以明确归因于其Th1诱导能力[46]。由于多种天然和重组蛋白不容易分离且易于降解,很难纯化出足够数量的蛋白质用于产生抗体等,所以基于DNA的免疫是一种有吸引力的替代策略,它绕开了抗原纯化步骤,直接注射机体以产生抗体[47]。但是DNA疫苗仍有局限性,如DNA疫苗往往具有相对较弱的免疫原性,常常需要大剂量才能有效[23]。通常在小鼠中每次注射(肌肉内)剂量为25~100 μg已经足够诱导小鼠产生较强的免疫反应,但在灵长类动物或人类中似乎需要更高的剂量[20]。
表达转录因子 Foxp3 的调节 T 细胞(Tregs)在维持免疫自我耐受性和预防自身免疫力方面发挥着重要作用[48],调节性T细胞可以发挥免疫抑制作用,抑制过敏性疾病的发生,或者缓解严重过敏性反应[49]。比如Treg细胞能够抑制过敏性Th2细胞反应的发展[50]。使用变应原特异性免疫疗法治疗患有特异性过敏皮炎的狗时,发现Treg细胞及其产生的细胞因子IL-10的含量都显著增加以及血IgE水平显著下降[51],说明Tregs可能在动物皮炎和其他过敏性疾病特应性治疗中发挥重要作用,本试验构建热带螨主要变应原Blo t 5和Blo t 21融合基因的真核表达载体pVAX1-PADRE-Blo t 5-21-CpG,免疫小鼠后可诱导产生较高水平的CD4+CD25+Foxp3+调节性T细胞,这表明表达质粒pVAX1-PADRE-Blo t 5-21-CpG可能可以抑制热带螨诱发的过敏性疾病,下一步计划利用Blo t 5-21重组蛋白或者热带螨粗提物诱导过敏性小鼠模型,然后利用pVAX1-PADRE-Blo t 5-21-CpG疫苗治疗过敏模型小鼠,评估该核酸疫苗抑制小鼠过敏症状的效果及深入探究其机制,这为开发防治热带螨过敏症的兽用疫苗奠定基础。
4 结 论
成功构建热带螨主要变应原融合基因的真核表达载体pVAX1-PADRE-Blo t 5-21-CpG,该核酸疫苗可以诱导小鼠产生特异性IgG,且IgG2a/IgG1比值升高,暗示了核酸疫苗pVAX1-PADRE-Blo t 5-21-CpG可诱导小鼠机体发生偏向Th1型的免疫反应,此外,pVAX1-PADRE-Blo t 5-21-CpG还可以诱导小鼠产生较高水平的CD4+CD25+Foxp3+调节性T细胞,为进一步开发防治热带螨过敏症的兽用核酸疫苗奠定了基础。
——一道江苏高考题的奥秘解读和拓展

