运动应激对衰老大鼠学习记忆能力及海马线粒体UCP4、Caveolin-1蛋白的影响
刘忠民,吕振磊,尹 超
(海南科技职业大学 健康科学学院,海南 海口571126)
运动应激已经被证实可以改善认知机能退行性或轻度认知功能障碍,如阿尔兹海默病(AD)、帕金森等。运动应激使机体的抗氧化防御体系对运动产生适应性改变,增强免疫、神经发生和突触可塑性,减少星形胶质细胞肥大和髓鞘失调,调节脑血管内皮生长因子(VEGF)、脑源性神经营养因子(BDNF)和神经细胞黏附分子(NCAM)等表达,进而延缓脑衰老[1]。解偶联蛋白(UCPs)是线粒体转运蛋白,其在线粒体内膜上产生质子泄漏,从而使氧化磷酸化与ATP合成解偶联。线粒体是活性氧(ROS)产生的主要部位。已经显示,斑块周围诱导型一氧化氮合酶(iNOS)的表达增加有助于AD脑中的氧化应激[2]。UCP是线粒体内蛋白,通过减少自由基的产生来保护神经元[3]。通过控制氧化应激调节细胞能量水平,人类UCP的遗传变异性已被证明与长寿有关[4]。解偶联蛋白4(UCP4)属于解偶联蛋白家族,其位于线粒体内膜并通过线粒体呼吸链在电子传递过程中产生质子电化学梯度。UCP4主要在脑组织中表达,包括海马,皮质,纹状体和小脑。最近的研究表明,UCP4调节不同生物学功能诸如线粒体功能,氧化磷酸化,神经元细胞存活和钙调节等。小窝蛋白-1(Caveolin-1)是小窝结构的蛋白质组分,在质膜。虽然最初认为细胞膜穴样内陷起大分子运输囊泡的作用[5],但它们的作用已经扩展到包括信号转导,细胞代谢,细胞老化,胆固醇体内平衡,内吞作用及肿瘤的促进与抑制[6]。本研究通过运动应激上调海马线粒体UCP4蛋白及控制Caveolin-1的分泌来改善神经细胞线粒体功能,从而抑制氧化应激,达到对大脑认知障碍保护的作用。
1 材料和方法
1.1 动物
所有程序均由海南医学院实验动物中心批准,并根据美国国立卫生研究院动物研究指南进行。6周龄SPF级雄性 Sprange-Dawley大鼠 40只(湖南实验动物有限责任公司提供),随机分为4组,对照组(C)、D-半乳糖注射组(D)、实验组(DE)和运动组(E),体重350 g-400 g,大鼠均分笼饲养于海南医学院动物实验室,自由饮水与摄食,每隔一天定时清理鼠笼、更换垫料。环境温度25℃,相对湿度60%-70%,自然昼夜交替。
1.2 D-半乳糖大鼠衰老模型
为了建立大鼠衰老模型,给D-半乳糖衰老组大鼠腹腔注射大剂量的D-半乳糖(取13 g D-半乳糖融入104 ml生理盐水),所有手术均在麻醉下进行,并努力减少痛苦。
1.3 运动应激大鼠模型的建立
根据BEDFORD 等[7]研究,运动模型采用中等强度的运动应激,完成分组后对照组不进行运动,运动组进行一周的适应训练,逐渐加快跑台速度,使其逐步适应实验设计的训练强度。跑台坡度设为0,跑台速度最终达到1.1 km/h,持续时间从20 min到60 min,每周6天训练,为期8周。具体运动强度实施如表1所示。
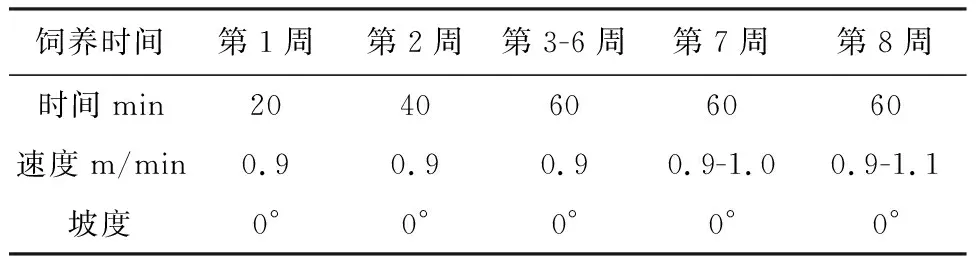
表1 运动组大鼠运动强度
1.4 Morris水迷宫实验
8周运动应激干预后各组大鼠进行水迷宫训练,训练方法采用周丽华[8]等人的研究方法,分为定位航行实验和空间探索实验。水迷宫训练的环境为一个可隔音、隔光的实验室。定位航行实验:实验为期5天,第一天让各组大鼠进行2 min的自游泳,从第二天起,每组每天训练四次,首先让大鼠在站台停留10 s,分别从4个不同象限面向池壁入水,找到并在站台停留5 s结束采集,观察并记录其在水池中的路程图、速度、潜伏期等,若120 s内未找到站台重新让其在站台上停留10 s,潜伏期记为120 s。空间探索实验:在最后一次训练结束后,撤掉站台,观察并记录大鼠在120 s内的站台穿越次数、站台所在象限路程和时间等。
1.5 准备脑组织及血清样本
在每组中,使用6只大鼠进行生化分析,剩余的4只大鼠用于Western Blot和免疫组织化学测试。大鼠经过第八周有氧训练,第九周水迷宫测试完24小时后,腹腔注射10%的水合氯醛(生理盐水,4 ml/kg体重)进行麻醉后,快速打开大鼠腹腔进行腹腔动脉取血,各组大鼠取血后静置过夜,第二天离心去上清,将其储存在-80℃下用于随后的实验。取血结束后用15 ml注射器抽取提前准备好的生理盐水,从心尖进针插入左心室推至主动脉,灌注生理盐水待大鼠肝脏变白后,仔细并迅速取出大鼠的脑组织。在冷板上立即剥离出海马和皮质,保存于液氮中用于生化分析。固定组更换4%多聚甲醛进行固定直到颈部及四肢僵硬为止。将固定组大鼠的脑储存在4%磷酸盐缓冲的多聚甲醛(在0.1M磷酸盐缓冲液,pH 7.4中)中,用于组织病理学检查和免疫组织化学测试。
1.6 免疫组化实验方案
将切片进行脱蜡处理/再水化:用二甲苯浸洗切片3次,每次5 min用无水乙醇浸洗切片2次,共10 min。用95%乙醇浸洗切片2次,每次10 min,在蒸馏水中漂洗2次,每次5 min。抗原修复:加热浸泡在10 mM pH 6.0的柠檬酸盐缓冲液中的玻片,使之维持在准沸腾的温度(95-99℃)10 min。取出放在实验台上自然冷却30 min。染色:切片用漂洗液洗两次,每次5 min。浸泡在3% H2O2中孵育10 min。用蒸馏水漂洗两次,每次5 min。用漂洗液洗5 min。在切片上滴加100-400 μl封闭液(进口羊血清工作液,中杉金桥,EK172428),室温封闭1小时。去掉封闭液,每个切片上加100-400 μl稀释的一抗(1∶50,UCP4:A-5,SC-365295)。4℃孵育过夜。去掉抗体稀释液。用漂洗液洗3次,每次5 min。每个切片加入过氧化物酶标记羊抗兔IgG二抗稀释液(1∶500,博士德,BA1054,HRP Conjugate,China),用漂洗液洗3次,每次5 min。加入100-400 μl DAB,观察染色进展。一旦切片染色成功,立刻将玻片浸入水中。如有需要,将切片泡在苏木精溶液中复染,按照产品说明进行。切片用蒸馏水洗两次,每次5 min。切片脱水:在95%乙醇中孵育两次,每次10 s。在100%乙醇中孵育两次,每次10 s。在二甲苯中孵育两次,每次10 s。加上盖玻片。用Permount固定,并在显微镜(Olympus,Tokyo,Japan)上评价(×200)。
1.7 Western Blot 实验方案
提取蛋白:从液氮中取出100 mg大鼠的海马组织,加入适量的RIPA buffer和PMSF,其中1 ml RIPA buffer加10 μl PMSF;组织匀浆:用剪刀将组织剪成小块,用匀浆器(PRO 200手持式均质匀浆器)在冰水中匀浆,直到没有明显的脑组织沉淀出现,4℃离心机13 000 rpm,8 min,离心两次取上清,取10 μl样品用BCA法测定蛋白浓度。其他分装置于-80℃保存。通过SDS PAGE分离蛋白质并转移到PVDF膜上,5%的脱脂牛奶封闭液(脱脂奶粉:TBST=0.5 g:10 ml)封闭PVDF膜,室温水平摇床孵育2小时。一抗/二抗孵育,将封闭后的杂交膜,在摇床上用TBST洗膜3次×5 min,分别加入经一抗稀释液(碧云天)稀释抗体(UCP4:A-5,SC-365295,1∶1000,Santa Cruz Biotechnology,USA);(Caveolin-1,1∶1000,Anti-Caveolin-1 antibody,ab36152,Abcam,USA)4℃平缓震荡孵育过夜。之后,在摇床上用TBST洗膜3次×5 min。加入辣根过氧化物酶标记山羊抗兔IgG二抗(1∶1000,A0208,碧云天,China)室温平缓震荡孵育2小时。在摇床上用TBST洗膜3次×5 min。ECL显色,打开化学发光显影系统,将配好的ECL发光液均匀的涂布于PVDF蛋白膜上,进行曝光显影,图像分析,测出灰度值。
1.8 微量法测定线粒体复合物Ⅲ活性
严格按照线粒体复合体Ⅲ试剂盒说明书(FHTC-1-Y 苏州科铭铭生物技术有限公司)检测。线粒体复合物Ⅲ的量:1)准确称取 0.1 g组织或收集 500万细胞,加入1 ml试剂一和10 μl试剂三,用冰浴匀浆;2)将匀浆 600 g,4℃离心5 min;3)弃沉淀,将上清液移至另一离心管中,11 000 g,4℃离心 10 min。上清液即为除去线粒体的胞浆蛋白,可用于测定从线粒体泄漏的复合体Ⅲ;步骤③中的沉淀即为线粒体,加入 200 μl试剂二和 2 μl试剂三,超声波破碎(冰浴,功率 20%或 200W,超声3 s,间隔10 s,重复30次;4)分光光度计或酶标仪预热30 min以上,调节波长至550 nm,蒸馏水调零;5)96 孔板中加入10 μl样本、25 μl试剂六和200 μl工作液,立即混匀,记录 550 nm 处初始吸光值A1和2 min 后的吸光值A2,计算 ΔA=A2-A1。
1.9 统计分析
使用双向方差分析(ANOVA)进行统计分析,然后通过SPSS软件(版本13.0)进行Student-Newman-Keuls事后检验。在95%置信水平下接受统计学显着性(P<0.05)。所有数据均表示为平均值±标准差。
2 结果
2.1 运动应激干预对D-半乳糖诱导衰老大鼠大脑认知障碍保护的作用
如图1A所示,随着训练天数的增加,从各组大鼠寻找平台的轨迹上可以明显看出D组在寻找平台时始终沿着平台边缘随意的游动,没有目的性。而DE与其他三组比较在寻找平台的路径上差异不显著。如图1B所示,在空间探索实验中,D组与C组及DE组相比,平均穿越次数明显减少(P<0.05);E组与C及DE组相比平均穿越次数增加(P<0.05)。

图1 运动应激对预防D-半乳糖诱导衰老大鼠认知功能障碍的作用
2.2 运动应激干预上调D-半乳糖诱导衰老大鼠海马CA1区UCP4蛋白
为了研究运动应激干预与非运动干预D-半乳糖诱导的衰老大鼠海马CA1区UCP4是否存在差异性表达,对D组及DE组进行了IHC(图2棕褐色为UCP4蛋白表达)。用IPP (Image-Pro Plus 6.0)软件对图像进行处理得到光密度值(IOD)然后进行差异性分析,由图2B可以看出DE组UCP4蛋白表达与D组相比较多,具有差异性(P<0.05)。
2.3 运动应激干预上调D-半乳糖诱导衰老实验组大鼠海马UCP4蛋白
实验结果显示(图3),D组大鼠海马中UCP4蛋白表达最低,与C组相比具有显著性差异(P<0.01),与DE组相比也具有差异性(P<0.05);而E组与DE组相比,表现出了差异性(P<0.05),与对照组及其他组相比未见差异性。这与之前免疫组化中的结果吻合,说明运动应激后能够上调大鼠海马UCP4蛋白,UCP4位于线粒体的内膜中,起到防止氧化应激的作用,运动应激能够改善因衰老导致的氧化应激给大脑带来的伤害。
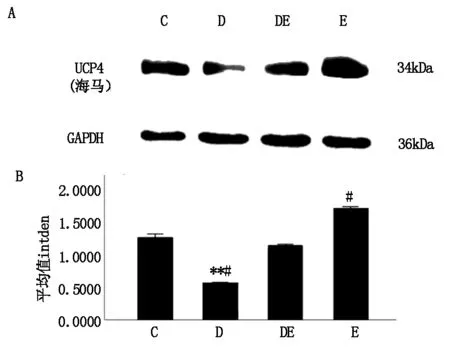
图3 各组大鼠海马UCP4蛋白表达的结果
2.4 运动应激能够抑制D-半乳糖诱导衰老大鼠海马Caveolin-1蛋白的上调
在探索线粒体功能与UCP4蛋白表达的同时研究Caveolin-1在线粒体功能中的影响,Western Blot实验表明,Caveolin-1在注射过D-半乳糖的组别中表达较高,C组Caveolin-1蛋白表达最少,而通过(图4B)可以看出运动后Caveolin-1与对照组相比有所增加但未产生差异性。Caveolin-1在D-半乳糖注射组中表达最多,与对照组相比具有显著的差异性(P<0.01),与DE组相比也产生差异性(P<0.05);DE组与对照组相比具有差异性(P<0.05)。这表明运动应激能够抑制因氧化应激所带来Caveolin-1蛋白的上调。
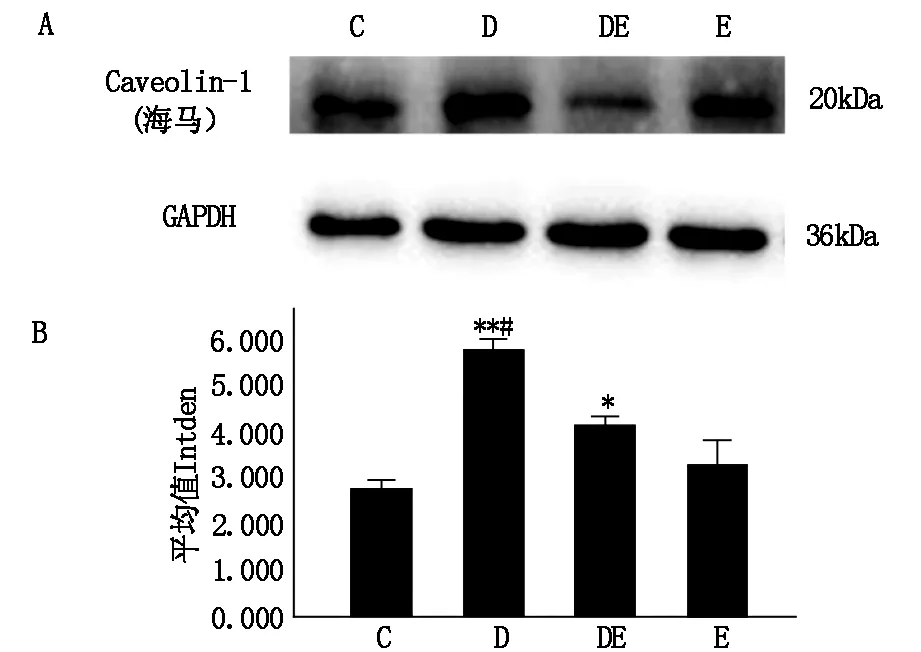
图4 各组大鼠海马Caveolin-1蛋白表达的结果
2.5 运动应激干预提高D-半乳糖诱导衰老大鼠海马线粒体复合物Ⅲ含量
如图5中ELISA测试所示,运动干预组与对照组相比均具有差异性,其中E组具有显著性差异性,这说明运动应激干预可以提高海马线粒提复合物Ⅲ的含量。而D组与运动组相比线粒体复合物Ⅲ的量明显低于运动组,具有差异性(P<0.05)。
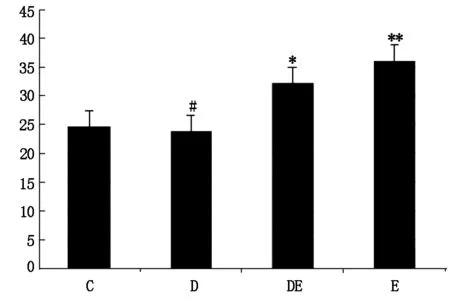
图5 运动应激干预提高D-半乳糖诱导衰老大鼠海马线粒体复合物Ⅲ含量的影响
3 讨论
研究表明,运动应激在衰老过程和几种神经退行性疾病的发展中起着重要作用。本研究揭示了运动应激对D-半乳糖注射大鼠衰老模型中海马神经UCP4蛋白和认知障碍的调节作用。总体而言,运动应激可以通过调节海马神经UCP4蛋白的表达及Caveolin-1蛋白的表达来影响海马线粒体功能,改善D-半乳糖诱导的全身氧化应激反应,学习记忆丧失和神经元损伤。
当细胞被自由基攻击时,Caveolin-1能维持线粒体的完整性和功能,促进线粒体定位[9]。在软骨和内皮细胞中氧化应激对Caveolin-1有上调作用[10]。线粒体UCP具有多种功能,所有这些功能都与它们在减少线粒体内膜质子梯度上的主要作用有关。这一行动的净效应是减少ATP合成,减少钙流入线粒体基质,消散热量,减少ROS产生[11]。
五种已知的UCP(UCP1-5)在组织分布和生理功能方面差异很大。UCP4的作用,几乎完全局限于中枢神经系统,仍然不清楚,但我们的数据表明也可能发挥神经保护作用,因为这些同种型的表达增加了线粒体复合物Ⅲ的活性,表明UCP4在D-半乳糖诱导的大鼠模型中增强了线粒体的功能。
在过去的几十年中,已经建立了多种动物模型用于研究衰老。通过长期施用D-半乳糖(100 mg·kg-1)可以通过实验模拟自然衰老。D-半乳糖是一种还原糖,可以在生理浓度下代谢。长期给药D半乳糖苷酶可导致酶的过载,这损害人体催化半乳糖转化为葡萄糖的能力,并导致过氧化氢和其他自由基的累积。最近的研究表明,慢性系统性D-半乳糖暴露诱导小鼠记忆丧失,神经变性,氧化损伤和炎症反应。在我们的研究中,通过多次动物行为实验,腹腔注射D-半乳糖减少了工作记忆丧失和参考记忆障碍,而没有丧失运动活动。
在本研究中,我们确定了运动应激对大鼠海马UCP4蛋白具有调控作用。在Morris水迷宫中潜伏期是一个很重要的指标,潜伏期时间的长短代表着各组实验大鼠空间记忆的好坏,潜伏期时间短,说明在入水后寻找平台的时间短,还能间接反应水中游泳速度以及入水后各组大鼠的反应,在实验中正常大鼠入水后游泳速度快,D半乳糖干预组游泳速度慢,其入水后四处观望,原地打圈。潜伏期时间长,预示着该组大鼠空间学习记忆能力差。结合水迷宫行为学的研究结果,我们可以推出,与衰老组对比运动应激干预增强了大鼠的学习记忆能力,同时上调了UCP4蛋白的表达,这说明UCP4蛋白对大鼠认知功能障碍具有一定的保护作用。
呼吸链功能下降直接会引起ATP合成量的下降,细胞所需能量不足,从而发生一系列的衰老表现,尤其是心、脑等以ATP为主要能源的代谢旺盛的器官,首先表现衰老[12]。另外呼吸链功能的下降可加速自由基的产生,线粒体复合物Ⅲ也被称为辅酶Q-细胞色素C还原酶,其通过Q循环传递电子,是电子链传递过程中的关键复合物。但有实验证明在没有Caveolin-1的情况下,m-AAA无法定位于线粒体,这种保护机制丧失,导致呼吸链蛋白降解。UCP4也称为脑线粒体载体蛋白,虽然UCP4在神经系统中的作用未证实,他们对减少氧化应激的功能是明确的。某些证据表明UCP4和线粒体复合物Ⅱ之间存在蛋白质 - 蛋白质相互作用:过表达UCP4的神经母细胞瘤细胞通过增加由线粒体复合物Ⅱ介导的琥珀酸诱导的细胞呼吸来增加ATP合成[13]。但是否与线粒体复合物Ⅲ存在一定的联系,需要进一步的研究。在本研究中我们证明了UCP4在脑神经保护的作用,这也与之前Hoang 等人[14]推测UCP4在早期神经元发育过程中起神经保护作用相吻合。在AD患者的大脑中,UCP2,4和5的表达水平显著降低,限制了细胞保护机制的激活[15]。
以前的研究表明,Caveolin-1的过表达可以破坏蛋白质的正常运输,因为它可以作为内化的小寡聚体递送到细胞表面,并被靶向溶酶体降解[16]。本实验结果显示在衰老组中Caveolin-1蛋白过量表达,这一结果说明可以把Caveolin-1作为评价衰老的一个靶点。但本研究可以看出在运动组(E)Caveolin-1的表达较对照组有所提高但并未产生差异性,这说明正常Caveolin-1的表达对神经细胞具有保护作用,这与其在线粒体电子链传递过程中调节复合物活性有关。有实验证明,在氧化应激后,缺乏Caveolin-1的细胞中线粒体蛋白酶活性降低。通过本实验也可以看出虽然过表达可以加速大鼠衰老但适度的表达对衰老具有改善的作用。
总之,目前的研究提供证据表明,通过运动应激干预D-半乳糖诱导的衰老大鼠能改善认知学习功能,延缓其脑老化进程。这可能与线粒体UCP4表达上调,线粒体复合物Ⅲ活性增强以及对Caveolin-1的调控有关。因此,在今后预防老年脑衰老的过程中,加强对老年人运动应激的干预及把Caveolin-1作为检查靶点,把UCP4作为治疗靶点在分子水平延缓大脑的老化具有可行性。

