免疫检查点抑制剂相关垂体炎的研究进展*
陈漂红,李建薇,刘肖珩,谭惠文△
1.四川大学华西医院 内分泌代谢科(成都 610041);2.四川大学华西医院 垂体瘤及相关疾病诊疗中心(成都 610041);3.四川大学华西基础医学与法医学院 生物医学工程研究室(成都 610041)
恶性肿瘤是严重威胁人类健康的一类重大疾病,手术、放疗、化疗是肿瘤治疗的主要手段,目前仍占据重要地位。靶向治疗和免疫治疗是近年来发展起来的新的肿瘤治疗方法,是肿瘤治疗中的革命性突破,其中免疫检查点抑制剂(immune checkpoint inhibitors,ICPis)是目前免疫治疗的主要方式。ICPis的使用为多种进展期恶性肿瘤患者带来了福音,但由于其缺乏肿瘤组织特异性,破坏T细胞对自身抗原的免疫耐受,可导致一系列免疫治疗相关的不良反应(immune-related adverse events,irAEs)[1]。免疫治疗相关垂体炎(immunotherapy induced hypophysitis,IH)作为一种常见的内分泌irAEs,因其垂体前叶功能不全等临床表现缺乏特异性,往往不能被及时准确诊断。因此,临床医生需要在肿瘤的免疫治疗过程中时刻保持警惕:一方面及时诊断处理IH,避免延迟诊断而出现垂体危象,甚至危及生命;另一方面避免因误诊为IH而中断免疫治疗导致肿瘤进展[2]。免疫治疗所致的irAEs, 尤其是IH,给肿瘤治疗带来了新挑战,本文将主要对IH的研究进展进行简要综述。
1 ICPis概述
免疫检查点是表达于T淋巴细胞表面的小分子,在维持机体免疫稳态和自身免疫耐受方面发挥着重要作用。一类免疫检查点如CD28、CD27,通过介导刺激信号增强T细胞活性;另一类免疫检查点主要包括细胞毒性T淋巴细胞相关抗原(cytotoxic T-lymphocyte antigen 4,CTLA-4)和程序性死亡蛋白-1(programmed cell death protein 1,PD-1),通过传递抑制信号钝化T细胞,在免疫耐受方面发挥着重要作用。CTLA-4作用于免疫应答的起始阶段,与其配体CD80和CD86结合后,可传递T细胞抑制信号[3]。PD-1一般作用于免疫应答的后期阶段,通过与程序性死亡蛋白配体1/2(programmed cell death ligand-1/2,PD-L1/2)结合,抑制T细胞的活性及免疫功能[4-5]。肿瘤细胞通过增强CTLA-4和PD-1对T细胞的抑制信号,逃避机体的免疫攻击[3]。ICPis是一类特异的IgG抗体,可识别抑制性免疫检查点PD-1或CTLA-4[6],通过竞争性阻断它们与其配体的相互结合,恢复或增强T细胞对肿瘤细胞的杀伤力,达到抗肿瘤的作用[7]。目前常用的ICPis主要包括PD-1抑制剂和CTLA-4抑制剂两类,国外已批准上市的PD-1抑制剂主要有帕姆单抗、纳武利尤单抗和西米普利单抗。其中,帕姆单抗和纳武利尤单抗已在我国批准上市,主要用于治疗黑色素瘤、非小细胞肺癌(non small cell lung cancer,NSCLC)、肾癌、霍奇金淋巴瘤、头颈鳞癌、尿路上皮癌等恶性肿瘤。另有我国自主研发的4种PD-1抑制剂,即特瑞普利单抗、信迪利单抗、卡瑞利珠单抗和替雷利珠单抗,均已经在国内获批上市[8],主要用于霍奇金淋巴瘤的治疗。CTLA-4抑制剂在国外批准上市的有伊匹木单抗和曲美木单抗两种,主用于治疗黑色素瘤,目前尚未在我国获批上市。为扩大上述两类ICPis对更多肿瘤的临床适应症,有不少临床前期研究正在进行。截至2021年8月17日,在美国国家医学图书馆临床试验官网(https://clinicaltrials.gov/)和我国药物临床试验信息及公示平台(http://www.chinadrugtrials.org.cn/)注册的正在进行的PD-1抑制剂临床研究共计3 218项,正在进行的CTLA-4抑制剂的临床研究共计615项。预计在不久的将来,这两类ICPis的临床适应症或进一步增加,临床运用也会越来越广泛。目前已经获准上市的PD-1单抗与CTLA-4单抗的代表药物、获批上市时间及详细临床适应症等信息(表1)。
2 ICPis相关不良反应概况
由于ICPis扰乱了机体对自身免疫耐受的维持,由自身反应性T细胞、自身抗体和细胞因子等多种途径共同参与导致一系列irAEs,可累及多个器官系统,最常见于皮肤和胃肠道,其次是肺、内分泌系统和肌肉骨骼系统,也可累及泌尿、神经、血液和心血管系统等[9]。自2017年欧洲临床肿瘤协会(European society for medical oncology,ESMO)[10]发布全球第一部关于免疫治疗不良事件管理的临床实践指南伊始,先后有美国肿瘤免疫治疗协会[9]、美国临床肿瘤协会(American society of clinical oncology,ASCO)联合美国国家综合癌症网络(national comprehensive cancer network,NCCN)[11]及中国临床肿瘤学会相继发布了免疫治疗相关不良事件管理的临床指南。内分泌系统因血供丰富成为irAEs较易累及的系统之一[12]。2018年开始,英国内分泌协会[13]、日本内分泌协会[14]及法国内分泌协会[15]先后发布ICPis治疗相关内分泌不良反应管理指南,中华医学会内分泌学分会和中国抗癌协会肿瘤内分泌专业委员会也于2021年相继发表了两个ICPis所致内分泌系统免疫相关不良反应的专家共识[16-17]。目前已经报道的内分泌系统irAEs 包括免疫治疗相关的糖尿病、甲状腺功能障碍、肾上腺功能不全和垂体炎等[18]。IH虽然总体发生率不高,但因临床表现缺乏特异性,误诊、漏诊均会导致不良预后,日益受到国内外学者的重视。上述关于内分泌系统irAEs的专家共识和临床指南都对IH 的诊治进行了阐述,并强调IH的正确诊治对肿瘤患者的预后非常重要。

表1 PD-1抑制剂与CTLA-4抑制剂代表药物及其适应证
3 ICPis相关垂体炎的发病情况
2003年Phan等[19]报道了第1例IH,一位54岁的男性黑色素瘤患者,在接受CTLA-4抑制剂伊匹木单抗治疗4个周期后,出现了性格改变和记忆力下降。在进行第5个治疗周期时,实验室检查提示患者全垂体前叶功能减退,促甲状腺激素(thyroid stimulating hormone,TSH)、游离甲状腺素(free thyroxine,FT4)、促肾上腺皮质激素(adrenocorticotrophic hormone,ACTH)、皮质醇、生长激素(growth hormone,GH)、催乳素(prolactin,PRL)和睾酮(testosterone,T)水平均低至无法检测;其鞍区核磁共振(MRI)显示垂体体积饱满。该患者随后被诊断为IH,在接受了氢化可的松、甲状腺素和T替代治疗后,临床症状得以改善。2016年,日本学者Ishikawa等[20]报道1例PD-1抑制剂所致IH,为黑色素瘤伴右侧肾上腺转移的55岁男性患者,在使用纳武利尤单抗治疗4个周期后,出现恶心、厌食、体重下降,实验室检查显示ACTH、皮质醇明显降低,予以氢化可的松治疗后症状逐渐好转,被诊断为纳武利尤单抗所致IH。此后,IH屡见报道[18,21-22]。
IH作为常见的内分泌irAEs之一,其发生率与ICPis的药物种类和治疗方案有关[23]。至今已有多个系统评价对IH的发生率进行统计分析[2,24-33],结果显示PD-1抑制剂与CTLA-4抑制剂联合治疗方案所致IH的发生率最高,可达接受治疗患者的10%[31],而CTLA-4抑制剂和PD-1抑制剂单药治疗所致IH发生率则远低于联合治疗方案,分别占治疗人群的5%和1%[25,28]。随着ICPis临床试验的开展及上市时间的延长,IH的发生率统计数据可能还会发生变化。有研究[34]报道,CTLA-4抑制剂伊匹木单抗所致IH的发生率随药物剂量增加而增加,在接受低剂量伊匹木单抗(<3 mg/kg)的患者中,IH发生率为1.8%~3.3%,而当伊匹木单抗剂量增加(>3 mg/kg)时,IH的发生率达到9%~17%[12]。目前关于PD-1抑制剂所致IH的报道较少,因此PD-1抑制剂所致IH的发生率及其与剂量的关系尚待观察。CTLA-4抑制剂所致IH多发于60岁左右的男性[4],男女发生比例约为4∶1[35],这种性别差异可能是由于CTLA-4抑制剂伊匹木单抗主要用于治疗黑色素瘤,而男性的黑色素瘤发病率高于女性[23]。PD-1抑制剂所致IH发病的中位年龄为60~65岁[36-37],男女比例约为1~3∶1[36-37],该数据来源于两项分别包含17例和22例PD-1抑制剂所致IH患者的随访研究,由于两项研究的患病例数有限,PD-1抑制剂所致IH是否具有性别差异还需要更多临床数据佐证。相关研究[36-39]发现,IH的发生时间与ICPis的种类有关。PD-1抑制剂与CTLA-4抑制剂联合治疗所致IH一般是在治疗后4周左右出现;CTLA-4抑制剂单药治疗者多在起始治疗9.3周左右出现[37];PD-1抑制剂所致IH发生时间相对较晚,中位发病时间约为28周[36],甚至有在停止使用PD-1抑制剂后15个月才出现IH[40]。
总之,目前看来在接受PD-1抑制剂与CTLA-4抑制剂联合治疗方案的男性患者中IH发生率最高;其次是CTLA-4抑制剂单药治疗,可能存在剂量依赖关系;在接受PD-1抑制剂单药治疗的发生率较低。IH发病时间从ICPis治疗后4~28周不等,甚至部分在结束治疗后才发病。相关流行病学数据还需要未来更多的临床研究加以补充和完善。
4 ICPis相关垂体炎的发病机制
irAEs发生的确切机制目前尚不完全清楚,多数学者认为其发生的病理生理机制与免疫检查点在机体维持免疫系统稳态中的作用失衡有关。目前IH的发生机制研究已有一定进展。Iwama等[41]在动物实验中证实CTLA-4抑制剂诱导的小鼠垂体炎模型的垂体组织中发现CTLA-4抗原的表达。研究[41-42]进一步对CTLA-4抑制剂治疗后出现IH后病故患者进行尸检,发现其垂体组织亦表达CTLA-4,尤其是在垂体TSH和PRL细胞上优势表达,提示CTLA-4抑制剂可直接与垂体细胞上的CTLA-4结合,并将其作为抗原呈递给CD8+T细胞,通过IV型超敏反应诱发IH[43]。这与CTLA-4抑制剂所致IH易出现甲状腺轴功能受损的临床表现符合。此外,CTLA-4抑制剂中,伊匹木单抗是IgG1亚型,曲美木单抗是IgG2亚型[41]。这两种IgG亚型均可触发Ⅱ型超敏反应中抗体依赖的细胞介导的细胞毒性作用(antibody-dependent cell-mediated cytotoxicity,ADCC)和经典补体激活途径[44]。因此,CTLA-4抑制剂还能通过Ⅱ型超敏反应诱发IH。相对于CTLA-4抑制剂而言,PD-1抑制剂所致IH的机制研究还比较匮乏。由于PD-1抑制剂的主要成分是类似IgG4的IgG-4κ或IgG4单克隆抗体,国内有学者[45]推测,PD-1抑制剂所致IH可能与IgG4相关垂体炎的发病机制类似。但实际上,IgG4相关垂体炎的具体发病机制也还未完全阐明[46]。有学者[47-48]发现,IgG4相关垂体炎患者的血清中存在抗垂体抗体,并用这些抗垂体抗体处理活检的垂体组织,再将其结合的垂体抗原蛋白进行质谱分析,发现生长激素和阿片黑素可能为可疑自身抗原。Kanie等[49]利用类似方法对20例使用PD-1/PD-L1 抑制剂治疗后出现IH患者的血清及肿瘤标本进行检测,结果显示这些IH患者外周血中存在抗垂体抗体、抗ACTH抗体和抗GH抗体。IgG4相关垂体炎和PD-1抑制剂所致IH患者的外周血中均存在抗垂体抗体或抗垂体激素自身抗体,提示PD-1抑制剂所致IH与IgG4相关垂体炎可能在发病机制上类似,均有自身免疫参与,但具体发病机制还需进一步探究。此外,Tahir等[50]利用重组表达cDNA克隆的血清学分析技术(serological analysis of recombinantly expressed cDNA clone,SEREX)对使用CTLA-4抑制剂伊匹木单抗、PD-1抑制剂纳武利尤单抗及联合使用两种ICPis所致IH患者的血清样本中的自身抗体进行筛查,发现抗鸟嘌呤核苷酸结合蛋白G(olf)亚基(guanine nucleotide-binding protein G subunit alpha,GNAL) 和抗整合膜蛋白2B(integral membrane protein 2B,ITM2B)的自身抗体明显升高,而GNAL和ITM2B是正常脑组织表达的蛋白[51-52],因此推测抗GNAL和抗ITM2B抗体可能是IH发生的潜在危险因素[50]。
总之,CTLA-4抑制剂主要通过Ⅱ型和Ⅳ型超敏反应诱发IH,PD-1抑制剂所致IH的发病机制尚不明确,可能与IgG4相关垂体炎类似,抗GNAL和抗ITM2B抗体也可能潜在参与IH,但是对于IH发病机制的研究有待进一步探索。
5 ICPis相关垂体炎的临床特征
IH患者的临床表现缺乏特异性。一般而言,头痛、疲乏、食欲不振和垂体增大是其主要特征,中枢性尿崩症和视觉障碍相对罕见,具体表现因ICPis的种类不同而存在一定差异[43]。PD-1抑制剂所致IH多表现为疲乏和食欲不振[36],常以孤立的继发性肾上腺功能不全为主要特征[36,53]。而CTLA-4抑制剂所致IH则以头痛、疲乏为常见表现,出现全垂体功能减退的患者常合并垂体增大[37]。据研究[36]报道,两类ICPis所致IH垂体前叶受累的程度不同,PD-1抑制剂所致IH出现ACTH缺乏近100%,而TSH、GH和促卵泡激素(follicle-stimulating hormone,FSH)/黄体生成素(luteinizing hormone,LH)受累较为少见,其发生率依次为治疗人群的11.8%、13.3%和18.8%[36]。CTLA-4抑制剂所致IH中较常见的是FSH/LH缺乏(88%)和TSH缺乏(81%),其次才是ACTH缺乏(55%)[37],但以ACTH缺乏者临床表现最为严重[21,54-55]。IH重症患者可出现高热、低血压、电解质紊乱(主要是低钠血症),甚至有意识障碍、昏迷等垂体危象表现,由于症状不具特异性,常需与具有类似表现的危重症相鉴别[16]。IH累及垂体后叶出现中枢性尿崩症十分罕见,目前仅4例,分别由PD-1抑制剂纳武利尤单抗[56-57]和CTLA-4抑制剂伊匹木单抗所致[58-59]。值得注意的是,这类IH相关的低钠血症需要同肿瘤所致的抗利尿激素不适当分泌综合征(syndrome of inappropriate antidiuretic hormone secretion,SIADH)相鉴别。垂体影像学检查有助于鉴别IH与垂体转移瘤、垂体腺瘤、感染性垂体疾病等,其中,垂体增强MRI是较敏感检查方法。PD-1抑制剂所致IH患者仅28%出现垂体增大[37],而CTLA-4抑制剂所致IH患者中98%可出现垂体增大[37]。一项有关IH的纵向回顾性研究[35]提示,垂体的影像学改变可出现在临床症状发生和激素水平变化之前,也可出现在临床症状发生和激素水平变化之后。因此,早期垂体增强MRI未见垂体明显长大也并不能排除IH[4,21]。PD-1抑制剂与CTLA-4抑制剂所致IH临床表现、实验室检查及垂体MRI的差异总结(表2)。
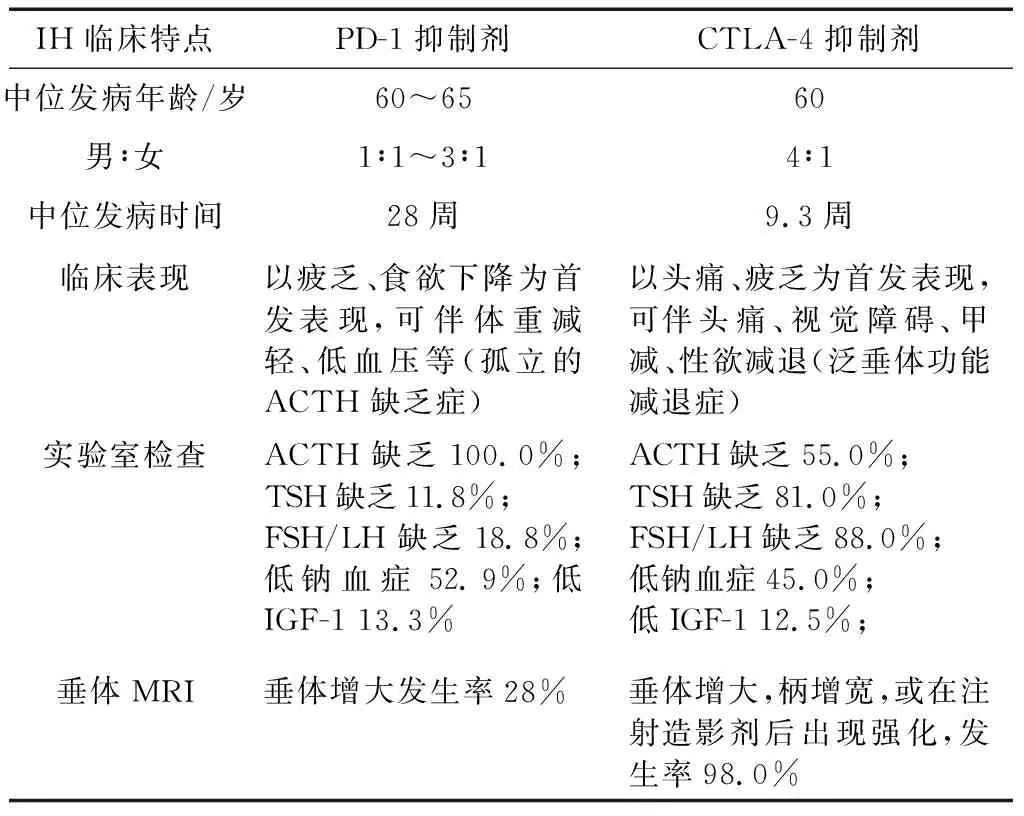
表2 PD-1抑制剂与CTLA-4抑制剂所致IH的差异
因IH出现的垂体前叶功能减退症状和垂体影像学变化缺乏临床特异性,容易被漏诊、误诊。但是,实验室检查对诊断IH却较为敏感。Albarel等[60]和Castinetti等[61]建议在使用ICPis前需评估垂体相关激素和垂体MRI,垂体相关激素包括下丘脑-垂体-甲状腺轴(hypothalamic-pituitary-thyroid axis,HPT)中的TSH、FT4、FT3,下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA)的ACTH、PTC,必要时行ACTH兴奋试验及下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonad axis,HPG)的FSH、LH、T/E2;此外,还包含GH、IGF-1和PRL的评估。同时还需要检测血电解质、血渗透压、尿渗透压及尿比重等指标评估垂体后叶功能。根据IH发病的中位时间,Briet等[38]建议使用ICPis治疗后,对未出现垂体功能减退症状的患者,在ICPis治疗的第1个6个月内,每1个疗程均要评估垂体前叶功能,检测血电解质等;在治疗的第2个6个月中,建议每两个疗程评估1次;在使用ICPis治疗12个月后,由于已经超过IH的常见发病时间,故不再常规进行垂体激素评估,但是如果患者出现头痛、乏力、食欲减退等可疑症状,仍需评估垂体前叶功能及血电解质等。垂体影像学检查在上述评估垂体前叶功能的时点并非必须,但若出现垂体前叶功能减退,则需进行垂体影像学检查。因此,在使用ICPis过程中,如患者出现可疑垂体前叶功能减退临床症状时,应立即评估垂体前叶及后叶功能[54],并同时完成垂体影像学检查。
6 ICPis相关垂体炎的诊断及严重程度分级
目前,国外指南[15,38]对IH的诊断尚无一致性诊断标准,但均建议当使用ICPis的肿瘤患者出现可疑垂体前叶功能减退临床症状(如疲乏、食欲下降等),和/或低钠血症,和/或检查提示≥1种垂体前叶激素缺乏(必备TSH或ACTH缺乏),和/或垂体异常影像学表现时,需考虑IH。2021年,中华医学会内分泌学分会和中国抗癌协会肿瘤内分泌专业委员会的专家共识[16-17]推荐IH诊断标准为:使用ICPis后出现垂体前叶激素缺乏≥1种(必有TSH或ACTH缺乏)且伴有垂体MRI异常表现,或使用ICPis后垂体前叶激素缺乏≥2种(必有TSH或ACTH缺乏)以及伴有头痛和其他垂体前叶功能减退症状。但这一标准有可能使部分以孤立性肾上腺功能减退,但不伴垂体MRI异常的PD-1抑制剂相关性IH的患者出现漏诊[37]。因此,对于这部分不伴垂体MRI异常患者要特别警惕。
IH严重程度不同,后续的诊治也存在一定差异。中国临床肿瘤学会(Chinese society of clinical oncology,CSCO)发表的《2019 CSCO免疫检查点抑制剂相关的毒性管理指南》、中华医学会内分泌学分会免疫内分泌学组[16]发表的《免疫检查点抑制剂引起的内分泌系统免疫相关不良反应专家共识(2020)》以及吴永忠等[17]在2021发表的《免疫检查点抑制剂主要内分泌不良反应急症处理中国专家共识》均推荐采用美国国家癌症研究所(national cancer institute,NCI)发布的《不良事件通用术语标准》(the common terminology criteria for adverse events,CTCAE)来描述IH的严重程度。IH的严重程度分为1~5级:1级=轻度(无症状或轻度症状),2级=中度(轻中度,轻微的局部症状;需非侵入性治疗;自理能力轻度受损;日常活动不受限),3级=重度(严重或临床重要的,但暂时没有生命威胁;需要住院或住院时间延长;自理能力严重受损;影响日常活动),4级=危及生命(威胁生命,需要紧急干预;不能进行日常活动),5级=死亡。目前CTCAE 1~5级的IH均有报道,但多数为CTCAE 1~2级,严重级别(CTCAE 3~5级)的IH报道相对较少,约占IH总例数的10%~40%[24,30,32]。
7 ICPis相关垂体炎的治疗和预后
英国内分泌协会[13]、中华医学会内分泌学分会免疫内分泌学组[16]和中国抗癌协会肿瘤内分泌专业委员会[17]均建议,首先根据患者的临床表现对IH的严重程度进行CTCAE分级,同时完善垂体前叶激素、血电解质、血渗透压、尿渗透压及尿比重等实验室检查。对于评估为CTCAE 1级的IH患者(轻度疲乏、厌食,不伴头痛或无症状),ESMO及国内专家共识均建议可继续ICPis治疗,同时根据实验室评估结果,给予受损垂体-靶腺轴相应的激素替代治疗[10,17]。对于CTCAE 2级的IH患者(头痛但不伴视觉障碍或者仅疲劳、情绪改变但无血流动力学不稳和电解质紊乱),ESMO建议应暂停ICPis治疗,并立即予以强的松0.5~1 mg·kg-1·d-1口服;若48 h内症状无缓解,需静脉给予甲强龙0.5~1 mg·kg-1·d-1,并在2~4周内减量为强的松5 mg/d口服维持治疗[10];同时对其他受损垂体-靶腺轴予以相应的激素替代治疗。由于停用 ICPis并不影响垂体炎的自然病程[62],而继续ICPis治疗肿瘤的生存获益远大于垂体前叶功能减退的风险,ESMO[10]认为度过IH急性期后可继续使用ICPis治疗。中国专家[16-17]共识提出,对于CTCAE 2级IH不需中断ICPis治疗。对于CTCAE 3~4级的IH患者(严重占位效应;或重度头痛、视觉障碍;或严重肾上腺功能不全;或低血压、严重电解质紊乱),所有指南均建议暂停ICPis治疗[63],并立即静脉给予甲强龙1 mg·kg-1·d-1,在2~4周内将糖皮质激素减量为强的松5 mg/d口服维持治疗;同时根据检测结果,对其他受损垂体-靶腺轴给予相应的激素替代治疗[10],直至度过IH急性期,再继续使用ICPis治疗。对于同时存在ACTH和TSH缺乏的患者,日本内分泌协会[14]建议在给予氢化可的松(10~20 mg/d)5~7 d后再给予低剂量左旋甲状腺素(12.5~25 μg/d)治疗,并根据FT4的血清水平调整左旋甲状腺素剂量,以避免诱发医源性肾上腺危象。研究[64]发现,接受大剂量(日平均强的松剂量>7.5 mg)的糖皮质激素治疗会影响ICPis的临床抗肿瘤疗效,降低患者生存率,同时增加感染、高血糖等发生风险[62],且不能改善垂体前叶功能减退的预后[11],故国内外学者[14,16]均不推荐大剂量糖皮质激素治疗。若患者合并难治性头痛和(或)视觉障碍等,日本内分泌协会[14]推荐使用强的松0.5~1.0 mg·kg-1·d-1。一旦难治性头痛和(或)视觉障碍等症状消失,应在2~4周内快速将糖皮质激素减量至生理替代剂量[10]。由于HPG轴受损较易恢复,且对患者的生存威胁较小,法国内分泌协会[15]建议对于HPG轴受损的患者可持续随访3个月,若3个月后仍未恢复,可根据患者的年龄等情况予以相应的性激素替代治疗。对于GH-IGF-1轴受损的患者,由于考虑到患者原发恶性肿瘤背景,法国内分泌学会[15]不建议进行生长激素替代治疗。若垂体后叶受损出现尿崩症,中华医学会内分泌学分会[16]以及黄乐富等[65]推荐使用人工合成的抗利尿激素(antidiuretic hormone,ADH)治疗。本文根据国内外指南推荐意见,对IH的诊治流程做简要总结(图1)。
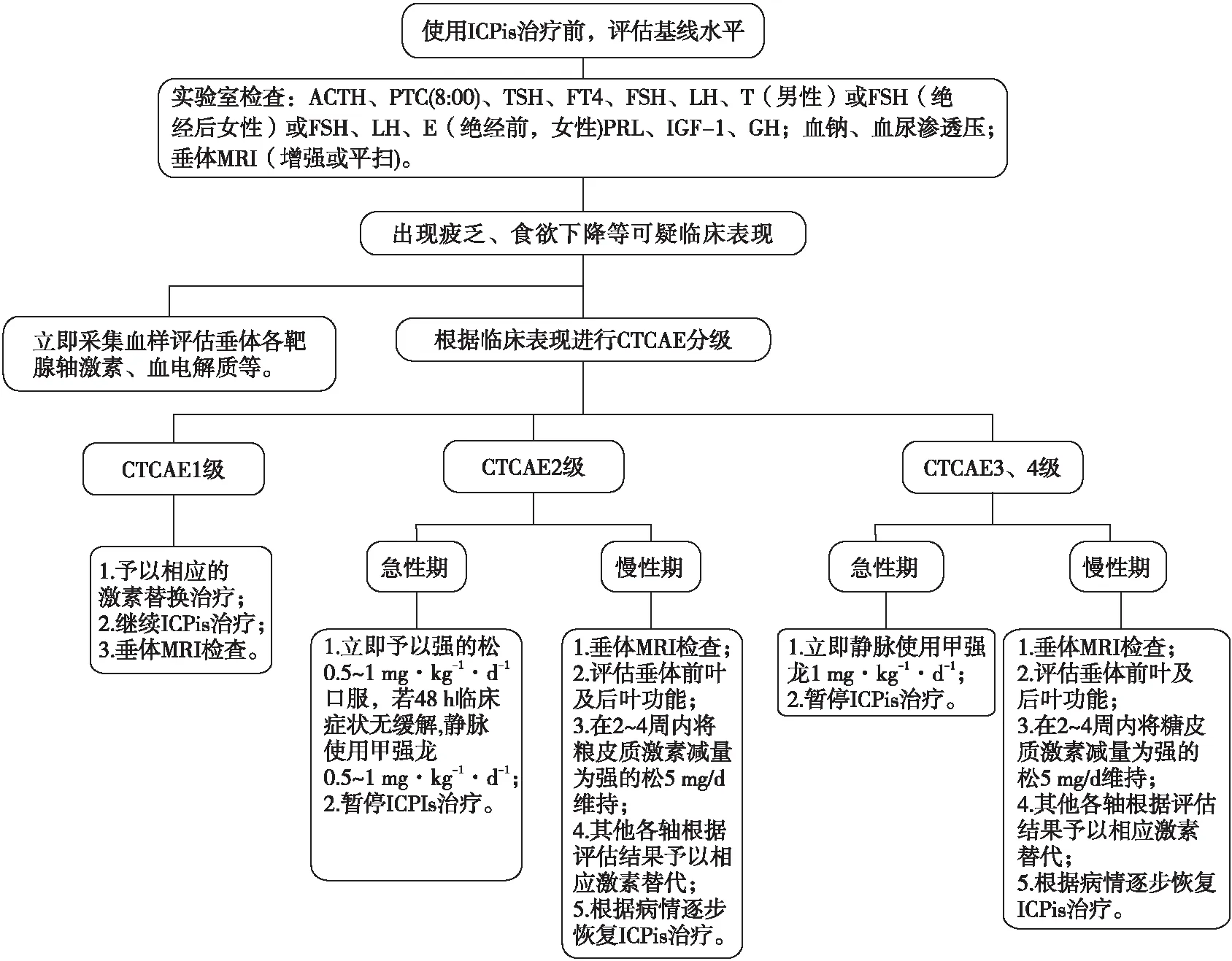
图1 ICPis相关垂体炎的诊治流程图
与ICPis其他相关不良反应相比,IH的预后相对较好。一般而言,度过疾病急性期,均可恢复ICPis治疗。86%~100%的IH患者出现永久性HPA轴受损,需要长期糖皮质激素替代治疗[66]。PD-1抑制剂所致IH出现永久性HPA轴受损较CTLA-4抑制剂更为常见[36],因此PD-1抑制剂的使用尤其需要引起临床医生重视。另外有研究[62]提示,一般情况下HPT轴10.5周左右恢复,HPG轴15周左右可以恢复,但是13%~36%患者可出现永久性HPG轴受损[62,66]。由于上述各垂体-靶腺轴受损程度与恢复时间并不同步[16],法国内分泌协会[15]建议对于已经诊断的IH患者,自IH诊断开始前6个月,每一疗程前均需评估各垂体-靶腺轴激素,及时发现新的垂体靶腺轴受损;在其后的6个月,每3个月评估1次各垂体-靶腺轴激素;12个月后则每年评估2次各垂体-靶腺轴激素;同时,建议自诊断IH开始,每3个月复查1次垂体MRI,评估IH影像学进展情况,帮助排除原发肿瘤的垂体转移。
8 小结与展望
近年来ICPis在进展期恶性肿瘤患者中的应用取得一定进展,IH作为ICPis使用过程中常见的内分泌irAEs也日益受到关注。IH的临床表现缺乏特异性,其所致的垂体前叶功能不全可威胁患者生命安全,中断ICPis治疗会导致肿瘤进展,故早期、正确诊断IH尤为重要。PD-1抑制剂及CTLA-4抑制剂所致IH的发病机制不同,PD-1抑制剂所致IH以孤立性ACTH缺乏为主要特征,而CTLA-4抑制剂所致IH则常出现全垂体前叶功能减退合并垂体增大。垂体前叶激素,尤其是HPA轴评估是诊断IH的较敏感方法之一,临床应重视在ICPis使用前和使用过程中动态监测垂体-靶腺轴激素和垂体MRI。一旦诊断IH,应立即启动激素替代治疗,谨慎使用大剂量糖皮质激素冲击治疗,并评估是否暂停ICPis治疗。及时准确诊断、治疗IH对保障患者安全、改善患者预后具有重要的临床意义。

