坤复康片中异泽兰黄素小肠吸收特征研究
徐人杰 张涛 潘海滔 钦博 周萍
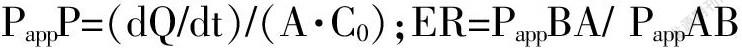
[摘要] 目的 研究坤复康片中的异泽兰黄素小肠吸收和坤复康片对其吸收的影响。方法 Caco-2细胞模型研究不同药物浓度、pH值、温度和抑制剂对异泽兰黄素双向渗透吸收的影响。采用药动学实验研究坤复康片在体内对异泽兰黄素吸收的影响。结果 数据表明,异泽兰黄素在Caco-2细胞模型中吸收较差,三种待测浓度下其吸收仅为3.27×10-7cm/s至5.37×10-7cm/s[从顶膜端(AP)到底膜端(BL)]和从6.27×10-7cm/s至9.63×10-7cm/s(从BL到AP),其转运具有pH和温度依赖性。异泽兰黄素的细胞通透性受多耐药蛋白抑制剂MK571和吲哚美辛的影响。当坤复康溶液加入后,异泽兰黄素的吸收显著性增加,从4.41×10-7cm/s至6.43×10-7cm/s(从AP到BL)。在药动学实验中,坤复康组的异泽兰黄素相对于单体组有更大的吸收入血暴露量。 结论 坤复康片中某些成分会显著促进异泽兰黄素的吸收。
[关键词] 异泽兰黄素;Caco-2;口服;吸收机制;坤复康片
[中图分类号] R969.2 [文献标识码] A [文章编号] 1673-9701(2022)06-0038-05
[Abstract] Objective To study the small intestinal absorption of eupatilin in Kunfukang tablets and the effect of Kunfukang tablets on its absorption. Methods Caco-2 cell model was used to study the effects of different drug concentrations, pH values, temperatures, and inhibitors on the bidirectional permeation and absorption of eupatilin. Pharmacokinetic experiments were used to study the effect of Kunfukang tablets on the absorption of eupatilin in vivo. Results Data showed that eupatilin was poorly absorbed in the Caco-2 cell model, and its absorption was 3.27×10-7cm/s to 5.37× 10-7cm/s (from AP to the BL) and from 6.27×10-7cm/s to 9.63×10-7cm/s(from BL to AP) at three concentrations to be measured. Its transport was pH and temperature-dependent. The cell permeability of eupatilin was affected by the multidrug resistance protein inhibitors MK571 and indomethacin. After the addition of Kunfukang solution, the absorption of eupatilin significantly increased, from 4.41×10-7cm/s to 6.43×10-7cm/s (from AP to BL). In the pharmacokinetic experiment, the absorption exposure of eupatilin in the Kunfukang group was greater than that in the monomer group. Conclusion Some components in Kunfukang tablets can significantly promote the absorption of eupatilin.
[Key words] Eupatilin; Caco-2; Oral; Absorption mechanism; Kunfukang tablets
坤复康片是著名的中药配方,包括赤芍、苦参、香附、猪苓、女贞子、南刘寄奴、乌药、粉萆解、扁蓄等几种中药材,临床用于治疗中国女性的骨盆炎症[1-3]。异泽兰黄素是坤复康片中最重要的黄酮类化合物之一,来源于南刘寄奴[4]。各种药理研究表明,异泽兰黄素具有抗炎、抗氧化、抗肿瘤、抗过敏等作用[5-8]。研究表明异泽兰黄素的绝对生物利用度偏低[9-10]。小肠吸收障碍是影响外源性物质生物利用度的重要因素[11-12]。探讨异泽兰黄素的肠道吸收机制不仅是研究其体内药代动力学所必需的,还为其起效机制提供了关键信息。本研究旨在通过体外Caco-2實验和体内药动学实验揭示异泽兰黄素的小肠吸收机制,并探讨坤复康片对异泽兰黄素口服吸收的影响[13-16],现报道如下。
1 资料与方法
1.1 一般资料
1.1.1 试剂 Transwell 转运小室(12孔,0.4 μmol/L);96 孔细胞培养板、培养瓶(Corning 公司,美国)。缓冲盐溶液(hanks balanced salt solutions,HBSS),二甲亚砜(dimethyl sulfoxide,DMSO),DMEM培养基由上海阿拉丁生化科技股份有限公司提供。坤复康片(陕西康惠制药股份有限公司,批号 200901)均为市售品。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5)-dimethylthiahiazo(-z-y1)-3,5-di-phenytetrazo liumromide,MTT)购自白鲨生物科技有限公司;细胞Caco-2 细胞株,购自中国科学院上海细胞库,代数在35~50代。
1.1.2 仪器 Applied Biosystem 5500 QTRAP hybrid triple-quad 三重四极杆质谱(美国AB科学技术公司);ZORBAX Eclipse Plus C18色谱柱(美国安捷伦科技有限公司,50 mm×2.1 mm,1.8 μmol/L)。跨膜电阻仪(Millicell ERS system,Millipore,MA,美国)。
1.2 方法
1.2.1 色谱及质谱条件 流动相:乙腈(A)-0.1%甲酸(B)。梯度洗脱如下:0~5.0 min,1.0→95.0% A;5.0~7.0 min 95.0% A;7.0~7.1 min,95.0→1.0% A;7.1~9 min, 1.0% A。在线脱气;流速:0.4 ml/min;柱温:30℃;进样量:2 μl。
ESI离子源,负离子模式;采集方式多反应监测(MRM)。m/z 343.0 → 328.0(异泽兰黄素),m/z 415.1 → 267.1(葛根素,内标),碰撞能量(CE):-26 V(异泽兰黄素),-40 V(葛根素)。
1.2.2 坤复康溶液的配制 坤复康片研磨后用水充分溶解后超声离心沉淀,收集水溶液1 ml置于10 ml容量瓶中定容。异泽兰黄素在坤复康片中的含量约为2.012 mg/g,在坤复康水溶液中约为5.850 μmol/L。
1.2.3 标准溶液的配制 精密称取异泽兰黄素对照品适量,用DMSO 配制成浓溶液,实验前用HBSS(用于Caco-2实验)或甲醇(用于药动学实验)稀释至所需药物浓度。
1.2.4 样本处理 培养基或大鼠血浆样品50 μl,加入70 ng/ml葛根素甲醇溶液10 μl,补足390 μl甲醇,涡旋离心后吸取2 μl上清进样LC-MS/MS分析。
1.2.5 Caco-2细胞毒 采用MTT法检测异泽兰黄素的细胞毒性。
细胞存活率(%)=A 实验组/A 对照组×100%。
1.2.6 转运实验 研究异泽兰黄素在5、20、80 μmol/L下的转运行为。4℃和37℃下研究温度对转运的影响。研究pH 6.0或pH 7.4对异泽兰黄素转运的影响。
将若干种抑制剂分别预处理转运体系研究几种转运蛋白的影响,包括P-糖蛋白(p-glycoprotein, p-gp)抑制剂维拉帕米;多耐药蛋白(multidrug resistance-related proteins,MRPs)抑制剂MK571、苯溴馬隆(multidrug resistance-related protein 3,MRP3)和吲哚美辛(multidrug resistance-related protein 2,MRP2);乳腺癌耐药蛋白(breast cancer resistance protein,BCRP)抑制剂芹菜素。通过添加钒酸钠和西咪替丁评估Na/K-ATPase的选择性;加入左旋肉碱或奎尼丁评估有机阳离子/麦角硫因转运蛋白(recombinant organic cation/erg-othioneine transporter,OCTN1)或OCTN2蛋白是否参与到异泽兰黄素的跨膜转运中。
1.2.7 药动学实验 所有动物实验均按照上海交通大学实验动物中心指南和规章制度操作,并通过上海交通大学动物伦理委员会审核。Sprague-Dawley(SD)大鼠(210~230 g)由上海交通大学实验动物中心提供,合格证号SCXK(沪)2017-0004。分别灌胃口服异泽兰黄素混悬液20 mg/kg或坤复康溶液10.58 g/kg(含约20 mg/kg异泽兰黄素)。
1.3 观察指标及评价标准
Caco-2实验结果由表观渗透系数(apparent permeability,Papp)值和外排率(efflux ratio,ER) 值表示。
PappP=(dQ/dt)/(A·C0);ER=PappBA/ PappAB
式中:A 为Transwell 小室的有效面积;dQ/dt为转运速率;C0为药物的初始浓度;PappBA为BL 到AP侧的Papp值;PappAB 为AP 到BL 侧的Papp值。当ER > 1.5提示可能存在主动转运,ER≤1.5提示以被动扩散为主[17]。
药动学数据由给药后的药-时曲线及药动学参数表示。
1.4 统计学方法
质谱数据通过 Analyst 1.5.2和MultiQuant 3.0.0软件处理,药动学数据通过DAS 2.0软件分析,统计学数据用SPSS 20.0 统计学软件进行处理,所有统计数据用均数±标准差(x±s)表示,各组间差异用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 异泽兰黄素的含量测定
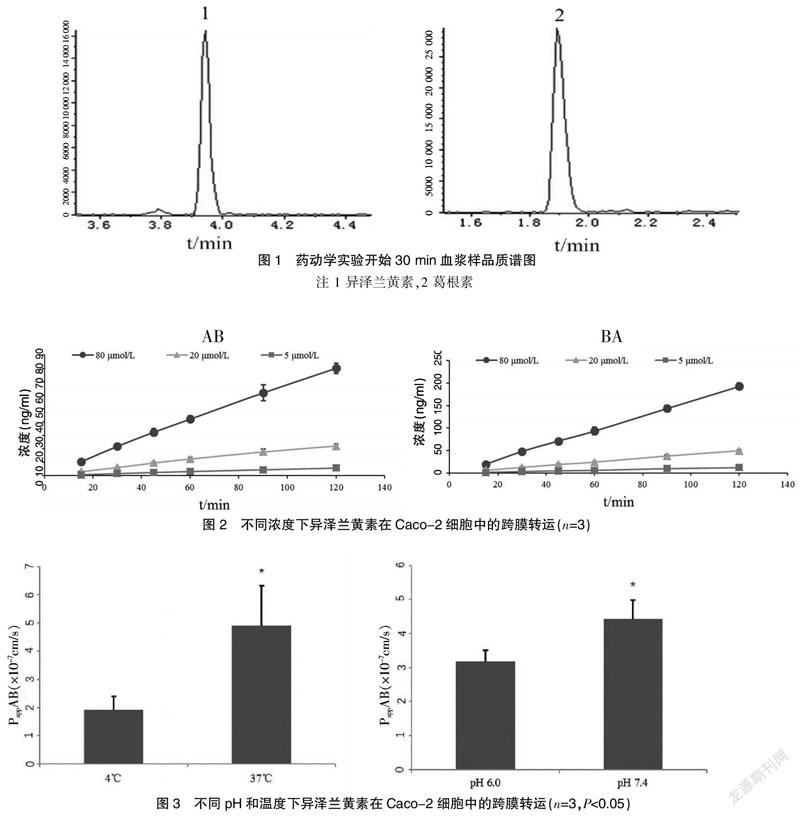
代表性质谱图如图1所示,该测定方法下异泽兰黄素在培养基和血浆中的线性范围分别为2.5 ng/ml至500 ng/ml和5 ng/ml至500 ng/ml。
2.2 细胞毒实验
结果显示,异泽兰黄素浓度小于200 μmol/L或浓度为0.58 mg/ml坤复康溶液对Caco-2细胞生长抑制率小于10%。
2.3 浓度和时间对异泽兰黄素转运的影响
异泽兰黄素三种浓度下的PappAB从3.27×10-7cm/s至5.37×10-7cm/s(从AP到BL)和从6.27×10-7cm/s至9.63×10-7cm/s(从BL到AP)。见图2。
异泽兰黄素在检测时间段内随时间呈线性增长,表明异泽兰黄素的转运有时间依赖性。
2.4 pH和温度对Caco-2细胞转运异泽兰黄素的影响
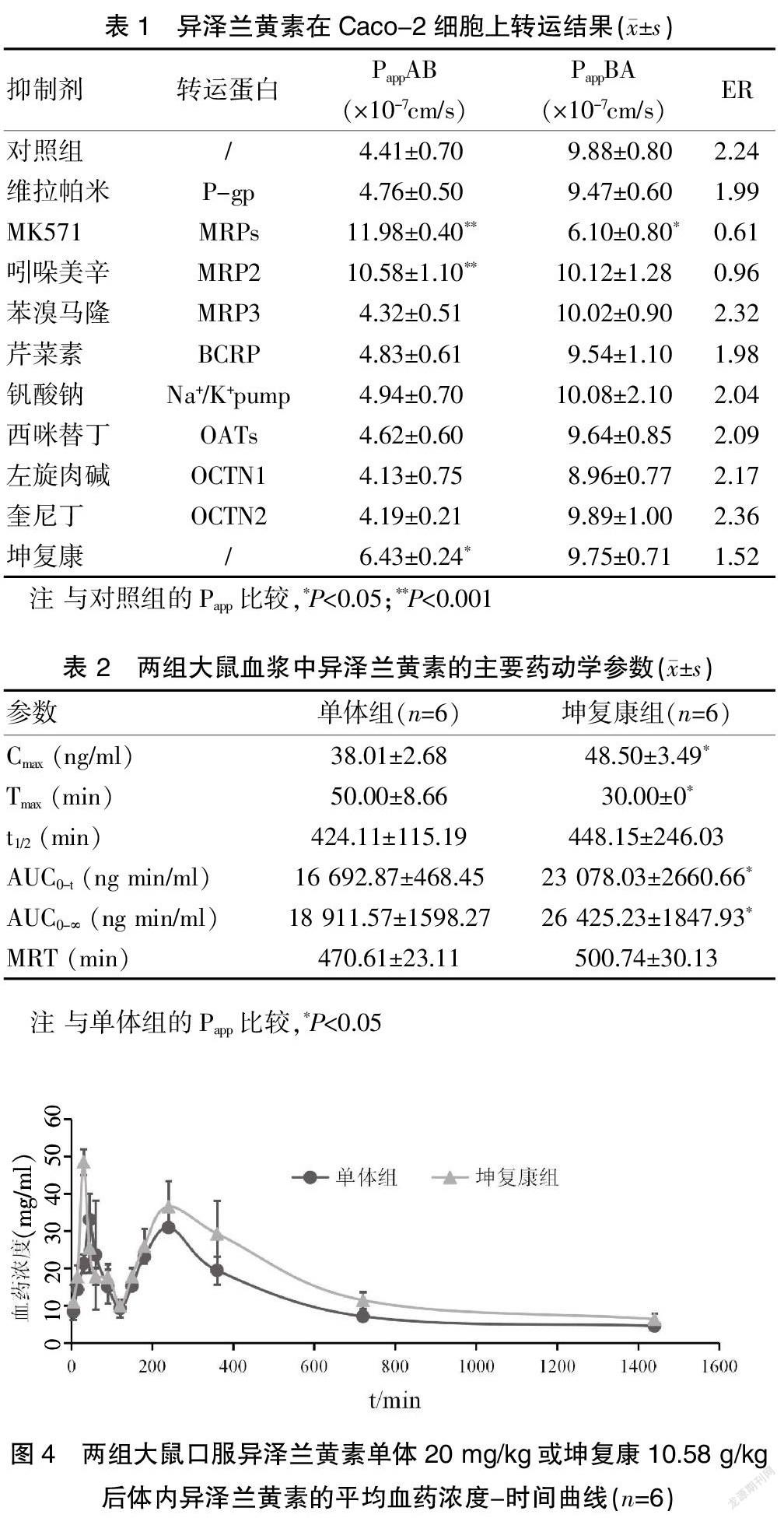
异泽兰黄素在pH 7.4时的PappAB值明显高于在pH 6.0时的PappAB值(P<0.05)。见图3。
温度降低会降低细胞的新陈代谢,降低异泽兰黄素转运效率[18]。低温(4℃)孵育使PappAB从4.90×10-7cm/s降低到1.91×10-7cm/s。见图3。
2.5 异泽兰黄素在Caco-2细胞上转运结果
在MK 571预处理的情况下,异泽兰黄素的PappAB几乎是对照组的2.7倍,而其PappBA值则降低38.26%。文献报道表明, MRP2和MRP3分别存在Caco-2细胞的顶膜端和基底端[19-20]。吲哚美辛是一种MRP2抑制剂,显著提高了异泽兰黄素的PappAB值(P<0.05)。见表1。此外,当加入坤复康片处理液后,异泽兰黄素的PappAB显著性升高。
2.6 体内药动学研究
坤复康组中异泽兰黄素的Cmax值为单体组的127.60%,两组达峰时间(Tmax)比较,差异有统计学意义(P<0.05)。两组中异泽兰黄素的血浆暴露量(AUC0-t和AUC0-∞)比较,差异有统计学意义(P<0.05),但MRT和t1/2值无显著差异,说明坤复康片中其他成分主要影响异泽兰黄素的吸收相。见表2、图4。
3 讨论
优良的口服吸收特征是新药试验筛选过程中的重要条件,而药物溶解度和胃肠通透性又是影响口服吸收效率的主要因素。一般来说,药物的溶解度和渗透性取决于亲脂性等因素,但预测口服给药后药物在人体中的吸收能力相对复杂。Caco-2细胞在体外分化成人体肠道上皮细胞时可以表达肠道特异性水解酶。此外,Caco-2细胞可以模拟人类肠道中的上皮细胞表达P-gp和其他膜转运蛋白。因此,Caco-2细胞模型常用于探讨药物在人体肠道中的吸收和转运机制。
一般认为,Papp值<1×10-6cm/s的化合物被认为吸收率低(<30%),Papp值在1×10-6cm/s和1×10-5cm/s之间的化合物被认为具有中等吸收(30%~70%),而Papp值>1×10-5 cm/s被认为具有高吸收(>70%)[21]。异泽兰黄素Papp值的结果表明了其在肠中吸收较差,与口服生物利用度低一致,因此较低的肠道渗透性可能是造成异泽兰黄素生物利用度低的一个原因。同时,异泽兰黄素吸收的ER>1.5,提示可能存在主动转运。
肝脏代谢也是导致口服生物利用度低的一个重要原因。异泽兰黄素是黃酮类化合物的一种。事实上,其他一些常见的黄酮类化合物,如芦丁[22]和黄芩苷[23],可以在体内发生强代谢。药物的体内过程十分复杂,需要更多的研究来解释口服生物利用度低的现象。
在预实验中,尝试按大鼠单次给药的临床等效剂量(约108 mg/kg坤复康片)进行药动学实验分析体内过程,但由于其入血含量低,在现有LC/MS/MS条件下,无法在血浆中定量异泽兰黄素,尝试在正式实验中加大给药剂量(10.58 g/kg)以达到检测目的。因此本药动学实验未考虑增加剂量对被测化合物体内过程的影响,实验结果仍需要进一步验证。
实验结果显示,复方成分对异泽兰黄素有增加吸收作用。该结果证明方剂配伍可明显影响活性化学成分在体内的药物动力学行为,说明在中医辨证理论指导下的复方配伍原则具有丰富的科学内涵。大多数中药单体成分的体外活性弱于天然药物,如黄芩苷、小檗碱、灯盏花素、丹酚酸等。但绝大部分传统草药是通过口服给药,这就让多成分相互作用提高单一成分的生物利用度成为可能。目前,关于单体联合给药的研究主要集中在药效学的关联效应上,而关于药动学的研究则很少。本研究从小肠吸收及药动学的角度,为如何提高天然产物生物利用度的问题提供新的解决思路及数据参考。根据文献报道[24],除异泽兰黄素外,坤复康片的主要活性成分还包括氧化苦参碱、苦参碱、红景天苷等,中药的复方成分之间的相互作用不局限于吸收阶段,对此将进一步深入研究。
[参考文献]
[1] Xu RJ,Yu BM,Wang SQ,et al. Characterization of the intestinal absorption of morroniside from Cornus officinalis Sieb. et Zucc via a Caco-2 cell monolayer model[J]. Lat Am J Pharm,2020,39(8):1500-1508.
[2] 赵子剑,陈迪钊.坤复康胶囊对慢性盆腔炎大鼠细胞因子的影响实验[J].时珍国医国药,2010,21(12):3054-3055.
[3] 卫昊,侯建平,郭惠玲,等. 坤复康胶囊对混合菌液致盆腔炎模型大鼠血液流变学和病理形态学的影响[J]. 中药药理与临床,2012,28(3):92-94.
[4] Zhu HY,Guan J,Zhang H,et al. Simultaneous deter- mination of ferulic acid,paeoniflorin, and eupatilin in rat plasma by ultra-high performance liquid chromatography with tandem mass spectrometry:Application to a pharmacokinetic study of Danggui-Shaoyao-San[J]. J Sep Sci,2020,43(11): 2053-2060.
[5] 肖永庆, 屠呦呦.中药南刘寄奴化学成分研究[J]. Journal of Integrative Plant Biology,1986,1986(3):307-310.
[6] 王小俊,陈林霖,方颖. 异泽兰黄素的药理作用研究进展[J]. 时珍国医国药,2019,30(3): 665-668.
[7] 吴志贤,李响,莫自增,等. 异泽兰黄素通过PDGFβ/ERK信号通路抑制增生性瘢痕生长的机制探讨[J]. 中国美容医学,2019,28(7):44-47.
[8] 刘瑞. 艾叶提取物异泽兰黄素诱导肝癌细胞凋亡機制的研究[D].广州: 南方医科大学,2019.
[9] 何瑾瑜,祁海燕,杨跃青,等. 异泽兰黄素对肝癌细胞SK-HEP-1增殖、凋亡以及作用机制的影响[J]. 临床和实验医学杂志,2019,17(24):2602-2606.
[10] Geng P W,Luo XH,Peng XF,et al. Development and valid-ation of UPLC-MS/MS method for determination of eupa-tilin in rat plasma and its application in a pharmac-okinetics study[J].Acta Chromatogr,2018,30(4):231-235.
[11] Wang XX,Ren J,Zhu SX,et al. Pharmacokinetics and tissue distribution of eupatilin and its metabolite in rats by an HPLC-MS/MS method[J].J Pharmaceut Biomed,2018,159:113-118.
[12] Peng Y,Fan M,Peng CS,et al. Alleviating the intestinal absorption of rhein in rhubarb through herb compatibility in Tiaowei Chengqi Tang in Caco-2 cells[J].Evid-based Compl Alt,2018:7835 128.
[13] US Department of Health and Human Services,Food and Drug Administration,Center for Drug Evaluation and Research. Guidance for Industry,Bioanalytical Method Validation,May 2001. doi:Available from: http://www.fda.gov/ downloads/Drugs/Guidance Compliance Regulatory Information/ Guidances/ ucm070107.pdf (accessed 26.08.11).
[14] Xu RJ,Peng Y,Wang MY,et al. Intestinal absorption of isoalantolactone and alantolactone,two sesquiterpene- lactones from radix inulae,using Caco-2 cells[J].Eur J Drug Metab Ph,2018,44(2):295-303.
[15] Lu J,Liu L,Zhu X,et al. Evaluation of the absorption beha- vior of main component compounds of salt-fried herb ingredients in qing'e pills by using caco-2 Cell model[J]. Molecules,2018,23(12):3321.
[16] 程珍珍,周本宏,姜姗,等.没食子酸在Caco-2 细胞模型中的吸收转运研究[J].中国药理学通报,2020,36(8):1183-1184.
[17] 张馨,王莉芳,陈佳琪,等.龙血竭酚类提取物主要成分在Caco-2 细胞中吸收机制研究[J].中国中药杂志,2020, 45(20):4889-4895.
[18] Rocha RA,Devesa V,V′elez D. In vitro study of intes- tinal transport of fluoride using the Caco-2 cell line[J]. Food Chem Toxic,2013,55:156-163.
[19] Duan J,Xie Y,Luo H,et al. Transport characteristics of isorhamnetin across intestinal Caco-2 cell monolayers and the effects of transporters on it[J].Food Chem Toxic,2014,66:313-320.
[20] Prime-chapman HM,Fearn RA,Cooper AE,et al. Differe- ntial multidrug resistance-associated protein 1 through 6 isoform expression and function in human intestinal epithelial Caco-2 cells[J].J Pharmacol Exp,2004,311(2):476-484.
[21] Willenberg I,Michael M,Wonik J,et al. Investigation of the absorption of resveratrol oligomers in the Caco-2 cellular model of intestinal absorption[J].Food Chem,2015, 167:245-250.
[22] 高慧敏,王智民,田娟.灯盏花素在正常和模型大鼠中的药代动力学及代谢物研究[J].药学学报,2005,40(11):1024-1027.
[23] 解立科,田小亭,郭小珍,等.黄芩素与黄芩苷微生物和肝脏代谢异同研究[J].中成药,2020,42(7):1830-1836.
[24] 赵莹.HPLC-MS/MS法同时测定坤复康片中5种有效成分的含量[J].沈阳药科大学学报,2015,32(11):869-974.
(收稿日期:2021-03-15)

