西门子 Atellica CH930 全自动生化分析仪常规生化检测项目性能验证
吴波 许安春 江泽友 张琼芳 沈漪萍


【摘要】目的:对西门子Atellica CH930全自动生化分析仪常规生化检测项目:总蛋白(TP)、白蛋白(ALB)、天门冬氨酸氨基转移酶(AST)、谷氨酸氨基转移酶(ALT)、碱性磷酸酶(AKP)、尿素(UN)、肌酐(CREA)、尿酸(UA)、血糖(GLU)、胆固醇(Cho)、甘油三酯(TG)的分析性能进行验证。方法:参考《临床实验室对商品定量试剂盒分析性能的验证》、《临床化学定量检验程序性能验证指南》并结合检验工作实际情况,对Atellica CH930全自动生化分析仪测定血清总蛋白等13项常规生化项目的精密度、正确度、临床分析测量范围以及生物参考区间进行验证和评价。结果:总蛋白等11项常规生化检测项目在2个不同浓度水平测定的期间标准差都小于厂家规定的不精密度要求;采用室间质评样本作为参考物质,11项常规生化检测项目的参考物质偏移值小于参考物质赋值的不确定度,验证厂家声称可靠;验证的分析测量范围分别为:TP 21.35~108.9 g/L,ALB 13.5~57.4 g/L,AST 9.5~862 U/L,ALT 11~776 U/L,AKP 11~931 U/ L,UN 2.04~48.77 mmoml/L,CREA 14.85~2400.65 Umol/L,UA 39.5~1095 mmol/L,GLU 0.75~38.27 mmol/L, Cho 0.87~7.59 mmol/L,TG 0.14~5.82 mmol/L;經验证仪器自动稀释功能稀释检测后,临床可报告范围分别为:TP 21.35~217.8 g/L,ALB 13.5~114.8 g/L,AST 9.5~5172 U/L,ALT 11~2329 U/L,AKP 11~2793 U/L,UN 2.04~97.54 mmoml/L,CREA 14.85~12003.25 Umol/L,UA 39.5~5475 mmol/L,GLU 0.75~84.81 mmol/L,Cho 0.87~15.18 mmol/L,TG 0.14~11.64 mmol/L;生物参考区间验证结果均在设定的范围之内。结论:西门子Atellica CH930 全自动生化分析仪测定总蛋白等11项常规生化项目的分析性能满足厂商声明的质量和性能要求,符合临床的要求,可应用于临床。
【关键词】全自动生化分析仪;性能验证;精密度;正确度
[中图分类号]R446.1[文献标识码]A[文章编号]2096-5249(2022)01-0033-04
Performance evaluation of SIEMENS Atellica CH930 automatic biochemical analyzer for detecting routine biochemical testing items
WU Bo1, XUAn-chun1, JIANG Ze-you1, ZHANG Qiong-fang1, SHEN Yi-ping2* (1.Clinical Laboratory, Affiliated Hospital ofChengduUniversityofTraditional Chinese Medicine, Chengdu 610072, China;2.Clinical Laboratory ofSichuan Integrated Traditional Chinese andWestern Medicine Hospital, Chengdu, Sichuan 610041, China)
[Abstract] Objective: To evaluate the performace verification of serum routine biochemical testing items (TP、ALB、ALT、AST、AKP、UN、CREA、UA、GLU、CHO、TG) detected by SIEMENS Atellica CH930 automatic biochemical analyzer. Methods: According to clinical and practial requirements, the accuracy and precision of these items were detected by Atellica CH930, and their linear range, biological reference and maximum dilution multiple were evaluated referring to the evaluation method of“Verification of the analytical performance of commercial quantitative kits by clinical laboratories” and Guidelines for performance verification of clinical chemistry quantitative testing procedures. Results: The standard deviation of 11 routine biochemical test items such as total protein during the measurement at 2 different concentration levels meets the imprecision requirements specified by the manufacturer. Using PT samples as reference substances, the reference substance offset value of 11 items is less than the uncertainty of the reference substance assignment, which verifies that the manufacturer claims to be reliable. The analytical measurement ranges verified were: TP 21.35~108.9 g/L,ALB 13.5~57.4 g/L,AST 9.5~862 U/L, ALT 11~776 U/L, AKP 11~931 U/L, UN 2.04~48.77 mmoml/L, CREA 14.85-2400.65 Umol/L,UA 39.5-1095 mmol/L,GLU 0.75-38.27 mmol/ L,Chol 0.87~7.59 mmol/L,TG 0.14~5.82 mmol/L. After the dilution test of the automatic dilution function of the verified instrument, the clinical reportable ranges were: TP 21.35~217.8 g/L,ALB 13.5~114.8 g/L,AST 9.5~5172 U/L, ALT 11~2329 U/L, AKP 11~2793 U/L, UN 2.04~97.54 mmoml/L, CREA 14.85~12003.25 Umol/L,UA 39.5~5475 mmol/L,GLU 0.75~84.81 mmol/L,Chol 0.87~15.18 mmol/L,TG 0.14~11.64 mmol/L. Biological reference interval verification results are within the set range. Conclusion: The main analysis performance of SIEMENS Atellica CH930 automatic biochemical analyzer meets the manufacturer’s declared quality and performance requirements, meets the clinical requirements, and can be used in clinical applications.
[Key words] Automatic biochemical analyzer; Performance verification; Precision; Accuracy
TP 等11项常规生化项目是评估患者基本状态的常用指标。TP、ALB、AST、ALT、AKP 用于肝功能检测,UN、CREA、UA 用于肾功能评估,GLU 作为糖尿病筛查,CHO、TG 用于脂代谢评估。笔者参考《临床实验室对商品定量试剂盒分析性能的验证》[1]《临床化学定量检验程序性能验证指南》[2] 并结合检验实际,对Atellica CH930全自动生化分析仪测定TP 等11项常规生化项目的精密度、正確度、分析测量范围和生物参考区间进行验证和评价。
1 材料和方法
1.1材料仪器西门子Atellica CH930全自动生化分析仪。试剂:①西门子Atellica CH930配套试剂、校准品;②朗道质控血清水平2,3。样本:选取成都中医药大学附属医院2020年4月至5月门诊和住院部患者标本,3000 r/min 离心10 min,取血清检测。排除标准:严重脂血、溶血、黄疸样本。
1.2方法①精密度验证:本次验证5 d 共计5 个批次,每批需检测高、低两个浓度血清。每次测量前按照制造商建议校准,测量前后均进行室内质控检测,如有失控,则弃去,重新增加1个批次。每个批次需要重复测量3次。根据公式[3]分别计算重复标准差(Sr),期间标准差(Sl),厂家声称值σl,根据计算值进行相应判断。②正确度验证:正确度验证进行5个批次,每个批次测定2次,选取2019年第二次、第三次常规化学室间质评样本作为参考物质进行测量。校准、室内质控的要求同精密度验证。按照公式[3]分别计算测量均值(x)、标准差(SX)及参考物质测量偏移值(b参),将计算值与参考物质赋值的不确定度(Sa)进行比较,如测定值大于 Sa,则需要将验证区间与赋值进行比较。③分析测量范围验证:按照参考文献[4-6],选取5~7个浓度样本,要求尽量覆盖厂家声称的线性范围。准备高、低值浓度样本,分别命名样本5(H)和样本1(L),按照4L、3 L+1 h、2 L+2 h、2 L+3 h、4 h 关系配置,形成系列浓度梯度,每个浓度水平至少测定2次。校准及室内质控要求同精密度验证。根据公式计算线性回归方程和相关系数 r ,若 r >0.995,用 SPSS19.0统计软件进行曲线回归分析,若最佳拟合曲线为一阶,则线性验证通过,若最佳拟合曲线为二阶或者三阶,则需要进行精密度验证以判断该非线性能否为临床可接受,将实测值的随机误差范围与线性理论值的允许总误差范围进行比较,实测值的随机误差范围应小于线性理论值的允许总误差范围,否则降低浓度重新计算。④稀释倍数验证:取1份高浓度标本分成两份,一份不做任何处理,一份按照制造商建议的稀释倍数做自动稀释,每个样本重复检测4次,计算稀释检测值和理论值的偏差,判断标准为1/2 总允许误差范围。⑤生物参考区间验证:参考 CLSIC28-A2文件[7],选取健康体检者各20例,根据项目要求分性别、年龄进行参考区间验证。按照实验室规定的操作程序进行检测,将检数据进行统计并与待验证的参考区间进行比较,若20例样本的检测数据不超过两份标本超出待验证参考区间,则验证通过。否则,需要进行确认实验。
1.3统计学处理使用 SPSS19.0统计软件进行数据分析。
2 结果
2.1精密度验证结果11项常规生化项目精密度验证结果,详见表1。
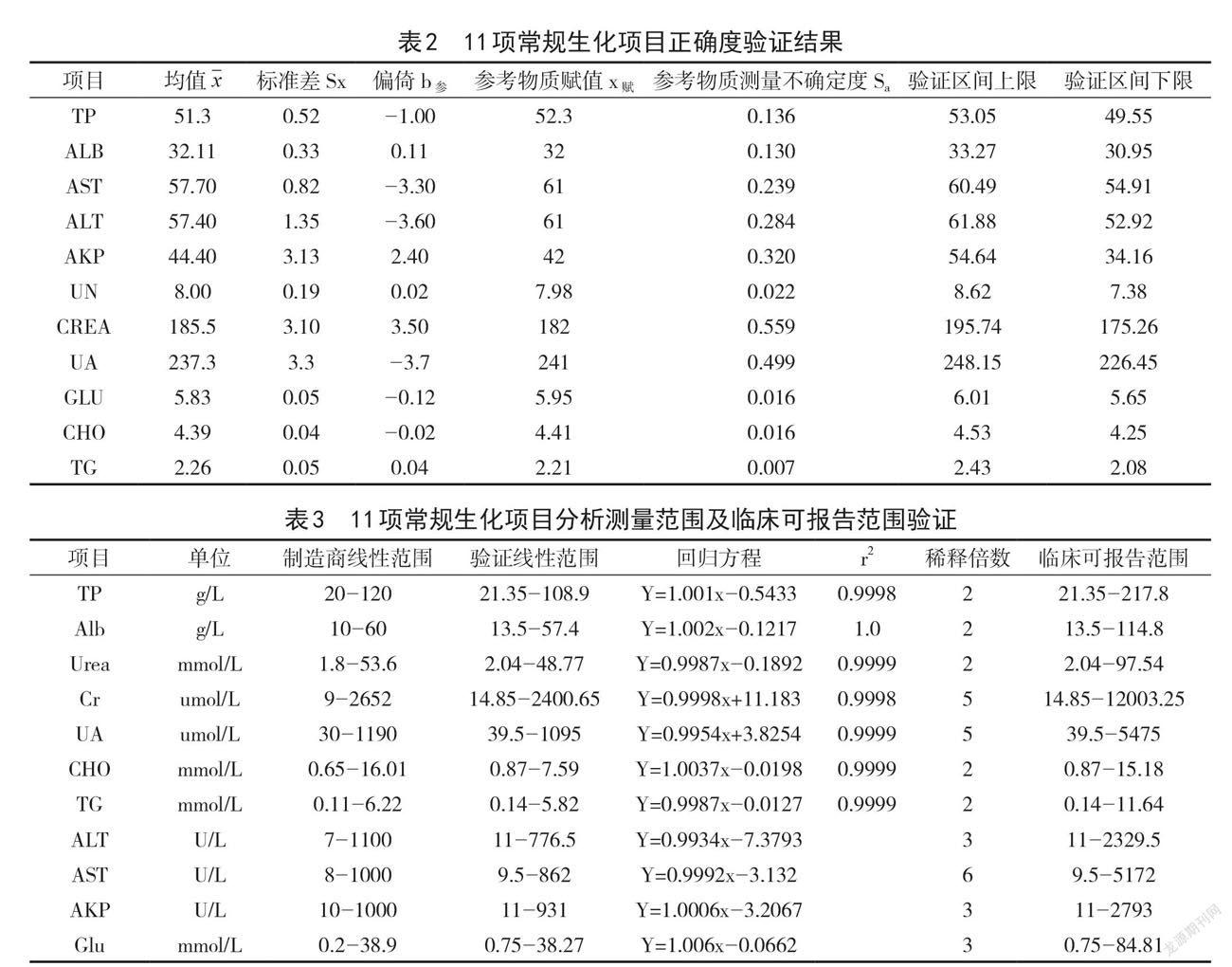
2.2正确度验证结果11项常规生化项目正确度验证结果,详见表2。
2.3分析测量范围及稀释倍数验证11项常规生化项目分析测量范围及临床可报告范围验证,详见表 3。
2.4参考区间验证参考区间验证数据详见表4。
3 讨论
按照《医疗机构临床实验室管理办法》的要求 [8-9],临床实验室为了保证检验结果的准确性,应对所选购的试剂盒进行性能验证,以此保证其能满足在临床使用,分析测量,经济技术等各方面的要求 [10]。本实验对Atellica全自动生化分析仪进行了包括 TP 等11项常规生化项目的不精密度、不准确度、分析测量范围、生物参考区间验证,以此来了解Atellica系统的分析性能。
精密度经常被用于评价检测系统的稳定性,是性能分析和评价的基础和前提[11]。从表1的结果分析来看,11个项目5个批次在两个浓度水平的期间标准差均小于制造商声明的分析性能,具有良好的精密度,满足性能要求。
正确度也是系统误差的衡量指标,用于评估靶值与实际检测值的差异[12]。正确度的验证有多种方式,可以使用患者样本,也可以采用参考物质[13]。本研究使用卫健委临检中心2019年第二次、第三次常规化学室间质评样本,从表2的结果可以看出,部分常规生化项目的参考物质偏移值大于参考物质赋值的不确定度,通过自由度计算验证区间上下限,所测均值在验证区间范围内,亦验证厂家声称可靠。
线性范围即标本在未经浓缩、稀释等预处理的情况下可被直接测定出检测物的范围[14],是方法学性能的又一衡量指标。因高浓度样本临床不易得,本实验均选用较高浓度样本进行线性范围验证。从表3看出,11项常规生化项目的相关系数 r2>0.999,线性验证符合要求。同时,通过对仪器自动稀释倍数的验证,可以给予临床更大的临床可报告范围,满足临床诊断和治疗的要求。
生物参考区间是95%“正常”值范围,实验室应保证检验项目的生物参考区间具有正确性和适用性 [15]。本试验根据检测项目的具体要求,将健康体检者按照年龄、性别进行分组验证,结果表明,11项指标的验证符合率及项目分组参考区间符合率均≥ 95%,20例样本的血清浓度均在验证的参考区间范围内,则认为此参考区间适用于本实验室。
综上所述,本研究参考试剂制造商、CLSI 文件,对Atellica CH930全自动生化分析仪上检测的 TP 等11项常规生化项目的性能进行了验证和评估,基本与试剂制造商的声明一致,该检测系统可用于临床。
参考文献
[1]尚红 , 王毓三 ,申子瑜.全国临床检验操作规程[M].北京:人民卫生出版社 , 2015:320-326.
[2]中国合格评定国家认可委员会.临床化学定量检验程序性能验证指南[S]. CNAS-GL37:2019.
[3]中华人民共和国国家卫生和计划生育委员会.临床实验室对商品定量试剂盒分析性能的验证[S].WS/T 420-2013.
[4]王治国.临床检验方法确认与性能验证[M].北京:人民卫生出版社 , 2009:153-159.
[5] 冯仁丰.临床检验质量管理技术基础第二版[M].上海科学文献技术出版社 , 2008:111-138.
[6]张秀明 , 庄俊华 , 郑松柏 , 等.临床化学发光免疫法检测AFP 的分析性能验证与实验方法[J].中华检验医学杂志 ,2007, 30(11): 1293.
[7]CLSI C28-A2. how to define and determine referenceintervals in the clinical laboratory, 2000:1-31.
[8]黄勤烽 , 黄少铃 , 王美珠 , 等.罗氏尿微量清蛋白检测试剂盒性能评价[J]. 国际检验医学杂志 , 2016, 37(15):2055-2057.
[9]于淼琛 , 孙芹敏 , 姜鳳全.强生 VITROS 5600全自动生化免疫分析仪性能验证报告[J]. 国际检验医学杂志 , 2017, 38(1):56-60.
[10]国家卫生和健康委员会. 《医疗机构临床实验室管理办法》. [EB/OL].(2018-08-16)https://www. nccl. org. cn/showSearchDetail?code=07&id=4
[11]张秀明 , 范勇利 , 温冬梅 , 等.临床化学自建检测系统性能确认的精密度与正确度及准确度的研究[J].中华检验医学杂志 , 2016, 39(9):715-719.
[12]张诗诗 , 王薇 , 赵海建 , 等.临床化学检验中精密度、正确度、总误差和测量不确定度的讨论[J].临床检验杂志 , 2017, 35(9):641-643.
[13]徐建华 , 庄俊华 , 郑松柏 , 等.常规方法检测血清总胆红素的正确度评价[J].临床检验杂志 , 2012, 30(12):946-949.
[14]吴金斌 , 欧嘉文. VITROS5600分析仪检测3项心肌损伤标志物的性能评价[J].检验医学与临床 , 2015, 12(2):3256-3259.
[15]赵有利 , 姜雯雯 , 李飞 , 等.罗氏 Cobas8000全自动生化分析仪检测心肌酶谱的性能评价[J].国际检验医学杂志 ,
2020, 41(5):540-543.
作者简介:吴波(1981-),汉族,四川汶川人,硕士,主管技师,研究方向:临床生化检验。
*通信作者:沈漪萍,四川省中西医结合医院检验科。 E-mail:2079075856@qq.com
(收稿日期:2021-6-29 接受日期:2021-8-20)

