人表皮生长因子受体2与晚期食管鳞癌患者含铂类药物化疗预后的相关性
梁 立,刘艳春,孟立宁,杨 曼,陈宏洋,韩爱勇,岳燕军
食管癌是源于食管黏膜上皮的一种恶性肿瘤,其发病率和病死率均较高,分别居于恶性肿瘤的第6位和第4位;食管癌病理类型具有显著的地域特征,欧美国家以食管腺癌为主,而亚洲国家食管鳞癌发病率更高[1]。食管癌常见治疗手段有放疗、化疗、外科手术等,外科手术是临床治疗早、中期及局部晚期食管癌的主要手段,可有效提高患者生存率,但大部分食管癌患者就诊时已发展至晚期,且伴有区域或全身淋巴结转移,手术已无法达到理想治疗效果,或患者无法耐受手术治疗,此时,临床多采用化疗的方式对患者进行治疗[2-3]。含铂类药物的联合化疗是目前治疗食管癌最常用的方案,但患者经铂类药物化疗后整体5年生存率仍不足20%[4]。因此,寻找可以预测晚期食管癌铂类药物化疗预后的分子标志物,并根据其特点制定新的治疗方案,对改善患者预后具有重要临床意义。人表皮生长因子受体2(HER2)是一种磷酸化受体蛋白,在肿瘤细胞中表达较高,可调控肿瘤细胞的增殖、分化和浸润转移,影响癌症患者预后[5-6]。本研究探讨肿瘤组织HER2蛋白表达及基因扩增与食管鳞癌患者含铂类药物化疗预后的相关性,现报告如下。
1 资料与方法
1.1一般资料 回顾性分析2018年6月—2019年6月张家口市第一医院采用含铂类药物化疗的晚期食管鳞癌100例的临床资料,根据患者随访2年预后情况分为预后良好组53例和预后不良组47例。纳入标准:①均符合食管癌诊断标准[7],且经内镜及病理组织学检查确诊为晚期食管鳞癌;②均失去手术治疗指征;③一线化疗均接受含铂类药物的方案;④存在可评价的肿瘤病灶;⑤预计生存时间≥3个月;⑥临床资料完整者。排除标准:①合并其他脏器转移者;②合并严重心、肝、肺、肾损伤者;③合并严重感染者;④合并其他恶性肿瘤者。本研究获医院医学伦理委员会批准。
1.2方法
1.2.1化疗方案:所有患者接受含铂类药物的化疗方案[7],包括顺铂、奥沙利铂、卡铂及奈达铂,与含铂类药物联合化疗药物包括5-氟尿嘧啶、长春瑞滨、长春地辛、多西他赛、紫杉醇、博来霉素、吉西他滨。
1.2.2预后标准:以患者随访2年的生存情况作为预后评估标准,将肿瘤相关死亡患者纳入预后不良组,生存患者纳入预后良好组。
1.2.3资料收集:通过病历系统收集两组入院时性别、年龄、肿瘤部位、肿瘤直径、TNM分期、浸润深度、淋巴结转移、分化程度、血红蛋白、白蛋白等各项临床资料。
1.2.4仪器和方法:取患者空腹血液5 ml,希森美康XN-3000血液分析仪及配套试剂盒测定血红蛋白、白蛋白水平;取患者入院活组织病理检查时的组织标本,采用荧光原位杂交技术检测HER2/neu基因扩增情况,采用免疫组织化学法检测HER2蛋白表达;DNA荧光原位杂交探针、荧光原位杂交TM试剂盒均购自北京金菩嘉生物技术有限公司;即用型C-erB-2兔抗人单克隆抗体、免疫组织化学Envision plus广谱试剂盒、PBS、枸橼酸盐缓冲液均购自北京中杉金桥生物技术有限公司。
1.2.5荧光原位杂交技术检测[8]:①采用HER2 DNA荧光原位杂交探针标记红色荧光,设对照探针标记绿色荧光。a.石蜡切片:在温度为65 ℃下烤片过夜,标本脱蜡至水,50 ℃条件下用酸性亚硫酸钠(浓度为30%)处理切片,时间为20~30 min,并用2×枸橼酸盐缓冲液漂洗2次,每次5 min;37 ℃条件下在蛋白酶K溶液中孵育20~30 min,2×枸橼酸盐缓冲液漂洗2次,每次5 min,室温下在0.1 mmol/L HCl中浸泡5~10 min,再次用2×枸橼酸盐缓冲液漂洗2次,每次5 min;b.脱水:玻片依次在-20 ℃预冷的浓度为70%、85%、100%乙醇中各脱水2 min,后置于室温下浸入丙酮溶液中2 min,取出后使玻片自然干燥。②荧光原位杂交技术:a.脱水:于73 ℃条件下在浓度为70%的甲酚胺变性液中浸泡5 min,后依次在预冷的浓度为70%、85%、100%乙醇中各脱水3 min;b.杂交:将10 μl探针混合液滴入玻片组织中,盖片,以橡胶封片,于73 ℃条件下进行变性,时间为5 min,后在42 ℃条件下杂交过夜;c.洗涤:于73 ℃条件下在2×枸橼酸盐缓冲液/0.3% NP溶液洗脱液中洗涤,时间为3 min,再于室温下洗涤5 s,干燥;将15 μl DAPI复染剂滴加于杂交区域,盖片,置于暗处10~20 min,荧光显微镜下观察。③结果判定:以橘红色HER2/neu基因荧光信号和绿色荧光信号数目比值作为判读标准,共计数30个细胞,当红色荧光信号/绿色荧光信号比值<1.8为基因无扩增,记为阴性;当比值>2.2或众多红色荧光信号连接成簇或团为基因扩增,记为阳性;比值位于1.8~2.2之间时增加计数细胞至100个后再次进行判断。
1.2.6免疫组织化学检测[8]:石蜡切片并于65 ℃条件下烤片,脱蜡至水,用pH值7.4的PBS冲洗3次,每次3 min,枸橼酸盐缓冲液(pH值6.0)加热修复10 min,用PBS冲洗2次,每次3 min;用3%过氧化氢阻断内源性过氧化物酶的活性,滴加聚合物增强剂于室温下孵育20 min,用PBS冲洗3次,每次3 min;滴加酶标抗鼠/兔聚合物试剂,室温下孵育30 min,用PBS冲洗5次,每次3 min;滴加DAB液,显微镜下观察6 min,苏木精复染,用0.1% HCl分化,冲洗,蓝化,乙醇脱水干燥,二甲苯透明,树胶封固,晾干观察。结果判定:HER2蛋白阳性位于细胞膜,呈棕褐色,无反应或肿瘤细胞膜染色<10%为“-”;细胞膜不完整染色≥10%为“+”;较弱的完整细胞膜染色≥10%为“++”;较强的完整细胞膜染色>10%为“+++”;其中“-”和“+”为无表达,记为阴性,“++”和“+++”为过表达,记为阳性。
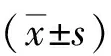
2 结果
2.1两组基线资料比较 两组性别、年龄、肿瘤部位、肿瘤直径、TNM分期、分化程度及血红蛋白水平比较差异无统计学意义(P>0.05)。预后良好组浸润深度为T4、淋巴结转移、白蛋白≤35 g/L、HER2蛋白表达阳性及HER2/neu基因扩增阳性患者占比显著低于预后不良组(P<0.05,P<0.01)。见表1。
2.2影响晚期食管鳞癌患者含铂类药物化疗预后不良的因素 将上述单因素分析中比较差异有统计学意义的相关因素纳入多因素Logistic回归分析,行量化赋值,因变量为是否发生不良预后(是=1,否=0),自变量为浸润深度(T4=1,T3=0)、淋巴结转移(是=1,否=0)、白蛋白(≤35 g/L=1,>35 g/L=0)、HER2蛋白表达(阳性=1,阴性=0)、HER2/neu基因扩增(阳性=1,阴性=0)。分析结果显示,浸润深度为T4、淋巴结转移、白蛋白≤35 g/L、HER2蛋白表达阳性及HER2/neu基因扩增阳性是晚期食管鳞癌患者含铂类药物化疗预后不良的独立危险因素(P<0.01)。见表2。

表2 影响晚期食管鳞癌患者含铂类药物化疗预后不良的多因素Logistic回归分析
3 讨论
HER2是一种原癌基因的表达产物,其表达上调可引起细胞过度增殖从而促使细胞向恶性转化,HER2水平在结直肠癌、胃癌、前列腺癌、乳腺癌、非小细胞肺癌等肿瘤组织细胞中均呈高表达,基于HER2的分子靶向治疗已成为上述恶性肿瘤综合治疗方案的重要组成部分[9-10]。既往研究显示,HER2在食管腺癌患者中的表达及病理机制相关研究较多[11],但我国食管癌病理组织学类型以鳞状细胞癌为主,而目前关于HER2对食管鳞癌的影响机制尚需进一步探讨。
本研究发现,预后良好组浸润深度为T4、淋巴结转移、白蛋白≤35 g/L、HER2蛋白表达阳性及HER2/neu基因扩增阳性患者占比显著低于预后不良组。提示上述因素可能是导致晚期食管鳞癌患者含铂类药物化疗预后不良的危险因素。其原因为肿瘤浸润深度、淋巴结转移是影响食管鳞癌患者生存情况的独立影响因素,在多项研究中均已被证实[12-14]。白蛋白是评估患者营养状态的重要指标,晚期食管癌患者存在吞咽困难的症状,营养物质摄入不足,同时机体能量消耗增加,常因营养不良引起免疫功能下降,此时患者肠黏膜屏障破坏、感染等严重并发症发生风险也会明显上升,进而引发不良预后[15]。
HER2/neu基因是一种受体酪氨酸激酶类原癌基因,属于表皮生长因子受体家族,其位于人染色体17q21,分子量约为185×103kD,在正常组织中有微弱的表达,但无HER2/neu基因扩增[16]。HER2受体细胞内区具有活化的酪氨酸蛋白激酶,自身也存在若干酪氨酸残基磷酸化位点,其可与特异性生长因子结合诱导二聚体化并促使受体交叉磷酸化,磷酸化的受体可将细胞外的生长信号传导至细胞核内,控制细胞分裂相关基因的表达[17]。HER2/neu基因扩增可促使转录上调,使HER2蛋白合成量增加,参与肿瘤细胞增殖、分裂、凋亡,并上调血管通透性因子及内皮生长因子表达,进而破坏抗体抑制侵袭的保护屏障,并促使肿瘤组织新生血管生成,使肿瘤细胞侵袭性增强[18]。HER2/neu基因扩增产物可通过不同信号传导通路使细胞异常增殖并向恶性转化,HER2蛋白表达上升又在细胞增殖、分裂、转化、侵袭、黏附中发挥重要作用[19-20]。因此,HER2蛋白表达阳性和HER2/neu基因扩增阳性常表明肿瘤恶性程度高,侵袭、转移能力强,此类患者肿瘤转移及复发早,预后较差。
经多因素Logistic回归分析证实,浸润深度为T4、淋巴结转移、白蛋白≤35 g/L、HER2蛋白表达阳性及HER2/neu基因扩增阳性是晚期食管鳞癌患者含铂类药物化疗预后不良的独立危险因素。因此,对晚期食管鳞癌患者采用含铂类药物化疗时应对上述因素予以干预,以提高患者生存率。
综上所述,HER2蛋白表达阳性、HER2基因扩增阳性与晚期食管鳞癌患者含铂类药物化疗预后具有明显相关性,可为临床制定基于HER2的分子靶向治疗方案提供理论依据。

