柠檬酸量对水热合成CuO/Ce0.8Zr0.2O2催化水气变换制氢性能的影响
王丽宝 ,王宏浩 ,张 磊,* ,庆绍军 ,刘冬梅 ,高志贤,* ,张海娟 ,官国清
(1. 辽宁石油化工大学 石油化工学院,辽宁 抚顺 113001;2. 中国科学院 山西煤炭化学研究所,山西太原 030001;3. 国立弘前大学 区域创新研究所能量转换工程研究室,青森松原 030-0813)
化石燃料的大量使用不仅造成了环境污染,而且引发了重大的能源危机,寻求可以替代的清洁能源已经迫在眉睫,氢气以其来源广泛、燃烧产物无污染、能量密度大等优点,受到社会各界的广泛关注[1-3]。在众多的制氢方法中,CO水气变换制氢反应[4-6](WGS, CO + H2O→CO2+ H2)是煤化工中最关键的一步,是工业上一种常用的制氢方法。为了提高反应速率,变换过程需要使用催化剂。目前,工业上常用的水气变换制氢催化剂主要有铁铬系高温催化剂[7-9]、铜系低温催化剂[10-12]、钴钼系耐硫宽温催化剂[13],其中,铜系低温催化剂在操作温度、原材料成本、催化活性等方面具有较大的优势,引起人们的高度重视[14,15]。然而,铜系低温催化剂的耐高温性差,极易出现失活的情况,因此,进一步提高活性组分抗烧结能力以及提升催化性能的研究非常关键。CexZr1-xO2固溶体作为CuO的载体具有更大的储放氧能力和耐热稳定性能[16],在催化剂的制备方面得到了广泛的应用。Jiang等[17]以Cu(NO3)2·3H2O、(NH4)2Ce(NO3)6和ZrO(NO3)2·2H2O为原料,以KOH为沉淀剂,采用共沉淀法制备了CuO/Ce0.6Zr0.4O2催化剂,并将其应用于水气变换制氢反应过程中。结果表明,与CuO/CeO2相比,加入Zr后,催化剂的比表面积变大、储氧能力和还原性能变强、催化活性得到显著提高,在n(H2O)∶n(CO) = 1∶1、GHSV = 10000 h-1、t= 320-350 ℃条件下,CO的转化率小于70%。Jeong等[18]以Cu(NO3)3·xH2O、Ce(NO3)3·6H2O和Zr(NO3)4·xH2O为原料,KOH作沉淀剂,制备了不同Ce/Zr比例的Cu-CeO2-ZrO2催化剂,其中,Ce/Zr物质的量比为4∶1时所制备的Cu-Ce0.8Zr0.2O2催化剂在水气变换制氢反应中表现出最好的催化活性,在气体体积空速GHSV为72152 h-1、水气比为4∶1、温度为320 ℃时,CO转化率接近40%。郑云弟等[19]以Ce(NO3)3·6H2O、Cu(NO3)2·3H2O和ZrOCl2·8H2O为原料,KOH作沉淀剂,采用共沉淀法制备了CuO/CeO2-ZrO2催化剂,结果表明,适量的ZrO2能提高催化剂的比表面积和Cu的分散度,在水气变换反应中具有较高的催化活性,在空速为3000 h-1、水气比为4∶1、温度为200 ℃时,催化剂中ZrO2含量为10%的催化活性达到73.7%。
与文献中采用方法不同,本研究采用络合水热法制备Ce0.8Zr0.2O2固溶体,用柠檬酸替代了碱类沉淀剂,避免了催化剂中残留Na+和K+对催化剂催化活性造成其他的影响。本研究探讨了柠檬酸量对Ce0.8Zr0.2O2固溶体合成的影响,经浸渍法负载活性组分制备了CuO/Ce0.8Zr0.2O2催化剂,并考察了催化水气变换制氢反应性能。
1 实验部分
1.1 催化剂的制备及实验方法
采用水热法制备Ce0.8Zr0.2O2固溶体。称取四份0.03 mol/L的Ce(NO3)3·6H2O和0.0075 mol/L的Zr(NO3)4·5H2O加入烧杯中(Ce∶Zr = 4∶1),分别向其中加入150 mL浓度为0.02、0.04、0.06、0.08 mol/L的柠檬酸溶液搅拌均匀,将完全溶解后的药品放入反应釜,置于180 ℃的均相反应器中反应12 h后进行抽滤,将得到的滤饼洗涤五次后放置在80 ℃的烘箱中干燥12 h,得到粉末状的样品后,放于400 ℃的马弗炉中焙烧3 h,将焙烧后的样品分别标记成Ce0.8Zr0.2O2-CA2、Ce0.8Zr0.2O2-CA4、Ce0.8Zr0.2O2-CA6、Ce0.8Zr0.2O2-CA8。
采用等体积浸渍法制备CuO/Ce0.8Zr0.2O2催化剂。用不同浓度的Cu(NO)2·3H2O溶液分别浸渍制备好的Ce0.8Zr0.2O2载体(浓度选择依据载体的吸水率),其中,Cu元素质量占催化剂质量的5%,浸渍好以后将其放入80 ℃的烘箱中进行干燥,干燥时间为12 h,然后放于400 ℃的马弗炉中焙烧3 h,冷却至室温取出样品,压片、粉碎、过筛后可得到40-80目的催化剂,分别标记成CuO/Ce0.8Zr0.2O2-CA2、CuO/Ce0.8Zr0.2O2-CA4、CuO/Ce0.8Zr0.2O2-CA6、CuO/Ce0.8Zr0.2O2-CA8。
文献中通常以KOH和NaOH为沉淀剂,采用共沉淀法制备Ce-Zr固溶体,不同的是,本研究以柠檬酸为络合剂,并且采用水热法进行制备,这是一次新的尝试,在水热法的制备过程中,同等条件下,只将铈和锆的硝酸盐溶液放入到水热反应釜中,未添加柠檬酸,反应结束后没有形成沉淀。当水热反应温度为120、140、160 ℃时,产生的沉淀极少,取滤液加碱实验有沉淀产生说明水热反应条件下铈未完全反应,存在铈的流失,当温度为180 ℃时,沉淀量较大,滤液加碱实验无沉淀产生,反应过程中添加柠檬酸所制备的CeO2和Ce0.8Zr0.2O2固溶体都可以获得较高的收率,CeO2、Ce0.8Zr0.2O2-CA2、Ce0.8Zr0.2O2-CA4、Ce0.8Zr0.2O2-CA6和Ce0.8Zr0.2O2-CA8的收率分别为90%、93%、92%、95%和96%。
1.2 催化剂的表征
采用法国塞塔拉姆仪器公司的Setline STA同步热分析仪对催化剂进行热重分析。采用德国布鲁克斯公司的S8型X射线荧光光谱仪测定催化剂的元素含量。物相组成测定是在德国布鲁克斯公司的D8 Advance型X射线粉末衍射仪上进行的。采用中国北京贝士德科技有限公司的BSDPM型自动比表面积和孔隙度分析仪对比表面积和孔体积进行检测,由BET法计算比表面积,BJH法计算孔容。H2-TPR及N2O氧化用中国浙江泛泰仪器有限公司的FINESORB-3010型化学吸附仪测定。XPS分析是在赛默飞Thermo Escalab 250光电子能谱仪上检测的。
1.3 催化剂的评价
催化剂的活性评价在以固定床反应器为基础自制的装置上进行,量取2 mL催化剂,进行活性评价前需要对催化剂进行还原,还原条件为:100 mL/min 5% H2-N2混合气在280 ℃下保持2 h。还原结束后关闭H2,在N2气氛下降低至反应温度,关闭N2后,5.11%CO-N2的混合气体经恒温水浴锅携带水蒸气(水气物质的量比为2)进入反应炉中进行催化反应,总气体体积空速为6600 h-1,反应生成的气体经冷凝器和干燥器后,进入杭州捷岛科学仪器GC-1690型气相色谱在线分析。
用下列公式计算CO转化率和产氢速率:
CO转化率:
式中,COin为气体进口时的体积分数,%;COout为重整气出口时的体积分数,%;FR是标准状况下重整尾气流量,mL/min;CH2为反应产物H2的含量,%;mcat为评价催化剂时的用量,kg;p为标准状况下的压强,Pa;T为标准状况下的温度,K。
2 结果与讨论
2.1 热重分析
图1是在Ar和高纯空气气氛下所做的Ce0.8Zr0.2O2-CA4样品的热重曲线。由图1可知,不同气氛下样品的失重规律是一样的,整个失重过程主要分为两个阶段,第一个阶段的起始温度为40 ℃,归属为样品中物理吸附水的脱除,结合DSC曲线来看,此过程为吸热过程。经计算,Ar下失重率为2.7%,空气下失重率为2.6%。第二阶段起始温度为138 ℃,Ar下失重率为:5.5%,空气下失重率为5.4%,可能为柠檬酸氧化产物(如羰基化合物、硝基化合物)的分解,可以看到在不同气氛下,样品失重差距较小,热量变化过程较为复杂,伴随着热解的吸热过程和燃烧的放热过程。
2.2 XRF分析
表1为不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂的元素含量。由表1可知,不同柠檬酸量制备的催化剂中Cu元素含量与目标含量相比略有下降,这可能是由于在采用等体积浸渍法负载活性组分时小部分的Cu2+未完全吸附在载体表面造成的。另外,经计算,催化剂中Ce/Zr物质的量比接近4∶1。
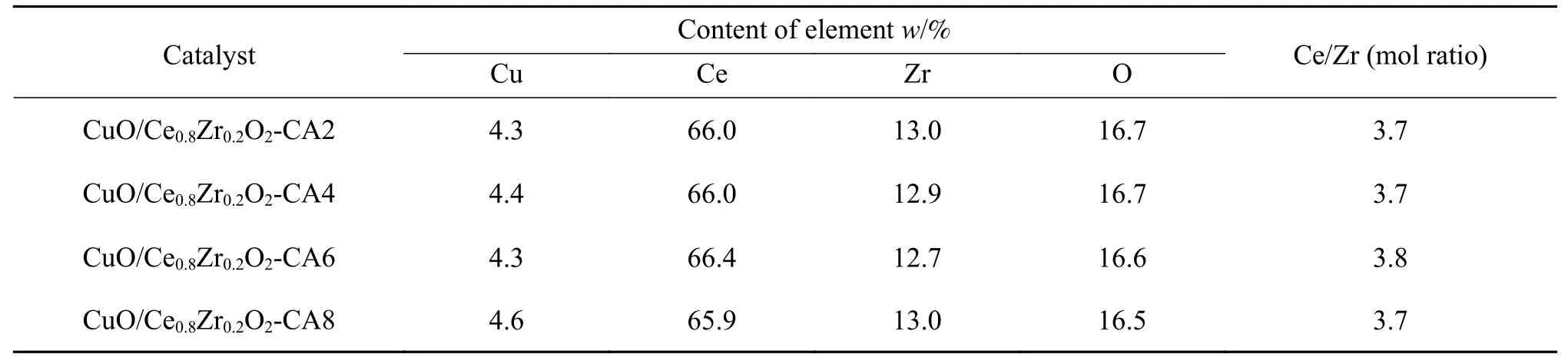
表 1 不同柠檬酸量制备催化剂的元素含量Table 1 Element content of catalysts prepared with different citric acid content
2.3 XRD分析
图2是CeO2和Ce0.8Zr0.2O2固溶体的XRD谱图。与纯CeO2的四个主峰(2θ= 28.6°、33.1°、47.5°、56.4°)相比,不同柠檬酸量所制备样品的特征衍射峰均向高角度发生了偏移,并且在图中并未发现ZrO2的特征衍射峰,说明较小半径的Zr4+进入到了CeO2的晶格当中,形成了立方萤石结构的Ce0.8Zr0.2O2固溶体[20,21]。另外,掺杂Zr元素后催化剂的特征衍射峰强度出现了不同程度地降低,这是由于Zr4+的离子半径(0.084 nm)小于Ce4+的离子半径(0.097 nm),Zr的加入导致CeO2的萤石结构发生了扭曲,结晶度变差[22]。但通过比较不同柠檬酸量制备的Ce0.8Zr0.2O2固溶体可以发现,CuO/Ce0.8Zr0.2O2-CA4催化剂的特征衍射峰的强度大且尖锐,结晶较为完整,结晶度较好。
图3是CuO/CeO2和CuO/Ce0.8Zr0.2O2催化剂的XRD谱图。由图3可知,所有催化剂均在35.5°和38.5°附近出现了强度较小的CuO特征衍射峰,表明CuO物种在Ce0.8Zr0.2O2固溶体表面以无定型或者高度分散的形式存在[23]。采用Scherrer公式计算CuO晶粒尺寸可得,CuO/CeO2、CuO/Ce0.8Zr0.2O2-CA2、CuO/Ce0.8Zr0.2O2-CA4、CuO/Ce0.8Zr0.2O2-CA6和CuO/Ce0.8Zr0.2O2-CA8中CuO的晶粒粒径分别为47.1、40.6、37.1、44.4、48.0 nm,显然,CuO/Ce0.8Zr0.2O2-CA4催化剂的CuO晶粒尺寸最小,表明CuO在铈锆固溶体表面的分散情况较好。
2.4 催化剂表面的物理化学性质分析
表2为催化剂的物理化学性质。由表2可知,与CeO2相比,添加Zr后形成的Ce0.8Zr0.2O2固溶体比表面积均有所增大,说明Zr的添加能有效提高CeO2的比表面积。与未负载活性组分的载体相比,经等体积浸渍法负载活性组分后的催化剂的比表面积均减小,这是由于载体的部分孔道被Cu物种所占据造成的。从表2中还可以看到,CuO/Ce0.8Zr0.2O2-CA4催化剂的Cu比表面积较大,为5.5 m2/g,产氢速率也最大,为3681.9 μmol/(kg·s),CuO/Ce0.8Zr0.2O2-CA8催化剂的Cu比表面积最小,为1.2 m2/g,产氢速率也最小,为2283.2 μmol/(kg·s),Cu比表面积影响着催化剂的催化活性,Cu比表面积越大,催化活性可能越好,这就是CuO/Ce0.8Zr0.2O2-CA4催化剂表现出较好催化活性的另一个原因。

表 2 催化材料的物理化学性质Table 2 Physicochemical properties of catalytic materials
2.5 H2-TPR分析
图4是CuO/Ce0.8Zr0.2O2催化剂的H2-TPR谱图。由图4可知,不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂均出现了两个还原峰,代表着不同CuO物种的还原。其中,α代表表相CuO的还原峰,β代表体相CuO的还原峰[24]。
表3为各催化剂还原峰所对应的温度。由表3可知,不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂的CuO还原温度均低于200 ℃,而文献报道中纯CuO的还原温度为340 ℃[25],说明CuO与Ce0.8Zr0.2O2固溶体之间的相互作用降低了CuO的峰位还原温度,通过比较不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂的CuO还原温度可以发现,CuO/Ce0.8Zr0.2O2-CA4催化剂的峰位还原峰温度较低,这是因为CuO/Ce0.8Zr0.2O2-CA4催化剂中CuO与Ce0.8Zr0.2O2固溶体之间的相互作用较强,CuO在Ce0.8Zr0.2O2表面的分散性较好,CuO更易还原。活性组分与载体之间的相互作用影响着催化剂的催化活性,相互作用越强,Cu的烧结能够得到抑制,催化剂在WGS反应过程中的催化活性也会得到增强[26],因此,CuO/Ce0.8Zr0.2O2-CA4表现出较好的催化活性。
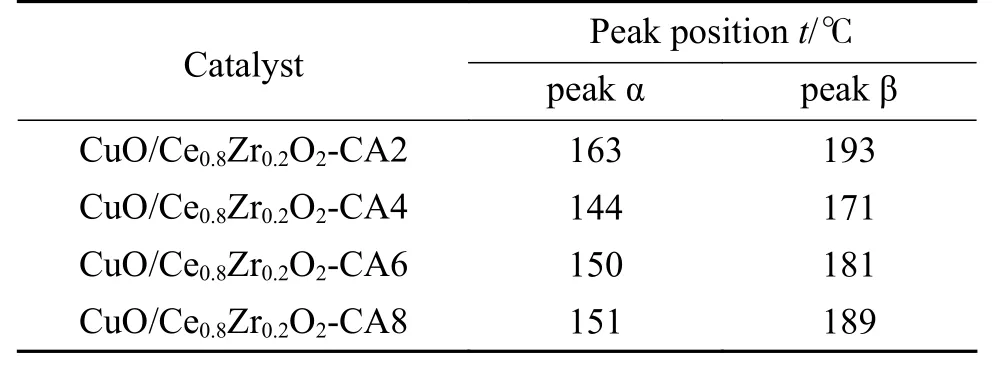
表 3 CuO还原峰位置Table 3 Reduction peak positions of CuO
2.6 XPS分析
图5为CuO/CeO2和CuO/Ce0.8Zr0.2O2催化剂的Ce 3dX射线光电子能谱。由图5可知,不同柠檬酸量制备的催化剂均出现了八个Ce 3d的特征衍射峰,其中,u、u'、u''、u'''属于Ce 3d3/2能级的电子结合能,而v、v'、v''、v'''则属于Ce 3d5/2能级的电子结合能,另外在图中所示的八个特征峰中,u'和v'属于Ce3+的特征峰,u、u''、u'''、v、v''、v'''则归属于Ce4+[27],说明Ce3+和Ce4+是同时存在的,Ce3+的存在主要是由于Ce4+与Cu+发生相互作用,Ce4+的电子状态发生改变造成的,而Ce3+离子与催化剂表面的氧空穴有着直接的联系,Ce3+含量越多,催化剂表面的氧空穴越多,氧空穴越多催化剂的催化活性越好,从表4给出的Ce3+/(Ce3++ Ce4+)比可以看到,不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂的Ce3+/(Ce3++ Ce4+)比大小顺序为:CuO/Ce0.8Zr0.2O2-CA4 > CuO/Ce0.8Zr0.2O2-CA6 > CuO/Ce0.8Zr0.2O2-CA2 >CuO/CeO2> CuO/Ce0.8Zr0.2O2-CA8,其大小顺序与催化剂的评价结果相吻合,CuO/Ce0.8Zr0.2O2-CA4催化剂的Ce3+/(Ce3++ Ce4+)比较高,为28.6%,催化剂表面的氧空穴较多,这就是CuO/Ce0.8Zr0.2O2-CA4催化剂表现出较好的催化活性的主要原因之一。

表 4 催化剂Ce 3d的XPS曲线拟合Table 4 Fitting results of Ce 3d XPS curves of catalysts
图6为CuO/CeO2和CuO/Ce0.8Zr0.2O2催化剂的Cu 2pXPS谱图。由图6可知,不同柠檬酸量制备的催化剂均出现了三个特征峰,其中,952.6 eV附近出现的特征峰归属于Cu 2p1/2能级的电子结合能,937.5-946.8 eV出现的特征峰为Cu 2p的卫星峰,该峰归属于Cu2+[28],932.8 eV附近出现的特征峰则属于Cu 2p3/2能级的电子结合能[29]。Cu2+离子的Cu 2p3/2电子结合能应在934.9 eV,而本研究所制备的催化剂的Cu 2p3/2电子结合能均出现在932.8 eV附近,向低结合能方向移动,说明催化剂表面存在其他铜物种,可能为Cu+或Cu0,然而对于Cu+或Cu0特征峰的区分有一定的困难,因此,作者又引入了催化剂的Cu LMM谱图,其测定结果见图7,图7为不同柠檬酸量下制备的CuO/Ce0.8Zr0.2O2催化剂的Cu LMM谱图。
由图7可知,915.8-916.4 eV特征峰的结合能均低于Cu0的俄歇电子能(918.7 eV),因此,将这个位置出现的特征峰归属于Cu+,表明催化剂表面存在着不同的Cu物种,但经过对XRD的分析发现,图中只有CuO的特征衍射峰,并未发现Cu2O的特征衍射峰,这是因为Cu2O高度分散于催化剂的表面。催化剂表面存在着Cu+,说明活性组分CuO与Ce0.8Zr0.2O2载体之间发生了较强的相互作用,Cu2+转化为Cu+,Ce3+也变成了Ce4+。
图8为不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂的Zr 3dXPS谱图。由图8可知,所有催化剂均出现了两个特征峰,其中,184.3 eV附近出现的特征峰归属于Zr 3d3/2的电子结合能,181.9 eV附近出现的特征峰归属于Zr 3d5/2的电子结合能,这两个特征峰归属于Zr4+,说明催化剂表面只存在单一的Zr4+物种。图9为CuO/CeO2和CuO/Ce0.8Zr0.2O2催化剂的O 1sXPS谱图。
由图9可知,不同柠檬酸量制备的催化剂均出现了两个特征峰,其中,529.1-529.4 eV出现的特征峰归属于晶格氧的电子结合能,530.9-531.4 eV出现的特征峰则归属于吸附氧物种的电子结合能。
2.7 催化性能测试
不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂用于CO水气变换制氢反应中的催化活性结果见图10。由图10可知,在反应温度为240-340 ℃,n(H2O)/n(CO) = 2∶1,GHSV = 6600 h-1的条件下,不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂的催化活性顺序为CuO/Ce0.8Zr0.2O2-CA4 > CuO/Ce0.8Zr0.2O2-CA6 > CuO/Ce0.8Zr0.2O2-CA2 > CuO/CeO2> CuO/Ce0.8Zr0.2O2-CA8,即当柠檬酸浓度为0.04 mol/L时,所制备的催化剂催化活性最好,温度为320 ℃时CO的转化率为96.9%,接近热力学平衡值,之后将反应温度升高至340 ℃,CuO/Ce0.8Zr0.2O2-CA4催化剂催化活性略有下降,但仍然接近热力学平衡,保持2 h后,再将温度降低到320 ℃,CO的平衡转化率不发生变化,显然,所制备的催化剂具有较好的稳定性。值得注意的是,当柠檬酸浓度为0.08 mol/L时催化剂的催化活性最差,CO转化率只有60.1%,这种不同结果主要是由于催化剂Cu的比表面积、Ce0.8Zr0.2O2固溶体和CuO之间的相互作用不同引起的。CuO/Ce0.8Zr0.2O2催化剂的活性中心主要是负载在Ce0.8Zr0.2O2载体表面上分散的Cu物种,CuO/Ce0.8Zr0.2O2-CA4催化剂的CuO晶粒粒径越小,Cu比表面积越大,活性组分与Ce0.8Zr0.2O2固溶体之间的相互作用较强,氧空穴越多,CuO/Ce0.8Zr0.2O2催化剂催化活性越好。
产物中CO含量是评价催化剂催化性能的重要指标,因此,对催化剂尾气中的CO含量进行测定有着重要的意义,图11是变换温度对CuO/Ce0.8Zr0.2O2催化剂的CO含量的影响。从图11可以看出,随着温度的升高,产物中CO的含量在逐步减少,表明CO的转化程度大幅度提高,不同柠檬酸量制备的催化剂用于水气变换反应后气体中CO含量最大的是CuO/Ce0.8Zr0.2O2-CA8催化剂,在温度为320 ℃、水气比为2、总气体空速为6600 h-1时,CO含量为1.9%,含量最小的是CuO/Ce0.8Zr0.2O2-CA4催化剂,CO含量仅为0.1%。
2.8 CuO/Ce0.8Zr0.2O2-CA4催化剂稳定性的测定
稳定性是衡量催化剂寿命的重要指标,因此,对催化剂稳定性进行测定具有重要的意义,本工作中所制备的CuO/Ce0.8Zr0.2O2-CA4催化剂在水气变换反应中表现出较好的催化活性,因此,对其进行催化剂稳定性的测定。测试条件:反应温度为320 ℃、水气物质的量比(H2O∶CO)为2、总气体体积空速为6600 h-1,测试时间间隔为2 h。图12为CuO/Ce0.8Zr0.2O2-CA4催化剂上CO转化率随反应时间的变化。由图12可知,在所测31 h的时间范围内,随着反应时间的延长,CO的平衡转化率上下波动,反应时间为17 h时,转化率最高为96.7%,反应时间为25 h时,CO转化率最低,为92.9%,从整体来看,催化剂稳定性较好,在长时间范围内保持着较高的CO转化率。
3 结 论
本研究采用水热法合成了Ce0.8Zr0.2O2固溶体,再经浸渍法负载活性组分制备了CuO/Ce0.8Zr0.2O2催化剂,考察了柠檬酸量对CuO/Ce0.8Zr0.2O2催化剂结构、性质及其催化水气变换反应制氢性能的影响。结果表明,不同柠檬酸量制备的CuO/Ce0.8Zr0.2O2催化剂在Cu比表面积、还原性能及Ce0.8Zr0.2O2固溶体与CuO之间的相互作用方面具有明显的区别。其中,柠檬酸浓度为0.04 mol/L时所制备的催化剂具有较大的Cu比表面积,较低的CuO还原温度和较强的Ce0.8Zr0.2O2固溶体与CuO之间的相互作用,在水气变换制氢过程中具有较高的CO转化率,表现出了较好的催化活性,在反应温度为320 ℃,水气物质的量比n(H2O)/n(CO) = 2,总气体体积空速GHSV = 6600 h-1时,CO平衡转化率接近热力学平衡值,为96.9%。

