电致孔技术促进瑞格列奈水凝胶经皮吸收
马丽兰,徐娜,吴桐,李海鹰,杨文智
(1.河北省第六人民医院 河北大学精神卫生研究院,药剂科,河北 保定 071000;2. 河北大学 药学院,河北 保定 071002)
瑞格列奈(repaglinide)是一种通过刺激胰腺释放胰岛素,专门控制Ⅱ型糖尿病患者的葡萄糖波动的口服降糖药物.相比其他磺酰脲类降糖药物,具有起效快、副作用少、用药剂量少等优点,市售多以片剂为主[1-2].>但瑞格列奈属于BCS Ⅱ分类系统,口服生物利用度有限.其水溶性差(34 μg/mL)极大限制了药物的吸收,也限制了药物新剂型的开发[3-4].透皮给药可避免肝首过效应,减少药物对胃肠道的副作用,能长时间维持恒定的血药浓度,减少给药次数.但皮肤是化学物质进入机体的天然屏障,其阻碍了药物的经皮渗透,使药物的治疗效果下降[5-7].因此设计有效的透皮制剂需克服皮肤阻碍.电致孔技术可增加药物的透皮速率和累积渗透量,其原理是利用瞬间脉冲电场的作用力改变皮肤中脂质双分子层的排列顺序,从而形成新的通道,促使药物分子顺利透过[8-9].近几年来,电致孔技术在透皮给药实验中应用广泛,也取得了良好的透皮效果[10-12].本文基于课题组采用助溶剂精氨酸极大改善瑞格列奈溶解度的基础上[13],制备了瑞格列奈水凝胶,考察电致孔条件下药物凝胶的兔体内释放情况,建立体内外药物释放相关性模型,综合判断制备瑞格列奈降糖水凝胶剂的可行性.
1 实验方法
1.1 仪器与试剂
Franz立式双室扩散仪(中科院上海有机所);LC3000型高效液相色谱仪(北京创新通恒科技有限公司);AN2651型分析天平(上海民桥精密科学仪器有限公司);DLZ-G电脑中频治疗仪(廊坊市豪迈医疗器械有限公司).
瑞格列奈(湖北康宝泰精细化工有限公司);卡波姆、精氨酸、尼泊金乙酯、EDTA-2Na、三乙醇胺、月桂氮酮、油酸等(国药集团化学试剂有限公司),其余试剂均为分析纯.
新西兰兔雌雄各半,合格证号:1805011,(2.5 ± 0.1)kg,购自河北省实验动物中心.
1.2 制备瑞格列奈水凝胶剂
称取瑞格列奈-精氨酸复合物适量,溶于100 mL的蒸馏水中,得5 mg/mL的药物溶液,并对瑞格列奈-精氨酸复合物进行XRD表征.按顺序依次加入氮酮(体积分数1%)、油酸(体积分数1%)、尼泊金乙酯(3 g/L)、EDTA-2Na(0.1 g/L)、甘油(体积分数10%)和卡波姆(10 g/L),磁力搅拌,使各组分充分混均、溶胀后,用三乙醇胺(13.5 g/L)调pH值至中性,继续搅拌过夜,即得.
1.3 体外渗透实验
采用紫外分光光度法考察瑞格列奈水凝胶的体外渗透性能.将瑞格列奈干燥至恒重,精密称定,加入甲醇配成100 μg/mL的储备液.分别精密量取一定量的储备液,稀释成不同质量浓度的标准溶液,并采用紫外-可见分光光度计进行测定.以吸光度A对药物质量浓度ρ(μg/mL)作图,得到瑞格列奈标准曲线.取一定质量浓度的瑞格列奈对照品溶液,同日内测定5次,连续测定5 d,考察日内、日间精密度.在制备的凝胶剂中分别添加高(10 μg/mL)、中(5 μg/mL)、低(1 μg/mL)3种质量浓度的瑞格列奈标准液各5份,处理后分析测定,计算回收率.
采用Franz立式扩散池进行体外释放实验,将小鼠的离体皮肤置于扩散池和接收池之间,用夹子固定好,角质层一侧皮肤面向上,真皮层与接收液接触,有效接触面积为2.69 cm2,接收池的容积为13 mL,保证装置的密闭性良好,避免产生气泡.选择的接收液为pH=7.4的磷酸盐缓冲液,搅拌条件为300 r/min、水浴温度为(32±0.5)℃.将制备好的瑞格列奈水凝胶涂敷于皮肤的角质层一侧,取样时间点(0.083、0.25、0.5、1、2、4、6、8、12、24、36、48 h)取出全部的接收液,并及时补充同温同体积的接收液.将取得的接收液样品3 000 r/min离心10 min后,用紫外分光光度计测定样品吸收度,计算含量.按下式计算药物的单位面积累积释放量(Q)和经皮吸收百分率(W).
式中ρn是第n次取样时样品中药物质量浓度,V是接收池的总体积,A是有效透过面积,M是凝胶中药物总量.
以单位面积药物的累积渗透量(Q)对时间(t)进行线性回归分析,分别用零级、一级和Higuchi方程拟合,探究最佳释放模型.
1.4 兔体内药物动力学实验
采用HPLC法考察瑞格列奈的动物体内药代动力学,色谱柱:Hypersil BDS C18色谱柱(46 mm×250 mm,5 μm),柱前接ODS C18保护柱;流动相:CH3OH-(0.02 mol/L)NH4H2PO4(体积比70∶30,pH=2.5);紫外检测波长:λ=282 nm;流速:1 mL/min;柱温:常温;进样量:20 μL.
样品制备:家兔耳缘静脉取血约0.5 mL至含肝素的EP管中,12 000 r/min离心10 min后,精密量取上清液200 μL血浆,加入0.5 mL三氯甲烷-甲醇(体积比4∶1)溶液,涡旋振荡5 min后离心10 min(12 000 r/min),取有机层经0.22 μm的微孔滤膜过滤,常温下氮气吹干,加入甲醇溶液100 μL复溶,3 000 r/min离心5 min,取上清液进行HPLC分析,每个样品平行进样3次.
标准曲线的建立及精密度、回收率考察:精密称定瑞格列奈,用甲醇配成1 mg/mL的瑞格列奈储备液,稀释后配制成不同浓度的标准溶液,分别取20 μL加入到180 μL空白血浆中,依上法处理血浆样品后,进行色谱分析,以峰面积对质量浓度(μg/mL)绘制标准曲线.取一定质量浓度的瑞格列奈血浆样品,处理后在相同条件下每隔3 h进样分析,连续测定5 d,考察方法的日间和日内精密度.在含药物的血浆中加入瑞格列奈标准溶液,配成低、中、高质量浓度(1、10和40 μg/mL)的样品各5份,处理后进行HPLC分析,计算高、中、低3种质量浓度的回收率.
兔体内药代动力学研究:将12只健康的新西兰兔随机分为正常组和电致孔组,每组雌雄各半,实验前12 h禁食.除去兔背部正中至两侧5 cm×5 cm区域体毛,正常组于一侧均匀涂敷瑞格列奈水凝胶,给药剂量为10 mg/kg.电致孔组用无水乙醇润湿兔背部皮肤后,将导电电极分别接在DLZ-G型电脑中频治疗仪的正负电极上,然后贴于家兔背部电致孔处理20 min,涂抹与正常组等量水凝胶.分别于0.083、0.25、0.5、1、2、4、6、8、12、24、36和48 h兔耳缘静脉取血0.5 mL,置于含肝素的EP管中.经处理后在选定的色谱条件下进样分析,采用DAS 2.0软件计算药物的体内药代动力学参数及药-时曲线下面积(AUC).同时,采取自制RPG-Arg水凝胶各个时间点下的累积释放量(Q)与体内累积AUC之间的相关性来评价自制载药水凝胶的体内外相关性.
2 结果与讨论
2.1 瑞格列奈-精氨酸(RPG-Arg)复合物XRD表征
图1A为瑞格列奈、精氨酸、RPG-Arg复合物、瑞格列奈与精氨酸的物理混合物粉末衍射图谱.

a.瑞格列奈;b.精氨酸;c.瑞格列奈与精氨酸的物理混合物(质量比5∶4);d.RPG-Arg复合物(质量比5∶4).图1 XRD衍射图谱(A),在PBS 7.4缓冲液中RPG-ARG复合物和RPG药物的释放曲线(B)Fig.1 X-ray powder diffractions(A), drug release from RPG-ARG complex and RPG at PBS 7.4 solution(B)
瑞格列奈主要特征峰出现在7.6°、10.0°、13.7°、15.2°、16.6°、20.1°、22.6°、25.3°和30.8°等处[14],精氨酸的特征结晶峰出现在10.9°、14.9°、16.9°、18.2°、19.2°、23.1°和27.3°等处[15].其物理混合图谱中,瑞格列奈和精氨酸的特征结晶峰依然存在,二者结晶态未变.与游离药物相比,RPG-Arg复合物(质量比5∶4)中无明显结晶峰,说明添加精氨酸助溶剂后,2种分子通过分子间氢键作用,形成了RPG-Arg复合物,导致瑞格列奈和精氨酸由原有结晶态变为无定形态,利于药物的快速溶出,导致皮肤内外的药物高浓度差,可有效促进药物的经皮渗透,即用RPG-Arg复合物可保证透皮给药时皮肤渗透端的药物高浓度.当RPG-Arg复合物中药物以无定形状态存在会促进复合物中药物释放,如图1B,RPG原型药物在PBS 7.4释放液中释放缓慢,5 h仅释放38%,而同条件下,RPG-Arg复合物中药物释放可达88%.因此,RPG-Arg复合物可有效保证透皮给药中RPG药物在皮肤释放端的高浓度,利于药物透皮吸收.
2.2 RPG-Arg复合物凝胶体外渗透
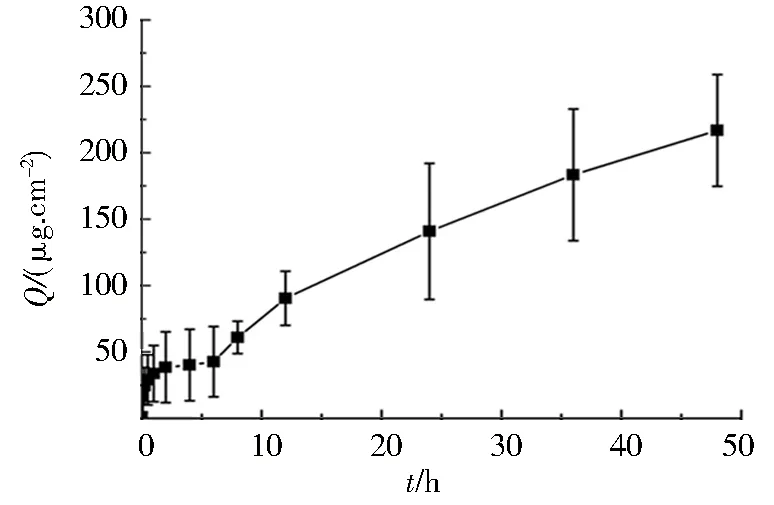
图2 瑞格列奈水凝胶中药物的累积释放曲线Fig.2 Repaglinide release profile of the hydrogel
药物水凝胶处方成分进行紫外扫描,水凝胶处方中基质对药物测定无干扰.测定瑞格列奈药物的标准曲线方程为y= 0.00 947x- 0.001 67(r=0.999),线性为0.1~10 μg/mL.日内和日间的RSD值分别为3.47%和3.75%.在制备的凝胶剂中分别添加高、中、低质量浓度的瑞格列奈标准液,测定后计算得到瑞格列奈的高、中、低平均回收率均高于98%(n=5).结果表明,样品检测方法可靠、准确,符合样品分析方法要求.
计算药物的单位面积累积渗透量(Q)和药物透皮吸收百分率,向扩散池中放入5 g水凝胶,含药25 mg.以Q为纵坐标,时间(t)为横坐标,得到瑞格列奈水凝胶中药物体外累积释放曲线.由图2可知,药物在12 h之内释放较缓慢,在12 ~ 48 h内释放加快,48 h药物的累积释放率达到了处方量的29%.此外,如表1所示,瑞格列奈水凝胶中药物单位面积的累积释放量与时间存在良好的线性关系(r2= 0.978),水凝胶中药物释放接近零级动力学方程,遵循Fick’s扩散机制.

表1 瑞格列奈水凝胶中药物累积渗透量与时间的拟合方程
兔血样中瑞格列奈标准曲线为y=1 695x+15 925(r=0.997;n=6),线性为0.1~80 μg/mL,血清中内源性物质对瑞格列奈测定无干扰,药物出峰时间在8.9 min.检测方法日内和日间精密度RSD值分别为2.66%和5.35%.高、中和低3种质量浓度瑞格列奈加样回收率分别为100.1%、97.7%、95.7%(n=5),结果均符合生物样品定量分析的要求.
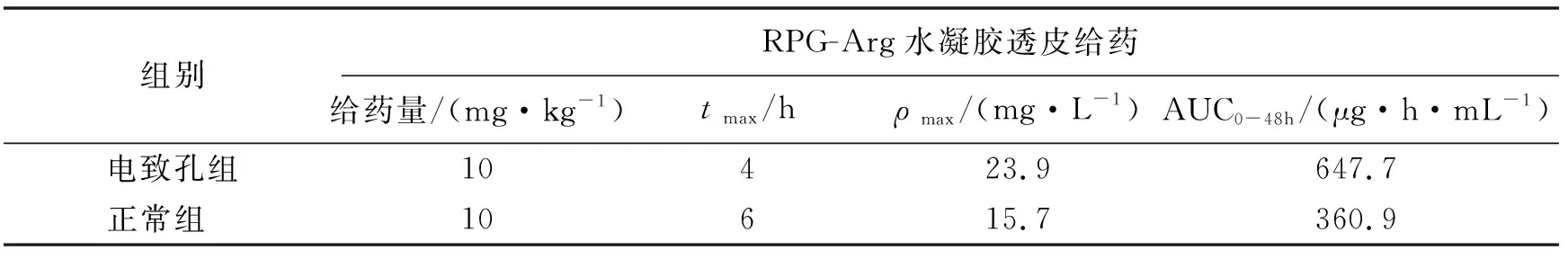
表2 瑞格列奈载药水凝胶正常组、电致孔组兔体内药代动力学参数(n=3)
表2和图3所示,正常组水凝胶涂敷兔皮肤后,被动扩散的药物在6 h其ρmax达到15.7 μg/mL,24 h后药物开始缓慢释放,直到48 h药物质量浓度维持在1.5 μg/mL,说明凝胶可长时间维持血药浓度,达到缓释的目的.对比被动扩散组,电致孔组缩短了药物在皮肤内的滞留时间,兔体内血药质量浓度提前至4 h达峰且增大了药物渗透量,ρmax为23.9 μg/mL,AUC0-48为647.7 μg·h/mL,是正常组渗透量的近2倍,皮肤经过电致孔处理后,脂质双分子层的排列顺序被打破,形成了亲水性孔道,使原本滞留在皮肤内的药物顺利通过.此外,高压脉冲作用可能提高了膜的渗透性,使之协同促进药物渗透,进而提高药物的渗透量,使药物持续渗透,提高药物的体内生物利用度.
体内外相关性是通过药物体外溶出特征来预测体内反应的一种相关关系的数学模型,针对难溶药物来说,建立体内外相关性非常重要.由于体外溶出可反映药物体内吸收,即通过体外水凝胶药物的释放曲线来预测水凝胶中药物的兔体内吸收情况.体内生物利用度(AUC)与药物进入体循环的量成正比.本实验各时间点瑞格列奈凝胶剂的兔体外单位面积药物累积渗透量(x)和体内药物累积AUC(y),见表3.以AUC为纵坐标,渗透量Q为横坐标,进行线性回归,以相关系数r较大者建立水凝胶的体内外相关模型,如图4.通过线性回归得到体内外相关线性方程为y=1.960 7x-25.33,r=0.98(n=12).结果显示自制载药水凝胶具备良好的体内外相关性,说明可以通过水凝胶体外释放来预测水凝胶中药物的透皮吸收.
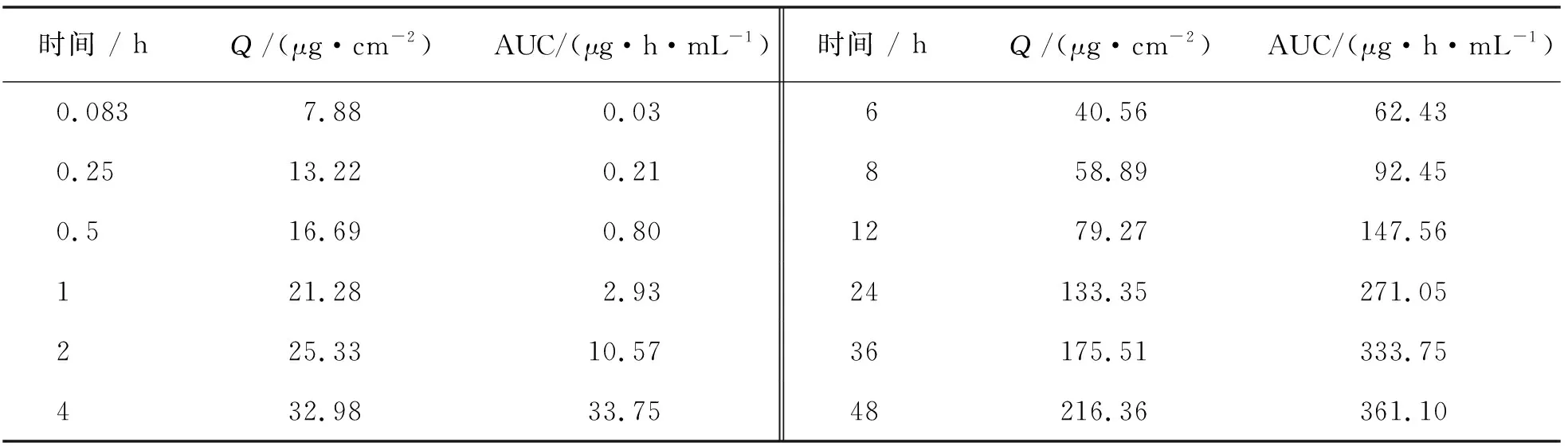
表3 各时间点下瑞格列奈的体内外累积释放
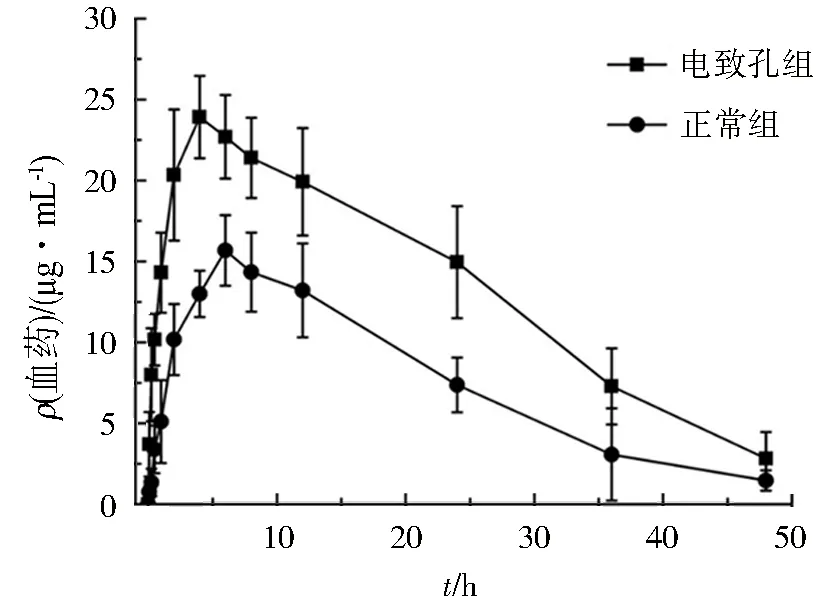
图3 兔正常组给药与电致孔组透皮 给药的血药浓度-时间曲线Fig.3 Plasma drug concentration-time curve for passive diffusion and electroporation diffusion
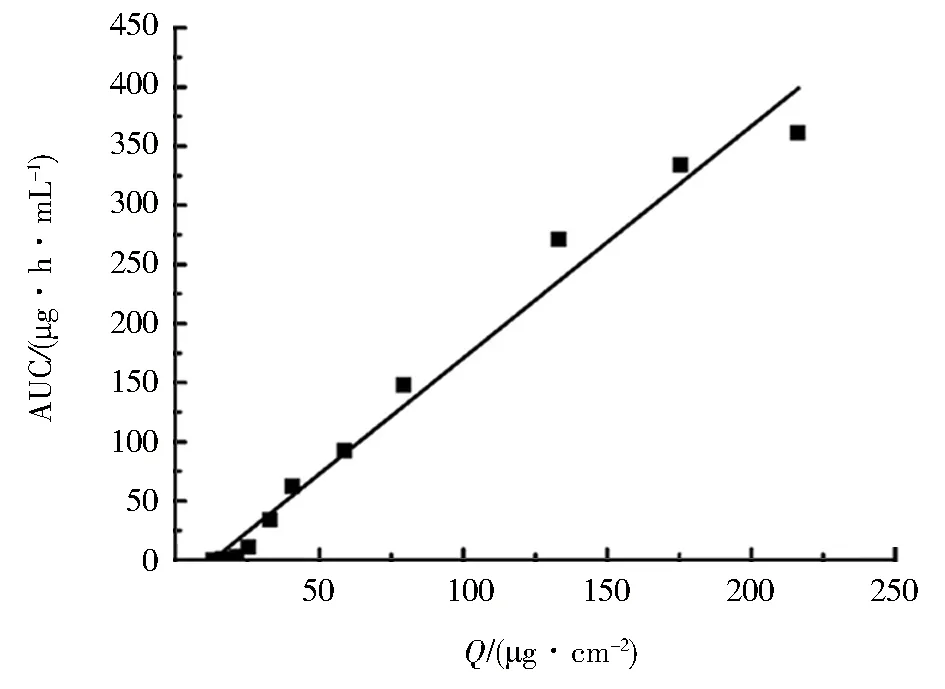
图4 瑞格列奈水凝胶中药物体内累积生物利用度(AUC) 与体外累积渗透量的线性回归Fig.4 Linear regression plot of accumulated absorbed in vivo AUC versus accumulated released in vitro of repaglinide hydrogel
3 结论
本文考察电致孔技术对自制瑞格列奈水凝胶透皮吸收的影响.采用HPLC进行样品分析,以离体鼠皮为介质,瑞格列奈水凝胶剂的体外透皮释放接近零级方程.兔涂敷瑞格列奈水凝胶,在48 h内可缓释药物.兔皮肤电致孔处理,涂敷等量药物水凝胶,血药浓度的达峰时间缩短2 h且体内药物生物利用度显著增大.因此,电致孔处理皮肤后涂敷载药水凝胶可有效促进药物的经皮吸收.此外,瑞格列奈水凝胶剂体内外释放具有显著相关性,通过水凝胶体外释放可推测药物水凝胶的体内吸收.

