意大利蝗越冬卵抗寒物质分析
宋 余,黄伟伟,赵 娜,蒋思涵,扈鸿霞,丁国婵,季 荣*,叶小芳*
(1.中亚区域跨境有害生物联合控制国际研究中心/新疆特殊环境物种保护与调控生物学实验室/新疆特殊环境物种多样性应用与调控重点实验室/新疆师范大学生命科学学院,乌鲁木齐 830054;2.新疆玛纳斯县蝗虫鼠害预测预报防治站,玛纳斯 832200)
耐寒性是指昆虫在低温条件下的生存能力,对昆虫的分布和生存具有重要意义[1]。昆虫生活史中不同时期的耐寒性不同,一般来说,越冬期耐寒性最强,滞育期次之,发育期耐寒性最弱[2]。滞育期间或低温胁迫的昆虫可通过积累小分子抗寒物质,如糖、甘油、脂肪、多元醇和氨基酸等以降低冰点和增加细胞外液的渗透压来保护细胞[3,4]。研究表明,越冬昆虫体内的多种小分子抗寒物质通过形成抗寒系统来抵御外界不良环境,不同昆虫在滞育期的抗寒系统组分及含量也不相同。如中华蜜蜂Apisceranacerana体内的抗寒物质系统为“葡萄糖-甘油-氨基酸”[5],棉铃虫Anoplophoraglabripennis的抗寒物质系统为甘油-葡萄糖-甘露醇-氨基酸(丝氨酸、谷氨酸、缬氨酸、亮氨酸、丙氨酸和脯氨酸)[6]。处于寒冷滞育期的亚洲小车蝗Oedaleusasiaticus卵的脯氨酸、丙氨酸、甘氨酸、甘油、海藻糖、肌醇和山梨醇含量显著增加;宽翅曲背蝗Pararcypteramicropateramerideonalis卵在低温条件下的甘氨酸、脯氨酸、谷氨酸、甘油、海藻糖、肌醇和山梨醇含量增加[7]。此外,不同地理种群的飞蝗受低温胁迫后其主要合成的抗寒物质种类不同:和硕种群的蝗卵主要合成海藻糖,哈密种群蝗卵主要合成甘油、山梨醇和海藻糖等,而北大港种群主要合成甘油和山梨醇[8],说明地理位置也可影响同种昆虫的耐寒物质组成。滞育期的西伯利亚蝗Gomphocerus sibiricus卵则以甘油、果糖、山梨醇和氨基酸为抗寒物质系统以抵御新疆严寒[9]。
在新疆分布的所有蝗虫中,意大利蝗Calliptamusitalicus是主要优势害虫,由于其分布范围广和繁殖力极强,严重为害当地草场及农作物生长。意大利蝗以卵滞育越冬,卵期是其抵御低温不利条件的重要发育阶段。新疆冬季较为寒冷且持续时间较长,蝗卵能否安全度过严寒冬季对其个体发育及为害程度至关重要。为能确保顺利越冬,意大利蝗除了采取适时滞育的对策外[10-12],越冬期间蝗卵的过冷却点极低[13],推测蝗卵在越冬发育过程中具有较强的抗寒性,但蝗卵是否通过积累小分子抗寒物质来提高抗寒性还不得而知。鉴于抗寒物质在昆虫抵御低温不良环境中的重要性,本研究通过对意大利蝗卵野外越冬发育过程的小分子碳水化合物、脂肪和游离氨基酸含量进行测定,明确蝗卵越冬过程的抗寒物质组成及含量变化,探讨意大利蝗越冬卵的耐寒能力,为揭示意大利蝗的抗寒适应机理提供科学依据。
1 材料与方法
1.1 蝗卵采集及样品准备
2017年7月至8月于新疆维吾尔自治区玛纳斯县大阳山(43°55′ N,86°91′ E;海拔1292 m)采集雌、雄意大利蝗成虫,并用其喜食植物(冷蒿Artemisiafrigida、紫花苜蓿Medicagosativa)进行就地笼罩饲养,待其交配产卵后,每天定时筛土收集蝗卵,埋于野外土壤中。定期解剖蝗卵,并于体式显微镜(SMZ 745T,日本尼康)下观察蝗卵发育情况。根据王香香等[12]的划分标准,确定蝗卵发育阶段,并将各阶段(Ⅰ~Ⅹ阶段)蝗卵于液氮中保存备用。采用电子温度记录器(TP-2200,北京安伏)测定室外蝗卵越冬过程5 cm的土层地温,待蝗卵孵化出土后读取温度数据,实时跟踪调查蝗卵发育过程的环境温度变化情况。
1.2 试验方法
取不同发育阶段的蝗卵及1龄蝗蝻于烘箱(DHG9070A,上海齐欣)中烘干至恒重,并研磨成粉,以备后续抗寒物质含量测定。
1.2.1 糖类物质含量测定 葡萄糖和果糖含量分别采用葡萄糖检测试剂盒(南京建成生物工程研究所)和果糖检测试剂盒(苏州科铭生物技术有限公司)进行测定。糖原和海藻糖含量参照张徐等[14]的方法进行测定。
1.2.2 多元醇含量测定 甘油含量参照张徐等[14]的方法进行测定。山梨醇含量的测定参照王洪亮[15]的方法进行。肌醇含量采用昆虫肌醇ELISA检测试剂盒(上海加科生物技术有限公司)进行测定。
1.2.3 脂肪含量测定 参照张徐等[14]的方法进行。
1.2.4 氨基酸含量测定 分别取不同发育阶段蝗卵各30粒,每个阶段重复3次,送至新疆畜牧科学院采用氨基酸自动分析仪(S-433D,德国Sykam)测定蝗卵的氨基酸含量,具体检测和分析方法参见国家标准GB/T 5009.124-2003。
1.3 数据统计与分析
试验数据采用SPSS 19.0软件进行统计分析,不同阶段蝗卵的抗寒物质含量其差异显著性检验采用单因素方差分析(One-Way ANOVA)。
2 结果与分析
2.1 意大利蝗卵发育与环境温度的关系
意大利蝗卵的发育过程分为10个阶段,具体划分标准参考王香香等[12]的报道。早期发育阶段(Ⅰ~Ⅲ):蝗卵发育较快,原头分化出触角,复眼基本形成,且胸部、腹部分节明显。此时外界环境温度较高,其中第Ⅰ阶段的平均温度最高为(26.80±2.73)℃。滞育阶段(Ⅳ~Ⅵ):随着外界温度降至零下,蝗卵发育基本停滞,复眼边缘出现色素,胚胎形态无显著变化,在深度滞育的第Ⅴ阶段,环境温度最低,为(-7.96±0.12)℃。滞育后发育阶段(Ⅶ~Ⅸ):当环境温度逐渐升高,发生胚转,胚转完成后,原头由原来的卵孔方向转为卵前端指向。第Ⅹ阶段:当平均温度升至(15.14±0.27)℃时,蝗卵刚孵化出壳为1龄蝗蝻(Ⅹ)(图1)。

图1 意大利蝗卵发育过程的野外环境温度变化(2017.8―2018.5)Fig.1 Temperature changes in the surrounding environment during egg development in C.italicus (2017.8―2018.5)
2.2 意大利蝗越冬卵不同发育时期的小分子糖类物质含量变化
通过对意大利蝗越冬卵发育过程的海藻糖、葡萄糖、果糖和糖原进行测定,结果显示:在越冬卵的发育过程中,海藻糖含量的变化趋势呈“W”型(图 2A)。早期发育阶段,蝗卵海藻糖含量先减后增,其中,第Ⅱ阶段显著低于Ⅰ和Ⅴ阶段(P<0.05);滞育阶段,蝗卵海藻糖含量先增后减,其中第Ⅴ阶段含量显著高于其他所有阶段(P<0.05),为(22.92±0.62)μg/mg;滞育后发育阶段,第Ⅷ阶段海藻糖含量最低,显著低于其他所有阶段(P<0.05),为(10.36±0.29)μg/mg。
意大利蝗越冬卵发育过程葡萄糖含量呈积累-消耗的变化趋势(图 2B)。早期发育阶段,葡萄糖含量不断积累,其中第Ⅲ阶段含量显著高于除Ⅶ、Ⅸ阶段外的其他所有阶段(P<0.05)。当蝗卵进入滞育,葡萄糖含量持续下降;在滞育刚解除后的第Ⅶ阶段的葡萄糖含量急剧上升,随着发育推进,含量急剧下降至最低(Ⅷ),为(0.90±0.15)μg/mg,发育至第Ⅸ阶段,葡萄糖含量升至最高,为(3.97±0.19)μg/mg,显著高于其他所有阶段(P<0.05)。1龄蝗蝻(Ⅹ)的葡萄糖含量较低,显著低于第Ⅲ、Ⅶ和Ⅸ阶段(P<0.05)。
果糖含量随着越冬卵的发育逐渐上升(图 2C)。早期发育阶段果糖含量不断积累,其中,第Ⅲ阶段显著高于第Ⅰ、Ⅱ阶段(P<0.05);滞育阶段的果糖含量无显著变化(P>0.05);滞育解除后,果糖含量持续升高,第Ⅸ阶段含量显著高于之前所有阶段(P<0.05),且1龄蝗蝻(Ⅹ)的果糖含量最高,为(5.78±0.39)μg/mg,显著高于其他所有阶段(P<0.05)。
越冬卵的糖原含量呈不断积累-消耗的趋势(图2D)。在早期发育阶段,第Ⅰ阶段的糖原含量最低,为(1.93±0.07)μg/mg,显著低于除第Ⅶ阶段外的其他所有阶段(P<0.05),随后,糖原含量逐渐升高,第Ⅲ阶段显著高于Ⅰ、Ⅱ阶段;随着蝗卵进入滞育,滞育早期(Ⅳ)的糖原含量显著低于第Ⅲ阶段(P<0.05),第Ⅴ阶段蝗卵糖原含量较高,显著高于除Ⅷ阶段外的其他阶段(P<0.05),随后逐渐下降;滞育后发育阶段蝗卵的糖原含量先增后减,在胚转时(Ⅷ)升至最高,为(11.77±0.31)μg/mg,显著高于除滞育中期以外的其他阶段(P<0.05),随后逐渐下降。

图2 意大利蝗越冬卵发育过程的糖类物质含量变化Fig.2 Changes of sugar content during the development process of overwintering eggs in C.italicus
2.3 意大利蝗越冬卵不同发育时期的多元醇含量变化
通过对意大利蝗越冬卵发育过程中的山梨醇、肌醇和甘油含量进行测定,结果显示:在整个发育过程中,山梨醇含量的变化趋势为:1龄蝗蝻>滞育阶段>滞育后发育阶段>早期发育阶段(图3A)。其中,第Ⅰ阶段的山梨醇含量最低,为(9.97±0.40)μg/mg;随着发育推进,山梨醇含量逐渐增加。当蝗卵进入滞育,山梨醇含量较早期发育阶段的第Ⅰ、Ⅱ阶段显著上升(P<0.05)。随着滞育解除,山梨醇含量逐渐下降,当蝗卵孵化为蝗蝻时,山梨醇含量急剧升高至最大,为(35.34±0.54)μg/mg,显著高于其他所有阶段(P<0.05)。
在蝗卵早期发育中,肌醇含量逐渐增加,第Ⅲ阶段显著高于第Ⅰ阶段(P<0.05)。当蝗卵进入滞育时,肌醇含量显著升高(P<0.05),随后逐渐下降,第Ⅳ阶段的肌醇含量显著高于Ⅴ、Ⅵ阶段(P<0.05)。滞育解除后,肌醇含量先增后减,其中第Ⅸ阶段的肌醇含量(5.38±1.00)μg/mg显著低于其他所有阶段(P<0.05),1龄蝗蝻的肌醇含量较孵化前高(P<0.05)(图3B)。
蝗卵的甘油含量随发育进程总体呈升高趋势(图 3C),其中,第Ⅰ阶段的甘油含量最低,为(13.25±1.89)μg/mg,显著低于其他所有发育阶段(P<0.05);滞育阶段,甘油逐渐累积,显著高于早期发育阶段(P<0.05);1龄蝗蝻的甘油含量最高(142.60±3.38)μg/mg,显著高于其他所有阶段(P<0.05)。

图3 意大利蝗越冬卵发育过程的多元醇含量变化Fig.3 Changes of polyols content during the development process of overwintering eggs in C.italicus
2.4 意大利蝗越冬卵不同发育时期的脂肪含量变化
通过对意大利蝗越冬卵发育过程的脂肪含量进行测定,结果显示:整个卵期的脂肪含量无显著变化(P>0.05),当蝗卵孵化成1龄蝗蝻时,脂肪含量升至最高,占干重的42.87%,显著高于其他所有发育阶段(P<0.05)(图4)。

图4 意大利蝗越冬卵胚胎发育脂肪含量变化Fig.4 Changes of fat contents during the development process of overwintering eggs in C.italicus
2.5 意大利蝗越冬卵不同发育时期的游离氨基酸含量变化
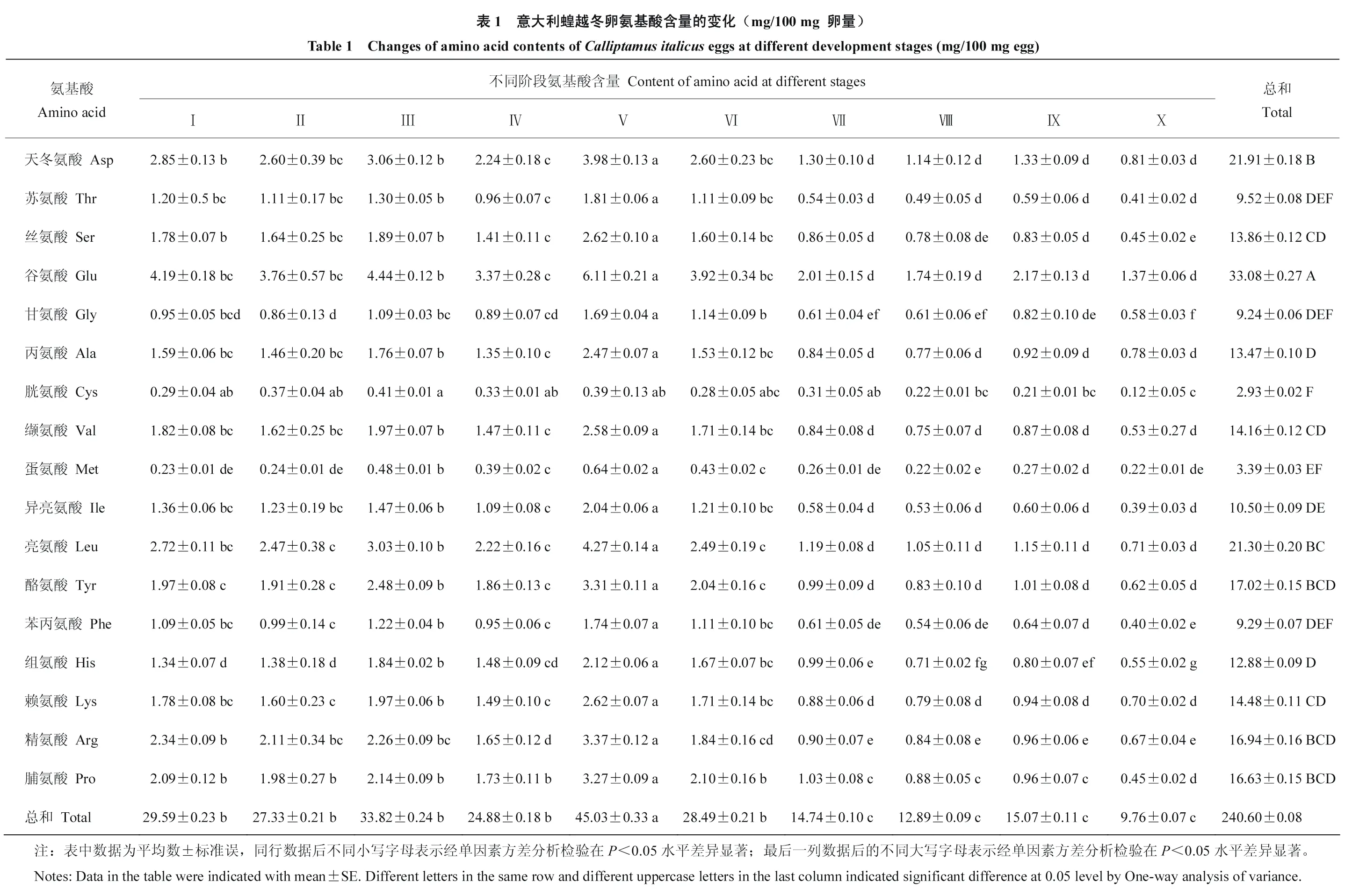
意大利蝗卵发育过程的氨基酸总量在早期发育阶段较稳定,但无显著变化(P>0.05)。处于深度滞育(Ⅴ)的蝗卵氨基酸总量(45.03±0.33)mg/100 mg显著高于其他所有阶段(P<0.05),且除胱氨酸 Cys的其他所有氨基酸含量均显著升高。滞育后发育阶段,蝗卵的氨基酸总量较早期发育阶段和滞育阶段显著降低(P<0.05)。蝗卵整个发育过程中,谷氨酸Glu含量显著高于其他氨基酸(P<0.05),占总氨基酸的13.75%;胱氨酸Cys含量最低,仅占总氨基酸的1.22%;天冬氨酸Asp、亮氨酸Leu、酪氨酸Tyr、精氨酸Arg、脯氨酸Pro的百分含量占比也较高;蛋氨酸Met、甘氨酸Gly以及苯丙氨酸Phe的百分含量占比较低(表1)。
?
3 讨论
昆虫的生长发育与生态因子尤其是温度密切相关[16],抵御外界不利条件是寒冷地区昆虫能够顺利完成生活史的条件之一[17]。昆虫在面对低温等不良环境时,为了确保发育正常,在长期进化中形成了一系列适应对策[18]。耐寒性强弱和是否滞育是影响多数昆虫顺利越冬的两个重要因素[19]。研究表明,大多数昆虫可通过改变体内抗寒物质种类或含量来抵御寒冷。如在滞育期间,昆虫体内的糖类[20]、脂肪、多元醇等[21,22]抗寒物质可随滞育进程发生改变,因此,抗寒物质可作为判定昆虫是否滞育与滞育解除的重要指标之一[23]。
作为新疆主要的优势害虫,意大利蝗以卵滞育越冬至孵化整个过程长达约9个月,而卵期较虫体脆弱,不能通过迁飞等行为躲避不利环境。新疆冬季寒冷且漫长,面临这样的低温不利环境,意大利蝗依然保持较大的种群数量和较为严重的发生程度,推测其可能原因是蝗卵具有较强的抗寒性。为弄清意大利蝗卵越冬期间的抗寒机制,在课题组前期研究基础上,本研究通过检测意大利蝗卵发育及滞育期间的抗寒物质种类及含量,探究其抗寒物质系统,为深入研究其发生机制及有效防控提供科学依据。
研究表明,糖类物质是昆虫体内的主要抗寒物质。其中,糖原除了作为昆虫的主要能源物质外[24],还可作为碳水化合物的底物转化为其他小分子糖和多元醇[19],作为小分子抗冻剂以抵御低温胁迫。果糖和葡萄糖则作为细胞的重要代谢中间产物,可通过糖酵解等途径转化为能量或合成其他抗冻保护剂以供细胞所需能量和抵御寒冷。
本研究中,蝗卵刚产下不久,其海藻糖含量较高。在早期发育阶段,蝗卵发育较快,海藻糖含量随着蝗卵发育逐渐降低,此时海藻糖作为能源物质以供蝗卵发育所需或转化为其他物质。随着温度降低至零下,蝗卵进入深度滞育(Ⅴ),海藻糖含量显著高于其他所有阶段,说明在深度滞育前,蝗卵海藻糖的积累大于消耗。低温条件下,一些昆虫体内出现海藻糖含量升高现象。如东亚飞蝗Locustamigratoria卵在不同冷却速率下其海藻糖、肌醇和甘油含量增加有助于抵抗低温胁迫[25]。轮纹异痂蝗Bryodemellatuberculatum dilutum可通过提高海藻糖含量来抵御寒冷[7],这与本研究结果一致。当蝗卵即将解除滞育时,海藻糖含量显著降低,说明随着滞育的持续,蝗卵在滞育末期消耗了较多前期积累的海藻糖,但其含量仍高于其他 3种糖类的含量,滞育期海藻糖含量的积累可能与平衡蝗卵的渗透压和稳定膜结构来抵御外界低温有关[26]。当蝗卵滞育解除,恢复发育,海藻糖含量显著降低,尤其在第Ⅷ阶段急剧下降,此时蝗卵消耗大量海藻糖使其顺利完成胚转,胚转完成后海藻糖含量再次积累,可为蝗卵的后期发育储备能量。海藻糖作为昆虫血糖,其含量在体内不随环境温度而变化,但作为抗寒物质会随着环境发生变化[4]。意大利蝗卵的海藻糖含量在最低温的深度滞育时积累至最大,越冬前和越冬后的非滞育卵含量显著低于滞育卵。结果表明,海藻糖不仅是意大利蝗卵发育过程的主要能源物质,也是越冬期间的主要抗寒物质,保护蝗卵免受低温损伤。
意大利蝗越冬卵发育阶段的各种糖类物质含量具有显著变化,其中,葡萄糖和糖原含量的变化幅度较大。葡萄糖含量在蝗卵整个发育阶段出现3次大量积累(滞育前、滞育刚解除和临近孵化)以及2次快速下降(滞育末期和发生胚转时)。蝗卵在早期发育阶段(Ⅲ)和滞育刚解除(Ⅶ)的葡萄糖大量积累可为蝗卵完成滞育及胚转储存能量,由于蝗卵孵化为1龄蝗蝻需突破卵壳的束缚而消耗大量的能量,因此在第Ⅸ阶段的葡萄糖含量大量积累。葡萄糖含量在滞育期一直下降,说明蝗卵主要消耗葡萄糖含量以维持蝗卵滞育或通过能量代谢途径转化为其他小分子物质;当蝗卵发生胚转时(Ⅷ)葡萄糖作为直接能源物质为其供能。以上阶段都为蝗卵发育的重要时期,这表明葡萄糖的合成和消耗与蝗卵发育进度有关,主要为蝗卵发育提供能量。糖原含量在深度滞育(Ⅴ)和胚转时(Ⅷ)显著高于其他阶段,说明蝗卵在滞育期间积累大量糖原,从而为滞育解除以及后期发育储备能量。蝗卵发生胚转时的糖原含量与葡萄糖和海藻糖变化趋势相反,此时糖原大量积累,推测三者之间存在相互转换的关系。随着蝗卵继续发育和孵化,糖原含量逐渐下降,可能与蝗卵后期发育需要消耗大量能源物质有关。大量研究表明,葡萄糖和糖原可作为能源物质在体内储存、消耗或转化为其他小分子物质,也可作为低温保护剂在体内积累以满足机体各种需求[4,27-28]。本研究中,葡萄糖和糖原均为意大利蝗卵发育的主要能源物质,糖原含量在滞育期虽显著上升,但远低于海藻糖,因此推测糖原不是蝗卵的主要抗寒物质。而果糖含量在整个蝗卵发育过程呈持续上升趋势,但低温滞育期间的果糖含量与早期发育阶段差异不显著,且平均含量远低于海藻糖。抗寒物质通常在初秋开始积累,越冬期维持较高水平或积累至最大,春季开始降解[19],说明果糖不是蝗卵抵御低温的主要抗寒物质,其作用还有待进一步研究。
多元醇在水溶液中极易溶解,即使在高浓度下对酶或代谢过程也无影响,可调节由脱水引起的细胞渗透压变化,并维持蛋白质的结构和稳定性,从而保护细胞免受低温造成的损伤[19,29],同时也是判断昆虫耐寒性的重要指标之一[4]。作为主要抗寒物质之一的甘油是目前研究最多的抗冻保护剂,可与山梨醇等协同保护组织安全越冬[29,30]。西藏飞蝗Locustamigratoriatibetensis在经过低温驯化后,体内大量积累甘油[31];轮纹异痂蝗卵在滞育期中甘油含量逐渐升高[7];经低温诱导的椰心叶甲虫Brontispalongissima其甘油含量升高[14];甘油在华山松大小蠹Dendroctonusarmandi幼虫越冬期积累[32];滞育期间东亚小花蝽Oriussauteri耐寒能力的增加与甘油含量增加有关[33];甘油也是大多数越冬鳞翅目幼虫的主要防冻保护剂[34,35]。在意大利蝗卵的整个发育期间,甘油含量总体呈上升趋势,尤其是低温滞育阶段的甘油含量显著高于早期发育阶段。甘油的合成伴随能量消耗,可在有氧代谢条件下促进甘油合成[36]。本研究中,甘油含量在早期发育阶段积累最快,这可能与早期发育阶段蝗卵呼吸代谢率最快有关,课题组前期对意大利蝗卵的呼吸代谢测定结果也证实了这一点[11],同时1龄蝗蝻的呼吸代谢较卵期更快,因此1龄蝗蝻甘油含量最高。综上所述,甘油的积累有助于蝗卵抵御外界低温和安全越冬。这与丽草蛉滞育预蛹Chrysopaformosa的研究结果一致[37],本研究也证实了“甘油是昆虫体内的一种重要抗冻保护物质”这一观点。
山梨醇可作为昆虫抗寒物质在体内积累,也是判断舞毒蛾Lymantriadispa卵滞育深度的指标[38,39]。本研究中,早期发育阶段和滞育阶段蝗卵的山梨醇含量呈持续升高趋势,说明山梨醇是意大利蝗卵越冬期间的抗寒保护物质。滞育解除后山梨醇含量下降,但不显著,表明山梨醇可为蝗卵滞育解除后的快速发育提供少量能量,但不是主要能源物质。而肌醇在蝗卵的滞育初期(Ⅳ)和胚转时(Ⅷ)积累最大,滞育期和即将孵化的第Ⅸ阶段含量下降。说明滞育初期肌醇含量的积累可为蝗卵滞育的维持储备能量,当蝗卵发生胚转时主要消耗糖类物质以完成胚转,而肌醇在体内大量积累可为胚胎发育储能。当蝗卵发育至即将孵化时(Ⅸ阶段),肌醇含量反而降到最低,这可能是由于蝗卵在后期发育过程中需要消耗比滞育期更多的肌醇以满足快速发育需要。
脂肪作为昆虫生长发育过程中的能源物质,经过一系列代谢途径转化,为昆虫的生命活动提供营养及能量。本研究中,各发育阶段蝗卵的脂肪含量无显著差异,可能是由于埋于土中的蝗卵,较虫体消耗能量少,糖类物质作为直接能源物质即可满足其发育和代谢需要。此外,课题组前期的呼吸代谢研究也发现,意大利蝗卵的呼吸代谢底物主要为糖类而不是脂类[11],本研究也证实了这一观点。1龄蝗蝻的脂肪含量显著高于卵期所有发育阶段,这是由于随着蝗卵的发育,胚胎逐渐吸收和消耗卵黄致使胚胎变大,临近孵化的胚胎占据整个蝗卵,孵化出的蝗蝻脱离了卵壳的保护,必须具备较多的脂肪才能更好适应外界环境条件的变化。此外,研究结果还表明脂肪对意大利蝗卵越冬期间抵御不良环境的贡献较小,不是越冬卵滞育阶段的主要抗逆物质。柑橘凤蝶Papilioxuthus滞育蛹的脂肪含量远高于非滞育蛹[40];沙葱萤叶甲Galeruca daurica成虫在越夏期间作为能源物质的脂肪其含量逐渐下降[41];这与本研究结果不一致,可能是因为物种和虫态不同,蛹、成虫和卵对温度、湿度等外界条件的响应程度也不相同,从而导致能量消耗来源及含量不同。
氨基酸作为蛋白质的基本构成单位,与昆虫的抗寒性密切相关。在意大利蝗越冬卵发育过程中,氨基酸总量高低顺序为:滞育阶段>早期发育阶段>滞育后发育阶段,这与越北腹露蝗Fruhstorferiola tonkinensis卵在滞育解除后的氨基酸总量增加的结果不一致[42],可能是由于刚产下的意大利蝗卵需经历早期胚胎发育阶段才能进入滞育,而越北腹露蝗产下的即为滞育卵。其次,越北腹露蝗位于粤北地区,本研究中的意大利蝗取自新疆,生境不同也会影响氨基酸总量,具体原因还有待进一步研究。越冬过程中,第Ⅴ阶段蝗卵处于深度滞育,此时谷氨酸、亮氨酸、天冬氨酸、精氨酸、酪氨酸、脯氨酸的含量较高,由此推测这6种氨基酸可能是蝗卵越冬过程中主要的抗寒物质。1龄蝗蝻所有氨基酸含量均减少,说明蝗卵顺利孵化成蝗蝻需要消耗大量氨基酸,氨基酸对于蝗卵的发育不可或缺。由于胚胎的主要成分为蛋白质,其主要构成成分为谷氨酸,因此,在蝗卵整个发育过程中,谷氨酸总量较其他氨基酸高,这与葛婧等[43]研究结果一致。蝗卵亮氨酸含量增加除了因为亮氨酸会影响蛋白质的合成和分解外[44],谷氨酸的增多也会导致亮氨酸含量增加。精氨酸参与蛋白质合成和激素分泌等生理过程[42,45],本研究中深度滞育期蝗卵的精氨酸含量增加,推测其可能通过合成蛋白质以及促使分泌维持滞育的激素,从而发挥抵御低温胁迫的功能。作为昆虫黑色素合成前体物质的酪氨酸,参与虫体的黑化作用[46]。蝗卵的酪氨酸含量增加,可为后期胚胎体色的黑化和顺利孵化奠定基础。当蝗卵受低温胁迫时脱水,脯氨酸则可插入生物膜磷脂分子中从而缓解低温对细胞膜的损伤,因此深度滞育时脯氨酸含量的增加有助于保持昆虫体内水分,同时也可作为抗冻保护剂在体内积累,并为其他蛋白质的合成提供能量[47-50]。滞育期的昆虫会以一种滞育蛋白的形式储存氨基酸,这些氨基酸在滞育期具有合成代谢、维持呼吸代谢以及滞育后的恢复发育等作用[21]。此外大量研究表明氨基酸与昆虫耐寒性密切相关,但部分氨基酸的耐寒机制尚不明晰,且一些氨基酸如丙氨酸、丝氨酸和脯氨酸等的浓度还受氧气、温度及滞育状态影响[51,52]。意大利蝗卵各氨基酸含量和氨基酸总量随蝗卵滞育进程的不同而发生变化,当外界温度最低时,处于深度滞育的蝗卵除胱氨酸外各个氨基酸含量和氨基酸总含量均显著积累,推测在滞育期的大量积累有助于蝗卵维持呼吸代谢及蛋白活性,从而更好地抵御新疆低温胁迫,为后期胚胎的快速发育提供能量。
越冬期间,昆虫体内可通过积累小分子抗寒物质增加体内束缚水的含量,也可与其他蛋白相互作用增强昆虫的抗寒能力。滞育与低温都会引起昆虫体内的小分子物质发生变化。分布于寒带地区的意大利蝗,通过采取以卵滞育的策略越冬,抵御低温环境引起的损伤。由于抗寒性强弱与蝗卵内积累的生理生化物质密切相关,因此本研究通过分析意大利蝗卵越冬发育过程中的多种抗寒能源物质含量的动态变化,结果表明,意大利蝗卵的抗寒物质系统主要为“小分子碳水化合物(甘油、海藻糖、山梨醇)-氨基酸(谷氨酸、亮氨酸、天冬氨酸、精氨酸、酪氨酸和脯氨酸)”。糖原、葡萄糖和肌醇在蝗卵发育过程中的变化幅度较大,主要发挥能量供给和参与代谢的作用。研究结果可为深入了解意大利蝗卵的滞育机制和适应机理奠定基础,但本研究涉及的这几种物质能否作为判定意大利蝗卵滞育状态的指标还有待进一步探讨。

