静电纺丝技术应用于局部治疗领域的研究进展
陈海妮,刘哲鹏,胡逸亭,孟天荟
(上海理工大学医疗器械与食品学院药物制剂(设备与工艺)研究所,上海 200093)
引言
针对恶性肿瘤转移和复发问题,通常会辅助化学疗法或者放射疗法[1-2]。与直接注射或口服的全身治疗方式相比,用于特定部位的局部治疗,能够直接作用于肿瘤和其周围组织,减少给药剂量且降低药物的全身毒性,可最大程度地降低对正常细胞的毒副作用[3]。在切除肿瘤后的术后腔内植入电纺辅助治疗制剂,消除残留的肿瘤细胞并避免肿瘤复发,是静电纺丝技术与医药领域结合的研究方向之一。
可用于局部辅助治疗的药物载体形式有凝胶、膜剂、可植入片剂、纳米粒、纳米棒和纳米纤维等[4]。其中,通过静电纺丝技术制备的纳米纤维具有与细胞外基质相似的结构、可控的表面形态、非常高的比表面积及包封率,可同时装载多种药物并实现可控递送(同时或贯续释药),且价格相对低廉,在近20年获得了极大的关注[5-6]。
针对近年来基于静电纺丝纳米纤维的局部递送药物研究,本文旨在总结现阶段利用静电纺丝技术在局部治疗领域的研究进展,重点介绍了电纺纳米纤维的结构设计和植入给药的局部给药系统应用研究。
1 静电纺丝
静电纺丝起源于20世纪,也被称为静电喷雾。利用该技术,可以将溶液、熔体、混悬液一步制备成纳米级纤维。静电纺丝装置通常包括电压发生器、注射泵、收集器、喷头。本文所涉及到的静电纺丝部件,见图1。施加在喷头的电压控制流经喷头液体的表面张力,形成带电流体射流,喷头处液滴形成稳定泰勒锥,一定浓度的流体因静电场力作用使溶剂挥发,继而形成连续纤维[7-8]。
目前,制备纳米纤维的主要方法有相分离、分子自组装、拉伸、模板合成和静电纺丝[9]。其中,静电纺丝可以使用不同生物材料制造直径在微、纳米之间的超细纤维,这些生物材料具有独特的特性,例如带孔结构、高孔隙率、高表面积与体积比、优异的拉伸强度等。此外,通过电纺技术还可以对纳米纤维进行表面修饰,以调整纤维表面的化学和物理特征,控制纤维结构、形态尺寸和空间分布,以获得特定的机械性能[10]。各种天然或合成聚合物作为药物载体广泛用于制备纳米纤维,应用于组织缺损修复和局部恶性肿瘤治疗中的药物递送系统[11]。
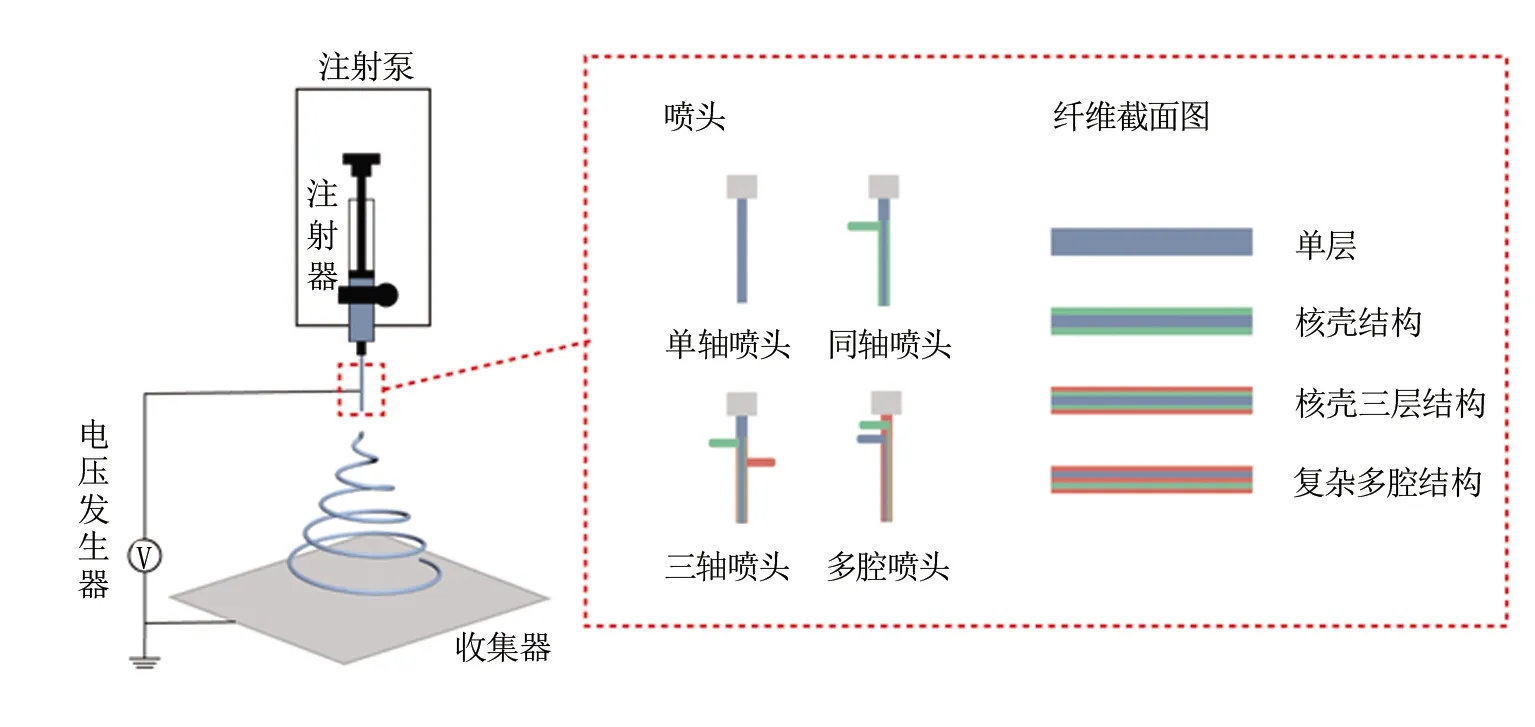
图1 静电纺丝过程示意图
2 载药静电纺丝
通过静电纺丝,将药物包封到纳米纤维中,材料的物理化学特性及其与药物分子的相互作用会影响药物分子在电纺纤维中的分布、均匀性、装载能力和释放动力学等[12-13]。
2.1 纤维结构设计
2.1.1共混静电纺丝 根据溶解性将亲水性药物和亲脂性药物分别与亲水性和亲脂性聚合物共溶混匀,进行纺丝[14]。通常,用亲水性聚合物与药物共混纺丝可以达到快速释放的目的;而亲脂性聚合物则可以有效缓释针对水溶性材料导致的明显突释;为了药物能够持续释放而使用不同比例的亲水和疏水聚合物混合物,显著提高了药物的包封率,减少药物突释[15]。如Zong等[16]设计了一款PEO/PLA复合电纺纳米纤维植入装置,载有化疗药顺铂,可直接植入小鼠阴道,作为局部化疗系统治疗小鼠宫颈癌的初步研究。通过体外黏附试验和体内阴道滞留评价,证明了该纳米纤维具有良好的黏附性能。Jassal等[17]采用静电纺丝法制备载有化疗药物盐酸阿霉素(DOX)的PCL纳米纤维,通过水解在纤维表面引入官能团进行表面修饰。结果表明,该药物成功地结合到功能化的电纺纤维上,并具有很高的载药量,药物释放受pH调控。
2.1.2同轴结构纤维 与简单的单层共混静电纺丝相比,经同轴喷嘴制备的纤维能够延缓药物释放和减少突释。同轴静电纺丝工艺是将两种或多种成分通过不同的单独喷嘴同时电纺,以制备核壳及多层结构纤维[15,18]。当药物被装载至核层,壳层的存在会减少处于核层药物的突释,有效延缓核层药物的释放。此外,不同药物可以同时封装到核壳结构纳米纤维中的核层和壳层,以达到保护核层药物及两层药物先后释放的目的。核壳纳米纤维结构的优势在于,根据所采用的聚合物材料,拥有不同的缓释或速释效果,便于满足不同药物的递送需求。Shen等[19]利用同轴电纺丝的方法设计了载药核壳纤维系统,用于宫颈癌治疗。核层由聚己内酯(PCL)和灵芝三萜类化合物(GTL)组成,外壳含有聚氧化乙烯(PEO)和抗癌药物甲氨蝶呤,以达到贯序给药的目的。
在同轴双层结构的基础上,引入中间层,有效防止内外层材料的相互影响。如Han等[20]所研究的同轴三层电纺纳米纤维。中间层作为核层和壳层之间的缓冲区域,使得内层药物缓释延长约24倍。在此期间,外层药物在前1 h内释放80%,实现两种药物双重有序控释。
2.1.3复杂结构纤维 除上述最常用的核壳结构纳米纤维设计,还可以运用静电纺丝设计复杂的多腔结构。Chang等[21]基于电纺整体复合材料的应用,利用特殊的三流体电纺制备了一种新的三腔复合纳米结构。该复合结构有一个共同的壳体和两个分离的核心,因此,被称为鞘核分离结构。核心可以分别搭载不同流体,类似于janus粒子中两种物质被鞘液隔开并且两者对称。三个通道均可载药,极其灵活。加以不同的聚合物作为载体,可满足更多的药物控释需求,如研究中运用pH响应的尤特奇Eudragit®,以适用于胃肠道控释。通过改变静电纺丝的喷嘴结构,可以制备不同的纺丝结构,其灵活性是静电纺丝工艺的一大优点。
2.2 纤维功能设计及其应用
2.2.1载纳米制剂的纳米纤维 将纳米制剂装载到电纺纳米纤维膜中可以提高纳米制剂的稳定性,并且进一步延长其释放。有时,药物-聚合物共混电纺纤维存在药物突释现象,在载入纤维载体前,先制备成纳米制剂,即纳米剂型为第二载体,可以改善药物持续释放,避免突释。鉴于纳米制剂的溶解性,通常装载至水溶性聚合物上,为满足给药需求,外层增加控释材料。Yang等[22]将主动靶向胶束系统与聚合物纳米纤维膜相结合,开发用于癌症治疗的可植入局部药物递送装置。该系统采用同轴静电纺丝工艺,其中叶酸(FA)-PEG-PCL共聚物所制备的载药胶束与PVA混合作为核层,经过交联的明胶作为壳层。由于电纺纳米纤维基质的降解,胶束可持续地从系统中排出,通过细胞间质转运和EPR效应在肿瘤细胞周围快速积累,并通过叶酸介导的内吞作用被肿瘤细胞内化。此外,Li等[23]制备载有化疗药物紫杉醇的木质素纳米粒中,然后将其包裹到PVA/PVP聚合物中,利用静电纺丝技术将其制备成纳米纤维膜作为药物载体。所制备的载药纤维膜经细胞实验证明,其有良好的细胞抑制能力,具有良好的恶性肿瘤局部治疗前景。
2.2.2刺激响应型纳米纤维 应用于静电纺丝的载药材料除了上述用于延缓药物释放的聚合物类型,还有一种响应性材料,在受到体内微环境刺激后,使得聚合物材料本身发生变化,来达到药物控释目的[24]。刺激分为内源性刺激和外源性刺激。恶性肿瘤微环境中的酸性环境、氧化还原环境和酶等均是内源性刺激。外源性刺激可能是温度、光线、电场和超声波的变化[25]。Yan等[26]针对肿瘤环境的弱酸性特性,利用同轴电纺制备了pH敏感型的PVA/PCL核壳纳米纤维。研究显示,pH=4的时候,DOX的释放率明显高于pH=7.4时的释放率,对宫颈癌HeLa细胞效果良好。此外,Ozcan等[27]近期的一项研究也使用DOX作为模型药物,基于pH敏感的基础上,分别添加谷胱甘肽(GSH)和FA偶联人血清白蛋白(HSA)-杯芳烃(AMP),制备纳米纤维。结果表明,该纤维膜不仅具有pH响应能力,并且对纤维进行的表面修饰使其能够应用于靶向治疗。
2.2.3药物联合应用型纳米纤维 在恶性肿瘤治疗领域,由于较高剂量的药物毒性、癌细胞的异质性、以及长期化疗后化疗耐药性的发展,通常使用多种药物共同递送。鉴于静电纺丝制备的可组装性能满足给药需求,可实现共同递药、贯序递药等多种功能,基于纳米纤维的多药给药方法研究日益增多[28-29]。Yang等[30]完成了一项基于聚合物胶束电纺纳米纤维的纳米多药给药系统的研究。针对产生肿瘤多药耐药的重要原因之一,即P-糖蛋白的过度表达,选取具有抑制P-糖蛋白功能的姜黄素(Cur)作为一种潜在的多药耐药的逆转剂。鉴于Cur的疏水性,该多药给药系统首先由可生物降解的mPEG-PCL共聚物组装成Cur胶束,然后将胶束粉末与亲水性阿霉素(DOX)在PVA溶液中共混,进行静电纺丝。DOX受pH刺激响应,在pH=5时,DOX和Cur的总释放量分别为(98.27±9.20)%和(43.33±4.23)%。针对预后较差,容易复发的原发性脑肿瘤——胶质母细胞瘤[31], Tseng等[32]将载有药物卡莫司汀、伊立替康和顺铂的PLGA电纺纳米纤维植入至脑中,以改善药物的持续释放。针对药物耐药性,Tseng等[33]通过静电纺丝技术制备双层纺丝膜,实现了化疗药物和抗血管生成药物的顺序和持续释放。体外释放表明,制备的纳米纤维表现出连续的药物释放行为,从第3 d开始释放高浓度的化疗药物卡莫司汀、伊立替康和顺铂,然后从第21 d开始释放高浓度的血管生成抑制剂考布他汀(Combretastatin)。
2.2.4速释纳米纤维 以上处方设计大多考虑到了药物的延长缓释,另有静电纺丝应用于药物速释[34]。Nam等[35]以PVA和维生素E聚乙二醇琥珀酸酯(TPGS)为载体,研制了用于口腔癌局部给药的速溶纳米纤维。采用静电纺丝法制备了平均粒径为321 nm,包封率大于90%的PVA/TPGS/根皮素纳米纤维。该纳米纤维在水介质中分散后,结构转变为纳米粒子。根皮素的水溶性较差,可通过将其掺入纳米纤维结构和快速润湿,并即刻给药加以克服。TPGS的加入提高了药物溶出度,在口腔鳞状细胞癌中,PVA/TPGS/根皮素纳米纤维组较PVA/根皮素纳米纤维组有更强的抗增殖和凋亡作用。在纳米纤维中掺入TPGS有助于制备更致密的纳米颗粒,并增强其在癌细胞中的蓄积。这些结果表明PVA/TPGS/根皮素纳米纤维有望成为治疗口腔恶性肿瘤的一种很有前途的纳米药物。
2.2.5其他类型纳米纤维 静电纺丝还可以与多种疗法联合应用治疗癌症,如静电纺丝结合化疗与热疗(光热纳米材料等)。例如,Wang等[36]将局部联合化疗和光热治疗结合应用于宫颈癌的治疗,研究制备了阿霉素和吲哚菁绿共负载介孔二氧化硅纳米粒。然后通过静电纺丝将纳(DIMSN)米颗粒引入壳聚糖/ PVA中,形成多功能复合纳米纤维。经阴道植入纳米纤维可最大限度地提高小鼠阴道内的药物蓄积量。结合光热化疗效应,原位宫颈癌的抑瘤率高达72.5%,在宫颈癌治疗方面显示出巨大的潜力。
单层乃至三层的纤维设计,大多源于不同的给药目的,以及所用药物的水溶性,利用不同的喷头结构,灵活组装各个喷头内通路,充分体现了静电纺丝工艺的灵活多变性(见表1)。
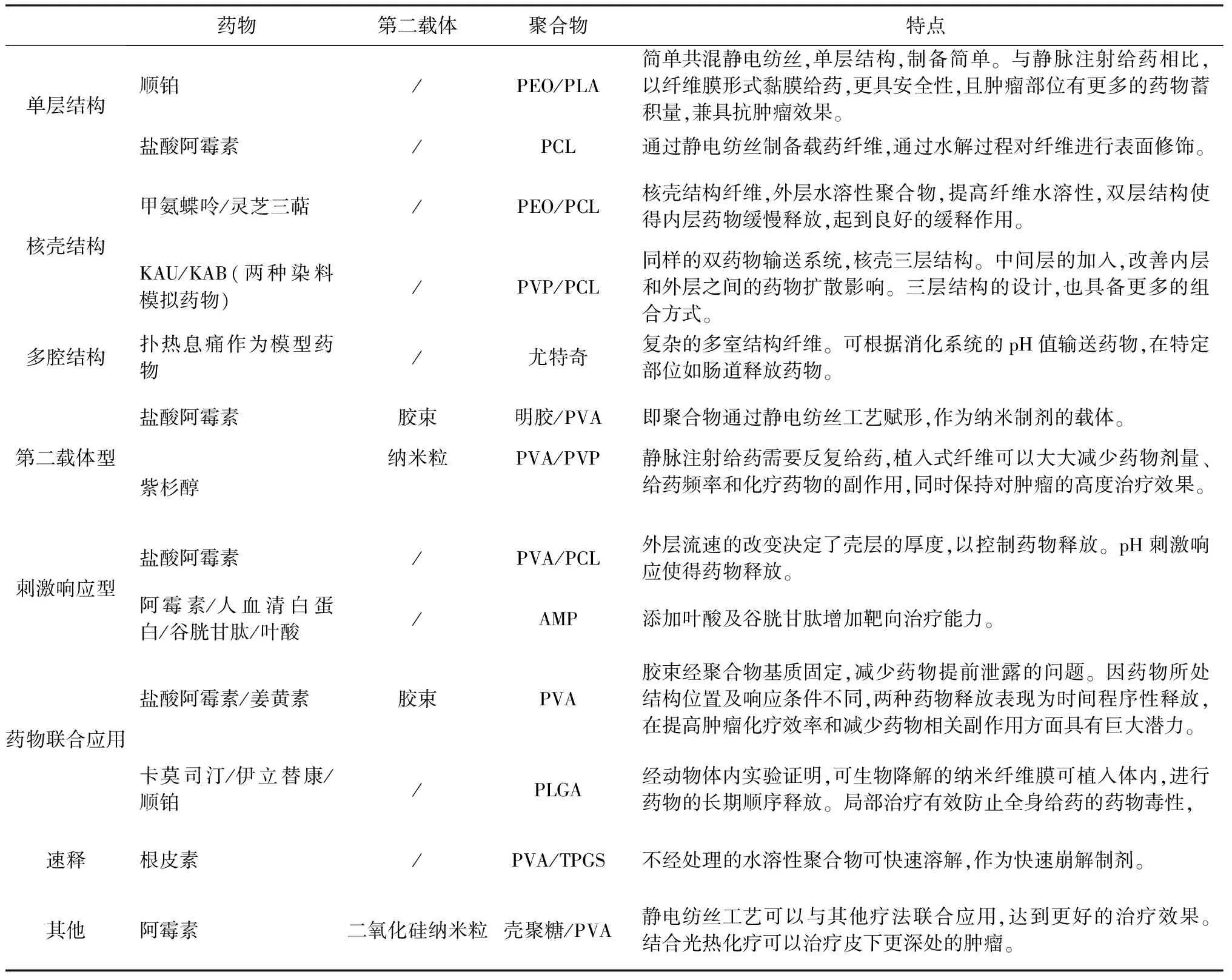
表1 静电纺丝制备的载药纤维
3 总结与展望
运用生物可降解材料所制备的电纺纳米纤维,可以在生物体内局部递药,提高递药效率,降低全身的毒副作用,是目前医药领域的研究热点之一。在恶性肿瘤治疗领域,单一药物因高剂量易导致药物毒性,故而多采用多种药物共同治疗。结合静电纺丝负载药物,能够实现多药顺序释放。电纺纳米纤维作为药物载体可通过改变喷头结构、纤维结构装载药物,更为便利且高效,极具研究前景。然而,到目前为止,用于恶性肿瘤治疗的基于电纺纳米纤维的药物递送策略仍处于临床前和临床试验阶段。究其原因主要是聚合物所用溶剂的相对毒性、纳米纤维的强度和韧性问题,聚合物与药物的相容性问题,以及体内药物动力学研究有待进一步加强。基于此,开发可生物降解的聚合物或对其改性,以及对局部植入制剂进入体内的有效性和安全性研究,是未来恶性肿瘤局部治疗领域的研究重点。因此,静电纺丝在恶性肿瘤治疗领域有非常广阔的研究和应用空间。

