应用于电阻抗断层成像检测及预测癫痫发作的动物模型*
王蓉,梁国华,朱文静,王蕾
(西北工业大学医学研究院,西安 710072)
引言
癫痫是由于大脑神经元突发性异常放电,导致短暂大脑功能障碍的一种神经性疾病,影响全球大约5 000万人,是全球范围内最常见的神经性疾病之一。癫痫发作的特点主要有突然性、不可预知性以及反复性[1]。对于癫痫,一部分人仍对其存有恐惧、歧视态度,这严重影响到患者及其家庭的生活质量[2]。
尽管目前大多数癫痫患者应用抗癫痫药物可得到很好控制,但仍有30%的患者对药物治疗无效,发展为难治性癫痫(refractory epilepsy,RE)[3]。难治性癫痫占癫痫患者的20%~30%,而仅有50%的难治性癫痫患者适于手术切除病灶,对于药物和手术均无法治疗的患者,不仅要持续承受病痛的折磨,而且癫痫发作会对大脑造成不可逆转的伤害。
癫痫外科治疗的关键是对癫痫灶的准确定位。脑电图检查是癫痫外科术前综合评价的重要组成部分,但对于术前检查呈现多个病灶区、病灶区位于脑功能区、现有检测技术无法提供明确致痫灶的难治性癫痫患者,手术治疗无法开展。因此,临床上亟需一种准确定位癫痫灶的成像技术。此外,虽然癫痫发作具有突然性,但有研究表明,癫痫发作是一个随时间演化的过程,理论上癫痫发作预测具有很高的可行性[4]。影像学研究已经证实,癫痫发作前期脑血流灌注发生改变[5]。血液的电阻率为1.6 Ω·m,脑组织的电阻率为4 Ω·m[6],血液的电阻率明显低于脑组织的电阻率,癫痫发作前期脑血流灌注变化会引起致痫灶处电阻率的变化。因此,如能找到一种能够实时反应癫痫发作前期电阻抗变化的检测技术,将有可能为癫痫患者带来新机。
电阻抗断层成像技术(electrical impedance tomography,EIT)是一种基于组织阻抗特性进行成像的新兴技术,它能够根据不同组织的不同电阻抗特性,或同一组织在不同的病理生理状态下不同的电阻抗特性进行成像。通过给人体注入小的安全电流,测量体表电位来重建人体内部的电阻抗分布图像,是医学成像技术的一个新方向。其中,动态电阻抗成像将电阻抗变化以图像的形式实时动态显示,对电阻抗变化敏感、时间分辨率高、功能成像,具有便携、快速、以及无创等优势[7]。研究表明,EIT是一种对于脑血流灌注变化很敏感的成像技术,能够检测到由脑出血和脑缺血引起的组织阻抗变化[8-9]。实际研究中,EIT也被证实对癫痫发作较为敏感,能够检测到癫痫发作前期脑血流灌注改变引起的电阻抗变化[10]。
1 EIT应用于癫痫疾病领域的研究现状
1994年,英国伦敦大学的Holder首次尝试将EIT应用于癫痫成像的研究,使用与癫痫发作机制类似的兔的皮质扩散抑制模型,初步证实了EIT对癫痫成像的可行性[11]。1997年,Holder电刺激麻醉兔的前爪神经制备癫痫模型,检测到癫痫发作期间的电阻抗变化,首次实现EIT在动物癫痫发作过程中成像,但由于技术限制,该研究并未实现实时监测,此外其时空分辨率较差[12]。之后,Holder 小组为探索癫痫发作与电阻抗变化的相关性,通过改进诱导癫痫发作的电刺激参数和注射化学致痫剂获得最接近人类癫痫发作机制的癫痫模型,不断增加 EIT 系统的采集电极个数、提高采集精度,以实现EIT对于癫痫发作的实时成像。2016年,Aristovich等[13]使用30接触电极垫对大鼠大脑皮层在诱发电位中的阻抗变化进行了EIT成像。虽然该研究首次在ms级对神经活动进行成像,但是其成像的深度有限,仅局限于大脑皮层。王蕾等[10]2017年使用16电极的EIT系统和脑电的3电极实时监测动物模型的癫痫发作,发现在癫痫发作过程中致痫灶处的电阻抗逐渐降低,直至癫痫发作结束,但因其在数据采集过程中所使用的电极较少,导致采集精度有限。2018年,Hannan等[14]采用电刺激麻醉大鼠诱导癫痫发作,使用57电极皮层阵列记录大鼠脑部癫痫发作过程中快慢阻抗变化的频率响应,得到成像癫痫活动的最佳频率,但是电刺激模型缺乏细胞特异性,且电刺激激活区域不固定。2020年,Hannan等[15]提出了新皮层癫痫ADs( A fterdischarges )模型和海马癫痫ADs模型,虽然该模型可以严格控制癫痫发作,但是缺乏细胞特异性,很难完全模拟人类癫痫活动。2021年,Hannan等[16]使用植入大鼠大脑皮质表面的非穿透电极,对大脑皮层和海马的癫痫发作过程中的慢阻抗成像,该研究表明癫痫发作过程中脑组织阻抗缓慢增加,这与文献[10]研究结果正好相反。
目前EIT应用于癫痫的研究中,有两种不同的研究结果。Holder小组检测到癫痫发作期间病灶处的阻抗上升,王蕾等[10]则发现发作期间病灶处阻抗下降。这种差异可能由以下几点原因造成:首先,两项研究中所使用的癫痫模型不同,与化学模型相比,电刺激模型会有更多的皮质锥体神经元被激活并同步放电,从而导致更大的阻抗增加[16]。其次,两项研究中使用的载波频率也不相同,可能会导致阻抗变化有所不同。此外,两项研究所关注的癫痫发作的时间尺度也不相同,Holder小组主要关注ms与s时间段内的瞬时阻抗变化,而王蕾等[10]关注的则是癫痫发作的整个时间段。
综上,在EIT对于癫痫的研究中,合适的动物模型对于研究结果至关重要,随着EIT采集精度的提高,用于EIT研究的动物模型也需要注重癫痫活动的真实性。在研究中选择合适的动物模型,会对了解癫痫发作前期与发作期间的阻抗变化有所帮助,可为实现用于难治性癫痫发作检测和预测的电阻抗断层成像新方法奠定基础。
2 用于EIT的动物癫痫模型
2.1 动物癫痫模型的必要性
研究表明,通过基于人体的研究,了解癫痫发作机制是非常困难的,需要一套完整的临床前安全性和有效性证据,证明研究的临床进展是合理的[17]。因此,实验模型有助于确定癫痫发生的机制和抗癫痫方法治疗的效果[18]。所以对于难治性癫痫的研究,动物模型是阐明癫痫发生机制和测试新的抗癫痫治疗方法的宝贵工具[19]。
动物癫痫模型既克服了人体研究的不足,且癫痫发作条件可控,又易于取得脑组织标本,用于难治性癫痫发病机制的研究。但是所有动物模型都只是人类疾病复杂系统的近似值,因此,对于所得的实验结果都应该谨慎对待,这是全部动物模型的固有特性。此外,与人类自发性癫痫发作相比,某些动物模型的诱发机制可能有所不同[20]。根据转化医学的定义,模型无需是临床条件的完美复制,重要的是模型提供的验证适合实验目的[21]。
2.2 常见的癫痫动物种类
癫痫模型在各种实验动物中都有研究,从简单的生物、非哺乳类生物[22]到非人类灵长类动物。常见的实验动物主要有大鼠、小鼠[23]、猫[24]、兔子、猪、狒狒[25]、猕猴[26]等。
其中,大鼠和小鼠是最常用的两种实验动物,因为它们体型小、温顺、繁殖快,尤其可以很好地概括人类癫痫背后的致病机制、人类状况的表型特征和临床上看到的治疗反应[27],并且长期研究所需的成本和维护要求较低[28]。此外,作为疾病模型大鼠更具优势,其体型较大,因此能够容纳更多的电极[15],且大鼠身体素质较高,癫痫模型死亡率较低。
2.3 已应用于EIT研究的化学癫痫模型
化学诱导的癫痫模型最常见的物质是惊厥药物,如海人酸、青霉素和匹罗卡品等。在全身或颅内注射后,这些药物会触发持续性癫痫(status epilepticus,SE),在经历潜伏期后引发癫痫的发作和自发性反复发作( SRS )[29]。
海人酸模型是研究癫痫发生和相关病理变化最常用的动物模型之一。可全身给药或海马内注射[17],给药后48 h内,大鼠普遍出现SE,引起组织的广泛损伤,与人类难治性癫痫病理特征相似[30]。海人酸模型的优越性在于较低的死亡率[31]。匹罗卡品是一种毒蕈碱乙酰胆碱受体激动剂,腹腔注射匹罗卡品可以成功地诱发癫痫发作。匹罗卡品癫痫模型的神经病理变化与癫痫患者的相似[32]。该模型的显著缺点是在全身给药后,包括海马体、杏仁核在内的多个大脑区域均会产生广泛损伤,病变范围更广[33],但是匹罗卡品模型的可靠性较高。研究表明,几乎所有腹腔注射匹罗卡品的大鼠都会发生自发性癫痫[34]。青霉素是目前应用最广泛的急性致痫剂,也是最常应用于EIT研究中的化学致痫剂。
2016年,Vongerichten使用4-氨基吡啶(4-AP)、印防己毒素或青霉素三种化学致痫剂分别注入麻醉大鼠大脑皮层内制备癫痫模型,该研究首次关注了癫痫发作间期的阻抗变化。由于青霉素是典型的急性致痫剂,未观察到其发作间期的阻抗变化。三种模型都选择深入大脑皮层1 mm局部注射致痫剂,未考虑到针头可能会对大脑皮层造成损伤,进而引起组织阻抗发生变化。王蕾等[10]在2017年也使用了青霉素诱导的大鼠急性癫痫模型,成功地从大鼠的大脑皮层记录到多次癫痫发作。研究发现,在青霉素注射部位,大多数癫痫发作期间电阻抗降低,且直至癫痫发生结束,此变化与生理盐水对照组的电阻抗变化具有显著性差异。该研究结果还提示致痫灶处电阻抗降低在癫痫发作前就已出现,该结果对于EIT在癫痫发作预测领域的应用具有重要意义。但是青霉素癫痫模型是典型的急性癫痫模型,在注射后20~30 min后就会诱发癫痫发作,因此,并未有足够的时间研究其发作间期的阻抗变化。2021年Witkowska-Wrobel等[35]提出了猪的癫痫模型,该模型是在猪的脑内注射青霉素诱发急性癫痫发作。研究表明,在猪脑中单次颅内注射BPN可导致癫痫发作。猪脑在大小、大体解剖学和发育程度上与人脑相似,因此,该模型可以更好地反映临床情况下的人脑。但是研究过程中未考虑到局部注射可能会造成阻抗变化,且急性癫痫模型与人类难治性癫痫发作机制可能有所不同。各化学癫痫模型见表1。
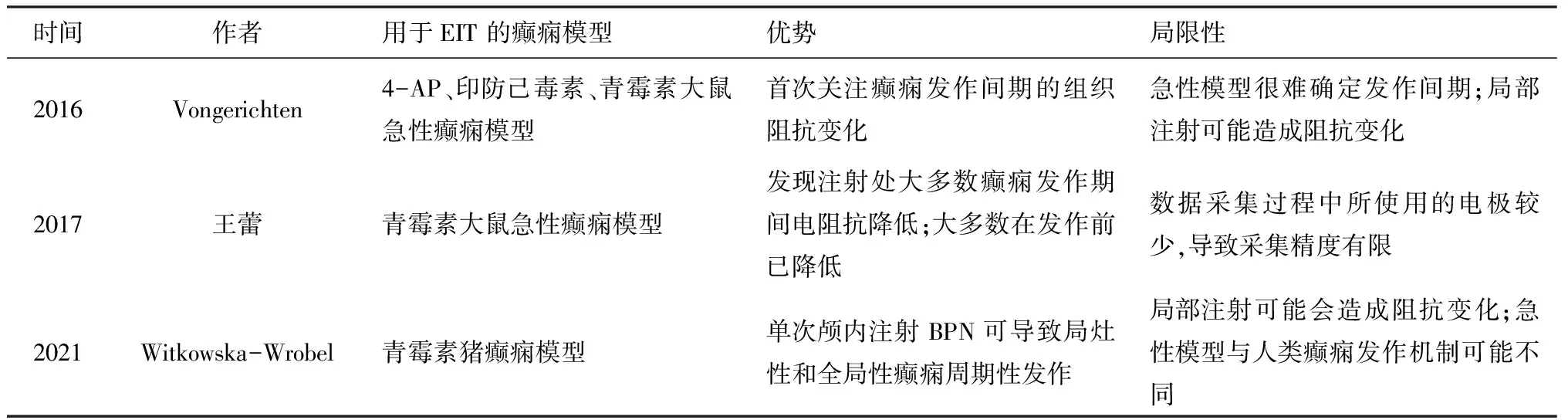
表1 目前已应用于EIT研究的化学癫痫模型
2.4 已应用于EIT研究的物理癫痫模型
动物的物理癫痫模型具有在完整的大脑中复制致痫特征的优势,死亡率低、可重复性高。此外,与化学诱发癫痫相比,当致痫条件不再存在时,可以研究电刺激引起的术后改变,但电刺激模型无法提供大脑细胞类型的特异性[36]。
电刺激诱发癫痫是目前研究最多的电刺激模型之一,使用方便,无需立体定向植入电极。单诱发癫痫后放电模型(AD)是电刺激的另一重要方法,是在大脑的特定区域诱发。AD 常用于研究局灶性癫痫的电生理学特性[37]。点燃是研究最多的电刺激模型。点燃指的是一种癫痫诱发的可塑性现象,即通过电刺激特定的大脑区域重复诱发AD,从而引起癫痫易感性的逐步增强[38]。电刺激癫痫模型是EIT研究领域应用最广泛的癫痫模型之一。
1994年,Boone等[11]使用了与癫痫发作类似的兔的皮质扩散抑制模型初步证实EIT对于神经功能活动成像的可行性,皮质扩散性抑制模型是由0.6~1.5 mA的直流电刺激麻醉兔的大脑皮层30~60 s引起的,刺激强度均足以诱发扩散性抑制。虽然该研究首次证明EIT在神经活动成像的可行性,但是他们在动物实验中并未考虑到由大脑干燥、刺激伪影带来的误差影响,最重要的是兔的皮质抑制模型只是发作机制与人类癫痫相似,但是无法完全模拟癫痫发作机制。 2016年,Aristovich等[13]使用电压刺激器刺激大鼠对角相邻的晶须造模,获得麻醉大鼠皮层活动的第一张EIT图像,但是该模型仅模拟了大鼠快速电活动发作时的皮层活动,并未深入大脑其它区域,穿透深度有限,其次该研究使用的模型是与癫痫发作类似的快速电活动,并非真实的癫痫。2018年,Hannan通过电刺激麻醉大鼠感觉运动皮层制备急性癫痫模型。与化学模型相比,间歇性电刺激皮质组织不会导致局部神经回路不可逆转的变化,因此,电刺激模型表现的时间依赖性变化最小。此外,模型的发作时间可以受到严格的控制,能够合理控制实验进程。然而,虽然电刺激的活动中心在空间上局限于体感皮质的颗粒下层,但实际激活的体积仍可能超过较浅表的皮质层,同时电刺激模型最显著的缺点在于其缺乏神经细胞的特异性。2020年,Hannan提出了海马癫痫ADs模型[39]与新皮质癫痫ADs模型[15],是通过电刺激麻醉大鼠的穿支通路和感觉运动皮层从而诱发癫痫。这两种模型的优点在于能够频繁地诱导可重现的癫痫发作,通常表现出比化学模型更小的电信号变异性,从而能够完全控制研究进程。但是它缺乏细胞类型特异性,无法影响特定神经元组的放电特征。与化学癫痫模型相比,它不能提供最真实的人类难治性癫痫模型。各电刺激癫痫模型见表2。
综上,目前已应用于EIT研究的动物癫痫模型存在一定的局限性,在尚未完全掌握癫痫发作前期及发作期电阻抗变化规律前,需要提出一种适合于EIT研究的动物癫痫模型,用于难治性癫痫检测及预测方法的研究。为了满足研究需求,所寻找的动物癫痫模型需要满足以下几点要求:(1)癫痫模型在行为学、神经病理学、脑电图特征等方面与真实的人类难治性癫痫相似,否则缺乏说服力;(2)要有明确的发作间期与发作期,目前对于癫痫发作期间电阻抗的变化仍存在争议,合适的动物模型的提出可能对探索癫痫发作期间阻抗变化提供支持,明确的发作间期与发作期为实现癫痫预测提供可能性;(3)选择合适的麻醉剂对动物进行麻醉,以消除癫痫发作过程中的运动伪影;(4)所选模型具有一定的稳定性,可重复多次发生癫痫活动,以便能够评估重建的准确性。
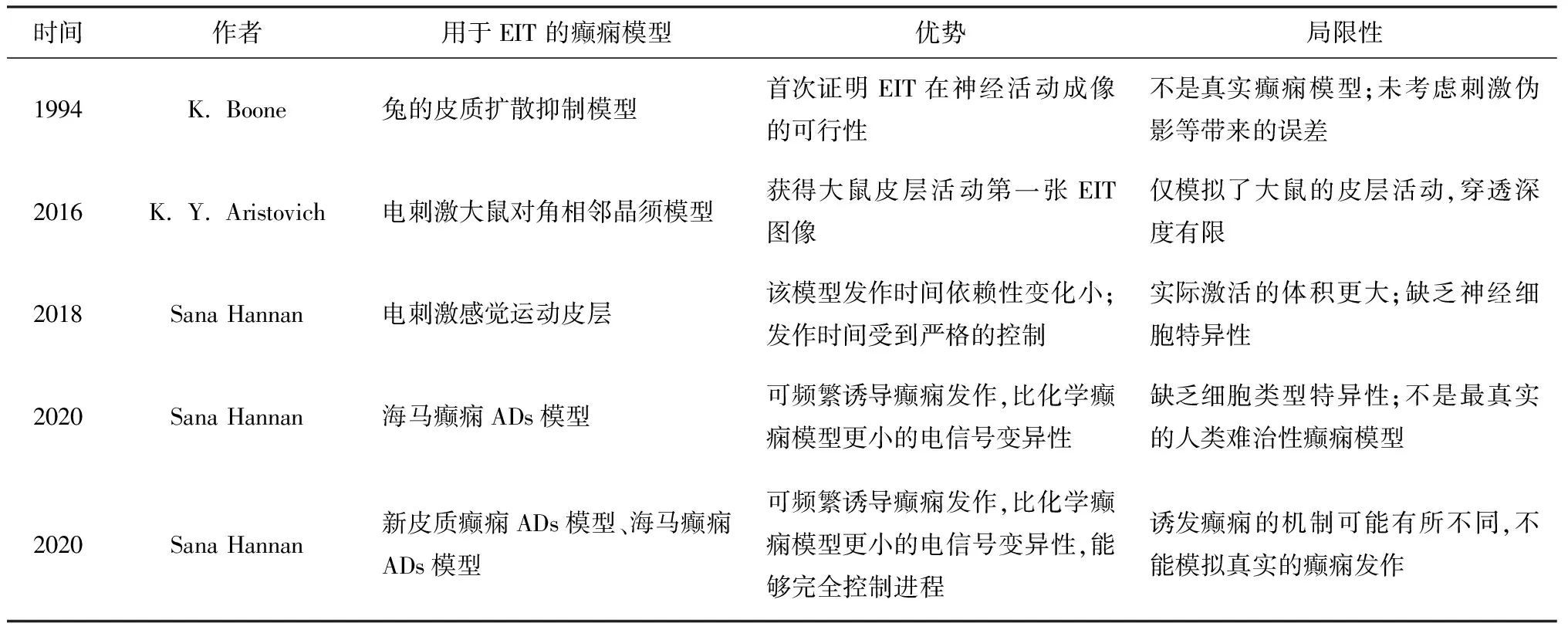
表2 目前已应用于EIT研究的电刺激诱导的癫痫动物模型
3 有可能适用于EIT研究的动物癫痫模型
动物的癫痫模型种类繁多,但是若想应用于EIT的研究中,需考虑多方面因素。首先,由于EIT的工作特点,化学致痫剂诱导的癫痫模型可能更适用于EIT的研究。EIT是通过对待测物表面施加安全激励电流或电压,同时测量物体表面的电压或电流信号,进而重建图像,而在电刺激模型中,同样需要对模型施加一定电流,以诱导癫痫的发作。那么在实验过程中,很难排除电刺激对于EIT信号采集的干扰。化学致痫剂一般分为全身和局部注射,局部注射时针头的插入可能会造成部分组织损伤,影响组织的阻抗变化。虽然全身注射诱导效果稍逊色,但也排除了受损组织阻抗变化对于EIT数据采集的影响。化学诱导的癫痫模型可分为慢性和急性,急性模型发作强烈,神经元的参与程度远超于人类癫痫发作,其机制可能与人类癫痫发作不同;其次,急性模型只能持续几分钟到几个小时,不会反复发作,这对于EIT的长期监测不利;另外,急性模型的死亡率一般较高,实验成本较大,而慢性模型虽然实验周期较长,但是模型存活率较高,且更接近人类癫痫。
综上,若能寻找到一种通过全身注射某种化学致痫剂诱导的慢性动物癫痫模型,且该模型的行为学、病理学以及脑电特征与人类难治性癫痫具有很高的相似性,模型构造过程中未引起组织阻抗的变化,将有可能会为EIT在癫痫疾病领域的研究提供帮助。
4 展望
EIT作为一种新兴蓬勃的医学成像技术,已经在癫痫研究领域展示了其与众不同的优势。对于无法确定致痫灶的难治性癫痫患者,EIT功能成像的优势可以用来辅助脑电定位致痫灶。其次,EIT作为一种对癫痫发作较为敏感的成像技术,若能够辅助脑电在癫痫发作前期就检测到脑血流灌注的变化,及时给予干预治疗,可减轻癫痫患者的痛苦。
合适的动物模型是研究的基础,也是关键。若寻找到与人类难治性癫痫发作类似的、有明确且足够长的发作期与发作间期的动物难治性癫痫模型,通过脑电特征波确定癫痫发作期,探索癫痫发作前期及发作期间的阻抗变化规律,提取电阻抗变化的特征参数,利用癫痫发作前期电阻抗变化特征信息实现EIT实时预测癫痫发作,就能为实现癫痫预测提供新方法,为难治性癫痫患者带来新机遇。

