载脂蛋白E4基因与阿尔茨海默病伴睡眠障碍患者血脂、炎症因子及抑郁相关因子的关系*
肖英,闫丽敏,陈斌
(海南医学院第二附属医院,海南海口570311)
阿尔茨海默病(Alzheimer′s disease,AD)属于神经系统退行性疾病,又称老年痴呆症,起病缓慢,随着时间延长病情可持续进展或恶化[1]。睡眠障碍是AD 患者较常见的并发症,严重影响患者生活质量及身心健康。目前AD 伴睡眠障碍病变机制较为复杂,且尚未明确。既往研究表明,AD 患者睡眠质量降低与血脂代谢紊乱、炎症及抑郁有一定关系[2-3]。载脂蛋白E(apolipoprotein E,ApoE)由299 个氨基酸构成,其基因多态性,尤其是ApoE4与AD 病变关系密切。近年来研究表明,ApoE4可促进血脂代谢紊乱,诱发炎症反应,产生认知损伤而影响患者精神状态[4-6]。目前AD 伴睡眠障碍相关研究较少。因此,本研究通过分析AD 伴睡眠障碍患者ApoE等位基因分布,探究ApoE4与AD 伴睡眠障碍患者炎症因子、脑源性神经营养因子(brain-derived neurotrophic factor,BNDF)、5-羟色胺(5-hydroxytryptamine,5-HT)的关系。
1 资料与方法
1.1 一般资料
选取2018年6月—2020年7月在海南医学院第二附属医院就诊的78 例AD 患者,根据匹兹堡睡眠质量指数(Pittsburgh sleep quality index,PSQI)量表[7]将患者分为伴有睡眠障碍组(42 例,PSQI >7 分)及未伴有睡眠障碍组(36 例,PSQI ≤7 分)。其中伴有睡眠障碍组男性25 例,女性17 例;年龄60~85 岁,平均(72.19±10.04)岁;文化程度:高中以下29 例、高中及以上13 例。未伴有睡眠障碍组男性20 例,女性16 例;年龄62~88 岁,平均(72.51±12.03)岁;文化程度:高中以下25 例、高中及以上11 例。另取50 例同期该院健康体检者作为健康组,男性27 例,女性23 例;年龄58~86 岁,平均(72.61±9.60)岁;文化程度:高中以下32 例、高中及以上18 例。3 组患者性别、年龄、文化程度比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批,受试者均知情同意。
1.2 纳入与排除标准
1.2.1 纳入标准①符合《2018 中国痴呆与认知障碍诊治指南(一):痴呆及其分类诊断标准》AD 诊断标准[8];②年龄<90 岁;③临床资料完整。
1.2.2 排除标准①在本实验前3 个月内服用过抗精神类、安眠类药物治疗者;②心、肝、肾等脏器严重病变者;③胃食管反流、药物滥用及慢性阻塞性肺疾病者,除AD 以外造成患者睡眠障碍的疾病;④内分泌代谢紊乱性疾病,如糖尿病、多囊卵巢综合征、甲状腺疾病等。
1.3 主要仪器及试剂
实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction,qRT-PCR)仪(上海力康生物医疗科技控股有限公司,型号CG-05),全自动生化分析仪(江西特康科技有限公司,型号TC6090L)。 酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒(美国贝克曼库尔特公司)。
1.4 观察指标
1.4.1 ApoE 等位基因分布从所有受试者静脉血标本中提取DNA,设计及合成ApoE引物。ApoE正向引物:5′-CCTCTGCCC CGTTCCTTC-3′,反向引物:5′-CGCCACCTGCTCCTTCAC-3′,引物长度20 bp,由日本TaKaRa 公司设计合成。qRT-PCR 反应条件:95℃预变性15 min,94℃变性30 s,55℃退火2 min,65℃延伸45 s,共45 个循环。然后采用PCR 扩增其产物99℃、5 min,冰浴5 min,与基因芯片上特异性核酸探针进行杂交,测定基因位点序列。
1.4.2 血脂采用全自动生化分析仪检测AD 伴睡眠障碍ApoE4 携带组及未携带组患者血脂水平,包括总胆固醇(total cholesterol,TC)、甘油三酯(Triglyceride,TG)、低密度脂蛋白胆固醇(lowdensity lipoprotein cholesterol,LDL-C)。
1.4.3 血清炎症因子采用ELISA 检测AD 伴睡眠障碍ApoE4 携带组及未携带组患者血清炎症因子水平,包括肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(Interleukin-6,IL-6)、白细胞介素1β(Interleukin-1β,IL-1β)。
1.4.4 抑郁相关因子采用ELISA 检测AD 伴睡眠障碍ApoE4 携带组及未携带组患者抑郁相关因子水平,包括BNDF、5-HT。
1.5 统计学方法
数据分析采用SPSS 22.0 统计软件。计数资料以构成比(%)表示,比较用χ2检验;计量资料以均数±标准差(±s)表示,比较用t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 3组ApoE等位基因分布
健康组、伴有睡眠障碍组、未伴有睡眠障碍组ApoE2、ApoE3 携带者占比比较,经χ2检验,差异无统计学意义(P>0.05)。见表1。
健康组、伴有睡眠障碍组、未伴有睡眠障碍组ApoE4携带者占比比较,经χ2检验,差异有统计学意义(P<0.05);其中伴有睡眠障碍组ApoE4携带者占比高于健康组和未伴有睡眠障碍组(P<0.05),而健康组与未伴有睡眠障碍组ApoE4携带者占比比较,差异无统计学意义(P>0.05)。见表1。
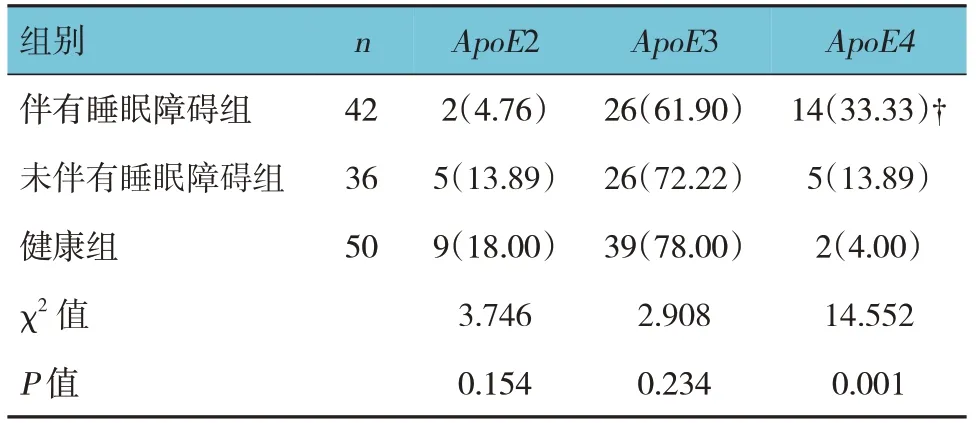
表1 ApoE等位基因的分布 例(%)
2.2 ApoE4携带组与未携带组患者血脂水平
由结果2.1 中可知AD 伴睡眠障碍患者中,14 例携带ApoE4基因(ApoE4 携带组),28 例未携带ApoE4基因(ApoE4 未携带组)。ApoE4 携带组与未携带组TC、TG 及LDL-C 水平比较,经t检验,差异有统计学意义(P<0.05),ApoE4 携带组高于未携带组。见表2。

表2 ApoE4携带组与未携带组患者血脂水平比较(mmol/L,x±s)
2.3 ApoE4 携带组与未携带组患者血清炎症因子水平
ApoE4 携带组与未携带组血清TNF-α、IL-6 及IL-1β 水平比较,经t检验,差异有统计学意义(P<0.05),ApoE4 携带组高于未携带组。见表3。
表3 ApoE4携带组与未携带组患者血清炎症因子水平比较(ng/mL,±s)

表3 ApoE4携带组与未携带组患者血清炎症因子水平比较(ng/mL,±s)
组别ApoE4携带组ApoE4未携带组t 值P 值n 14 28 TNF-α 213.76±52.60 124.75±38.02 6.197 0.000 IL-6 122.41±30.05 72.49±12.38 7.655 0.000 IL-1β 57.11±10.24 32.39±6.54 9.519 0.000
2.4 ApoE4 携带组与未携带组患者抑郁相关因子水平
ApoE4 携带组与未携带组BNDF、5-HT 水平比较,经t检验,差异有统计学意义(P<0.05),ApoE4 携带组低于未携带组。见表4。

表4 ApoE4携带组与未携带组患者抑郁相关因子水平比较(ng/mL,x±s)
3 讨论
睡眠障碍是AD 常见并发症,严重影响患者治疗及生活质量[9]。ApoE 是一种通过介导胆固醇代谢的载脂蛋白,在动脉粥样硬化及神经细胞功能中发挥重要生物学作用。本研究结果表明,伴有睡眠障碍组ApoE4携带者占比高于健康组及未伴有睡眠障碍组,而健康组及未伴有睡眠障碍组之间ApoE4分布无显著差异。提示携带ApoE4的AD 患者更容易并发睡眠障碍,即ApoE4不仅是AD 致病的危险因素,而且可能增加AD 患者睡眠障碍发生风险。分析其原因可能为:①ApoE4致病机制与大脑中β 淀粉样蛋白沉积有关,而β 淀粉样蛋白沉积会对睡眠产生一定影响[10-11];②可能与ApoE4对AD 患者血脂、炎症因子及情绪相关因子的调节作用相关[12-14]。然而现阶段ApoE4诱发AD 患者睡眠障碍的具体作用机制尚未明确。
胡雨亭等[15]研究报道,血脂水平异常对老年人认知功能有不利影响,TC、TG 及LDL-C 水平越高,认知能力越弱。且有报道证实,认知功能对患者睡眠障碍影响显著,两者相互作用[16-17]。为进一步探究血脂水平与睡眠的关系,马爱娟等[2]研究发现北京人存在睡眠问题,认为其与TC、TG 及LDL-C 水平呈正相关。本研究结果表明,ApoE4 携带组TC、TG 及LDL-C 水平显著高于ApoE4 未携带组。这一结果与贾新等[4]的研究结果类似,其发现携带ApoE4的AD 或轻度认知障碍患者血脂表达较未携带者更异常,认为ApoE基因的多态性与血脂水平密切相关。分析原因可能是ApoE4作为血浆中脂蛋白重要组分,参与脂蛋白代谢及胆固醇转运,对患者血脂水平起到一定的调节作用,因而推测ApoE4通过调节患者血脂代谢来影响睡眠。
睡眠调节不仅与心理、神经及内分泌等因素有关,而且受细胞因子的影响。TNF-α、IL-1β 虽然是与免疫密切相关的炎症因子,但是其受体也广泛存在于脑干、海马、下丘脑等与睡眠觉醒周期调节相关的大脑组织中,被认为与机体的生理性非眼球快速运动睡眠调节相关。有研究表明,TNF-α、IL-6、IL-1β 等炎症因子表达上调可促进睡眠障碍[18]。低剂量TNF-α、IL-1β 可促进睡眠,高剂量则相反,可能是由于TNF-α、IL-1β 及其产物可以激活NF-κB 以延长满波睡眠时间,而NF-κB 又可以增强TNF-α、IL-1β 的转录,在睡眠/剥夺中起到类似神经递质的作用[19]。IL-6 是一种多功能细胞因子,健康人入睡前注射IL-6 可明显缩短快动眼睡眠时间,白天易出现倦怠、精力不集中等表现,被认为参与了睡眠调节。本研究结果表明,ApoE4 携带组TNF-α、IL-6 及IL-1β 水平显著高于未携带组。分析原因可能与ApoE4的促炎机制有关,国希云等[20]发现ApoE4可引发一系列炎症反应,致使脑血管功能严重退化。因而推测ApoE4可增强AD 患者的炎症反应,进而导致睡眠障碍。
AD 患者常伴有抑郁症状,且既往报道已证实抑郁症状对睡眠障碍影响显著,如张楼凤等[3]研究报道抑郁症患者的睡眠质量与健康人存在显著差异,且抑郁程度越重,患者睡眠障碍越严重。BNDF 属于神经营养蛋白,动物实验发现敲除BDNF基因的小鼠抑郁症、狂躁症发生率显著高于健康小鼠[21]。BNDF 主要表达于大脑皮层、海马、下丘脑等组织中,可维持神经元功能、促进神经元再生、参与突触可塑性,当机体BNDF 表达降低时导致神经元凋亡增多,中枢神经系统突触可塑性降低,进而引起抑郁、狂躁症状的出现[22-23]。本研究结果表明,ApoE4 携带组BNDF 水平显著低于未携带组,提示ApoE4可能会抑制BNDF 的表达,BNDF 低表达则会导致抑郁症状的发生,而ApoE4抑制BNDF 的机制有待进一步研究。
5-HT 属于哚衍生物,与人体睡眠、痛觉等生理功能相关,5-HT 水平升高可发挥抗抑郁作用。动物实验发现,酒精依赖伴抑郁症大鼠予以5-HT后,大鼠抑郁症状明显缓解[24]。5-HT 是一种存在于人体血液、肠道、大脑等部位的神经递质,其水平升高会导致机体中枢神经系统的慢波睡眠增多,觉醒减少;当其水平降低则可能导致失眠和情绪波动[25]。本研究结果表明,ApoE4 携带组5-HT 水平显著低于未携带组,提示ApoE4可能会抑制5-HT 表达,5-HT 低表达会降低神经活动兴奋度,影响大脑快速动眼睡眠,导致抑郁及睡眠障碍的发生,而ApoE4抑制5-HT 的机制仍有待进一步研究。
综上所述,AD 患者并发睡眠障碍与ApoE基因多态性有关,其中ApoE4对该类患者影响最显著,其原因可能与ApoE4调节患者血脂、炎症因子及抑郁相关因子水平有关。然而本研究具有一定不足之处,后续研究可扩大样本量及通过相关基础实验进一步明确其生物学作用机制。

