番茄颈腐根腐病抗性鉴定技术的建立及抗性种质资源筛选
王梦蕊,刘淑梅,侯丽霞,王施慧,吕宏君,苏晓梅
番茄颈腐根腐病抗性鉴定技术的建立及抗性种质资源筛选
王梦蕊1,2,刘淑梅1,侯丽霞1,王施慧1,吕宏君1,苏晓梅1
1山东省农业科学院蔬菜研究所/山东省设施蔬菜生物学重点实验室/国家蔬菜改良中心山东分中心/农业农村部黄淮地区蔬菜科学观测实验站(山东),济南 250100;2中国农业大学园艺学院,北京 100193
【】探索番茄颈腐根腐病(Fusarium crown and root rot,FCRR)苗期抗性鉴定技术,并对番茄种质资源及品种进行抗性鉴定分析,挖掘和丰富可利用的抗性资源,为培育抗颈腐根腐病番茄品种打下基础。以尖镰孢番茄颈腐根腐病专化型病原菌(f. sp.,Forl)和感病栽培番茄Heinz 1706为材料,研究接种菌液浓度、接种寄主苗龄、接种后管理温度和不同接种方法对番茄颈腐根腐病人工接种鉴定效果的影响。随后通过苗期人工接种鉴定方法结合文献中已报道的与抗性基因连锁的分子标记,对100份番茄种质材料进行颈腐根腐病抗性鉴定分析。在一定范围内,番茄颈腐根腐病发病率及病情指数随着接种菌液浓度的升高而增大,接种菌液浓度为107个孢子/mL时,发病率及病情指数分别为100%和89.2,可以反映寄主真实的抗性水平;接种寄主苗龄为2—5叶期均能使植株发病,不同苗龄间病情指数无显著差异;接种后不同的管理温度对番茄颈腐根腐病的病情指数影响显著不同,其中较低的管理温度(20℃)有利于番茄颈腐根腐病的发生;使用浸根法和灌根法进行鉴定,番茄颈腐根腐病发病率和病情指数较高且效果稳定,显著优于茎注射法。对100份番茄种质材料进行分析,接种鉴定结果显示有38份材料表现抗病,这些材料可用于番茄抗颈腐根腐病育种或生产。在已报道的与连锁的分子标记中,SCAR的准确率最低,仅为51%,C2-25的准确率为59%,而PNU-D4的准确率为83%,该标记可用于番茄抗颈腐根腐病辅助选择。建立的苗期抗性鉴定技术能客观反映供试材料的实际抗性水平,可用于番茄抗颈腐根腐病材料的鉴定筛选。
番茄;颈腐根腐病;抗性鉴定;分子标记
0 引言
【研究意义】番茄颈腐根腐病(Fusarium crown and root rot,FCRR)是由尖镰孢番茄颈腐根腐病专化型(f. sp.,Forl)引起的番茄土传性真菌病害[1-2]。该病害在世界范围内均有发生[3-8],设施栽培地区较为严重,在连作栽培区造成的损失逐年加大,是设施番茄生产的限制因素之一[9-10]。抗源材料的利用是抗病育种的前提和基础,对种质资源进行抗性鉴定和筛选,对于抗性基因的克隆以及加速番茄抗颈腐根腐病育种进程具有重大意义。【前人研究进展】近年来,番茄颈腐根腐病已成为威胁我国设施番茄冬春生产的最重要的病害之一,侵染后可造成番茄严重减产甚至绝收[11-15]。我国东北、华北地区发病比较严重,尤以山东省寿光地区病情最为突出。据调查,寿光日光温室番茄颈腐根腐病发病率达80%以上,致死率达30%以上[12],给当地生产造成了严重影响。培育和利用抗病品种是控制该病害最为经济、有效的措施,抗性鉴定是抗病育种的基础工作,也是抗源筛选、挖掘和利用的前提条件。国外开展颈腐根腐病抗性鉴定及抗源筛选利用工作较早,并且在抗性基因研究和分子标记应用方面也取得了一定的进展[16-21],然而不同研究者得到的结果也并不一致,其中STANIASZEK等[18]根据与紧密连锁的保守序列位点C2_At2g38025设计的CAPS标记C2-25应用最为广泛。【本研究切入点】我国有关番茄抗颈腐根腐病的研究报道较少,多数集中在对病原菌的鉴定以及防治措施的简单描述,在颈腐根腐病抗性鉴定及抗源筛选方面的工作相对落后,抗病育种工作进展也较为缓慢[22-25]。在不同的室内条件下,使用不同的接种方法产生的效果也不尽相同,因此建立一套快速、高效、稳定并且适用于大批量试材的抗性鉴定技术十分必要。【拟解决的关键问题】以高感颈腐根腐病的栽培番茄Heinz 1706为材料,研究人工接种番茄颈腐根腐病的最佳条件,为番茄抗颈腐根腐病材料的选育提供切实可行的鉴定技术,同时利用苗期人工接种鉴定技术结合分子标记分析,对收集的100份番茄种质材料进行抗颈腐根腐病鉴定,明确其抗病水平,为番茄抗颈腐根腐病育种提供基础材料。
1 材料与方法
1.1 材料
抗病鉴定技术所用材料为高感颈腐根腐病的番茄品系Heinz 1706,抗性种质资源筛选材料共100份,由山东省农业科学院蔬菜研究所番茄课题组收集保存,包括49份自交系材料和51份杂交种。以上材料均选取粒饱满无病种子,10%次氯酸钠溶液浸泡10 min消毒处理,清洗后在28℃恒温箱中催芽,待露白后播种于灭菌的基质土中。试验于2020年8月在山东省农业科学院蔬菜研究所培养室内进行,苗期控制室内温度24—28℃,正常栽培管理。
供试病原菌采集于山东省农业科学院蔬菜研究所核心试验区温室内,采用组织分离法进行分离纯化,经鉴定为尖镰孢番茄颈腐根腐病专化型,-80℃保存备用。
1.2 方法
1.2.1 菌悬液制备 将培养在PDA平板培养基上的病原菌接种于盛有150 mL PDB培养基的锥形瓶中,25℃下140 r/min振荡培养4 d,培养液经过滤除去菌丝体后4 000 r/min离心10 min,倒掉上清液,加灭菌蒸馏水稀释成一定浓度的接种悬浮液。
1.2.2 不同接种条件试验 不同接种菌液浓度:当番茄长至2—3片真叶时,使用浓度为106、107、108个/mL的孢子悬浮液,采用浸根法对番茄幼苗进行接种。不同寄主苗龄:采用浸根法,使用浓度为107个/mL的孢子悬浮液对2—3、3—4、4—5叶期的番茄幼苗进行接种。不同管理温度:采用浸根法,使用浓度为107个/mL的孢子悬浮液对2—3叶期的番茄幼苗进行接种后,将其分别置于20、25、30℃环境中进行培养。
不同接种方法:当番茄长至2—3片真叶时,使用浓度为107个/mL的孢子悬浮液进行接种。浸根法:将番茄幼苗从穴盘中轻轻拔起后用水洗掉根部泥土,把主根尖端剪去0.5 cm左右后,将幼苗的根系在菌悬液中浸泡15 min,然后移栽至灭菌的育苗基质中[20-21]。灌根法:当番茄长至2—3片真叶时,在幼苗根部一侧用刀片将部分根轻轻切断,给根系造成机械伤害,将浓度为107个/mL孢子悬浮液30 mL灌入伤根部位[14]。茎基部注射法:用注射器吸取0.1 mL病原菌孢子悬浮液,由番茄幼苗的茎基部刺入并将接种菌液注射到番茄幼苗茎基部木质部,每株注射两处[26]。
试验设置3次重复,每重复10株苗,4周后调查发病情况。
1.2.3 番茄种质资源抗病性鉴定 当番茄幼苗长至2—3叶期时,用清水将根系清洗干净后剪去主根尖端0.5 cm,放在浓度为107个/mL的孢子悬浮液中浸根处理15 min,然后移栽至灭菌基质土中,对照组用清水浸根处理,接种后置于18—22℃室内环境中,16 h·d-1光照条件,4周后调查发病情况。试验设置2次重复,每重复8株苗。病情分级(disease- severity scale,DSS)按照Kim等[20]的标准稍作修改。0级:根系正常;1级:主根基部轻微褐变,侧根正常,茎纵剖维管束正常;2级:主根基部褐变,侧根轻微褐变,茎纵剖维管束褐变;3级:主根侧根明显褐变,侧根脱落,茎纵剖维管束明显褐变;4级:植株萎蔫死亡或茎基部、根部严重褐变甚至腐烂,侧根脱落,茎纵剖维管束严重褐变(图1)。病情指数(disease index,DI)=[Σ(病级数值×该病级株数)]/(病级最高值×调查株数)×100。寄主抗性等级为免疫:DI =0;高抗:0<DI<12.5;抗病:12.5≤DI<25;中抗:25≤DI<50;感病:50≤DI<75;高感:75≤DI≤100。
1.2.4 番茄种质资源分子标记检测 当番茄长至2—3片真叶时,每个编号混合取样,采用CTAB法提取基因组DNA,使用文献中已报道的与连锁的分子标记及功能标记对收集的番茄种质材料进行标记分析(表1)。PCR扩增体系为10 μL:50 ng·μL-1DNA模板2 μL,2×PCR mix 5 μL,10 μmol·L-1上下游引物各0.25 μL,ddH2O补足至10 μL。引物C2-25、Tm-2和PNU-D4的PCR产物经酶切后用2%琼脂糖凝胶电泳检测。

a:0级DSS-0;b:1级DSS-1;c:2级DSS-2;d:3级DSS-3;e:4级DSS-4

表1 番茄颈腐根腐病抗性基因(Frl)分子标记
1.3 数据分析
采用Excel和SPSS 20.0软件进行数据的统计与分析,应用Duncan’s新复极差法进行差异显著性检验。
2 结果
2.1 不同接种条件对人工接种鉴定效果的影响
2.1.1 接种菌液浓度 不同接种菌液浓度下,番茄幼苗颈腐根腐病病情指数差异极显著。接种菌液浓度为106个/mL时,病情指数为66.7,发病率为90%,试验所用高感材料部分表现为抗病,不能真实反映植株本身的抗性。随着菌液浓度的增加,病情指数也随之增加,接种菌液浓度为107、108个/mL时,病情指数分别为89.2和96.7,发病率均为100%,能够真实反映材料本身的抗病性(表2)。
2.1.2 接种寄主苗龄 2—3、3—4、4—5叶期进行人工接种,番茄均可发病,发病率均为100%。随着苗龄的增加,病情指数略有下降,2—3片真叶时发病最重,病情指数为91.7,但不同苗龄接种对病情指数影响差异并不显著(表2)。
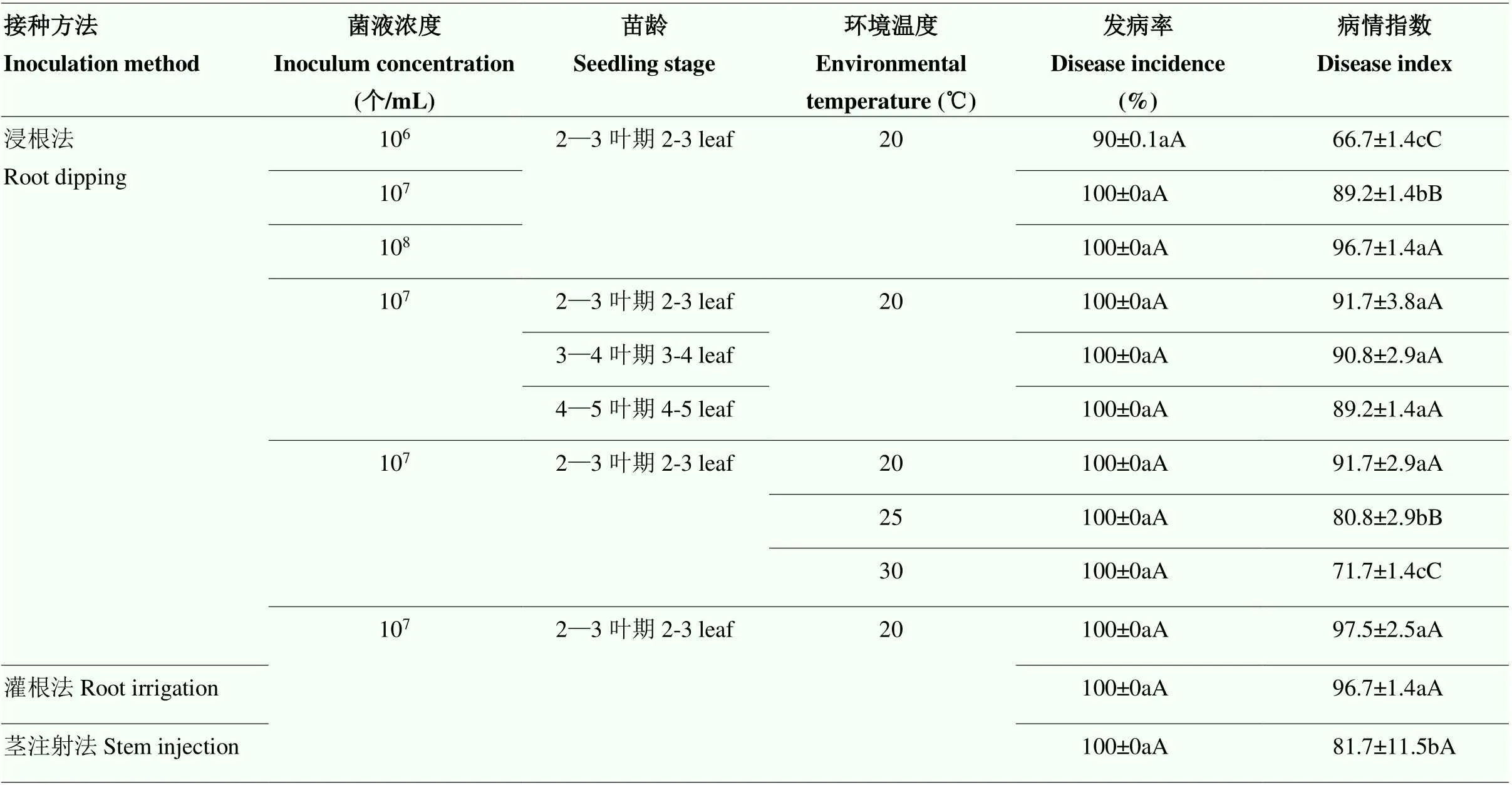
表2 不同接种条件对人工接种鉴定效果的影响
数据后不同大、小写字母分别表示经Duncan’s新复极差法检验在= 0.01和= 0.05水平差异显著
Different capital and lowercase letters after the data indicate significant differences at 0.01 and 0.05 levels by DMRT, respectively
2.1.3 接种后管理温度 番茄幼苗植株接种颈腐根腐病病原菌后,在不同的温度环境中发病率均为100%,在20℃时病情指数最高,随着温度的上升,病情指数也随之下降,差异极显著,表明接种后较低的管理温度有利于番茄颈腐根腐病的发生(表2)。
2.1.4 接种方法 采用不同的接种方法,番茄发病情况有所不同。使用浸根法和灌根法进行鉴定,番茄颈腐根腐病发病率和病情指数较高,显著优于茎注射法(表2)。
2.2 番茄种质资源接种鉴定
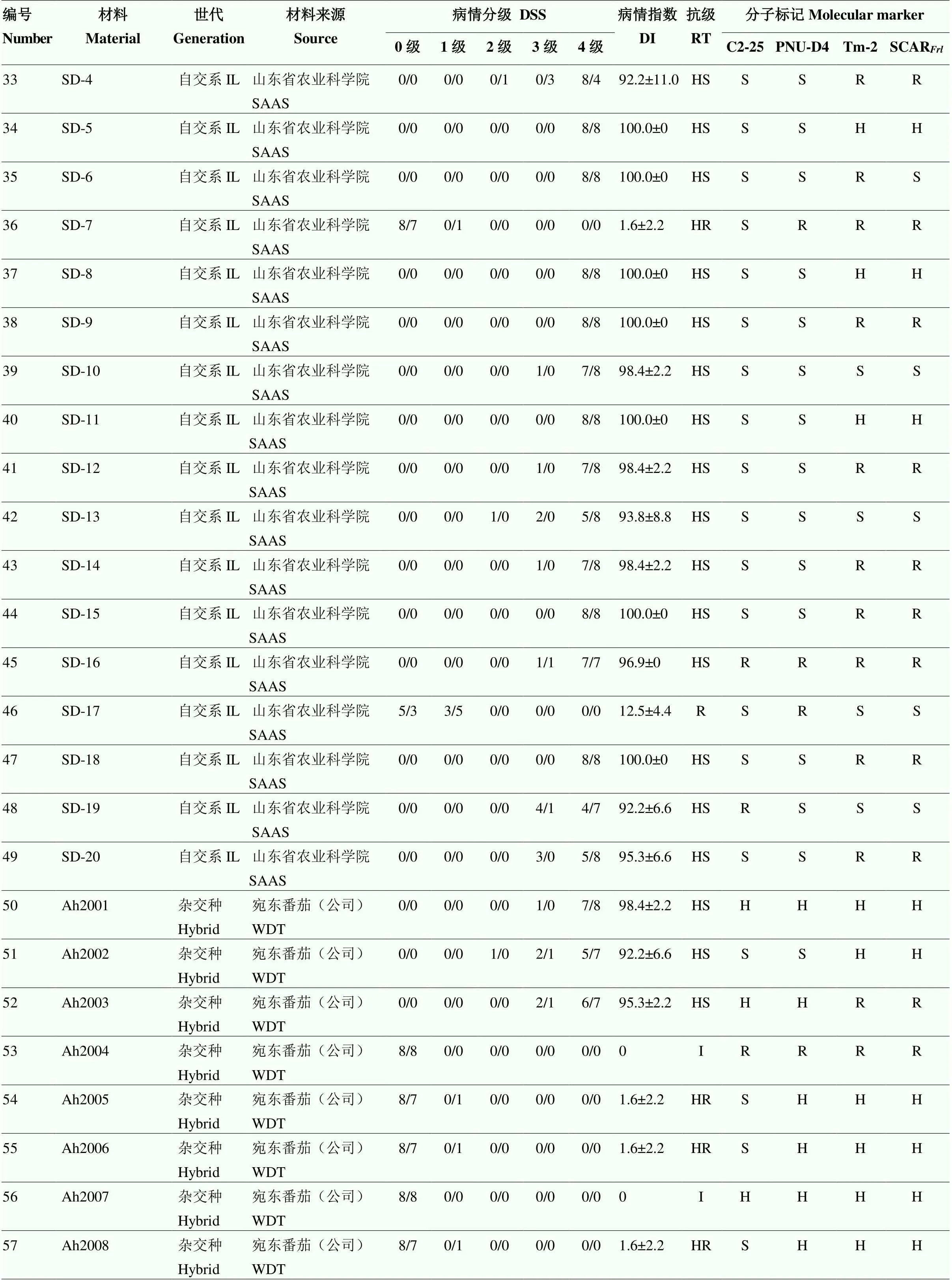
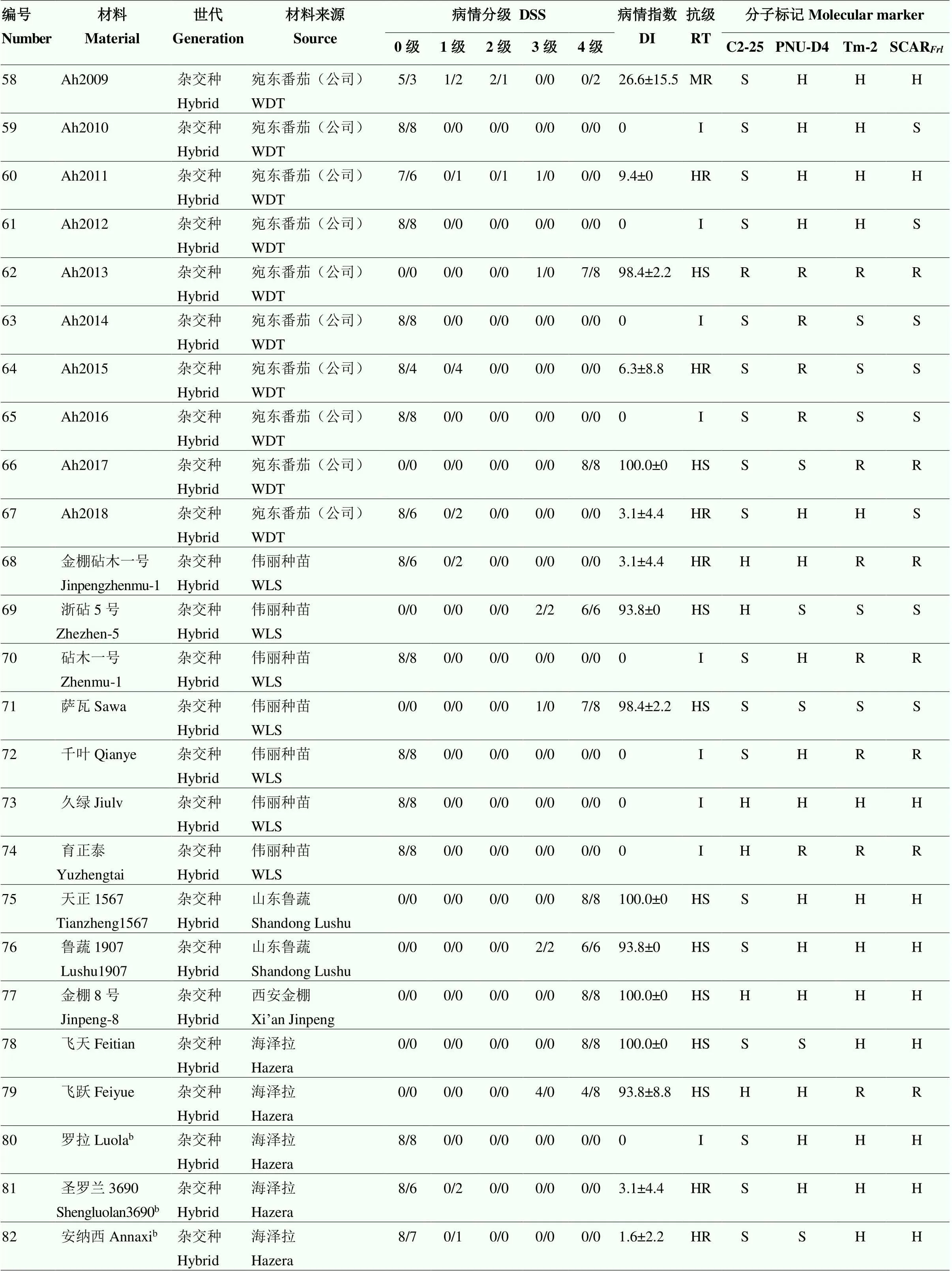
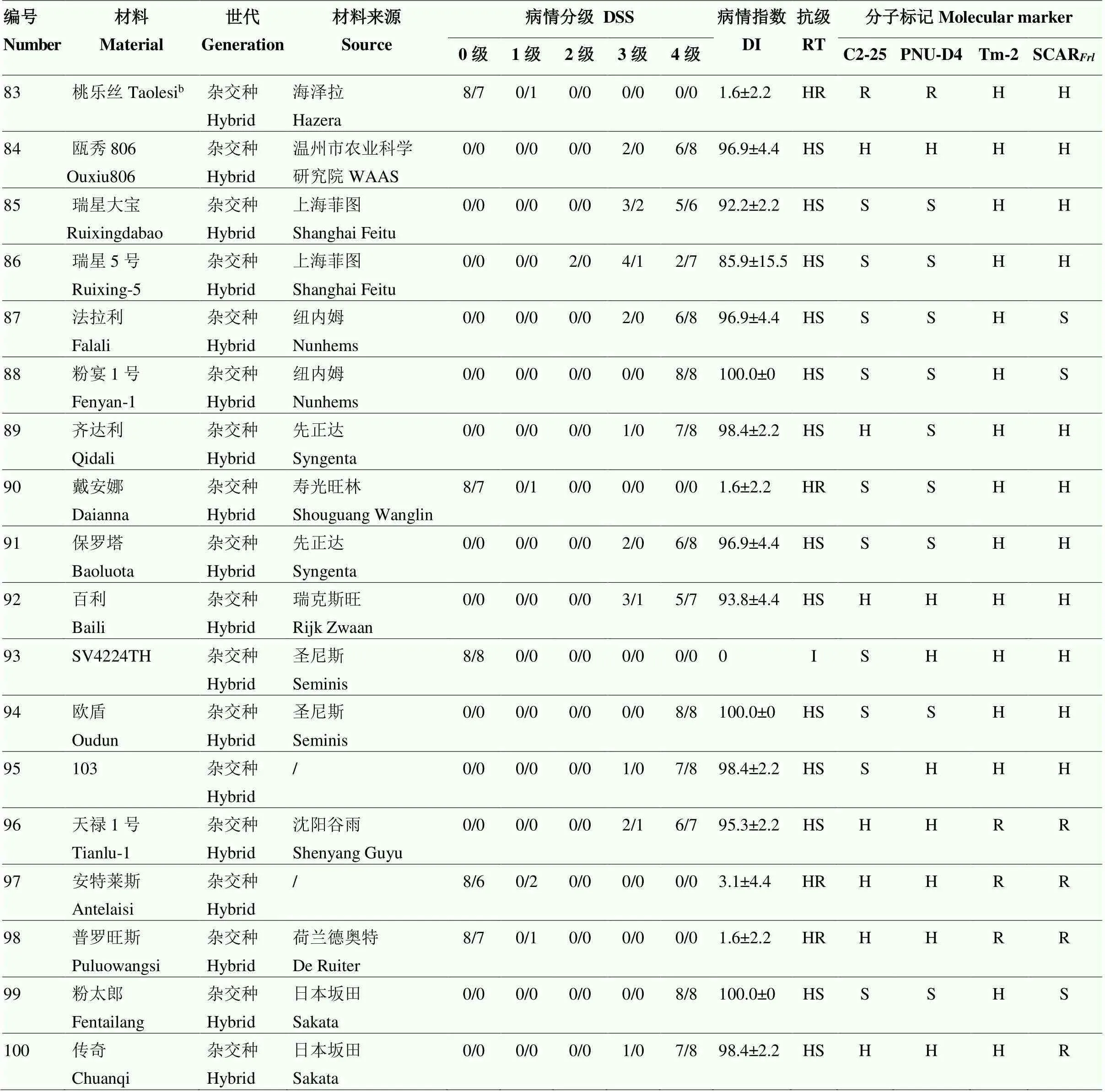
采用苗期人工接种鉴定方法对100份番茄种质材料进行抗颈腐根腐病鉴定,其中高代自交系49份,杂交种51份。接种后4周进行病情分级调查,计算病情指数并确定材料抗性级别。鉴定结果如表3所示,在49份高代自交系材料中,抗病种质有12份,包括来自TGRC含的5份抗源材料LA1791、LA2829、LA3273、LA3292和LA3471,以及课题组筛选的3份砧木材料ZM-4、ZM-6和ZM-7。在51份杂交种中,表现抗病的品种有26份,包括来自伟丽公司的5份砧木以及不同单位或公司选育的商业栽培品种。
2.3 番茄种质资源分子标记检测
对100份番茄种质材料进行分子标记检测(图2),不同标记检测结果与人工接种鉴定结果有所差异。改良C2-25标记准确率为59%,PNU-D4标记的准确率为83%,而改良SCAR标记准确率仅为51%(表3);Tm-2(I)标记检测结果显示,有37份材料携带了纯合,37份材料携带了杂合。
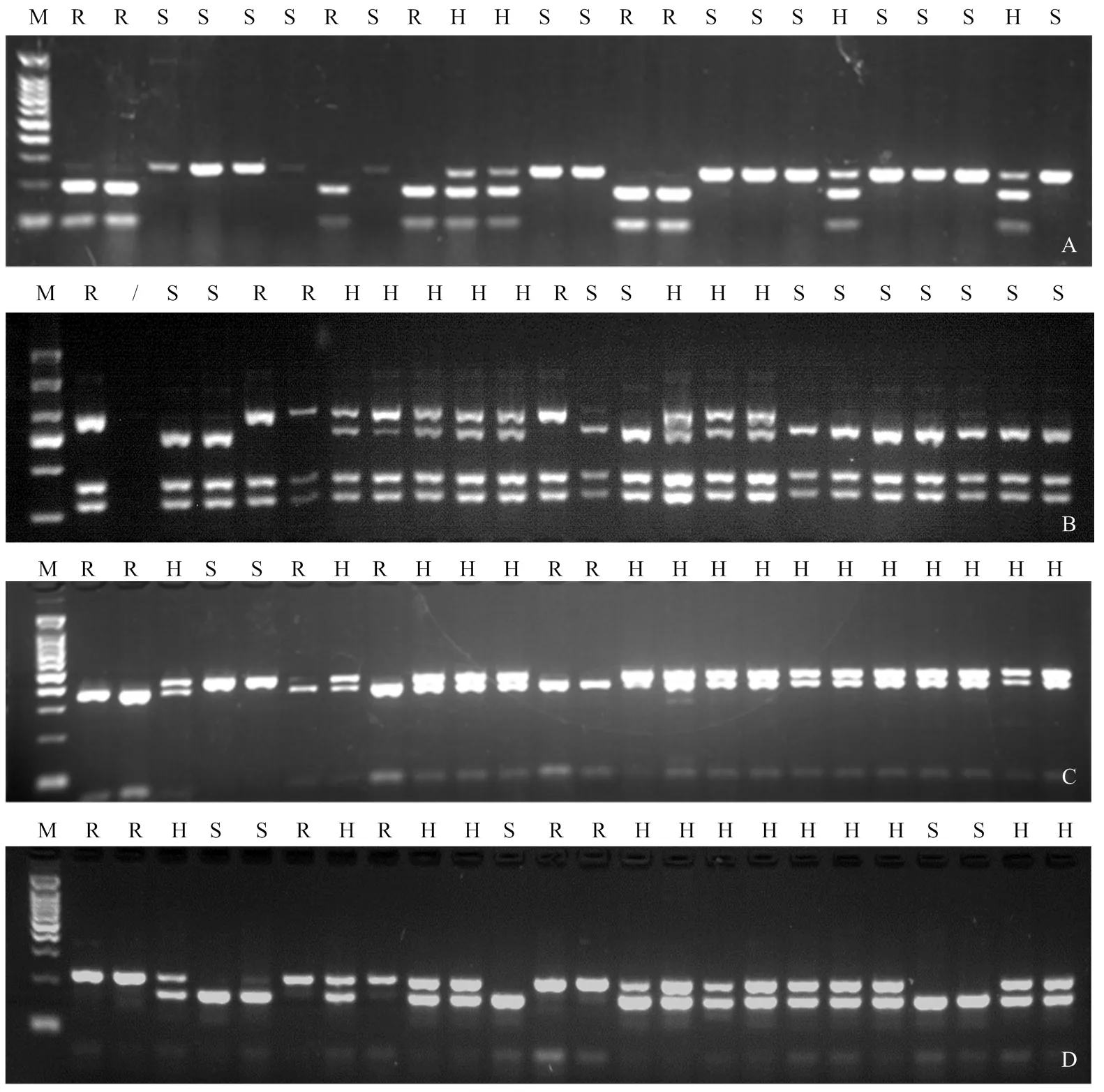
M:DNA ladder,100 bp;R:抗病型resistant;S:感病型susceptible;H:杂合型heterozygous
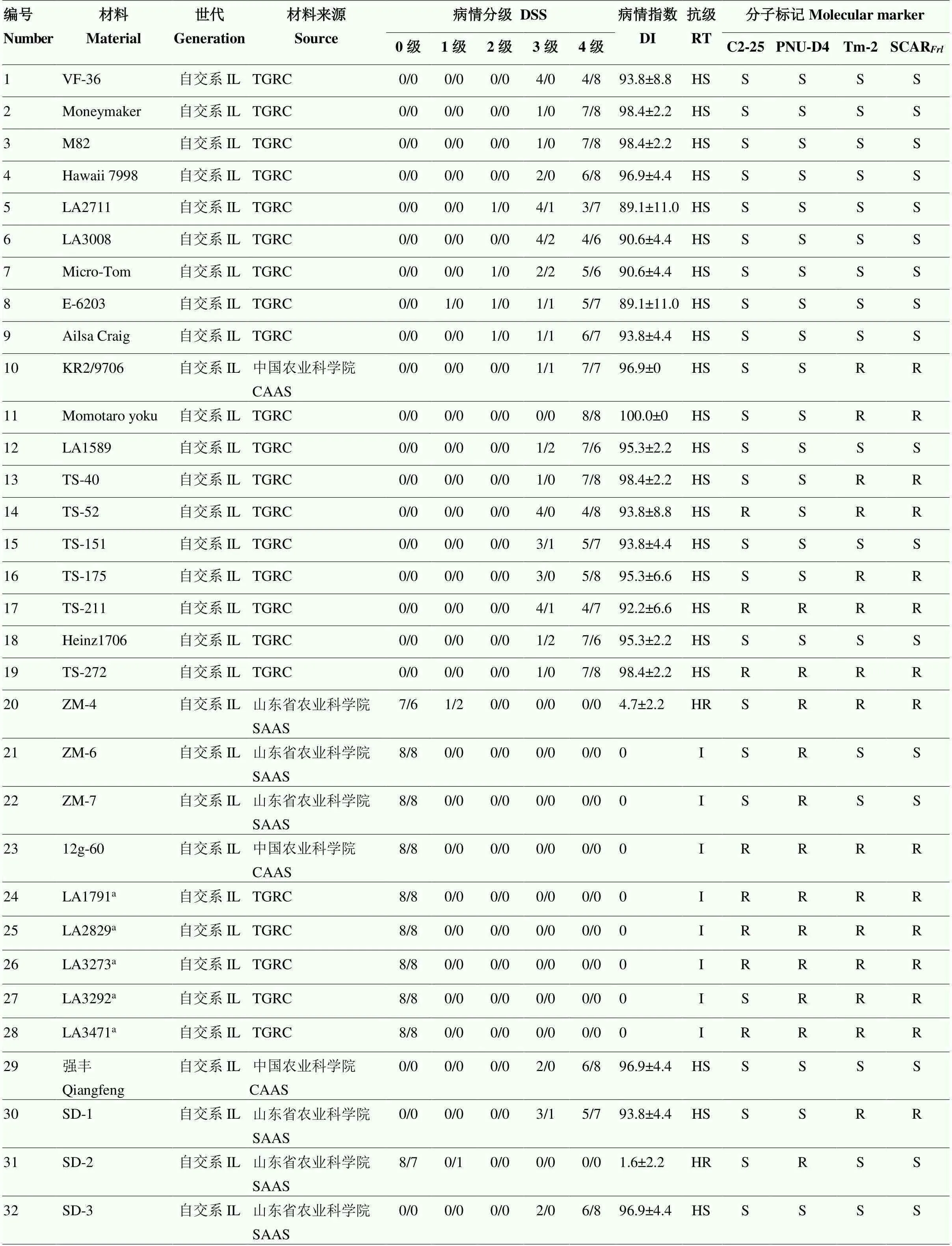
表3 番茄种质资源人工接种鉴定与分子标记检测结果
续表3 Continued table 3
续表3 Continued table 3
续表3 Continued table 3
IL:自交系inbred line;CAAS:中国农业科学院Chinese Academy of Agricultural Sciences;SAAS:山东省农业科学院Shandong Academy of Agricultural Sciences;WAAS:温州市农业科学研究院Wenzhou Academy of Agricultural Sciences;WDT:宛东番茄Wandong Tomato;WLS:伟丽种苗Weili Seeding;
DSS:病情分级Disease-severity scale;DI:病情指数Disease index;RT:抗病等级Resistance type;I:免疫Immune;HR:高抗Highly resistant;R:抗病Resistant;MR:中抗Moderately resistant;S:感病Susceptible;HS:高感Highly susceptible。H:杂合(分子标记一栏)Heterozygous (the column of molecular marker) a:已知含有的抗源材料Resistant material known to contain the;b:生产中已知抗病商业品种Resistant commercial varieties known in production
3 讨论
3.1 番茄颈腐根腐病苗期抗性鉴定技术体系的建立
苗期人工接种鉴定是种质资源抗病性鉴定的重要方法之一,其优点在于可以有效控制环境因子,且保证寄主只被单一病原菌侵染,同时能够避免因病原菌蔓延而造成的生产影响,因此得到育种工作者的普遍重视。本试验结果表明,在一定范围内,随着接种菌液浓度的升高,番茄颈腐根腐病病情指数增加,当菌液浓度为107—108个/mL时接种效果明显,能够真实反映番茄幼苗抗性。考虑到108个/ml的孢子悬浮液制备需大量摇菌,因此接种菌液浓度为107个/ml即可。在番茄2—5叶期,接种颈腐根腐病原菌后均能发病,但差异并不明显,其中2—3叶期接病效果稍好,这可能是幼苗接种苗龄越大,植物本身的抗性越强,病情指数就会越低,并且在调查中发现,接种苗龄越大,发病时间也会随之推迟。另外试验结果表明,在接种病原菌之后的不同温度环境中,番茄颈腐根腐病的发病情况不同。当温度在20℃左右时,番茄颈腐根腐病发生情况较重,表明该病原菌适宜较低的土壤温度[27],这也可能是该病常发生于冬春低温季节的原因之一[11]。采用不同的人工接种方法,番茄颈腐根腐病发病情况有所不同。浸根法和灌根法相较于注射法效果较好,浸根法操作技术要求相对较低,菌液可以多次使用,对菌液量要求少,适合大规模的抗性资源筛选,该方法也是众多研究者普遍使用的接种鉴定方法;而灌根法是在李潇等[14]的基础上进行了改良,对植株根系进行处理后使其存在伤口而更容易被病原菌侵染,该方法省时省力,但对菌液数量要求极大,适合对少量材料进行接种鉴定;注射法操作技术要求较高,且病情指数不同重复间偏差较大,推测可能是因为注射进幼苗茎基部的菌液溢出,导致无法定量每个单株注射的菌液,从而影响试验结果,另外不同操作者产生的效果也可能不同,因此该方法并不适合大批量材料的鉴定。本试验使用苗期人工接种鉴定方法对100份番茄种质材料进行抗颈腐根腐病鉴定,其中有38份材料对番茄颈腐根腐病表现抗性。尽管室内苗期接种鉴定具有诸多优点,但经该方法筛选获得的抗性材料仍需要进一步在田间进行鉴定,以明确其在生产环境中的抗性表现。
3.2 Frl分子标记的应用与分析
分子标记辅助选择技术已成为番茄育种过程中不可或缺的一种辅助手段,可以有效加速育种进程,然而其准确性取决于分子标记与目标基因的连锁程度。国内外研究者在分子标记的开发和应用方面做了很多工作。最初应用于育种筛选的是由C2_At2g38025标记改造的CAPS标记C2-25[18]。程琳等[12]用人工接种鉴定病原菌的方法对25份番茄种质材料进行抗病性鉴定,并使用分子标记C2-25对其进行检测,结果表明人工病原菌接种鉴定结果与分子标记检测结果高度吻合,吻合率达100%。然而在本试验中,该标记的准确率仅为59%,其原因可能在于前人研究试验中所检测的材料均引自荷兰,其遗传背景较为单一,因此分子标记检测结果与人工接种鉴定结果高度吻合。而本试验中的材料为收集保存的自然群体及不同来源的新品种,其遗传背景较为复杂,因此该标记准确率较低。Mutlu等利用抗病材料Fla.7781构建群体,筛选获得了一个SCAR标记SCAR,该标记距离仅0.016 cM,位于9号染色体的61.8 Mb位置[19],与标记C2-25的物理位置较远,然而Kim等[20]验证了标记SCAR在43份商品种中准确率不到45%,与本试验中该标记51%的准确率较为相近。Kim等筛选的标记PNU-D4,在F2群体及60份商品种番茄中的准确率分别为92.8%和90%[20],在本试验中该标记的准确率为83%,可用于番茄抗颈腐根腐病的分子标记辅助选择。
研究表明番茄抗烟草花叶病毒基因与紧密连锁[16],在本试验鉴定的38份抗颈腐根腐病的材料中,有31份同时携带,这些材料可用于番茄抗病育种或商业生产。另有研究表明较早应用到抗病育种中的秘鲁番茄PI128650同时携带抗病基因和,研究者对300多份栽培番茄材料基因组重测序,通过与PI128650基因组相似性比较发现,其中20个个体携带有秘鲁番茄9号染色体长约51.7—54.7 Mb的部分片段,该外源野生片段占据了番茄9号染色体的大部分区域[28]。由于野生番茄和栽培种番茄存在结构变异[29-30],在长期的自交和回交育种过程中,该外源片段依旧没有完全被打断。而在本试验中,标记Tm-2和标记SCAR的分析结果中二者的吻合率为92%,表明该染色体区间紧密连锁,这与前人的研究结果一致。
到目前为止,对于的定位和分子标记的应用,不同研究者的结果并不一致,特别是不同标记在商品种中验证的准确率往往有很大差别,其原因可能在于不同商品种的遗传背景不同,不同研究者所检测的商品种来源不一,其遗传背景在很大程度上会影响标记的准确率。另外,在本次鉴定的100份材料中,有12份材料(TS-211、TS-272、SD-16、Ah2001、Ah2003、Ah2013、金棚8号、飞跃、瓯秀806、百利、天禄1号、传奇)人工接种鉴定结果均为高感,而分子标记检测均为抗病,其原因除了遗传背景差异造成的影响外,还可能在于外源野生片段在转育到栽培种的过程中,该基因内部发生某些突变导致功能丧失,而本研究中所使用的标记均为连锁标记,因此二者鉴定结果不吻合。只有开发基因内部的功能标记才能提高选择效率,因此该基因的定位克隆及分子标记辅助育种研究仍是当前亟待解决的重大科学和生产实际问题。
4 结论
建立了适用于大批量番茄颈腐根腐病苗期抗性鉴定的技术,即当番茄长至2—3片真叶时,使用浓度为107—108个/mL的病原菌孢子悬浮液,采用浸根法进行接种,接种后管理温度为20℃左右,4周后调查发病情况。同时,对收集的100份番茄材料进行了接种鉴定及分子标记分析,明确了其抗性,这些材料可用于番茄抗颈腐根腐病育种或生产。
致谢:感谢中国农业科学院蔬菜花卉研究所、宛东番茄科技(广州)有限公司、山东伟丽种苗有限公司提供的部分资源材料。
[1] JARVIS W R, SHOEMAKER R A. Taxonomic status ofcausing foot and root rot of tomato. Phytopathology, 1978, 68: 1679-1680.
[2] SZCZECHURA W, STANIASZEK M, HABDAS H.f. sp.——the cause of fusarium crown and root rot in tomato cultivation. Journal of Plant Protection Research, 2013, 53(2): 172-176.
[3] SONODA R M. The occurrence of a Fusarium root rot of tomatoes in South Florida. Plant Disease Reporter, 1976, 60(3): 271-274.
[4] KRIKUN J, NACHMIAS A, COHN R, LAHKIM-TSROR L. The occurrence of Fusarium crown and root rot of tomato in Israel. Phytoparasitica, 1982, 10(2): 113-115.
[5] BRAMMALL R. Occurrence of fusarium crown and root rot of tomato in New Brunswick, Canada. Plant Disease, 1990, 74(12): 24-28.
[6] MCGOVERN R J, VAVRINA C S, NOLING J W, DATNOFF L A, YONCE H D. Evaluation of application methods of metam sodium for management of Fusarium crown and root rot in tomato in Southwest Florida. Plant Disease, 1998, 82(8): 919-923.
[7] CAN C, YUCEL S, KOROLEV N, KATAN T. First report of fusarium crown and root rot of tomato caused byf. sp.in Turkey. Plant Pathology, 2004, 53(6): 814.
[8] MALATTRAKIS N E. Tomato crown and root rot caused byf. sp.in Greece. Plant Pathology, 1985, 34(3): 438-439.
[9] JARVIS W R, THORPE H J, MELOCHE R B. Survey of greenhouse management practices in Essex County, Ontario, in relation to Fusarium foot and root rot of tomato. Plant Disease, 1983, 67(1): 38-40.
[10] KIM J T, PARK I H, HAHM Y, YU S H. Crown and root rot of greenhouse tomato caused byf. spin Korea. Plant Pathology Journal, 2001, 17(5): 290-294.
[11] 耿丽华, 李常保, 迟胜起, 王丽君, 柴敏. 番茄颈腐根腐病病原鉴定及不同条件对其生长的影响. 植物病理学报, 2012, 42(5): 449-455.
GENG L H, LI C B, CHI S Q, WANG L J, ChAI M. Identification of the pathogen causing Fusarium crown and root rot of tomato and its growth affecting factors. Acta Phytopathologica Sinica, 2012, 42(5): 449-455. (in Chinese)
[12] 程琳, 张生, 李艳青, 陈福东, 程斐, 张晓艳, 董甜, 国家进. 番茄颈腐根腐病病原菌鉴定与抗病种质材料的筛选. 园艺学报, 2016, 43(4): 781-788.
CHENG L, ZHANG S, LI Y Q, CHEN F D, CHENG F, ZHANG X Y, DONG T, GUO J J. Pathogen identification of fusarium crown root rot and screening for resistant sources in tomato. Acta Horticulturae Sinica, 2016, 43(4): 781-788. (in Chinese)
[13] 张尚卿, 韩晓清, 缪作清, 吴志会, 张立娇. 番茄颈腐根腐病病原鉴定及2种接种方法的评价. 华北农学报, 2017, 32(5): 124-129.
ZHANG S Q, HAN X Q, MIU Z Q, WU Z H, ZHANG L J. Pathogen identification and two inoculation methods of fusarium crown and root rot. Acta Agriculturae Boreali-Sinica, 2017, 32(5): 124-129. (in Chinese)
[14] 李潇, 李雪萍, 漆永红, 郭成, 李敏权. 番茄颈腐根腐病病原鉴定及其品种抗性鉴定. 甘肃农业大学学报, 2019, 54(5): 121-127.
LI X, LI X P, QI Y H, GUO C, LI M Q. Identification and variety resistance of the pathogen of tomato crown and root rot. Journal of Gansu agricultural university, 2019, 54(5): 121-127. (in Chinese)
[15] 王家哲, 任平, 张锋, 洪波, 常青, 刘晨, 杨艺炜, 王远征, 李英梅, 付博. 温室大棚番茄颈腐根腐病病原菌的分离鉴定//中国植物保护学会2019年学术年会论文集, 2019: 68-73.
WANG J Z, REN P, ZHANG F, HONG B, CHANG Q, LIU C, YANG Y W, WANG Y Z, LI Y M, FU B. Isolation and identification of the pathogen of Fusarium crown and root rot of tomato in greenhouse// Proceedings of the 2019 annual meeting of the Chinese society of plant protection, 2019: 68-73. (in Chinese)
[16] VAKALOUNAKIS D J, LATERROT H, MORETTI A, LIGOXIGAKIS E K, SMARDAS K. Linkage between(f. sp.resistance) and(tobacco mosaic virus resistance-2) loci in tomato (). Annals of Applied Biology, 1997, 130(2): 319-323.
[17] FAZIO G, STEVENS M R, SCOTT J W. Identification of RAPD markers linked to fusarium crown and root rot resistance () in tomato. Euphytica, 1999, 105(3): 205-210.
[18] STANIASZEK M, SZCZECHURA W, MARCZEWSKI W. Identification of a new molecular marker C2-25 linked to thef. sp.resistancegene in tomato. Czech Journal of Genetics and Plant Breeding, 2014, 50(4): 285-287.
[19] MUTLU N, DEMIRELLI A, ILBI H, IKTEN C. Development of co-dominant SCAR markers linked to resistant gene against thef. sp.. Theoretical and Applied Genetics, 2015, 128(9): 1791-1798.
[20] KIM B, KIM N, KIM J Y, KIM B S, JUNG H J, HWANG I, NOUA I S, SIM S C, PARK Y. Development of a high-resolution melting marker for selecting Fusarium crown and root rot resistance in tomato. Genome, 2016, 59(3): 173-183.
[21] DEVRAN Z, KAHCECI E, HONG Y, STUDHOLME D J, TOR M. Identifying molecular markers suitable forselection in tomato breeding. Theoretical and Applied Genetics, 2018, 131(10): 2099-2105.
[22] 刘蕾, 王辉. 番茄颈腐根腐病病原菌及抗病育种研究进展. 长江蔬菜, 2016(6): 35-37.
LIU L, WANG H. Research progress of tomato fusarium crown and root rot pathogen and resistance breeding. Journal of Changjiang Vegetables, 2016(6): 35-37. (in Chinese)
[23] 李景富, 孙亚莉, 赵婷婷, 姜景彬, 许向阳. 番茄颈腐根腐病菌分离鉴定与生物学特性研究. 东北农业大学学报, 2018, 49(2): 22-30.
LI J F, SUN Y L, ZHAO T T, JIANG J B, XU X Y. Separation identification and biological characteristics of pathogen causing Fusarium crown and root rot of tomato. Journal of Northeast Agricultural University, 2018, 49(2): 22-30. (in Chinese)
[24] 刘蕾, 王辉, 李文丽, 王富. 与番茄颈腐根腐病抗病基因连锁的标记及应用. 江苏农业科学, 2018, 46(16): 91-93.
LIU L, WANG H, LI W L, WANG F. Application of the linkage markers with thegene conferring resistance to fusarium crown and root rot in tomato. Jiangsu Agricultural Sciences, 2018, 46(16): 91-93. (in Chinese)
[25] 杜建峰, 吴伟, 张晓英, 李洋, 丁新华. 番茄颈腐根腐病的发生及其防治研究进展. 生物技术通报, 2020, 36(10): 200-206.
DU J F, WU W, ZHANG X Y, LI Y, DING X H. Research progress on the occurrence and control of fusarium crown and root rot of tomato. Biotechnology bulletin, 2020, 36(10): 200-206. (in Chinese)
[26] 姜景彬, 许向阳, 孙亚莉, 李景富, 张贺, 杨欢欢, 赵婷婷. 一种番茄茎腐根腐病苗期快速接种鉴定方法: CN108841916A[P] (2018-11-20) [2021-07-23].
JIANG J B, XU X Y, SUN Y L, LI J F, ZHANG H, YANG H H, ZHAO T T.A method for rapid inoculation identification of Fusarium crown and root rot in tomato seedlings: CN108841916A[P] (2018-11- 20) [2021-07-23]. (in Chinese)
[27] MENZIES J G, KOVH C, SEYWERD F. Additions to the host range off. sp.. Plant Disease, 1990, 74(8): 569-572.
[28] LIN T, ZHU G, ZHANG J, XU X, YU Q, ZHENG Z, ZHANG Z, LUN Y, LI S, WANG X,. Genomic analyses provide insights into the history of tomato breeding. Nature Genetics, 2014, 46(11): 1220-1226.
[29] SEAH S, YAGHOOBI J, ROSSI M, GLEASON C A, WILLIAMSON V M. The nematode-resistance gene,, is associated with an inverted chromosomal segment in susceptible compared to resistant tomato. Theoretical and Applied Genetics, 2004, 108(8): 1635-1642.
[30] JI Y, SCHUSTER D J, SCOTT J W., a begomovirus resistance locus near the tomato yellow leaf curl virus resistance locuson chromosome 6 of tomato. Molecular Breeding, 2007, 20(3): 271-284.
Development of artificial inoculation methodology for evaluation of resistance to Fusarium crown and root rot and screening of resistance sources in tomato
WANG MengRui1,2, LIU ShuMei1, HOU LiXia1, WANG ShiHui1, LÜ HongJun1, SU XiaoMei1
1Institute of Vegetables, Shandong Academy of Agricultural Sciences/Shandong Province Key Laboratory for Biology of Greenhouse Vegetables/Shandong Branch of National Improvement Center for Vegetables/Huanghuai Region Scientific Observation and Experimental Station of Vegetables (Shandong), Ministry of Agriculture and Rural Affairs, Ji’nan 250100;2College of Horticulture, China Agricultural University, Beijing 100193
】The objective of this study is to explore the resistance identification technology of Fusarium crown and root rot (FCRR), carry out the resistance identification and analysis of tomato germplasm resources and varieties, enrich the available tomato resources resistant to FCRR, and to lay the foundation for the cultivation of tomato varieties that resistant to FCRR.【】In the present study, four parameters that influence the inoculation effect including inoculum concentration, seedlings stage, environmental temperature and inoculation methods were studied using susceptible line Heinz 1706 infected withf. sp.(Forl). Subsequently, 100 tomato materials were identified through artificial inoculation at seedling stage as well as the molecular markers linked to the resistance gene.【】The disease incidence and disease index of FCRR increased in a certain range along with the increase of inoculum concentration, and the actual levels of plant resistance could be revealed with the inoculum of 107spores/mL, for which the disease incidence and disease index were 100% and 89.2, respectively. The disease index was not significantly different among different seedling ages when the host was inoculated at 2 to 5 leaf stage. The effects of different environmental temperatures after inoculation on the disease index of FCRR were significantly different and the lower temperature (20℃) condition was more favorable to the occurrence of FCRR.The incidence and disease indexwere higher and the effect was stable using root dipping and root irrigation methods, which were significantly better than stem injection. The result of inoculation identification suggested that 38 materials showed resistance to FCRR among 100 tomato materials, which could be used for breeding or production in tomato for FCRR resistance. In addition, among the reported markers linked to, SCARhas the lowest accuracy of 51%, while C2-25 has the accuracy of 59% and the accuracy of PNU-D4 is 83%, which is expected to be used in marker-assisted selection (MAS) for FCRR resistance.【】The established assessment system can identify levels of the resistance to FCRR in tomato seedlings, which can be used for identification and screening of tomato materials.
tomato; Fusarium crown and root rot (FCRR); resistance identification; molecular marker

10.3864/j.issn.0578-1752.2022.04.007
2021-07-23;
2021-08-28
山东省自然科学基金(ZR2020QC152)、国家现代农业产业技术体系建设专项(CARS-23-G13)、山东省农业良种工程(2020LZGC005)
王梦蕊,E-mail:wangmr151@qq.com。刘淑梅,E-mail:lsmei78@126.com。王梦蕊和刘淑梅为同等贡献作者。通信作者苏晓梅,Tel:0531-66659184;E-mail:sxm198846@126.com
(责任编辑 岳梅)

