微RNA介导巨噬细胞极化的转录后调控
贾 瑞, 闫曙光, 惠 毅
(1)陕西中医药大学基础医学院方剂教研室,陕西 咸阳 712046;2)陕西中医药大学陕西省胃肠病证方药重点研究室,陕西 咸阳 712046; 3)陕西中医药大学基础医学院温病教研室,陕西 咸阳 712046)
巨噬细胞是免疫系统的重要组成部分,作为人体的第一道防线,它通过吞噬衰老、坏死细胞及外来入侵物和/或释放不同介质(例如细胞因子、趋化因子和蛋白酶)来诱导炎症,以清除病原体或修复受损组织,从而维持宿主稳态。巨噬细胞通过感知组织受损情况,表现出特定功能表型,这种对遇到的微环境刺激和信号做出反应的过程称为巨噬细胞极化[1]。巨噬细胞极化一般分为经典激活的M1型巨噬细胞(classically activated macrophage,M1)和替代激活的M2型巨噬细胞(alternative activated macrophage,M2)。虽然此二分法对于极化这个动态过程过于片面,但为便于区分表型,此分类方法目前仍广泛适用。M1型巨噬细胞通常由辅助性T细胞1型(T helper lymphocyte 1,Th1)细胞因子诱导,产生和分泌高水平的促炎细胞因子:肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6等,M1巨噬细胞介导组织损伤并启动炎症反应,损害组织再生和伤口愈合,且M1巨噬细胞对癌细胞具有细胞毒活性,介导对肿瘤的耐药性[2]。M2巨噬细胞由Th2相关细胞因子诱导极化,具有抑制炎症反应,促进组织修复和伤口愈合,清除寄生虫感染,促进肿瘤发生发展的功能[3]。巨噬细胞是炎症的关键协调者,巨噬细胞极化也被认为是组织内稳态和病理的重要调节器,是疾病发展或消退的关键决定因素[4]。因此,了解调控巨噬细胞极化的机制是治疗疾病过程中极其重要的一环。
微RNA(microRNA,miRNA)是一种长度约22~26 个核苷酸的小内源性非编码RNA,通过与mRNAs的3′非翻译区(3′ untranslated region,3′ UTR)的直接互补序列结合,控制转录后基因沉默,从而针对它们进行翻译抑制或降解[5]。miRNAs几乎涉及发育、细胞分化、免疫调节和致病条件等生物学过程的各方面。miRNAs调控的特点是其积极参与并严格控制负反馈环。现已被证明,其在巨噬细胞极化和炎症及癌症的发展中发挥关键调节作用[6]。到目前为止,已在人类基因组中鉴定出2000 多个miRNAs,但与巨噬细胞极化有关的仍是少数。本文综述近年来已经被发现和证实对巨噬细胞极化具有调控作用的miRNAs,探讨其在巨噬细胞极化中的种类及作用机制,借此为相关疾病的治疗提供理论支撑。
1 调控巨噬细胞向M1型极化的微RNAs
巨噬细胞极化的转录调控是近年来的研究焦点。转录因子是决定特定基因表达的关键分子,在巨噬细胞中受到多种信号分子的密切调控[5]。miRNAs通过靶向信号网络中的不同转录因子来调控巨噬细胞极化,参与炎症及肿瘤发病机制。例如,过氧化物酶体增殖物激活受体(peroxisome proliferator activated receptors,PPARs)、信号转导和转录激活因子(signal transducers and activators of transcription,STATs)、CCAAT增强子结合蛋白(CCAAT enhancer binding proteins,C/EBPs)、干扰素调节因子(interferon regulatory factor,IRF)、Kruppel样因子(kruppel-like factors,KLFs)、GATA结合蛋白3(GATA binding protein 3,GATA3)、核转录因子κB(nuclear transcription factor kappa-B,NF-κB)等。其中,STAT1、STAT3、C/EBP-α、C/EBP-δ和NF-κB是参与M1巨噬细胞极化的重要转录因子。miRNAs通过调控这些转录因子从而影响巨噬细胞向M1型极化。另外,有一些新型调节因子也参与调节M1巨噬细胞极化过程。
最具特征性的促炎性miRNA是miR-155,这表现在感染或其他炎症过程中巨噬细胞的迅速增加。这些过程的特点是刺激IL-1a、IL-1b、TNF-α和干扰素γ(interferon-γ,IFN-γ)产生。同时,被抗炎因子例如,IL-10、转化生长因子β(transforming growth factor β,TGF-β)和糖皮质激素抑制[7]。STAT蛋白家族成员是介导巨噬细胞M1/M2极化的关键转录因子。其中,STAT6是M2巨噬细胞极化的关键转录因子。而研究表明,miR-155可以靶向IL-13受体α1(IL-13Rα1)抑制STAT6激活并抑制M2极化[8]。C/EBP家族成员在激活巨噬细胞方面发挥关键作用。miR-155通过靶向C/EBPβ降低精氨酸1 (arginine 1,Arg-1)表达,从而抑制M2极化[9]。研究发现,在动脉粥样硬化载脂蛋白E(apolipoprotein E,APOE)敲除小鼠模型中,当miR-155水平被抑制时,斑块的形成和浸润的巨噬细胞数量减少[10],下调miR-155可降低动脉粥样硬化斑块的尺寸[11],其作用机制可通过调节细胞因子信号转导抑制因子1-信号转导,以及转录激活因子3-程序性细胞死亡4(suppressor of cytokine signaling 1-STAT3-programmed cell death 4,SOCS1-STAT3- PDCD4)通路来解释[12]。在实验性结肠炎的小鼠模型中发现,miR-155表达上调且显著促进M1型巨噬细胞细胞因子分泌,包括IL-6、TNF-α、IL-1β和IFN-γ。促炎机制是通过抑制SRC同源物2含结构域的肌醇5′-磷酸酶-1 (src homology 2 domain-containing inositol 5′-phosphatase-1,SHIP-1)表达,从而加重实验性结肠炎[13]。miR-155在促进炎症方面的作用还体现在其抑制肌醇多磷酸-5-磷酸酶 (inositol polyphosphate-5-phosphatase,145 kD,INPP5D),INPP5D是PI3K/AKT通路的一种抑制剂,是传递Toll样受体4(toll-like receptor 4,TLR4)(M1极化驱动因子)信号所必需的[7]。此外,临床上观察到溃疡性结肠炎患者结肠黏膜中miR-155表达上调[14],虽然目前只是现象性指标,但其提示,可将miR-155介导的M1巨噬细胞极化作为治疗炎症性肠病的一个重要手段。miR-155既是促炎信号的靶标,又是炎症的启动者,对M1极化有重要影响。众多研究证明,miR-155表达上调在各种炎症性疾病中是一个重要信号。一些临床试验将其作为炎症的生物标志物,未来可以考虑使用miR-155抑制剂作为炎症性疾病的干预手段。
肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)具有亲肿瘤M2样表型,可促进肿瘤生长、血管生成和转移。近期一项研究表明[15],层状双氢氧化物(layered double hydroxides,LDHs)是一种纳米载体,载有miR155的LDH纳米材料(LDH @ 155)通过显著降低磷酸化STAT3的表达水平,并激活TAMs中NF-κB的表达,将TAM重新极化为抗肿瘤M1巨噬细胞。此结果提示,miRNA搭载纳米材料在未来将成为癌症联合免疫治疗的一种有前途的药物。
miR-9是唯一一种由脂多糖(lipopolysaccharide,LPS)以髓样分化因子(myeloid differentiation primary response 88,MyD88)和NF-κB依赖的方式,在单核细胞中持续诱导的miRNA[16],对癌症生长、转移、免疫和放射敏感性至关重要[17]。PPARδ是配体激活的核激素受体超家族转录因子的成员之一,在巨噬细胞中高表达,在炎症和癌症发展中发挥重要作用[18]。miR-9被证明通过靶向PPARδ,阻止蛋白B细胞淋巴瘤-6(B-cell lymphoma-6,Bcl-6)(一种抗炎转录抑制因子)介导的抗炎作用,从而促进M1极化[19]。头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是全球第6大最常见的癌症[20]。人乳头状瘤病毒(human papillomavirus,HPV)被认为是HNSCC肿瘤发生的重要病因。最近一项研究[21]证实,来自HPV + HNSCC衍生的外泌体miR-9,通过下调PPARδ并上调诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)表达,促进巨噬细胞极化为M1表型,并增加HPV + HNSCC的放射敏感性。这提示,miR-9可用作HNSCC的潜在治疗方法。另外,在多种类固醇耐药气道高反应性模型中,IFN-γ和LPS协同作用会上调肺巨噬细胞中miR-9表达,且抑制miR-9可减少促炎因子分泌,恢复类固醇敏感性并抑制气道高反应炎症[22]。而Cao等[23]发现,单独使用LPS刺激巨噬细胞,也会出现上述结果。其机制为上调沉默信号调控因子1(silent signal regulator 1, SIRT1(miR-9的靶基因))后,NF-κB通路被抑制,从而减轻LPS所致的炎症。另据报道,miR-9介导的双特异性磷酸酶-6(dual specificity phosphatase-6,Dusp6)下调,以及细胞外调节蛋白激酶1 (extracellular regulatory protein kinase 1,ERK1)介导的信号转导增强了巨噬细胞的经典激活[24],这也提示,miR-9可能具有保持巨噬细胞处于M1极化状态的作用。
miR-125b是一种在巨噬细胞中高表达的miRNA,已被证实能通过靶向干扰素调节因子4 (interferon regulatory factor 4,IRF4)增强巨噬细胞对M1诱导剂IFN-γ的应答,从而促进M1巨噬细胞极化[25]。最近的一项研究发现[26],1,25-二羟基维生素D (1,25-dihydroxy vitamin D,1,25(OH)2D3)通过抑制miR-125b的表达,将M1巨噬细胞转化为M2亚型,抑制IRF5磷酸化,并增加固有层单核细胞中IRF4表达,进而改善实验性炎症性肠病,其下调miR-125b表达能抑制巨噬细胞向M1型极化。在遗传相关的非小细胞肺癌模型中,通过腹腔注射包裹miR-125b的透明质酸纳米颗粒,将TAMs重新编程为抗肿瘤/促炎的M1表型[27]。一些外切体miRNAs被用作癌症的诊断标记物。例如,Talekar等[28]发现,miR-125b和p53编码质粒的联合治疗,导致M1巨噬细胞表达在体外和体内升高。更重要的是,外切体中改变miR-125b水平会介导巨噬细胞向更有利于抗肿瘤M1表型的复极化[29]。在治疗肿瘤时,一些化疗药物与miRNA联合使用,可能会增强抗肿瘤效果,提高药物疗效。
综上所述,miR-155、miR-9和miR-125b可以通过调控多种转录因子来促进M1经典巨噬细胞极化,从而增强促炎反应和抗肿瘤特性。
2 调控巨噬细胞向M2型极化的微RNAs
miRNAs通过调节PPARγ、STAT3、C/EBP-δ、IRF4和KLF4等转录因子促进巨噬细胞向M2型极化。以下将展开具体介绍。
miR-124是体外和体内M2巨噬细胞极化的调节器。Sun等[30]观察到,在LPS刺激的小鼠和巨噬细胞中, miR-124被胆碱能激动剂上调,miR-124模拟物在RAW 264.7细胞中的转染,导致TNF-α和IL-6产生减少。作者进一步确定,这是通过miR-124直接靶向STAT3和TNF-α转换酶发挥的作用。与其类似,Veremeyko等[31]观察到,在IL-4和IL-13处理的巨噬细胞中,miR-124表达均被上调,而敲低miR-124则会抑制M2标记物(CD206)表达,并增强M1标记物(CD86、iNOS、TNF)表达。这些研究均提示,miR-124具有促进巨噬细胞M2型极化,增强抗炎的作用。Li和其同事[32]发现,骨髓间充质干细胞来源的外切体中的miR-124-3p,能通过耗尽内质网到核信号转导1(endoplasmic reticulum to nucleus signaling 1,Ern1)增强M2极化,从而减轻脊髓缺血再灌注损伤(spinal cord ischemia-reperfusion injury,SCIRI)诱导的神经损伤。这被认为是治疗SCIRI的新靶点。miR-124是最丰富的脑特异性miRNA。Taj等[33]首次发现,卒中(48 h、第6 d、第10 d、第14 d)后,脑内注射miR-124,小胶质细胞/巨噬细胞由促炎表型逐渐转变为M2抗炎表型,同时M1表型减少,改变促/抗炎平衡,其机制主要是作用于C/EBP-α及其下游靶标PU.1。这表明,在脑内应用miR-124的治疗方式,将会增加卒中亚急性期的康复几率。胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)是一种高破坏性的癌症,Geng等[34]发现, miR-124通过直接靶向Notch配体Jagged 1(JAG1)抑制胰腺癌转移,正是取决于TAMs在胰腺导管腺癌中的参与。该团队进一步证明,活化的巨噬细胞通过IL-6/STAT3信号传导促进胰腺癌细胞侵袭和抑制miR-124表达,表明胰腺癌细胞和巨噬细胞之间存在Notch信号依赖的串扰。而miRNA介导这种调节机制,这为胰腺导管腺癌提供了潜在治疗靶点和坚实的临床依据。
miR-223是一种进化上保守的抗炎miRNA,在炎症、细胞增殖和肿瘤调控中发挥重要作用,参与M2巨噬细胞极化。据报道,RAW264.7巨噬细胞中miR-223的过表达可通过靶向STAT3进而抑制LPS刺激的IL-6和IL-1β的释放[35]。miR-223还能负向调节NF-κB和MAPK信号通路激活,从而降低M1巨噬细胞炎性因子的分泌[36]。PBX/同源盒蛋白1(pbx/knotted 1 homeobox,Pknox1)是巨噬细胞中miR-223真正的靶基因,miR-223通过直接靶向Pknox1,抑制M1表达,促进巨噬细胞向M2抗炎表型极化,不仅可减少高脂饮食诱导的炎症[37],还对病毒性心肌炎发挥保护作用[38]。Wei等人最近证实,miR-223两个新的靶基因:活化T细胞的核因子5(nuclear factor of activated T-cells 5,NFAT5)[39]和RAS p21蛋白激活剂1 (RAS p21 protein activator 1,RASA1)[40],其研究结果表明[41],miR-223及这2个靶基因是PPARγ介导的调节M2替代激活巨噬细胞的重要介质,PPARγ在控制巨噬细胞双向极化、抑制经典M1激活和促进替代M2巨噬细胞反应中发挥关键作用,这为靶向miR-223的治疗策略提供了新基因靶点。宫颈癌是由高危型HPV持续感染所致,Zhang等[42]报道了控制宫颈癌发生的新途径:STAT3- miR-223- 人转化生长因子β受体3(transforming growth factor beta receptor 3,TGFBR3)/羟甲基戊二酰辅酶A合酶重组蛋白 (recombinant hydroxy methyl glutaryl coenzyme A synth 1,HMGCS1)轴。研究发现,miR-223在STAT3介导下在宫颈肿瘤组织中高表达,而TGFBR3或HMGCS1表达明显下调,miR-223靶向TGFBR3和HMGCS1的3′ UTR并抑制其表达,导致体内外宫颈鳞状细胞癌肿瘤生长增加,而抑制miR-223表达则会有效抑制肿瘤生长,这为宫颈癌的治疗提供了一种新的思路和机制。
miRNA let-7c是最丰富和高度保守的miRNAs之一,参与调节巨噬细胞极化。据报道,miRNA let-7c通过靶向p21激活激酶1(p21-activated kinase 1,PAK1)能促进M2表型,miRNA let-7c模拟物可作为一种潜在的治疗剂,用于治疗髓样PAK1在LPS诱导的脓毒症和炎症中过度活化[43]。最近,Banerjee等发现,miRNA let-7c的过表达降低M1型细胞因子(IL-12和iNOS)的表达,并通过靶向C/EBP-δ导致小鼠骨髓来源的巨噬细胞具有更多的M2表型,其特征是Arg1、FIZZ1和YM-1的表达增加。相反,敲除M2巨噬细胞中的miRNA let-7c导致M2标记物的下调和M1标记物的上调[44]。这说明miRNA let-7c具有促进M2表型的能力。miRNA let-7c-5p是miRNA let-7c家族的一个关键成员,Lv等研究表明,miRNA let-7c-5p在成年C57BL/6小鼠大脑的创伤性损伤病灶中迅速降低,后注射miRNA let-7c-5p模拟物上调小鼠脑组织中miRNA let-7c-5p表达,发现miRNA let-7c-5p过表达可减轻创伤性脑损伤诱导的神经炎症,机制之一正是由于miRNA let-7c-5p抑制M1巨噬细胞表达,增强M2极化。这提示miRNA let-7c-5p参与创伤性脑损伤后的病理过程,有可能成为其潜在治疗靶点[45]。肌肉浸润性膀胱尿路上皮癌(muscle-invasive bladder urothelial carcinoma,MIBC)具有高死亡率和高复发率特点,目前,很少有在分子水平上区分MIBC的预后风险。近期有学者分析了MIBC中上皮间质转化(epithelial mesenchymal transition,EMT)评分和免疫浸润丰度,发现miRNA let-7c表达值与肿瘤组织中的EMT得分和巨噬细胞的丰度相关,证明可将miRNA let-7c作为一种新型生物标志物来预测MIBC的预后[46]。
综上所述,miR-124、miR-223、miRNA let-7c在不同炎症性疾病促进巨噬细胞向M2型极化,从而发挥抗炎作用,而在癌症中通过采用此类miRNA抑制剂不失为治疗肿瘤的一条可行途径。
3 在调控巨噬细胞极化过程中功能尚不确定的微RNAs
在调控巨噬细胞M1/M2极化的过程中,也存在一些具有争议,功能尚不十分确定,甚至具有双向调控作用的miRNAs参与炎症及肿瘤的发病机制。
关于miR-127的作用具有不同报道。Ying等[47]认为,miR-127能促进M1巨噬细胞的发育,并同时抑制M2标记基因的转录,其机制在于,miR-127通过下调Bcl6表达,降低Dusp1表达水平,增强JNK活化和促炎性M1巨噬细胞的发育,拮抗剂抑制miR-127可将巨噬细胞重编程为M2表型,进而保护小鼠免受肺部和系统性炎症性疾病的侵害。
另外,miR-127也具有抗炎功能。Fc受体(Fc receptors,FcγRs)被认为是重要的免疫调节受体,参与过敏、自身免疫和炎症等多种疾病过程,尤其是免疫球蛋白(immunoglobulin,Ig)介导的人类疾病,FcγRI(CD64)是IgG受体家族的成员之一,只存在于单核细胞和巨噬细胞上,且FcγRI被证明是miR-127真正的靶点。最近,Xie等[48]在IgG免疫复合物(immune complexes,IC)诱导的急性肺损伤(acute lung injury,ALI)中,发现miR-127减轻炎症反应和肺通透性,其机制正是由于miR-127直接针对CD64的3′ UTR,导致CD64下调;同时,为研究miR-127在巨噬细胞中的作用,体外建立稳定的miR-127过表达模式,观察到在LPS、透明质酸、前列腺素或IgG IC刺激下,TNF-α、IL-1β、IL-6等M1巨噬细胞分泌的促炎因子释放减少。这些数据表明,miR-127在体内和体外通过靶向FcγRI发挥抗炎作用,可将miR-127作为治疗ALI和急性呼吸窘迫综合症等炎症性疾病的靶点。Chen等[49]研究表明,miR-127-5p可减少LPS诱导的促炎因子TNF-α、IL-1β和IL-6的产生,并通过靶向肿瘤坏死因子受体激活因子-1(TNF receptor activation factor-1,TRAF1)使AKT/NF-κB信号通路失活,从而减轻重症肺炎。目前,miR-127-5P已被用作诊断重症肺炎新的生物标志物[50],可以将miR-127作为巨噬细胞极化中的分子开关,在炎症性疾病中发挥关键调节作用。
miR-34a作为肿瘤抑制因子而闻名。三阴型乳腺癌是最为致命的乳腺癌之一,且预后较差。最近一项研究表明:miR-34a联合T细胞多重拷贝(multiple copies in t-cell,MCT-1)抑制剂,或IL-6R拮抗剂能通过刺激MCT-1/IL-6/IL-6R/STAT3轴改变巨噬细胞极性,促进M1极化,抑制M2极化,从而提高三阴性乳腺癌的治疗效果[51]。
除此之外,miR-34a被认为可作为新的炎症调节因子。KLF4是调节巨噬细胞极化为抗炎M2表型的主要效应器之一,是miR-34a的一个已证实靶点。随着膳食肥胖的发展,miR-34a在脂肪组织中的表达逐渐增加,脂肪选择性或脂肪细胞特异性miR-34a-KO小鼠对肥胖引起的葡萄糖耐受、胰岛素抵抗和全身炎症具有抵抗力,并伴随着脂肪驻留巨噬细胞极化,从促炎M1表型向抗炎M2表型显著转变。其作用机制为,成熟脂肪细胞分泌的外切体将miR-34a转运到巨噬细胞,通过降低KLF4表达,抑制M2极化,进而促进肥胖诱导的脂肪炎症[52]。Khan等[53]发现,气管内注入LPS可增强肺巨噬细胞miR-34a的表达,miR-34a过表达则加重肺损伤,而抑制miR-34a可减少M1促炎因子分泌,显著改善肺组织学状况。其作用机制为,抑制miR-34a通过靶向Klf4促进M2巨噬细胞极化,改善LPS诱发的肺损伤,提示miR-34a可能成为治疗急性肺损伤或急性呼吸窘迫综合症的潜在靶点。
另有不同的观点认为,miR-34a可抑制M1巨噬细胞极化。Jiang等[54]报道,miR-34a通过靶向Notch1抑制LPS诱导的小鼠巨噬细胞炎症反应,也能抑制NF-κB通路的活化,进而减轻炎症状态[55]。
关于miR-21在巨噬细胞极化中的作用,目前也存在较多争议。miR-21是哺乳动物细胞中含量最丰富的miRNAs之一,也是巨噬细胞中含量最丰富的miRNA,被描述为调节促炎和抗炎反应平衡的关键信号[56]。最新的一项研究[57]表明,miR-21在糖尿病创面伤后不同时期的表达存在差异:糖尿病创面伤后1 d(炎症期)miR-21表达升高,伤后3 d和7 d(增殖期)miR-21表达降低,14 d和21 d(重建期)糖尿病创面miR-21表达又明显升高。这表明,时间对miR-21表达的调节在其靶向治疗中具重要性。同时发现,外源性miR-21与miR-21模拟物共转染会进一步诱导M1标记基因表达,提示miR-21可能参与M1巨噬细胞极化。
Wang等[58]报道,miR-21促进腹腔巨噬细胞M1极化,抑制M2极化。研究表明,miR-21与脂质介质前列腺素E2(prostaglandin E2,PGE2)之间的串扰是巨噬细胞极化的决定因素。PGE2是炎症和感染过程中产生的一种内源性脂质介质,PGE2抑制miR-21表达,增强M2基因表达,这种作用在miR-21缺陷细胞中更为明显。研究进一步证明,miR-21是通过靶向STAT3抑制M2极化。以上数据均揭示了miR-21是PGE2介导的M2极化的内源性制动因子。miR-21拮抗剂可能是一种增加M2巨噬细胞数量、降低炎症介质表达的良好治疗剂。
与Wang等研究相反,Caescu等[59]最近研究发现,miR-21通过NF-κB参与调控集落刺激因子1受体(colony stimulating factor 1 receptor,CSF-1R)的下游,从而增加M2巨噬细胞,抑制M1表型。敲除miR-21后,导致M2表型基因,例如Arg-1、甘露糖受体1、IL-4ra和FIZZ表达减少。且给小鼠腹腔注射miR-21抑制剂后,炎性单核细胞募集增多,腹腔巨噬细胞对LPS的反应增强,表明miR-21具有启动M2极化的能力。
miR-21也是一种致癌RNA,可促进癌症的化疗耐药性,而耐药性正是卵巢癌患者复发和死亡的重要原因之一。最近,An等[60]用miR-21模拟物和miR-21抑制剂转染的M2巨噬细胞与卵巢癌细胞共培养48 h,发现转染miR-21模拟物会增加M2巨噬细胞标志物CD206和IL-10表达,并降低M1巨噬细胞标志物iNOS和TNF-α表达。而转染miR-21抑制剂具有相反效果,表明miR-21调节M2巨噬细胞向M1型极化,其机制是通过调节PI3K/AKT信号通路改善卵巢癌细胞的化疗耐药性,这为顺铂耐药患者提供了一个有前途的治疗靶点。
目前,miR-21对巨噬细胞极化相互矛盾影响的原因尚不十分清楚。有种说法认为,在炎症的早期阶段,pri-miR-21占主导地位并呈现促炎活性,使巨噬细胞极化为M1表型;在解决炎症阶段,成熟miR-21调节抗炎反应,并将巨噬细胞极化为M2表型,参与炎症消退[56]。但无论miR-21在促炎/抗炎中哪方面发挥作用更多,miR-21毋庸置疑已能作为调节巨噬细胞极化的关键介质。
综上所述,miR-127、miR-34a、miR-21可以调控巨噬细胞朝不同方向极化均得到不同研究证实。至于为何同一种miRNA调控巨噬细胞会出现看似矛盾的极化状态,原因有几点:(1)不同研究所采用巨噬细胞的来源不同;(2)体内/体外差异性环境或可影响研究结果;(3)可能某些miRNAs具有双向调控巨噬细胞极化的功能。鉴于此,需要以多中心多靶点的研究去进一步证实此类具有争议的miRNAs具有的确切功能,以为临床治疗疾病提供不同思路,或为开发以miRNAs为靶点的药物提供更充分的证据。
4 问题与展望
在短短几年内,国内外学者对miRNAs的研究已经产生了较丰富的理论知识。它是参与调节巨噬细胞极化的转录因子的上游调节因子,miRNAs在巨噬细胞极化转录后调节对炎症、免疫反应和肿瘤等的治疗作用,也获得了大量的研究和临床证实。然而,有几个耐人寻味的问题仍然需要不断深入的研究去解答。首先,炎症反应的每个阶段都涉及1个甚至多个调节的miRNAs,多个miRNAs如何协作,以恰当地平衡巨噬细胞极化依然缺乏更深入的研究。其次,由于即使是1 个miRNA也能够靶向大量的mRNA。因此,识别任何单个miRNA的特定靶点仍然具有挑战性。最后,研究巨噬细胞极化相关miRNAs的失调是否可作为疾病预后和诊断的生物标志物仍需要更充分更有说服力的动物研究,以及临床研究去进一步证实。总而言之,深入探索miRNAs调节巨噬细胞极化的种类及分子机制,将有助于为以巨噬细胞为中心的诊断和治疗策略提供理论基础。
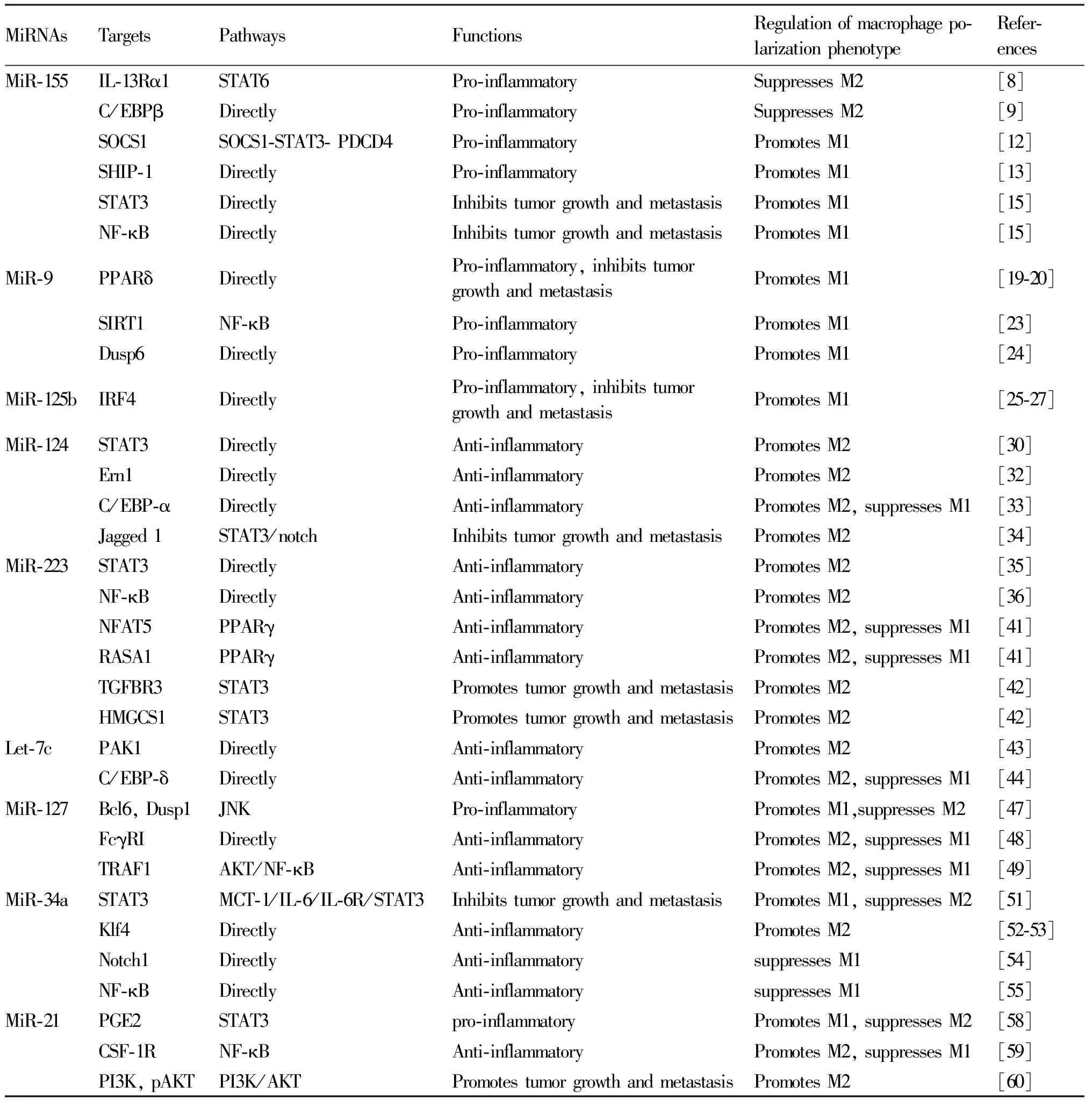
Table 1 MicroRNAs regulate macrophage polarization by regulating transcription factors

