环状RNA的m6A修饰在肿瘤中的作用
林 红, 龙方懿, 王 婷*
(1)电子科技大学医学院,四川省肿瘤医院药学部, 成都 610054;2)四川省妇幼保健院实验医学中心, 成都 610041)
1976年,Sanger等首次发现,植物类病毒以环状RNA(circular RNA,circRNA)而非线状RNA这种前所未知的分子形式的存在。在1979 年,通过电子显微镜观察发现其存在于真核细胞中[1]。近年来,随着高通量测序技术和生物信息学的飞跃发展,许多circRNA被发现存在于各种生物体内,它们具有结构稳定、进化保守、高度丰富和组织特异性等特征。越来越多研究表明,circRNA广泛参与了细胞的生长、分化和凋亡等各个病理生理过程,并与多种恶性肿瘤的发病机制有关[2,3]。
转录后修饰已成为多种生理病理过程中重要的调控因子。在过去几十年里,已经发现了100多种RNA修饰类型[4]。其中,N6-甲基腺嘌呤(N6-methyladenosine,m6A)修饰是真核生物中最常见的一种RNA修饰。m6A修饰是一个动态的调节过程,在RNA的翻译、剪接、降解等多个方面发挥作用。m6A修饰不仅发生在mRNA等编码RNA中,也发生在一些非编码RNA(non-coding RNA,ncRNA)中,例如微小RNA(microRNA,miRNA)和circRNA[5]。越来越多的研究发现,circRNA的m6A修饰在多种肿瘤的发生发展过程中发挥调控作用。本篇综述总结了RNA m6A修饰机制、m6A修饰对circRNA的调控作用,以及circRNA的m6A修饰在肿瘤中的作用,也讨论了m6A修饰的circRNA在未来肿瘤的诊断与治疗中的潜在应用价值。
1 环状RNA概述
1.1 circRNA分类及形成机制
CircRNA是一种具有新型结构的RNA分子,其3′-和5′-末端共价连接形成环状闭合结构。根据circRNA的来源不同,可分为4类:外显子circRNA(exonic circRNA,ecRNA)、内含子circRNA(intronic circRNA,ciRNA)、外显子-内含子circRNA(exon-intron circRNA,EIciRNA)和线粒体编码的circRNA(mitochondria-encoded circRNA,mecciRNA)[6, 7]。MecciRNA是一种最近发现的新型circRNA,已经在人类和鼠细胞中发现了数百种。同时,一些mecciRNA被证明可以促进核基因组编码的蛋白质进入线粒体,以帮助线粒体适应不同的生理条件[7]。CircRNA通常来源于前体mRNA(pre-mRNA),它的形成机制较为复杂,尚未完全阐明。目前,主要有3种模型解释它的形成机制:(1)套索驱动的环化;(2)内含子配对驱动的环化;(3)RNA结合蛋白(RNA-binding protein,RBP)依赖性的环化。在套索驱动的环化模型中,环化过程随着2个不相邻的外显子结合在一起,最终产生circRNA。在内含子配对驱动的环化模型中,pre-mRNA的外显子1和外显子3之间的2个内含子中的互补序列能够相互配对连接以诱导环化,最终产生circRNA。在RBP依赖的环化模型中,一些RBPs能够结合到pre-mRNA的外显子1和外显子3之间的2个内含子序列的特定位点上,代替内含子中反向重复序列或者互补序列的作用,促进供体和受体序列共价结合形成环化序列,进而使相邻外显子连接环化,最终产生circRNA[8, 9]。
1.2 circRNA的生物学功能
1.2.1 circRNA充当miRNA分子海绵 许多circRNA具有不同类型和数量的miRNA结合位点。这些位点能够特异性与miRNA结合,从而消除miRNA对其靶基因的抑制作用,上调相应靶基因的表达[10]。研究表明,许多circRNA可以充当miRNA分子海绵,调控肿瘤的发生发展。Ma等[11]发现,circNFATC3可能直接作为miR-9-5p海绵来调节黏结蛋白聚糖2(syndecan-2,SDC2)的表达及其下游信号通路,从而促进宫颈癌的发展。circTRIM33-12吸附miR-191,从而抑制肝细胞癌细胞的增殖、迁移和侵袭[12]。
1.2.2 circRNA调控基因转录 部分circRNA可以作为转录调控因子调控基因转录过程。一些ciRNA和EIciRNA通过结合RNA聚合酶 Ⅱ(RNApolymerase Ⅱ,Pol Ⅱ)转录复合物和转录相关蛋白质来调控亲本基因的转录或剪接过程。Zhang等[13]报道, ci-ankrd52和ci-sirt7可以通过与Pol Ⅱ相互作用作为亲本基因转录的正向调控因子。此外,Li等[14, 15]发现了2个EIciRNA(circ-EIF3J和circ-PAIP2),它们可以结合U1核小核糖核蛋白(small nuclear ribonucleic proteins, snRNPs),进一步与亲本基因启动子处的Pol Ⅱ相互作用,增强亲本基因的表达。
1.2.3 circRNA与功能蛋白质相互作用 RBPs包含1个或多个RNA结合域,在基因表达的各个方面发挥着重要作用,例如转录、pre-mRNA剪接和RNA修饰等过程。CircRNA可以与RBPs直接特异性相互作用,作为竞争元素来阻断蛋白质作用。CircRNA可以与RBPs相互作用的一个典型例子是circFoxo3,它与细胞周期进展相关,沉默内源性circFoxo3可促进细胞增殖。circFoxo3通过与周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)和p21结合,形成circFoxo3-p21-CDK2三元复合物,抑制了CDK2发挥功能,进而阻断了细胞周期的进程[16]。
1.2.4 circRNA可被翻译成蛋白质 长期以来,circRNA被忽视了其翻译产生蛋白质的功能。直到2017年Legnini等[17]发现,circ-ZNF609通过非帽依赖的方式翻译为小鼠成肌细胞中的蛋白质,这一发现为真核生物中circRNA能够编码蛋白质提供了依据。迄今为止,已报道了若干circRNA的翻译功能在人类癌症中发挥重要作用。例如,Li等[18]发现,circ-HER2可编码一种新的蛋白质HER2-103,HER2-103通过与表皮生长因子受体(epidermal growth factor receptor,EGFR)或HER3的直接作用,诱导EGFR/HER3或EGFR/EGFR的二聚化,进而激活下游AKT信号通路,促进三阴性乳腺癌细胞的增殖。
2 RNA m6A修饰的机制
m6A修饰主要是由3类酶蛋白参与的动态调节过程,包括m6A甲基转移酶(writers)、m6A去甲基化酶(erasers)和m6A识别蛋白(readers)。m6A修饰参与调节RNA剪接、输出、翻译和降解等多个过程[19](Fig.1)。
2.1 m6A甲基转移酶
m6A甲基转移酶是一类具有催化活性的蛋白质,它们能够结合形成甲基转移复合物(methyltransferase complex, MTC),催化RNA特定位点发生m6A修饰。甲基转移复合物包括甲基转移酶样蛋白3(methyltransferase-like 3,METTL3)、甲基转移酶样蛋白14(methyltransferase-like 14,METTL14)、肾母细胞瘤1-相关蛋白(Wilm’s tumor 1-associated protein,WTAP)、RNA结合基序蛋白15(RNA-binding motif protein 15,RBM15)、病毒样m6A甲基转移酶相关蛋白(Vir like m6A methyltransferase associated protein,VIRMA)和锌指CCCH域蛋白13(zinc finger CCCH domain-containing protein 13,ZC3H13)等[20]。METTL3和METTL14形成稳定的复合物,在基底的识别中发挥关键作用。其中,METTL14 本身无甲基转移酶活性,主要帮助METTL3识别底物[21]。WTAP 和METTL3 直接结合,确保了METTL3-METTL14异二聚体的定位,提高催化活性[22]。RBM15与m6A复合体结合,并将其招募至特定的RNA位点[23]。此外,METTL16是一种新发现的甲基转移酶,催化U6 snRNPs中核小RNA(small nuclear RNA,snRNA)的m6A修饰,参与pre-mRNA的剪接[24]。
2.2 m6A去甲基化酶
m6A去甲基化酶的功能与甲基转移酶相反,主要发挥让m6A修饰的RNA去甲基化的作用。m6A去甲基化酶主要包括脂肪和肥胖相关蛋白(fat mass and obesity-associated protein,FTO)和Alk B同源物 5(Alk B homolog 5,ALKBH5),两者均属于Fe2+/α-酮戊二酸依赖型双氧酶ALKB家族成员。FTO是第1个被发现的m6A去甲基化酶,Jia等[25]发现,FTO具有使体外RNA中大量m6A残基的有效氧化脱甲基活性。敲除FTO导致mRNA中m6A的量增加,而FTO的过表达导致人细胞系中m6A的量减少,从而证明了FTO催化去甲基的活性。ALKBH5为第2个被鉴定出的m6A去甲基化酶。ALKBH5缺乏的雄性小鼠mRNA的m6A修饰增多,而且ALKBH5选择性地分布在核斑点中,影响核mRNA的输出和RNA的代谢[26,27]。
2.3 m6A识别蛋白
m6A识别蛋白能够“阅读”m6A介导的生理行为,从而影响RNA行使功能。常见的阅读子有YT521-B同源(YT521-B homology,YTH)结构域家族的蛋白(YTHDC1、YTHDC2、YTHDF1、YTHDF2和YTHDF3)、核不均一核糖核蛋白C(heterogeneous nuclear ribonucleoproteins,HNRNP)家族蛋白(HNRNPA2B1、HNRNPC和HNRNPG)、胰岛素样生长因子2 mRNA结合蛋白(insulin-like growth factor 2 mRNA-binding proteins,IGF2BPs)、真核起始因子3(eukaryotic initiation factor 3,eIF3)和Prrc2a(proline rich coiled-coil 2 A)[28,29]。不同的阅读子(readers)执行不同的功能。YTHDC1有助于RNA的剪接和输出[30, 31];YTHDC2增强RNA的翻译效率,降低mRNA的丰度[32];YTHDF1、YTHDF2分别促进mRNA翻译和降解[33];而YTHDF3增强YTHDF1和YTHDF2各自的作用[34]。与YTHDF2的功能相反,IGF2BPs在正常和应激条件下以m6A依赖的方式促进其靶mRNA的稳定性和储存,从而影响基因表达输出[35]。Prrc2a是一种最近新发现的RBP,具有稳定mRNA表达的作用[36]。
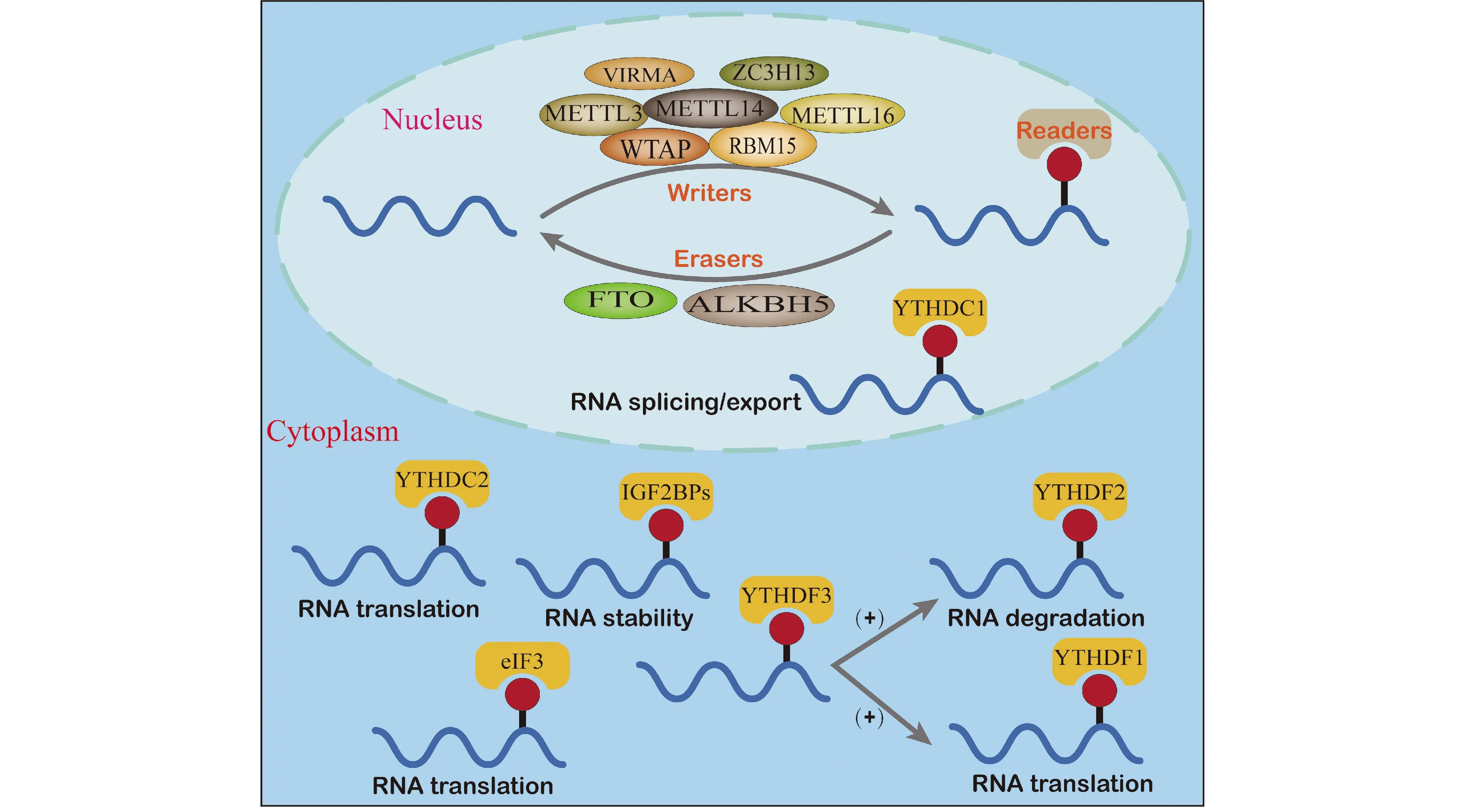
Fig.1 m6A methylation is a dynamic and reversible process m6A RNA modification is regulated by writers, erasers and readers. m6A methylation is installed by the m6A methyltransferases (writers), including METTL3/14, WTAP, RBM15, VIRMA and ZC3H1. And it could be removed by RNA demethylases (erasers), such as FTO and ALKBH5. In addition, m6A methylation could be specifically recognized by m6A-binding proteins (readers), including YTH domain containing reader proteins YTHDC1-2 and YTDF1-3, IGF2BPs and eIF3. The Readers perform various functions in RNA export, splicing, stability, translation and degradation
3 m6A修饰对环状RNA的调控作用
3.1 m6A修饰促进circRNA的核输出
成熟RNA转录物的核输出对于其正常功能的行使至关重要。不同类型的RNA包含不同的信号序列,用于确定通过哪种途径将其自身从细胞核输送到细胞质。例如,随着mRNA的合成,它与RBPs结合,形成核糖核蛋白颗粒(ribonucleoprotein particles,mRNPs)。异二聚体输出受体NXF1-NXT1被招募发出mRNPs装配完成的信号,随后通过核孔复合体(nuclear pore complex,NPC)将mRNA以mRNPs的形式输出[37]。不同类型的circRNA具有不同的定位,ciRNA和EIciRNA主要保留在细胞核中,而ecRNA主要定位于细胞质[38]。CircRNA是如何从细胞核中输出的研究较少,其输出途径仍然还在不断探索中。
Huang等[39]使用RNAi筛选发现,果蝇DExH/D-box解旋酶Hel25E的缺失导致长circRNA(> 800 nt)在细胞核中的大量积累。他们进一步在人类细胞中测试了这种长度依赖的circRNA输出途径。令人惊讶的是,他们发现,Hel25E的2个人类同源物(UAP56和URH49)参与circRNA的定位,但具有不同的特征。UAP56负责长circRNA(> 1 200 nt)的核输出,而短circRNA(< 400 nt)的核输出需要URH49。然而,由这2种同源物如何测量circRNA长度的详细机制仍不清楚。最近的一项研究表明,m6A修饰会促进circRNA的核输出。细胞核中m6A修饰的circNSUN2可被YTHDC1识别,并促进其输出到细胞质中,敲除YTHDC1或METTL3导致circNSUN2在细胞核中大量积累,而这种现象可以通过它们的重新表达来逆转[40](Fig.2)。这些研究为circRNA的核输出机制提供了新的视角。
3.2 m6A修饰驱动circRNA的翻译
CircRNA通常被认为是一种ncRNA。然而近年大量研究表明,circRNA具有编码蛋白质潜能[18, 41, 42]。在真核生物中,传统的mRNA翻译是由帽依赖途径所介导。帽依赖途径需要真核翻译起始因子4F(eukaryotic initiation factor 4F,eIF4F)复合物的参与。eIF4F复合物是由eIF4A、eIF4E 和eIF4G所组成,其定位于5′帽子结构处,起始翻译过程[43]。但是,由于circRNA的环状闭合结构,缺乏5′端帽子结构,不能通过此途径编码蛋白质。在研究者的不断探究下,发现了2种非帽依赖翻译途径:核糖体介入位点(internal ribosome entry site,IRES)介导的翻译途径和m6A修饰介导的翻译途径。IRESs是位于mRNA 5′UTR的序列,可以直接招募核糖体(ribosome)启动翻译。IRES所介导的翻译最初是在RNA和DNA病毒中发现。随后的一些研究表明,在某些压力条件下,真核生物mRNA也可以通过IRES所介导的途径翻译[44]。近年来,一些IRES所介导的circRNA翻译也被发现,并参与肿瘤的调控过程。Zhang等[42]发现,circ-SHPRH可以通过IRES介导途径编码SHPRH-146aa,在U251和U373胶质母细胞瘤细胞中,过表达SHPRH-146aa降低了胶质母细胞瘤细胞的体内外恶性行为和致瘤性。
另一个重要的非帽依赖翻译途径是m6A修饰所介导的。研究表明,5′UTR中的m6A可以直接与eIF3结合,它足以招募43 S核糖体复合物来启动翻译。不同的细胞应激选择性地增加了5′UTR内m6A的水平,表明5′UTR中的 m6A修饰在介导应激诱导的翻译反应中很重要[45]。Yang等[46]最近进行的一项研究发现,circRNA中有丰富的m6A修饰,含有m6A修饰的circRNA在细胞内被翻译,并且调控circRNA中的m6A水平会影响翻译效率。这种m6A驱动的翻译需要eIF4G2和m6A识别蛋白YTHDF3,eIF4G2负责招募eIF4A和eIF4B组成翻译起始复合物eIF4,启动 circRNA翻译(Fig.2)。在应激条件下,敲除m6A去甲基化酶FTO会抑制circRNA翻译,而敲除m6A甲基转移酶METTL3/14则会促进circRNA翻译。通过进一步分析,发现有数百种内源性circRNA具有编码蛋白质潜力,此研究扩展了人类转录物组的编码范围。此外,Timoteo等进行的另一项研究中也发现,YTHDF3和eIF4G2可以通过识别m6A修饰位点来调控circ-ZNF609的翻译[47]。
3.3 m6A修饰促进circRNA的降解
CircRNA由于其封闭的环状结构,比亲本线性RNA更稳定。有研究表明,含有m6A的mRNA主要有2种不同的降解途径:YTHDF2-CCR4 /NOT复合物去烯酰化和YTHDF2-HRSP12-RNase P/MRP复合物核内裂解[48]。然而,circRNA的降解机制在很大程度上是未知的,仍然在不断探索中。此前有研究报道,miRNA可以通过Ago2切片依赖的方式引导circRNA降解[49]。但对于一些无miRNA海绵功能的circRNA不起作用。Jia等[50]发现,果蝇GW182及其人类同源基因(TNRC6A、TNRC6B和TNRC6C)对circRNA的降解具有调节作用,但是这种机制尚未完全阐明,仍需要其他机制的补充。
最近的一项研究报道,m6A修饰的circRNA也可以通过YTHDF2-HRSP12-RNase P/MRP轴被核糖核酸内切酶切割。经免疫共沉淀实验发现,HRSP12发挥连接YTHDF2和RNase P/MRP的作用。YTHDF2是m6A阅读子,可以识别circRNA上的m6A修饰位点。RNase P/MRP是一种核糖核酸内切酶,其通过HRSP12与YTHDF2相连接,形成YTHDF2-HRSP12-RNase P/MRP复合物,切割circRNA[51](Fig.2)。此外,Chen等[52]发现,内源性m6A修饰的circRNA结合YTHDF2不能刺激视黄酸诱导基因蛋白I(retinoic acid-inducible gene-I,RIG-I)通路,抑制先天性免疫的发生,推测这可能是由于YTHDF2介导的circRNA降解。Paramasivam等[53]报道,缺乏m6A修饰的外源性circRNA可激活RIG-I通路,诱导先天性免疫。这一发现揭示了m6A修饰在区分内源性circRNA和外源性circRNA中的作用,并暗示了YTHDF2识别m6A修饰所介导的circRNA降解在抑制先天性免疫中的潜在作用。
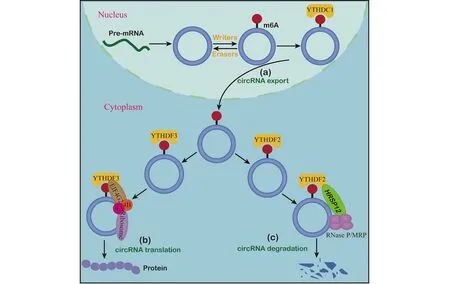
Fig.2 Roles of m6A methylation in the regulation of circRNA (a) YTHDC1 binds to m6A methylation sites and promotes circRNA nuclear export. (b) The m6A-driven translation of circRNA is initiated by factor eIF4G2, eIF4, eIF4B and m6A reader YTHDF3. (c) M6A-modified circRNA is endoribonucleolytically cleaved via the YTHDF2-HRSP12-RNase P/MRP axis
4 环状RNA的m6A修饰在肿瘤中的调控作用
随着高通量测序技术以及生物信息学的迅速发展,越来越多的circRNA在肿瘤组织中被发现,它们在肿瘤的发生发展过程中发挥重要的作用[11, 12, 18]。m6A修饰是circRNA一种常见的修饰方式,其参与circRNA的核输出、非帽依赖的翻译和降解等过程,在维持circRNA的生物学活性上具有重要的作用,从而调节circRNA在肿瘤细胞增殖、迁移、侵袭和耐药性等方面的作用。在这里,对近几年来有关“circRNA的m6A修饰在肿瘤中调控作用”的研究进行了简单总结。
4.1 宫颈癌
宫颈癌是世界上第4常见的女性恶性肿瘤,高危型人乳头瘤病毒(HPV)是导致宫颈癌发生的高危因素,是一个重大的全球健康挑战[11]。尽管HPV筛查和疫苗接种计划被认为是有效预防宫颈癌工具,但对高危型HPV病毒如何从潜在感染发展为不可治愈的癌症的了解仍然不完整。在最近的一项研究中发现,HPV病毒能产生1种circRNA(circE7),m6A修饰赋予circE7翻译产生E7癌蛋白的能力,从而促进宫颈癌的发生发展。同时,m6A对circE7的修饰,帮助病毒逃脱宿主的抗病毒免疫反应[54]。这一发现,推动了对人类乳头瘤病毒导致宫颈癌发病机制新见解的产生。
4.2 结直肠癌
结直肠癌是一种常见的消化系统恶性肿瘤。近年来,我国结直肠癌的发病率和死亡率呈上升趋势,确定有效的诊断和预后生物标志物至关重要[55]。Chen等[40]发现,m6A修饰的circNSUN2在结直肠癌肝转移患者的肿瘤组织和血清样本中经常上调,并预测患者较低的存活率。经深入研究的结果表明,m6A修饰的circNSUN2可被YTHDC1识别并输出到细胞质中,然后参与形成circNSUN2/胰岛素样生长因子2-mRNA结合蛋白(Insulin-like growth factor 2 mRNA-binding protein 2,IGF2BP2)/高迁移率族蛋白2(high mobility group AT-hook,HMGA2)三元复合物。circNSUN2增强HMGA2 mRNA的稳定性,从而促进结直肠癌的侵袭和肝转移。circNSUN2可能成为结直肠癌肝转移的潜在治疗靶点。
4.3 肝细胞癌
肝细胞癌是最常见的原发性肝癌类型,全球癌症相关死亡的主要原因之一。肝细胞癌病人5年生存率很低,探究肝细胞癌的发生发展机制至关重要[56]。Rao等[57]发现,乙肝病毒x蛋白(hepatitis B virus x protein,HBx)上调了甲基转移酶METTL3的表达,从而增加了circ-ARL3的m6A修饰,然后YTHDC1结合m6A修饰的circ-ARL3,有利于它的反向剪接和生物合成,促进circ-ARL3在肝细胞癌细胞和组织中显著上调。此外,circ-ARL3能够通过海绵作用拮抗miR-1305,抑制下游靶基因从而促进乙型肝炎病毒相关肝细胞癌进展。化疗是治疗晚期恶性肿瘤的一种有效方法,但是肿瘤细胞在治疗过程中会对多种药物产生耐药性,导致治疗失败。索拉菲尼是治疗晚期肝细胞癌的一线药物,由于其耐药性限制了它的临床应用。近年来,许多研究揭示了circRNA与肿瘤细胞产生耐药性的关系。例如,最近一项研究在索拉非尼耐药的肝细胞癌细胞中发现了circRNA-SORE上调。circRNA-SORE通过充当miRNA分子海绵吸附miR-103a-2-5p和miR-660-3p,从而竞争性激活Wnt/β-catenin通路,并诱导索拉非尼耐药性产生,且其异常表达的机制为m6A对circRNA-SORE的修饰,使其稳定性增强[58]。
4.4 非小细胞肺癌
肺癌是常见的癌症之一,在世界范围内具有很高发病率和死亡率。其中,非小细胞肺癌约占85%[59 ]。尽管非小细胞肺癌的诊断与治疗取得了一定的进展,但仍然存在一定的局限性,需要更多的探索。据报道,IGF2BPs在非小细胞肺癌中上调,高水平的IGF2BPs会促进肿瘤的生长与转移。最近,Li等[60]发现,circNDUFB2可以作为一种支架增强TRIM25和IGF2BPs之间的相互作用,而且这种作用可以通过m6A修饰得到进一步的加强。TRIM25是一种E3泛素连接酶,所以m6A修饰的circNDUFB2会进一步促进IGF2BPs的泛素化和降解,进而抑制非小细胞肺癌的进展。此外,circNDUFB2也可以被RIG-I识别,以激活免疫信号级联,并将免疫细胞募集到肿瘤微环境(tumor microenvironment,TME)中。TME被认为是导致肿瘤增殖、转移和化疗耐药性的关键因素[61],这一发现为非小细胞肺癌治疗提供了新方向。
4.5 胃低分化腺癌
胃低分化腺癌是胃癌中的一种,预后较差。最近,Zhang等[62]通过circRNA测序技术,对胃低分化腺癌组织以及配对的正常胃组织中的circRNA表达情况进行了检测,发现了一系列差异性表达的circRNAs。其中,Hsa-circRNA-0077837与对照组相比差异最显著,可作为临床诊断标志物。而且大部分表达差异的circRNA都有m6A修饰,m6A修饰的变化趋势主要与circRNA表达水平一致。但是,对于m6A修饰如何影响circRNA在胃低分化腺癌的生物学功能,仍需进行深入的研究。
5 问题与展望
如今,随着人们生活水平的大幅度提高,各种恶性肿瘤的发病率逐年上升,因此,迫切需要寻找到更多有效的早期诊断、预后标志物,以及潜在的治疗靶点。CircRNA作为ncRNA类的新星,吸引了越来越多研究者的注意力。随着高通量测序技术以及生物信息学的迅速发展,许多circRNA在肿瘤组织中被发现,它们在肿瘤的发生发展中发挥重要的调控作用。m6A修饰是circRNA一种常见的修饰方式,它通过参与调节circRNA的核输出、翻译和降解等过程,从而调控circRNA在肿瘤发生发展中的生物学功能。这些m6A修饰的circRNA有望成为肿瘤有效的早期诊断、预后标志物,以及潜在的治疗靶点,为肿瘤的诊断与治疗提供了新的思路。但是,目前关于circRNA的m6A修饰的研究仍较少,m6A修饰对circRNA的哪些方面具有调控作用的了解也较少,仅仅局限于circRNA的核输出、翻译和降解等几方面。circRNA的m6A修饰如何影响肿瘤的发生发展的机制也尚未完全阐明,仍有待进一步的研究。因此,完全揭示circRNA的m6A修饰对肿瘤以及其他疾病的调控机制仍然有较长一段路要走,任重而道远。在未来,仍需要更多的研究来进一步阐明m6A修饰与circRNA之间的关系,以及它们在疾病中的调控机制。随着研究的深入,对circRNA的m6A修饰机制的探索有望为肿瘤的诊断与治疗开启新的篇章。

