不同亚细胞结构中的长非编码RNA
潘剑锋, 张燕军*, 李金泉
(1)内蒙古农业大学动物科学学院动物遗传育种与繁殖系, 呼和浩特 010018;2)农业部肉羊遗传育种重点实验室, 呼和浩特 010018; 3)内蒙古自治区动物遗传育种与繁殖重点实验室, 呼和浩特 010018;4)内蒙古自治区山羊遗传育种工程技术研究中心, 呼和浩特 010018)
长非编码RNA(long non-coding RNA,lncRNA)是转录长度超过200 nt且缺乏蛋白质编码能力的非编码RNA(non-coding RNA,ncRNA)。但在研究中发现,lncRNA实际上有较短的开放阅读框(short open reading frame,sORF)可编码功能性微肽[1]。lncRNA主要是RNA聚合酶II(RNA polymerase II,Pol II)转录的副产物,在结构上与mRNA(messenger RNA)类似,经剪切具有5′端m7G(7-methyl guanosine)帽子结构和3′端poly A尾巴[2]。但不同于mRNA,lncRNA具有独特的转录、加工及修饰等方式[3]。大量lncRNA被证明具有保守的二级结构及时空特异性表达[4, 5]。根据lncRNA在基因组上相对于蛋白质编码基因的位置可将其分为:反义链lncRNA、正义链lncRNA、基因间lncRNA、双向lncRNA和内含子lncRNA[6]。
lncRNA出现在不同的亚细胞结构中。其中,定位于细胞核中的lncRNA所占比例最大。位于核内的lncRNA,多富集在染色质或特定亚核区室(subnuclear compartment)中。主要参与表观遗传和转录水平的基因调控,包括组蛋白修饰、DNA甲基化和染色质重塑等[7-9]。在细胞质中,它们多在转录后和翻译水平上调节基因表达,例如调节mRNA的稳定性[10]、参与翻译调控及翻译后修饰[11]、介导RNA衰变[12]和编码微肽[1]等。在外泌体中,它们的功能与其所来源细胞类型相关,并随着外泌体进入受体细胞中参与细胞的表观遗传、转录及翻译水平上的基因调控。
在本文中,将讨论lncRNA在不同亚细胞结构中的调控机制,包括核中染色质及特定的亚核区室内的调控机制、细胞质中各个亚细胞结构之间的调控机制、外泌体中lncRNA进入受体细胞后所参与的调控机制,并概述了lncRNA在不同亚细胞结构内表达失调,所引起的相关疾病,最后对lncRNA的研究做出展望。
1 细胞核内的长非编码RNA参与染色质水平的表观遗传机制
表观遗传是指在基因的DNA序列未发生改变的情况下,基因功能发生可遗传的改变,最终导致表型变化。染色质水平的表观遗传机制主要包括组蛋白修饰、DNA甲基化和染色质重塑等。
1.1 细胞核内的lncRNA与组蛋白修饰
组蛋白修饰是以共价方式进行的翻译后修饰,包括组蛋白乙酰化和甲基化等,并且不同的修饰与基因表达的激活或抑制有关。lncRNA可通过将组蛋白修饰相关的复合物或酶募集至相应基因启动子区域,以调节该区域组蛋白甲基化和乙酰化水平影响基因表达。其中,组蛋白甲基化通常发生在H3和H4的精氨酸(Arg或R)和赖氨酸(Lys或K)残基上,受组蛋白甲基转移酶、组蛋白脱甲基化酶和组蛋白修饰复合物调控[13]。lncRNA通过将LSD1(lysine specific demethylase 1)、MLL1(mixed lineage leukaemia protein-1)等与组蛋白甲基化相关的酶或复合物,募集到相应基因启动子区域,影响组蛋白的甲基化和脱甲基化水平,从而调节基因的转录激活或干扰[7, 14]。此外,lncRNA还可以同时结合组蛋白甲基转移酶和DNA甲基转移酶,调控相关基因的转录(Fig.1A)[15]。这一发现表明,基因的表达可同时受到组蛋白修饰和DNA甲基化调控。
而与组蛋白甲基化相比,组蛋白乙酰化则主要与基因激活有关,并主要发生在H3、H4的N末端比较保守的赖氨酸位置上,同样也受到其相应的酶及其修饰复合物的调控[16]。例如,组蛋白乙酰转移酶EP300(histone acetyltransferase p300,EP300)[17]、组蛋白脱乙酰酶 SIRT6(sirtuin 6,SIRT6)[18]等。此外,lncRNA也能通过与线粒体代谢相关产物作用调控基因的组蛋白修饰。例如,lncRNA TINCR通过与ATP-柠檬酸裂解酶(ATP citrate lyase,ACLY)结合,使细胞中乙酰辅酶A(acetyl-CoA)水平升高,从而促进PADI1(peptidyl arginine deiminase 1)基因启动子区域H3k27ac(histone H3 lysine 27 acetylation)富集,激活PADI1基因转录[19]。另一方面,lncRNA可同时募集甲基化及乙酰化相关酶或复合物,到相应基因启动子区,同时调控该基因的甲基化及乙酰化水平。例如,lncRNA GClnc1通过将组蛋白甲基转移酶WDR5(WD-40 repeat protein 5)和组蛋白乙酰转移酶KAT2A(lysine acetyltransferases 2A)复合物募集到SOD2(superoxide dismutase 2)基因启动子区域,使该区域H3K4me3(histone H3 lysine 4 trimethylation,H3K4me3)和H3K9ac (histone H3 lysine 9 acetylation)富集,从而促进SOD2基因表达(Fig.1B)[20]。综上所述,组蛋白甲基化和乙酰化多调控基因启动子区的状态,影响基因的表达,这印证了定位于细胞核内的lncRNA多在表观遗传及转录水平调节基因表达这一观点。
1.2 细胞核内的lncRNA与DNA甲基化
DNA甲基化作为一种相对稳定的修饰状态,在DNA甲基转移酶(DNA methyltransferase 1/3a/3b,Dnmt1、Dnmt3a、Dnmt3b)的作用下,可随DNA复制遗传给新生的子代DNA,是一种重要的表观遗传机制[21]。在哺乳动物中,发现lncRNA 能够通过募集Dnmt1、Dnmt3a和Dnmt3b至目的基因的启动子,调控基因转录[8],而且其自身转录也可能受到这些DNA甲基转移酶的调控。2021年,Geng等[22]在多囊卵巢综合征(polycystic ovary syndrome,PCOS)中发现,lnc-MAP3K13-7∶1通过与Dnmt1结合,抑制CDKN1A(cyclin-dependent kinase inhibitor 1A)基因启动子区域的DNA甲基化,促进该基因转录(Fig.1C)。She等[23]在心肌纤维化中发现,Dnmt1的下调可降低心肌成纤维细胞中GAS5(growth-arrest-specific 5)基因启动子区域甲基化水平,使lncRNA GAS5表达增加。这一发现表明,DNA甲基转移酶也可被直接募集至lncRNA基因启动子,调控lncRNA的转录。综上所述,lncRNA不仅可将DNA甲基转移酶募集到目的基因启动子区域调控基因转录,而且其本身也是DNA甲基转移酶的靶标,其基因转录也受到DNA甲基化调控。
1.3 细胞核内的lncRNA与染色质重塑
染色质重塑是由染色质重塑复合物介导的一系列以染色质上核小体变化为基本特征的生物学过程,是一种重要的表观遗传学机制。染色质重塑复合物可分为4个家族:SWI / SNF(Switch/Sucrose Non-Fermentable),INO80/SWR1(inositol auxotrophy 80/SWI2/SNF2- related 1),ISWI(imitation Switch)和CHD(chromodomain- helicase-DNA-binding)。lncRNA通过与这4个家族的成员相互作用,改变核小体的位置和翻译后修饰来调控基因的表达及DNA复制与修复[24, 25]。其中,现阶段研究最多的是SWI/SNF家族。lncRNA可通过与SWI / SNF家族成员SMARCB1(SWI/SNF-related matrix-associated actin-dependent regulator of chromatin subfamily B member 1)和BRG1(Brahma-related gene 1)等结合,调控DNA在组蛋白上的滑动或使DNA脱离组蛋白,改变染色质的松散程度,调控基因的转录[9, 26]。在另一项研究中发现,lncRNA可通过充当SWI/ SNF家族成员及组蛋白修饰酶的分子支架,将该复合物募集到基因启动子区,调控基因的转录(Fig.1 D)[27]。这表明,染色质重塑和组蛋白修饰可共同调控基因转录。此外,另一种在染色质重塑中充当重要作用的INO80/ SWR1家族,它们以多种方式修饰染色质,包括核小体滑动、DNA修复与复制等[28]。lncRNA可通过招募其家族成员,例如INO80 D(INO80 complex subunit D)、INO80等,调控基因启动子的激活或干扰[29, 30]。相比lncRNA在前2个家族的研究,lncRNA在ISWI家族及CHD家族的研究仍相对较少,并且较多的分子机制仍不清晰。其中,ISWI家族成员NURF(nucleosome remodeling factor)和BPTF(Bromodomain PHD finger transcription factor),可通过与lncRNA相互作用调节核小体间距,参与DNA的修复及改变染色质的状态和结构等过程[31, 32]。而CHD家族在DNA修复、氧化应激反应、维持基因组稳定性中发挥重要作用[33]。并发现CHD家族中的CHD1、CHD4 、CHD5可被lncRNA调控,影响基因表达及细胞的生命活动过程[34, 35]。此外,这些染色质重塑复合物也在人类疾病和癌症的发生与发展中发挥关键作用。例如,恶性动脉瘤[27]和非小细胞肺癌[30]等。综上所述,lncRNA多通过与染色质重塑复合物结合,调节染色质上核小体的变化及染色质的状态和结构等过程,调控基因转录。
2 细胞核内的长非编码RNA与无膜亚结构
核体(nuclear bodies, NBs)是一种由蛋白质和RNA聚集形成的无膜亚结构。包括核仁(nucleoli),核斑点(nuclear speckles)和核旁斑(paraspeckles)等[36]。lncRNA在这些无膜亚结构的成核、结构维持及相应的机制调控中扮演着重要的角色。其中,核斑点是大多数前体mRNA (precursor messenger RNA,pre-mRNA)剪接因子聚集的结构,通常与lncRNA MALAT1共定位[37]。有研究发现,与核斑点共定位的lncRNA MALAT1可影响剪接因子在核斑点中的分布[38],并且经过n6-甲基腺苷修饰(N6-methyladenosine modification,m6A)的lncRNA MALAT1还可重塑核斑点[39];此外,与核斑点共定位的lncRNA MALAT1还能使pre-mRNA发生m6A并介导pre-mRNA的核输出[40]。表明核斑点的形态维持及其相应功能的发挥离不开lncRNA的作用。而且也提示,m6A修饰的RNA对机体的稳态维持发挥重要作用。核旁斑是邻近核斑点的一种无膜亚结构,由lncRNA NEAT1与核旁斑的结构蛋白质共同组装形成(Fig.1E)[41]。并且抑制lncRNA NEAT1或NONO(non-POU domain-containing octamer-binding protein)蛋白的表达,可破坏核旁斑的形成[42]。
核仁是rDNA(ribosomal DNA)转录、rRNA合成加工以及核糖体亚单位的装配场所,是生物体生命活动过程中重要的结构单位[43]。由于核仁是无膜结构,所以其结构的维持就显的尤为重要。有研究发现,lncRNA可以维持核仁的结构和形态[44],并且通过调控核仁应激及翻译重编程等过程,参与到核仁在生物体的功能调控过程[45, 46]。Xing等[47]发现,lncRNA SLERT可通过改变DDX21(DEAD-box RNA helicase)的蛋白质构象,促进核糖体RNA前体 (precursor ribosomal RNA,pre-rRNA) 的转录(Fig.1F)。此外,lncRNA还可以通过与核仁蛋白(nucleolin,NCL)及纤维蛋白(fibrillarin,FBL)结合,调节rRNA转录和多核糖体的分布[48]。这表明,lncRNA在rRNA转录上发挥关键作用。
综上所述,lncRNA在无膜亚结构的成核、维持及相应的机制调控中发挥着重要的作用。但由于这些结构无膜的包被,这就给其结构解析带来了挑战。同时,其功能的发挥与其结构有较大的联系。所以,这些无膜亚结构的结构解析以及与成核和结构维持相关的lncRNA的研究就显着尤为重要。
3 细胞质中长非编码RNA的调控机制
lncRNA通过参与核糖体、内质网、线粒体、溶酶体等细胞器的形成、内部机制调控、信号传导等途径介导细胞生物学调控过程。
3.1 lncRNA与内质网
内质网是一种独特的多功能细胞器,广泛参与蛋白质的生物合成,细胞解毒等生理过程。近年研究发现,由内质网生理异常引起的内质网应激(endoplasmic reticulum stress,ERS)是多种疾病发生与发展的罪魁祸首。而lncRNA可通过调控ERS来维持机体稳态,并调节多种疾病和癌症发生与发展。例如,在心肌缺血/再灌注损伤(myocardial ischemia/reperfusion injury)和心肌梗塞(myocardial infarction,MI)疾病中,可通过保护心肌细胞免受ERS损伤,阻止疾病的恶性发展[49]。此外,在肿瘤微环境中持续的ERS会导致细胞产生毒性,促进细胞凋亡。而lncRNA能通过调控这种ERS的促凋亡机制,阻止癌症向恶性发展。例如,在结直肠癌中,lncRNA MEG3通过诱导内质网应激,抑制肿瘤细胞的增殖、促进肿瘤细胞凋亡,从而阻止肿瘤细胞向恶性发展[50]。这些发现证明了内质网应激不仅可以引发疾病,还可以通过诱导细胞凋亡的方式,阻止恶性细胞的生长,这可为日后疾病和癌症的治疗和临床研究提供一种新的策略。
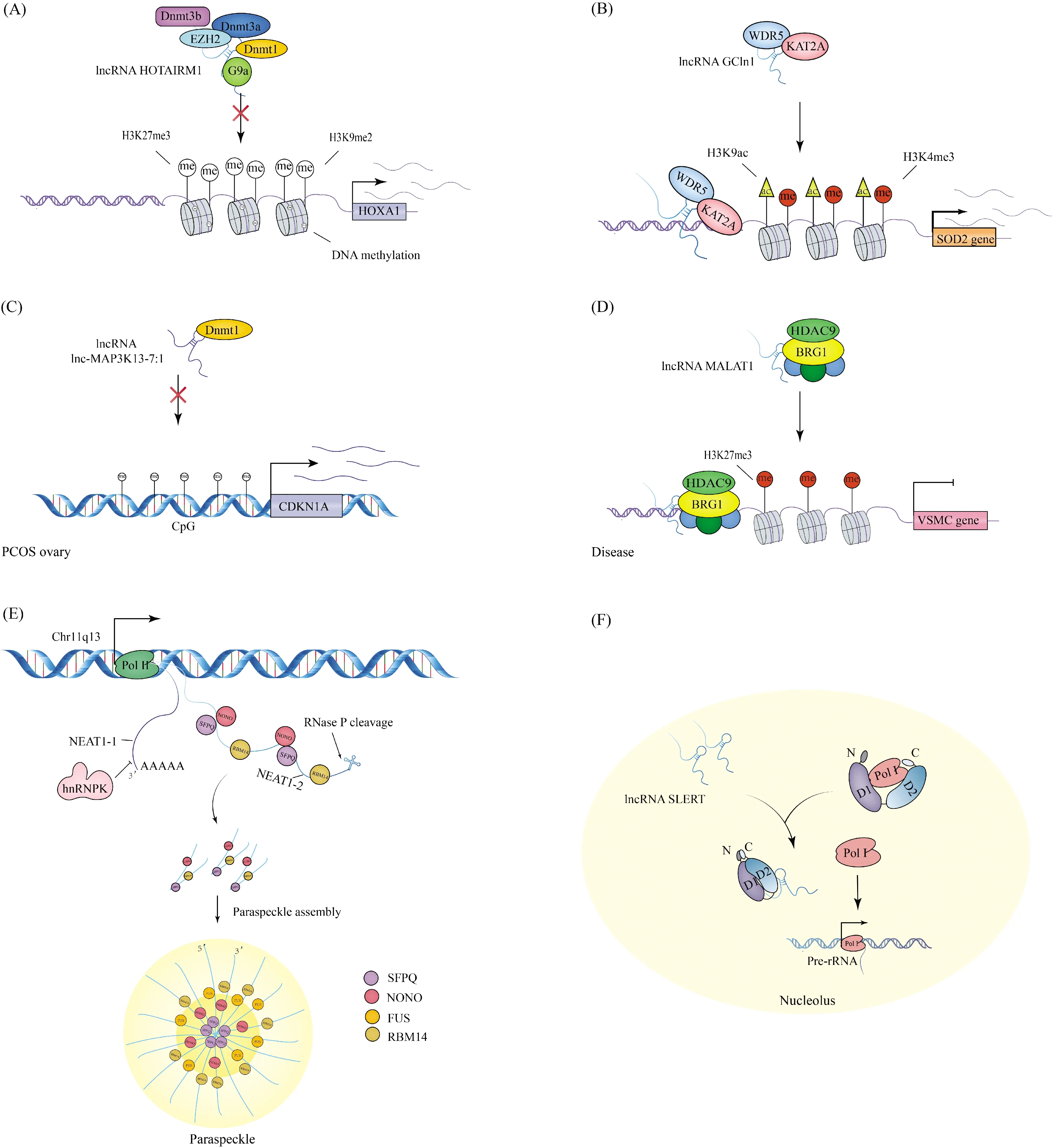
Fig.1 Schematic diagram of the regulatory mechanism of lncRNA in the nucleus (A) Schematic diagram of the mechanism action of lncRNA HOTAIRM1 binding to G9a, EZH2 (Enhancer of zeste homolog 2) and DNA methyltransferase (Dnmts). lncRNA HOTAIRM1 binds to G9a, EZH2 and Dnmts complex and prevents the complex from being recruited to the promoter region of HOXA1 gene, causing H3K9, H3K27 and DNA demethylation in this region, and promoting HOXA1 gene transcription[15]. (B) Schematic diagram of the mechanism action of lncRNA GClnc1 as a molecular scaffold for BRD4 and WDR5. lncRNA GClnc1 recruits the WDR5 and KAT2A complex to the SOD2 gene promoter region, enriches this region with H3K4me3 and H3K9ac, and promotes SOD2 gene transcription[20]. (C) Schematic diagram of the mechanism action of lnc-MAP3K13-7:1 and Dnmt1 in polycystic ovary syndrome (PCOS). In PCOS, lnc-MAP3K13-7∶1 binds to Dnmt1 and inhibits the recruitment of Dnmt1 to the CDKN1A gene promoter region, thereby reducing the level of DNA methylation in this region,and promoting CDKN1A gene transcription[22]. (D) Schematic diagram of the mechanism action of the HDAC9-MALAT1-BRG1 complex. During the disease process, lncRNA MALAT1 binds to HDAC9 and BRG1, and recruits the complex to the promoter region of the target gene VSMC to promote H3K27me3 enrichment, so that VSMC is silenced[27]. (E) Schematic diagram of the role of lncRNA NEAT1 paraspeckles formation. lncRNA NEAT1 motif on chromosome 11 transcribes two single-exon isoform lncRNA (NEAT1_1 and NEAT1_2), where the 3′-end processing signal of NEAT1_1 is inhibited by hnRNP K (heterogeneous ribonucleoprotein K), NEAT1_2 is cleaved by Ribonuclease P (RNaseP) to produce a tRNA-like structure and forms a triple helix at its 3′ -end, and subsequently lncRNA NEAT1_2 participates in the nucleation process of paraspeckles by recruiting structural proteins (NONO, SFPQ and RBM14, etc.)[41]. (F) Schematic diagram of the mechanism by which lncRNA SLERT deregulates the repressive effect of the DDX21 loop on RNA polymerase I (Pol I). lncRNA SLERT dissociates Pol I from the protein conformation of DDX21 by altering the protein conformation of DDX21, and promotes the precursor ribosomal RNA (pre-rRNA) transcription[47]
3.2 lncRNA与核糖体
核糖体由rRNA和核糖体蛋白质共同组成,是细胞的蛋白质工厂。其在功能上可调节mRNA稳定性、介导mRNA的翻译以及与lncRNA编码功能性微肽等[51]。随着近几年科研技术的发展,发现核糖体可通过与lncRNA的sORF结合编码功能性微肽,并调节疾病和癌症的发生与发展。例如,lncRNA HOXB-AS3编码的微肽可通过抑制葡萄糖代谢的重编程,抑制结肠癌细胞的生长(Fig.2A)[52];LINC00998编码的微肽可通过激活MAPK(mitogen-activated protein kinases)信号通路促进肝细胞癌(hepatocellular carcinoma ,HCC)的肿瘤发展[53]。此外,核糖体不仅存在于细胞质中,线粒体中也存在着核糖体并与细胞质中核糖体的翻译存在某种平衡关系[54]。这种平衡关系对维持细胞稳态至关重要。lncRNA能够通过调控关键RNA结合蛋白质的定位,实现这种翻译平衡的状态,从而促进细胞生长[55]。综上所述,lncRNA除可以参与到核糖体的翻译过程,同时还可以与核糖体结合编码微肽。但有趣的是,这一编码过程多在细胞质中进行,而线粒体内核糖体编码微肽的研究还较为鲜见,有待进一步去探究。
3.3 lncRNA与线粒体
哺乳动物细胞中,线粒体是主要的动力源和代谢工厂。lncRNA可通过调节线粒体功能及稳态,介导各类疾病及癌症的发生与发展。在疾病发生或衰老过程中,线粒体的功能会受到损害。而线粒体的功能障碍则会引起哺乳动物的应激反应,而该应激反应则会导致lncRNA的异常表达,而异常表达的lncRNA则介导了线粒体动力学干扰细胞凋亡过程[56]。线粒体动力学平衡又是维持细胞内环境稳态的重要方式,所以线粒体的功能障碍会导致机体稳态失调,从而引发各类疾病。线粒体的稳态维持是调控一些代谢疾病和肿瘤发生与发展的重要方式,lncRNA可通过调控线粒体内的自噬和分裂等过程来维持这种稳态,并保持体内的氧化代谢平衡[57, 58]。此外,线粒体与细胞核和细胞质的lncRNA之间存在相互串扰的关系,并且这种关系也是线粒体稳态维持的一种方式。例如,核编码的lncRNA MALAT1可与mtDNA的多个基因座结合,调节线粒体功能(Fig.2B)[59];干扰lncRNA MALAT1可破坏线粒体功能并改变肝癌细胞HepG2的表型,同时线粒体编码的lncCytB的定位也在HepG2细胞中出现异常。在正常肝细胞HL7702中lncCytB位于线粒体中,而在HepG2细胞中却在细胞核中大量富集[60]。表明无论是核基因组编码还是线粒体基因组转录的lncRNA,其异常穿梭都可能使癌细胞发生异常并影响线粒体的代谢。此外,由mtDNA编码的lncND5、lncND6和lncCyt b 表达受到线粒体加工蛋白质调节[61],同时它们可与各自ND5、ND6和Cyt b的 mRNA互补形成双链体,稳定其伴侣mRNA或调节自身表达[62]。综上所述,发现由线粒体编码的lncRNA可以通过与核编码的lncRNA相互串扰或直接调节线粒体功能等方式,来维持细胞及细胞器内的稳定,并借此调控疾病和癌症的发生与发展。
3.4 lncRNA与溶酶体
溶酶体是真核细胞中最主要的降解细胞器,其可以通过接收由内吞途径、吞噬途径和自噬途径传递来的大分子,并对其进行降解或再循环,藉此促进细胞的新陈代谢[63]。而lncRNA则能通过调控这些过程,介导溶酶体对大分子的降解或再循环过程。lncRNA可以通过影响LC3(microtubule-associated protein light chain 3)、LAMP-2(lysosome-associated membrane protein 2)、LAMP-1(lysosome-associated membrane protein 1)等参与细胞自噬通量分子的表达[64],以及影响蛋白质的泛素化过程(Fig.2C)[65],参与到细胞自噬及自噬溶酶体的形成过程。此外,lncRNA还能通过抑制自噬关键调节剂mTOR(mechanistic target of rapamycin)表达和阻止mTORC1(mTOR Complex1)向溶酶体募集的方式促进细胞的自噬[1, 66]。综上所述,lncRNA多通过调控细胞自噬及自噬溶酶体的形成过程,参与到溶酶体对大分子的降解或再循环过程。反观lncRNA参与溶酶体膜形成、溶酶体内降解过程以及溶酶体内降解酶的合成等方面的研究仍较少,值得进一步探索。
4 外泌体中的长非编码RNA
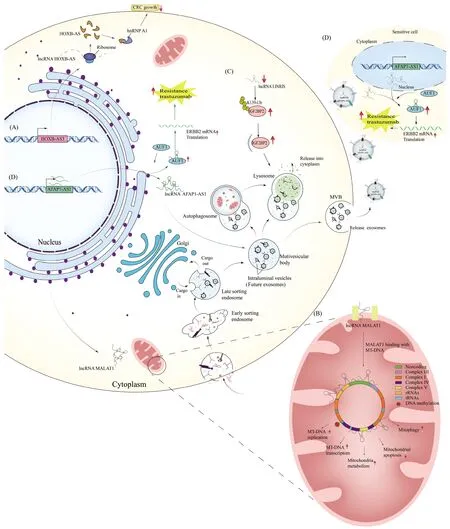
Fig.2 Schematic diagram of the regulatory mechanism of lncRNA in the cytoplasm (A) Schematic diagram of the micropeptide encoded by lncRNA HOXB-AS3 regulating the growth of colon cancer (CRC) cells. lncRNA HOXB-AS3 encodes a micropeptide that inhibits the growth of CRC cells by binding to hnRNP A1[52]. (B) Schematic diagram of lncRNA MALAT1 regulation of mitochondrial function. lncRNA MALAT1 is aberrantly expressed in mitochondria and binds to mtDNA, thereby altering mtDNA methylation status and mitochondrial function, which includes mitochondrial synthesis, metabolism, mitochondrial phagocytosis and apoptotic processes[59]. (C) Schematic diagram of the process of lncRNA LINRIS regulating ubiquitination of IGF2BP2 (insulin-like growth factor 2 mRNA-binding protein 2). When the expression of lncRNA LINRIS is reduced, it leads to degradation of IGF2BP2 by the ubiquitinated autophagic pathway[65]. (D) Schematic diagram of the mechanism of exosomal lncRNA trastuzumab resistance regulation. The highly expressed AFAP1-AS1 was divided into two parts. One part of AFAP1-AS1 binds to AUF1(AU-binding factor 1) to activate the translation of ERBB2 mRNA, upregulates HER-2 expression and induces trastuzumab resistance; the other part of AFAP1-AS1 is packaged into exosomes to propagate trastuzumab resistance to trastuzumab-sensitive cells[70]
外泌体是封装脂质,蛋白质和非编码RNA等各类小分子物质的小细胞外囊泡(extracellular vesicles,EV),其可将各类小分子转移至受体细胞,并介导受体细胞的表型变化[67]。在研究中发现,外泌体中含有大量来源不同的lncRNA,这些lncRNA随着外泌体进入受体细胞并调控细胞的表型变化。例如来源于血浆中的外泌体lncRNA可抑制远端垂体瘤的生长[68];人脐带间充质干细胞(human umbilical cord mesenchymal stem cell,UMSC)衍生的外泌体lncRNA,可防止由衰老引起的心功能性障碍[69]。此外,外泌体lncRNA可将细胞的耐药性传递到相应的敏感细胞中,从而使该细胞产生耐药性。例如在HER2(human epidermal growth factor receptor 2)阳性乳腺癌中lncRNA AFAP1-AS1的表达可增加乳腺癌细胞对曲妥珠单抗(trastuzumab)耐药性,而该耐药性可随该细胞的外泌体lncRNA AFAP1-AS1扩散至敏感细胞中(Fig.2D)[70]。除此之外,lncRNA还会通过诱导多泡体(multivesicular bodies,MVB)转运过程影响外泌体的释放[71],以及通过靶向与外泌体生成相关的基因影响外泌体的生成[72]。综上所述,外泌体lncRNA可在细胞间进行多种多样的调控,影响细胞的进程,维持着细胞的稳态。同时,lncRNA还在外泌体的生成及释放过程中发挥关键作用。此外,外泌体的功能通常取决于其所来源细胞的类型,所以可根据这一特性去设计不同治疗的载体和维持机体的稳态减少不良反应。
5 问题与展望
lncRNA大部分功能与其所在的位置密切相关。lncRNA可穿梭到细胞内的各个亚细胞结构,并富集在特定的亚细胞区室,激活相关生物功能。例如在细胞核内的lncRNA可在染色质及特定亚核区室中富集,并主要参与表观遗传和转录水平上的基因调控;细胞质内的lncRNA多在其特定的细胞器富集,并主要参与转录后和翻译水平上的基因调控;外泌体中的lncRNA进入受体细胞后可穿梭在其特定的亚细胞区室中,并进行相应的基因调控。
随着研究技术的不断发展,我们对lncRNA的研究也逐步深入,并不断刷新着对lncRNA的认知。结构决定功能,任何物质的功能发挥都离不开其特有的分子结构,研究一个物质的结构是了解其功能及其作用机制的必要前提。因此,lncRNA分子结构的解析对研究lncRNA的功能及作用机制至关重要。但由于lncRNA结构的复杂性及其表达的时空特异性,导致现在对lncRNA结构特征的研究仍相对较少。所以,lncRNA结构解析及结构与功能关系仍是接下来研究的重点。同时由于lncRNA分布与表达的时空性,这就给lncRNA的研究带来了很多的不确定性及难度,并且这一部分的解析又是了解lncRNA具体作用机制的关键,所以如何更好的去解析及寻找这些lncRNA分布与表达的时空性的内在联系,就成了现在研究亟待解决的问题。lncRNA在体内的调控通常是多种调控机制共同作用的结果,所以在研究过程中不应将lncRNA归为一类独立的参与者。
已有研究表明,lncRNA在人类各类疾病的靶向治疗和提高动物生产性能等方面都充当着重要的角色,但其具体的作用机制还需要更加深入的解析。目前关于lncRNA的研究大都集中在人类疾病,而对动物(例如山羊、奶牛等)的研究相对较少,并且大多数lncRNA功能注释数据库也是基于人类基因组数据的基础下构建。而由于物种间差异,这些基于人类基因组数据构建的数据库,不足于满足动物研究的需要。而这一现状很大程度局限了动物方面的研究,所以构建及完善与动物基因组相关的lncRNA数据库,就成了目前当务之急。此外,随着现在科学技术的发展,与疾病和动物生产性能相关的lncRNA有望获得更多的相关性,取得更大的成果,有望进一步推动人类疾病治疗及动物产业未来的发展。

