根区高温胁迫下不同空气温度对葡萄叶片PSⅡ活性的影响及恢复情况*
王 浩,李中瀚,徐鲁成,王 明,康 慧,姚玉新,杜远鹏,高 振
(山东农业大学园艺科学与工程学院,作物生物学国家重点实验室,山东果蔬优质高效生产协同创新中心,泰安 271018)
设施栽培是葡萄生产的一种重要的方式,能够克服自然条件的限制,调控葡萄生长所需要环境条件,从而达到优质、高产的目的[1-2]。设施栽培虽然可实现调温、避雨的目的,但温度过高成为不可避免的问题[3],尤其南方地区日光温室中广泛应用限根栽培模式[4],气温过高的同时伴随着根区温度的上升。此问题北方地区也时有发生,在山东省泰安地区(山东农业大学园艺实验站)日光温室的限根器中,夏季10 cm 土层的温度能够上升到35 ℃,20 cm 和30 cm 的土层温度也能够上升到31 ℃。气温和根区温度的异常升高给农业生产带来了巨大的挑战。
光合作用是植物最基础的生命活动之一,对胁迫环境极为敏感。有研究发现,葡萄光合作用最适气温为25~35 ℃[5-6],当超过这一范围时葡萄叶片光合效率便有所下降。孙胜楠等[7]发现,在高气温环境中处理的黄瓜幼苗叶片PSⅡ最大光化学效率(Fv/Fm)、PSⅡ有效量子效率[Y(Ⅱ)]、电子传递效率(ETR)均较适宜气温显著降低,在大葱[8]、三七[9]上也得到了相似的结论。Ding 等[10]发现,35 ℃的根区高温显著降低了黄瓜幼苗叶片的叶绿素含量、光合速率以及其相关基因的表达,影响了光合作用的正常进行。普遍认为PSⅡ是光抑制发生的主要位点,抑制程度取决于光破坏和光修复的速率[11],如果损伤速率超过修复速率,便会严重影响叶片PSⅡ的光能利用效率。然而高等植物在进行光合作用时不可避免地会发生PSⅡ光破坏,主要是由于PSⅡ反应中心D1 蛋白的破坏、降解和净损失[12]。为保证光合作用能够正常进行,植物能对受损伤的PSⅡ进行快速修复[13-14],主要由以下几个步骤组成:蛋白的去磷酸化、PSⅡ复合物的分解,D1 蛋白的降解和从头合成,装配至PSⅡ复合体上[15]。另外,PSⅡ光抑制与活性氧(ROS)紧密相关,ROS 能够抑制编码D1 蛋白基因(PsbA)的转录和翻译,进而抑制逆境胁迫中PSⅡ的修复[16]。
近年来,异常高温天气频繁出现[17],高气温出现的同时往往伴随着根区高温,设施栽培虽然可通过通风、微喷、搭设遮阳网等措施快速降低设施内气温,但由于土壤比热容大,升温和降温慢[18],气温降低后根区高温仍会持续一段时间。因此,研究根区高温胁迫下不同空气温度对葡萄叶片PSⅡ活性的影响及恢复情况具有重要意义。对叶片进行叶绿素荧光分析是研究胁迫反应的重要手段之一,但目前尚未有对此种环境条件下的葡萄叶片进行叶绿素荧光分析的报道。本文以巨峰葡萄为试材,利用叶绿素荧光测定分析探讨根区高温胁迫下不同空气温度对葡萄叶片PSⅡ活性的影响及恢复情况的影响,为葡萄的种植管理提供依据。
1 材料与方法
1.1 试验设计
以1 年生巨峰葡萄(Vitis viniferaL.×V.labruscaL.cv.‘Kyoho’)为试材,种植用双色盆直径17 cm、高15 cm,栽培基质按蛭石∶草炭∶珍珠岩∶牛粪=1∶1∶1∶1 的比例进行混合。葡萄苗培养于山东农业大学南校区园艺实验站日光温室,待植株长至10~12 片完全叶时进行胁迫处理。选取长势一致的植株转移至人工气候箱,用LED 冷光源植物灯(型号SP501-N,405 W,上海三澎机电有限公司)进行照光,光照强度设为(800±100) μmol·m-2·s-1。利用水浴锅(型号HH-4,300 W,国华仪器制造有限公司)对根区温度进行控制,用11 号自封袋套住双色盆,将其置于水浴锅中,以土壤表面没入水面之下为标准,用水银温度计监测土壤表面下5~8 cm 处的温度。处理前先对自然生长环境30/25 ℃气温/根区温度组合中的叶片进行荧光参数的测定并以此为对照(CK),然后将根区温度稳定在(35±2)℃,利用人工气候箱控制空气温度,共设置(30±1)℃、(35±1)℃、(40±1)℃ 3 个气温梯度,胁迫处理时间均为5 h,分别记为T1、T2、T3。而后在30/35 ℃气温/根区温度组合下暗恢复3 h,在0 h(R0)、1 h(R1)、2 h(R2)和3 h(R3)分别选择第5 节位的完全展开叶进行相关参数的测定。
1.2 快速叶绿素荧光诱导曲线的测定
用连续激发式荧光仪(Handy PEA,Hansatech,英国)对不同处理后的葡萄叶片充分暗适应30 min后测定快速叶绿素荧光诱导动力学曲线(OJIP 曲线),OJIP 曲线由3 000 μmol·m-2·s-1红光诱导,测定时间为1 s。从OJIP 曲线中可以得到以下参数。Fo:(20~50 μs)最小荧光;Fk:K 点(0.3 ms)的荧光;Fj:2 ms 时J 点的荧光;Fi:30 ms 时I 点的荧光;Fm:0.3~2 s 时的最大荧光。
依据JIP-text 得到的OJIP 曲线,可获得如下参数[19-20]。PSⅡ最大光化学效率(Fv/Fm)=φPo=TRo/ABS=[1-(Fo/Fm)];J 点的相对可变荧光(Vj)=(Fj-Fo)/(Fm/Fo);单位面积内有活性的反应中心的数量(RC/CSm)=Fm·φPo·(Vj/Mo);捕获激子将电子传递到电子传递链中超过QA的其他电子受体的概率(φEo)=ETo/TRo=(1-Vj);单位面积吸收的光能(ABS/CSm)≈Fm;单位面积捕获的光能(TRo/CSm)=φPo·(ABS/CSm);单位面积电子传递的量子产额(ETo/CSm)=φEo·(ABS/CSm);单位反应中心吸收的光能(ABS/RC)=Mo·(1/Vj)·(1/φPo);单位反应中心捕获的用于电子传递的能量(ETo/RC)=Mo·(1/Vj)·φEo;单位反应中心捕获的用于还原QA的能量(TRo/RC)=Mo·(1/Vj);用(Fm-Fo)进行标准化后K 点相对可变荧光的变化(Wk)=(Ft-Fo)/(Fm-Fo)。
1.3 叶绿素荧光淬灭参数的测定
使用Dual-PAM-100 叶绿素荧光仪(Walz,德国)进行饱和脉冲分析,在测量之前将植株于原处理环境中暗适应30 min。测定暗适应后最小荧光(Fo)和PSⅡ最大荧光产量(Fm)以及P700 中最大氧化量子产量(Pm)。然后打开光化光测定诱导曲线,光照强度设定为471 μmol·m-2·s-1,每30s 打开1次饱和脉冲(10 000 μmol·m-2·s-1)对荧光参数进行测定,记录不同光化光强度下荧光参数及光曲线拟合参数的变化。参照仪器使用说明手册以及Kramer 等[21]的方法分析不同叶绿素荧光参数,Y(Ⅱ)=(Fm′-Fs)/Fm′:PSⅡ的有效量子效率;Y(NO)=1/[NPQ+1+qL(Fm/Fo-1):非调节能量耗散的量子产率;Y(NPQ)=1-Y(Ⅱ)-1/[NPQ+1+qL(Fm/Fo-1)]:调节性能量耗散的量子产率;qP=(Fm′-Fs)/(Fm′-Fo′):光化学淬灭,由于光诱导碳同化酶的活化和气孔的开放,使得电子从PSⅡ向外传递的速率加快而引起的荧光猝灭;1-qP:PSⅡ次级电子受体QA氧化还原状态。
1.4 数据分析
用Microsoft Excel 2019 处理数据和作图,用SPSS 26.0 软件对数据进行单因素方差分析及多重比较。数据以平均值±标准差表示。
2 结果与分析
2.1 根区高温胁迫下不同空气温度处理对葡萄叶片快速叶绿素荧光动力学曲线(OJIP)的影响
OJIP 曲线能反映多种关于PSⅡ的光化学信息,因此荧光检测分析技术被广泛地应用到PSⅡ活性的检验上[22-23]。如图1-A 所示,胁迫处理后T1、T2仍保持着典型的OJIP 曲线形状,而T3 处理则失去了典型的形状。T1、T2、T3 处理相较于CK P 点(0.3~2 s)最大荧光产量(maximal fluorescence,Fm)均明显下降,表明叶片单位面积吸收光能的能力显著降低,而T3 处理O 点初始荧光(initial fluorescence,Fo)强度相较于CK 明显升高,O 点荧光是暗适应后的光合机构全部PSⅡ中心完全开放时的荧光强度,反映了PSⅡ天线色素受激发后的电子密度,Fo明显升高表明反应中心和天线色素可能发生了解离。

图1 根区高温胁迫下不同空气温度处理对原始快速叶绿素荧光诱导曲线(A)和标准化快速叶绿素荧光诱导曲线(B)的影响
为了更加直观地展现出不同处理之间的差异,对原始的OJIP 曲线进行Vt=(Ft-Fo)/(Fm-Fo)标准化处理后得到相对荧光变化曲线。从图1-B 可知,与CK 相比,T1、T2 处理K 点(0.3 ms)、J 点(2 ms)有较为明显的升高,但不及T3 处理K 点、J 点上升明显,表明根区高温下3 个处理放氧复合体(OEC)均受到了一定的损伤,天线色素捕获的光能进入电子传递链的比例显著降低,其中T3 处理损伤最为明显。
2.2 根区高温胁迫下不同空气温度处理及3 h 暗恢复对葡萄叶片快速叶绿素荧光动力学参数的影响
与CK 相比,处理后葡萄叶片各参数均表现出明显的变化,其中T3 处理各参数变化最为明显,T1 处理变化幅度最小(图2)。各处理叶片Fv/Fm相较于CK 均有所下降,其中T3 处理下降幅度最大,下降了18.2%,T1、T2 处理分别降低了5.5%、5.0%;RC/CSm也表现出相同的变化趋势,T1、T2、T3 处理分别下降了25.0%、27.5%、56.7%。T1、T2 处理的φEo较处理前变化幅度小,而T3 处理则表现出显著的变化,下降了74.5%。Wk、Vj能够反映PSⅡ供体侧和受体侧的受伤害程度,与处理前相比3 个处理Wk分别增加了12.7%、15.4%、26.4%,Vj分别上升了 5.5%、17.5%、115.3%,表明在 30/35 ℃、35/35 ℃、40/35 ℃的气温/根区温度的环境中均对叶片PSⅡ供受体侧造成了一定的损伤。暗恢复3 h后,T1、T2 处理的荧光参数具有明显的回升或回落趋势,表明T1、T2 对叶片的伤害是可逆的;T3 处理的Fv/Fm、RC/CSm、Wk在暗恢复过程中能够较快地恢复,其中Fv/FmR3 期较R0 期上升了15.5%、RC/CSm上升了71.3%、Wk下降了6.0%,而φEo、Vj经3 h 的恢复后并无明显的回升或回落趋势。

图2 根区高温胁迫下不同空气温度处理及3 h 暗恢复对快速叶绿素荧光动力学参数的影响
通过JIP-text 还可以对叶片PSⅡ光能吸收、捕获、传递效率进行分析[19]。如图3-A、B、C 所示,以单位反应中心(RC,PSⅡ)为研究对象时,不同气温协同根区高温处理的ABS/RC、TRo/RC相较于CK 均显著上升,气温越高二者的上升幅度越大。相较于CK,T3 处理的ABS/RC、TRo/RC分别上升了39.3%、28.1%,而ETo/RC变化趋势与前二者相反,相较于处理前,3 个处理的ETo/RC均有所下降,T3处理下降最显著,降低了69.1%。经过3 h 的暗恢复,各处理的ABS/RC、TRo/RC、ETo/RC均无明显的变化。
如图3-D、E、F 所示,以单位面积(CS)为研究对象时,3 个处理的ABS/CSm、TRo/CSm、ETo/CSm相较于CK 均显著降低,其中T3 处理下降幅度最为显著,与CK 相比T3 处理的ABS/CSm、TRo/CSm、ETo/CSm分别降低了21.7%、49.6%、82.2%。暗恢复3 h 后,3 个处理的ABS/CSm、TRo/CSm能够较快地回升,3 个处理R3 期ABS/CSm较R0 期分别上升了10.1%、9.7%、18.6%,TRo/CSm分别上升了16.2%、24.0%、64.9%,而ETo/CSm无明显的回升趋势。

图3 根区高温胁迫下不同空气温度处理及3 h 暗恢复对叶片光能吸收、能量捕获及电子传递的影响
2.3 根区高温胁迫下不同空气温度处理及3 h 暗恢复对葡萄叶片荧光淬灭参数的影响
如表1 所示,高温胁迫处理显著降低了叶片的Y(Ⅱ),T1、T2、T3 处理与CK 相比分别降低了17.7%、33.3%、43.3%,气温越高Y(Ⅱ)值越小;Y(NO)的变化趋势与Y(Ⅱ)相反,随气温上升其值逐渐上升,T3 处理变化达到显著水平,相较于处理前上升了47.1%;Y(NPQ)随气温的上升呈现出先升高后下降的变化规律,但均未达到显著水平;1-qP 表现出随气温的升高而逐渐上升的趋势,且均达到了显著水平,分别上升了5.0%、6.3%、7.9%。经3 h 暗恢复后,3 个处理Y(Ⅱ)值仍在继续减小,其中T1 处理较胁迫处理后下降幅度达到显著水平,降低了30.2%;Y(NO)值较胁迫处理后也有所降低,T3 处理较胁迫处理后下降幅度达到显著水平,降低了10.4%;Y(NPQ)变化趋势与前者相反,3 个处理较胁迫处理后有所上升,这可能是由于暗恢复后热耗散机制活性恢复,耗散过剩激发能的能力上升所致;暗恢复后1-qP 同胁迫处理后相比无显著变化。
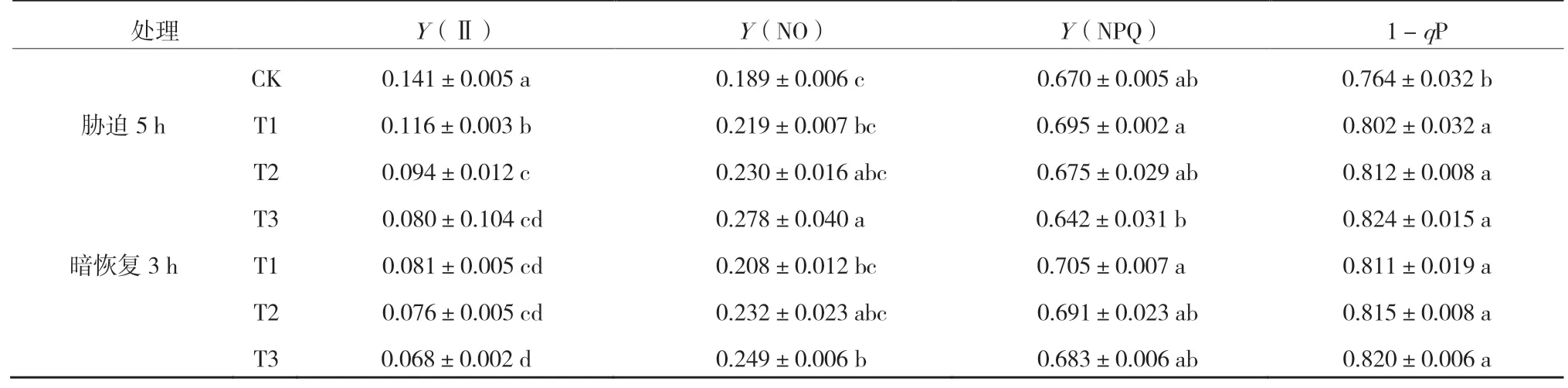
表1 根区高温胁迫下不同空气温度处理及3 h 暗恢复对叶绿素荧光淬灭参数的影响
3 讨论与结论
植物的光合机构受到外界环境和内部环境的综合影响,光合作用的正常进行需要一定的温度和光照范围,超出这个范围植物便会受到胁迫,对光合作用产生光抑制[24]。孙永江等[25]研究结果表明,在适宜的光照条件下,当空气温度上升至37 ℃及以上时,赤霞珠葡萄叶片的PSⅡ便会发生严重的光抑制甚至光破坏。Xia 等[26]研究表明,当根区温度上升到36 ℃时,玉米叶片PSⅡ反应中心便会受到损伤,光合速率下降。本试验也得出了相似的结论,经过5 h 处理后T1、T2、T3 处理的Fv/Fm、φEo、RC/CSm相较于CK 显著下降,且WK、Vj均有上升的趋势,说明处理后叶片PSⅡ受到了一定的损伤。光破坏有2 种可能的情况,即起源于受体侧的光破坏和起源于供体侧的光破坏,前者主要是由于CO2同化受阻,还原性Q-A的积累促生了大量的三线态P680,三线态P680 能和O2反应生成强氧化剂单线态氧(1O2),而D1 蛋白中的组氨酸残基是1O2攻击、破坏的位点;后者则是由于原初电子供体电子传递受阻从而延长了P680+的寿命,P680+对D1 蛋白造成氧化破坏[27]。本研究中T1、T2 处理的Wk、Vj上升幅度大致相同,而T3 处理的Vj上升幅度显著高于Wk的上升幅度,这可能是由于40/35 ℃的气温/根区温度环境降低了Rubisco 的活性,抑制了PSⅡ受体侧的电子传递,从而对PSⅡ造成了严重的光破坏。另外,T1、T2、T3 处理叶片的ABS/RC、TRo/RC值相较于CK 明显上升,而ABS/CSm、TRo/CSm却较CK 显著下降,表明叶片可能通过增加单位反应中心的光能吸收和能量捕获来弥补单位面积功能的下降,以此来适应胁迫环境。
许大全[28]研究表明,在没有其他严重胁迫的自然环境中,光抑制是维护光合机构免受光破坏的机制运转反应,它主要是以热的形式耗散掉过剩光能从而避免过剩激发能的积累。在本试验中,根区高温的条件下叶片有效量子效率Y(Ⅱ)都呈现出下降趋势,且气温越高下降幅度越大。在气温上升到40 ℃之前,叶片尚可以通过提高Y(NPQ)来耗散掉光合性能下降而过剩的激发能,以保护叶片不受到过剩激发能造成的氧化损伤,而当气温上升到40 ℃之后,调节性能量耗散机制变得低效,Y(NPQ)值较CK 显著降低,从而致使T3 处理的Y(NO)显著上升,此时T3 处理叶片光合机构受到了严重的损伤。
植物存在一系列的保护机制来缓解光的伤害作用,如叶黄素循环、环式电子传递、光呼吸等,其中D1 蛋白的快速合成被认为是重要的光修复途径之一[29]。Luo 等[30]研究表明,葡萄叶片在气温40 ℃的适光环境中胁迫5 h 后经一段时间的恢复后荧光指标均能恢复至对照水平,这表明叶片可以通过自身的修复机制进行快速的功能恢复。本试验中经过3 h 的暗恢复T1、T2 处理荧光参数具有明显的回升或回落趋势,表明室温黑暗处理对根区高温环境中叶片PSⅡ具有一定的恢复作用;T3 处理经3 h 的暗恢复Fv/Fm、RC/CSm、ABS/CSm、TRo/CSm能够较快地回升,而φEo、Vj、ETo/CSm无明显的回升或回落趋势,这可能是由于T3 处理下电子从QA到QB的传递受阻,三线态P680 与O2反应生成1O2对D1 蛋白造成损伤,从而致使代表受体侧受伤害程度的参数Vj不能较快地回落。另外,在暗恢复过程中,叶片还可以通过提高Y(NPQ)和提高1-qP 的方式来减少激发能的积累,从而对光合机构起到一定的保护作用。
综上所述,30/35 ℃、35/35 ℃气温/根区温度的环境中对叶片PSⅡ产生的影响较小,并且经过暗恢复后呈现出明显的恢复趋势;而在40/35 ℃气温/根区温度的环境中,PSⅡ受到了严重的损伤,且经过暗恢复后φEo、Vj、ETo/CSm无明显的回升或回落趋势,表明此环境条件下由于电子传递受阻而对PSⅡ受体侧造成的损伤在短时间内无法恢复。

