miRNAs可能通过调控MAPK通路参与心室间隔缺损
江 辉,张 林
(浙江中医药大学 生命科学学院,浙江 杭州 310053)
先天心脏病(congenital heart disease,CHD)指出生时由于心血管系统异常或发育障碍而引起的心血管畸形[1]。室间隔缺损(ventricular septaldefect,VSD)是 CHD最常见的症状之一,占 CHD的20%[2]。近年来,对VSD的分子调控和发病机制的研究受到了国内外学者的重视,认为从分子水平研究与心脏发育有关的染色体和基因变化,对于探索其发生机制具有重要意义[3],但由于涉及的基因、途径和机制复杂,VSD的发病机制尚不明确。
miRNA是一类非编码、高度保守的RNA,其长度约18 nt[4]。它在心脏发育及心肌细胞的增殖等过程中具有重要作用,可检测血样中miRNA表达水平的变化,并将其作为诊断和预测VSD的标志分子[5]。本研究旨在通过miRNA表达谱技术检测VSD患儿和健康婴儿血样,并对差异表达的miRNAs进行整理分析,深入探究其与靶基因及相关信号通路之间的潜在联系,进一步阐明miRNAs在VSD中的表达在分子生物学中的角色。
1 材料与方法
1.1 材料
1.1.1 研究对象:选取浙江绿城心血管病医院中经胸部X片和心脏彩超诊断为单纯型 VSD患儿5例,设为 VSD组;选取该院未患心脏疾病的健康婴儿4例,设为正常组。所有血样均经浙江绿城医院伦理委员会批准(20150029),并告知血样将用于研究目的,并取得所有涉及此研究患者或监护人的同意。
1.1.2 试剂:PAXgeneTm采血管(Qiagen有限公司);microRNA microarray-miRBase human 20.0版μParaflo®芯片;TaKaRaSYBR®Premix Ex TaqTm、RT-qPCR试剂盒TaKaRa PrimeScriptTmR(TaKaRa公司);抗兔单抗血清、山羊抗兔血清IgG/HRP(艾碧康生物公司)。
1.2 方法
1.2.1 样本的采集:参照PAXgeneTm采血管产品手册的要求,采集VSD组和健康组中婴儿的外周血液作为样本,并保存于-80℃冰箱中。
1.2.2 高通量测序分析miRNAs表达谱:miRNAs表达谱实验操作由联川公司杭州分公司进行。对所得数据取中间值并进行标准化处理,分别计算VSD组和健康组的log2比值和t检验的P值。对有显著性差异表达的 miRNAs按log2的绝对比值大于1且P≤0.1的标准进行筛选。
1.2.3 靶基因的预测与分析:分别使用 miRbase、Targetscan和 Miranda等生物信息数据库预测差异表达 miRNAs的靶基因。对获得的靶基因进行生物信息学Gene Ontology基因功能与富集分析。
使用集算器算法(esProc)将近年来已被研究证实与心脏发育密切相关的基因和预测靶基因进行交集比对,并通过Cytoscape软件对交集比对的结果和差异表达的miRNAs进行互作分析。
1.2.4 靶基因信号通路的搜索:通过 KEGG和REACTOME通路数据库检索差异表达miRNAs靶基因参与的信号通路。利用Fisher’s法计算每条路径的P值,以P<0.05为标准进行筛选。
1.2.5 RT-qPCR检测关键通路中关键基因转录水平:内参基因为GAPDH。使用RT-qPCR法检测关键通路中关键基因的转录水平,实验步骤按照试剂TaKaRaSYBR® Premix Ex TaqTm和TaKaRaPrimeScriptTmRT的使用说明进行。
1.2.6 Western blot检测关键通路中关键基因蛋白表达水平:Western blot检测关键通路中关键基因蛋白表达水平。洗净条带后加入显影液进行 ECL处理,利用显像仪进行曝光成像,并用Image J分析各蛋白相对表达。内参蛋白为 GAPDH。
1.3 统计学分析
2 结果
2.1 差异表达的miRNAs列表
与健康组相比,有22个差异表达miRNA符合筛选要求。共有19个miRNA表达下调,3个miRNA表达上调(表1)。
并做出22个差异表达的miRNAs微阵列达谱热聚图(图1)。

表1 差异表达的miRNAsTable 1 Differentially expressed miRNAs
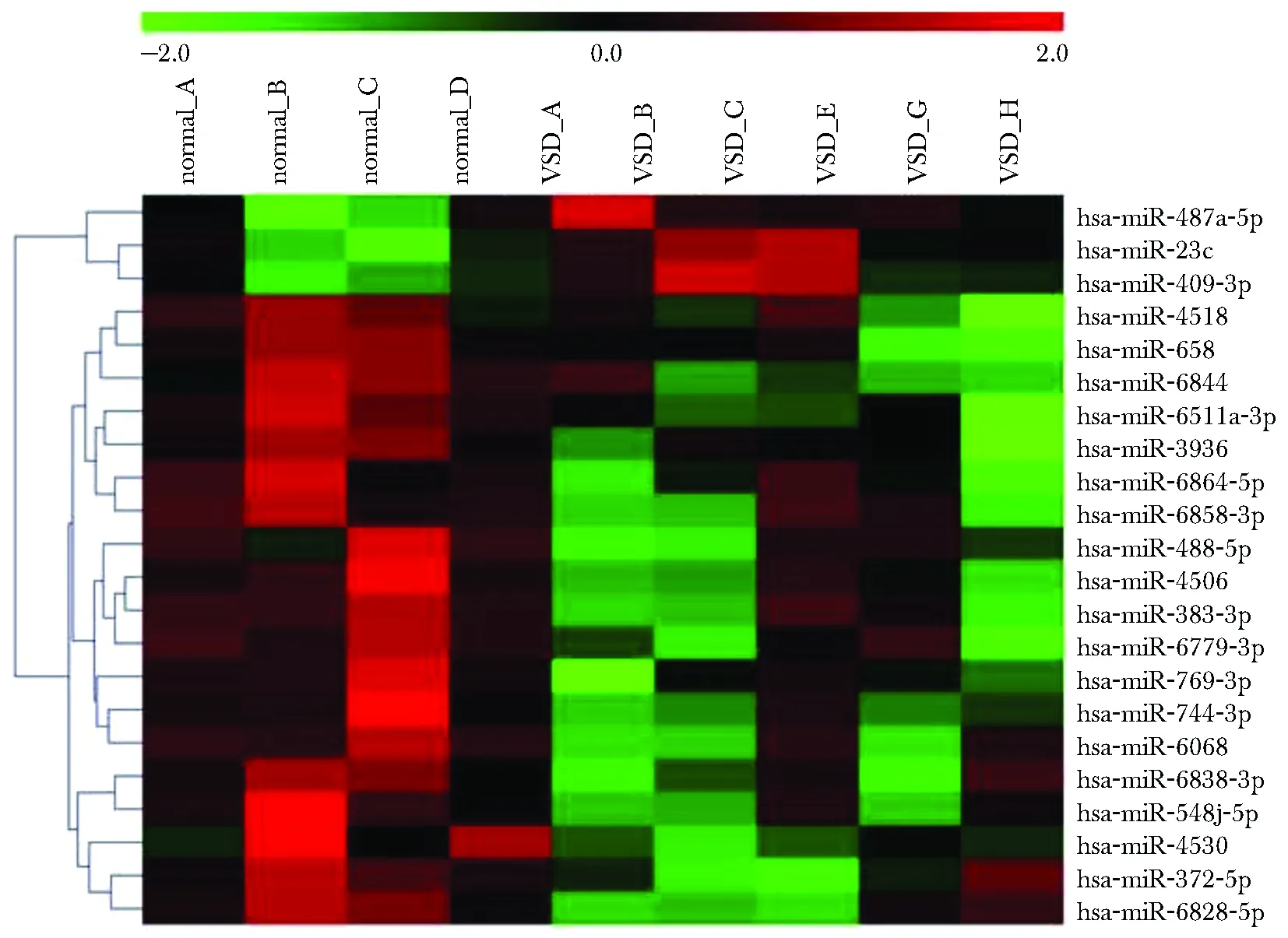
The top showed the corresponding numbers of the samples in the normal group and the VSD group;from left to right, there were 4 normal groups and 5 VSD groups; the right side represented the names of 22 differentially expressed miRNAs; the color of the thermal aggregation graph indicated the expression level of miRNA in the sample, where the expression level from red to green gradually decreased; the miRNA cluster tree was located on the left side of the picture, and these 22 miRNAs were clustered
2.2 22种差异表达miRNA靶基因的预测结果
共获得12 744个目的基因。由于每个miRNA对应的靶基因数量过多,本文仅显示部分靶基因(表2)。且大部分目的基因可能与心肌细胞分化、增殖,心脏生长发育密切相关。
2.3 与心脏发育相关的重点靶基因的筛选
整理得到61个已被证实与心脏发育有着密切联系的相关基因(下简称:已知心脏发育相关基因),并将其与预测的12 744个目标基因进行交集比对,发现其中NKX2-5、GATA6等50个已知心脏发育相关基因受到22个差异表达miRNA的调控。做出22个差异表达的miRNA与50个已知心脏发育相关基因之间的调控网络图(图2)。
2.4 靶基因信号通路分析结果
共获得126条相关信号通路。通过对这126条信号通路的研究和分析,发现其中的MAPK通路与心脏发育密切相关,经过进一步筛选,发现差异表达miRNAs参与调控MAPK通路中的关键5个靶基因,分别为:神经纤维蛋白1(neurofibromin 1,NF1)、Ras GTPase激活蛋白1(Ras GTPase-activating protein 1,RASA1)、肿瘤坏死因子(tumor necrosis factor,TNF)、肿瘤坏死因子受体超家族成员1A(tumor necrosis factor receptor superfamily member 1A,TNFRSF1A)、肌细胞增强因子2C(myocyte enhancer factor 2C,MEF2C)(图3)。
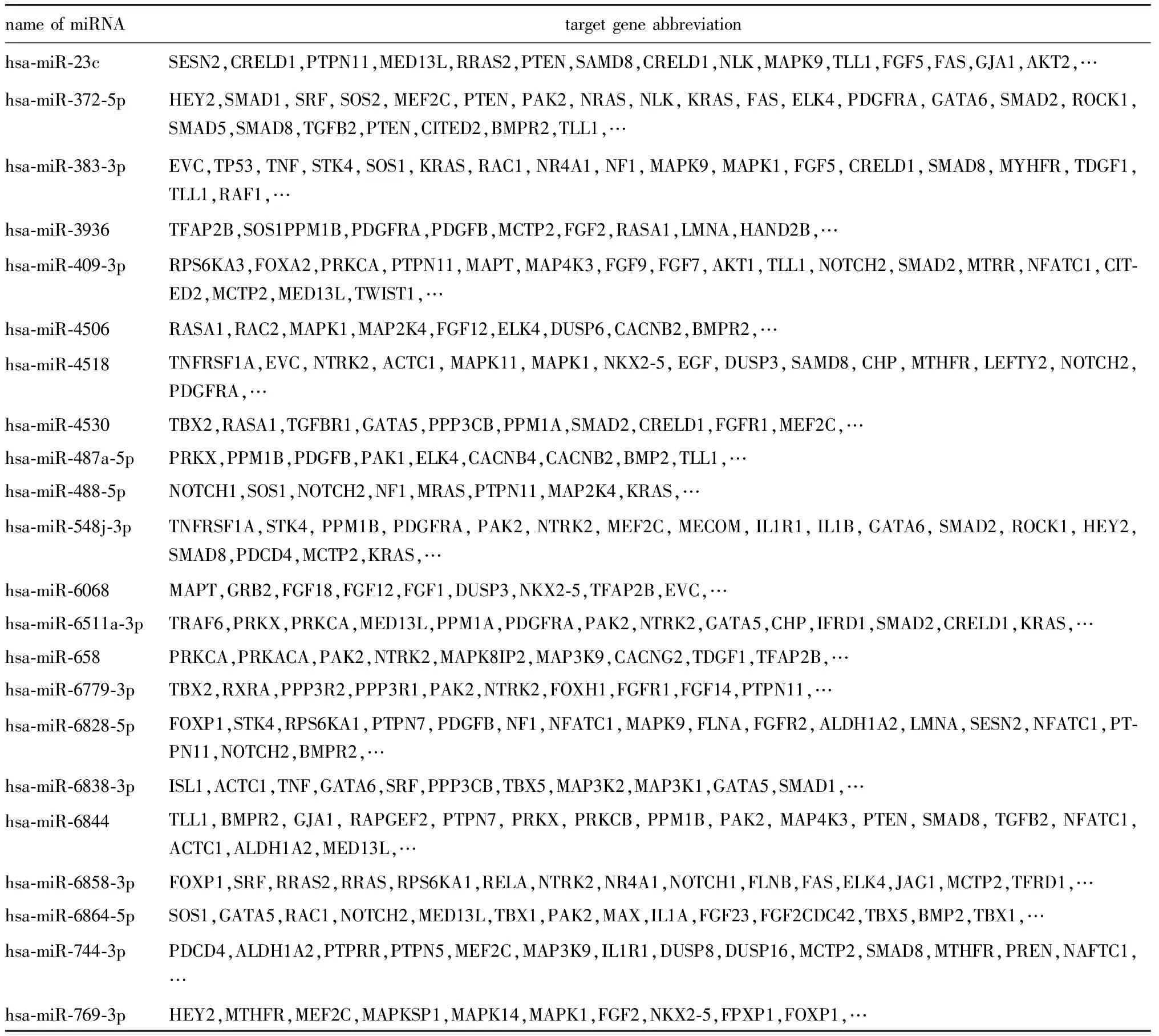
表2 22个差异表达miRNA与心脏发育相关的靶基因列表Table 2 List of 22 differentially expressed miRNA target genes related to heart development
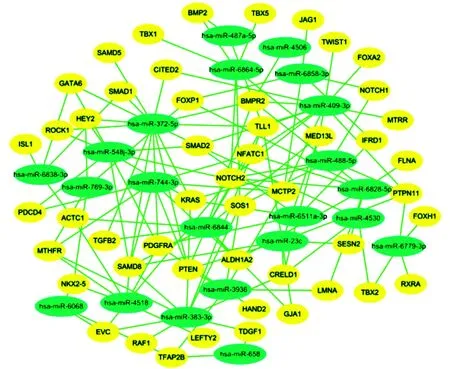
Blue indicated 22 differentially expressed miRNAs, yellow indicated 50 known heart development-related genes, and the line indicates that there was a regulatory relationship between the two
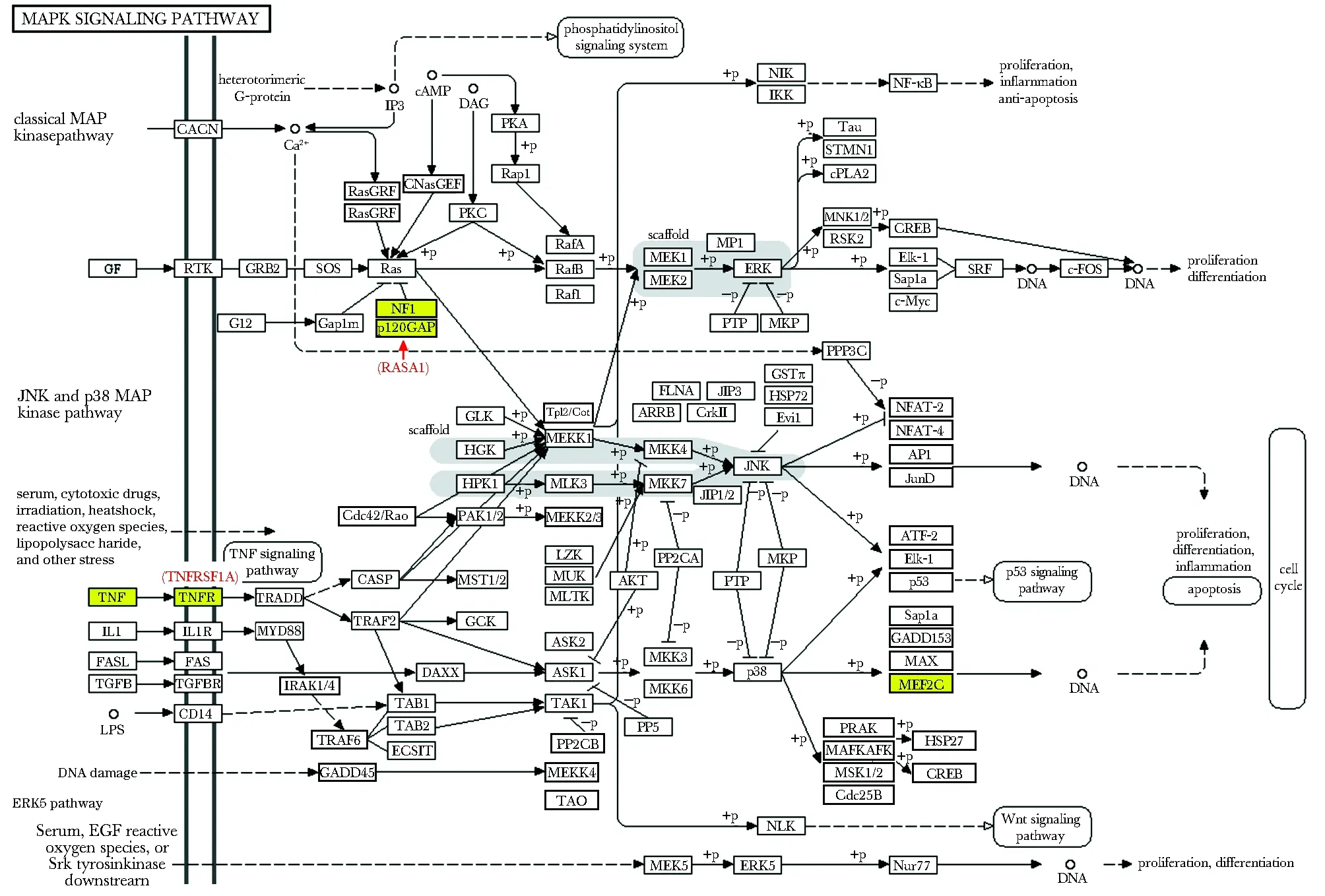
The yellow box indicated the target gene that had been screened; among them, NF1 and RASA1 participated in the ERK sub-pathway, and MEF2C, TNF, and TNFRSF1A participated in the p38/MAPK sub-pathway
2.5 关键通路中关键基因的转录水平
对健康组和VSD组的全血标本关键通路(MAPK通路)中的10个关键基因NF1、 RASA1、TNF、 TNFRSF1A、MEF2C、Ras蛋白(Ras protein,Ras)、丝裂原激活的蛋白激酶激酶1(mitogen-activated protein kinase kinase 1,MEK1)、丝裂原活化蛋白激酶1/3(mitogen-activated protein kinase1/3,ERK)、TNF受体相关因子2(TNF receptor-associated factor 2,TRAF2)、p38 MAP激酶(p38 MAP kinase,p38)的转录水平进行检测(图4)。
2.6 关键通路中关键基因的蛋白表达水平
对NF1、 RASA1、TNF、 TNFRSF1A、Ras、TRAF2的蛋白表达水平进行测定。其中MEK1、ERK、p38、MEF2C分别测定其总蛋白和磷酸化(phospory-lation,p)蛋白的表达水平(图5)。
2.7 差异表达的miRNAs与MAPK通路中关键靶基因间的关系
在22个差异表达的miRNA中有12个差异表达miRNA参与调控MAPK通路,有6个miRNA参与调控ERK通路中的2个靶基因(NF1、RASA1);8个miRNA参与调控p38/MAPK通路中的3个靶基因(TNF、TNFRSF1A和MEF2C)(图6)。
并做出12个差异表达miRNA和5个关键靶基因之间的调控网络图(图7)。
3 讨论
本研究利用miRNAs表达谱芯片检测VSD组与健康对照组全血样本,共获得22个差异表达miRNA,其调控的靶基因中有50多个已知基因对心脏发育有重要影响。
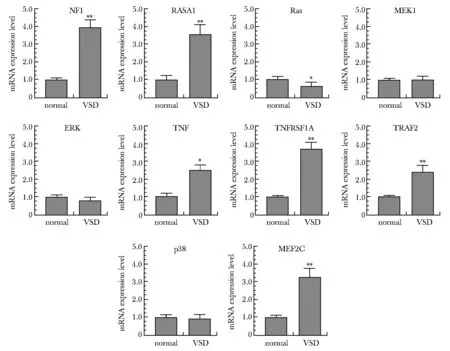
*P<0.05, **P<0.01 compared with normal图4 健康组和VSD组关键通路中关键基因转录水平Fig 4 Transcription levels of key genes in key pathways in the normal group and the VSD group
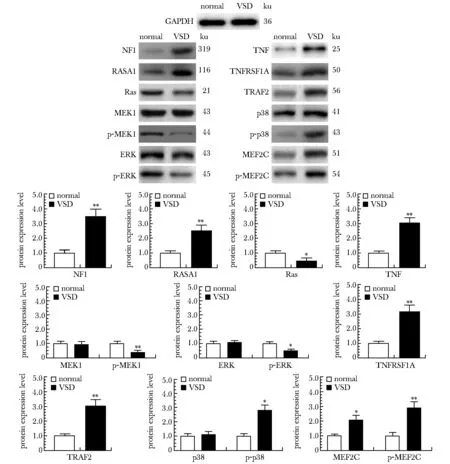
*P<0.05, **P<0.01 compared with normal图5 健康组和VSD组关键途径中关键基因的蛋白表达水平Fig 5 Protein expression levels of key genes in the key pathways of the normal group and VSD group
进一步发现其中12个表达异常miRNAs可导致MAPK通路异常。MAPK家族是丝/苏氨酸蛋白激酶的一种,有ERK、JNK、p38/MAPK 3条子通路[6]。本研究发现RASA1、NF1、TNF、TNFRSF1A、MEF2C 5个靶基因参与ERK和p38/MAKP通路。
ERK通路在调节细胞增殖、分化以及细胞对外部压力和其他生理过程的反应中起重要作用。在ERK通路中,Ras蛋白是其中的核心蛋白,涉及增殖、分化、蛋白合成等功能[7]。当受到外界鸟苷酸交换因子刺激时, Ras与GTP结合形成激活状态[8],通过磷酸化修饰增强BRAF、ARAF基因的表达,激活RAF激酶。激活的RAF激酶又能通过磷酸化修饰激活MEK,MEK不仅能够作为ERK的活化剂, 也能作为ERK的细胞质锚定蛋白[9]。活化的MEK通过磷酸化修饰激活下游的ERK促进细胞进入分裂增殖周期,在细胞分化、增殖中发挥重要的调控作用[10]。活化的ERK可以促进Fos蛋白的表达,在胞质内形成后迅速进入细胞核,促进心肌细胞的分化。在ERK通路的一系列激活过程中,Ras蛋白占据着重要地位,但其受到NF1和RASA1两个基因的负调控作用。本研究检测了ERK通路中的NF1、RASA1、Ras、MEK1、ERK等5个关键基因的转录水平和蛋白表达水平,结果显示ERK通路被抑制。
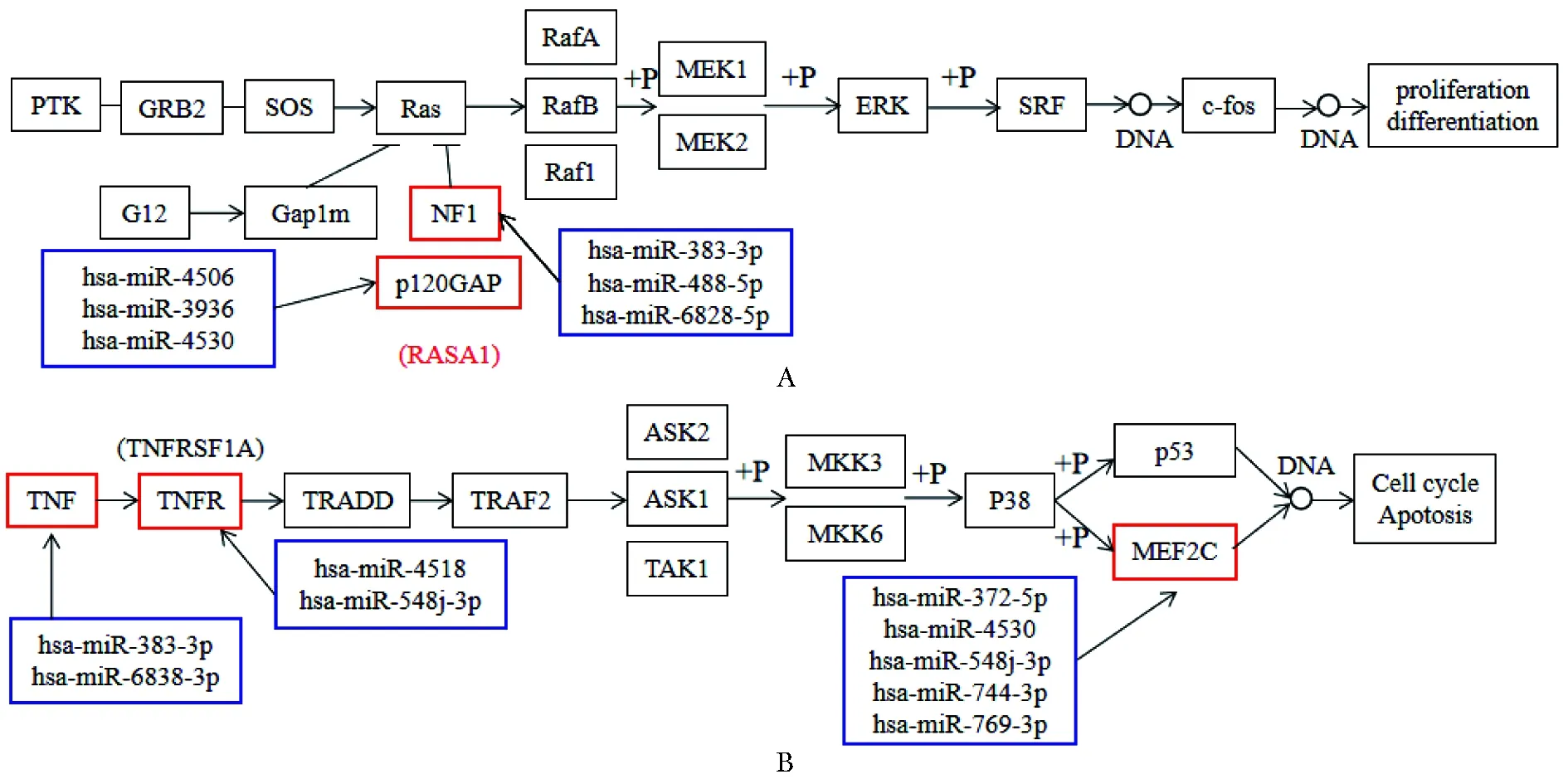
A.indicated the ERK pathway; B.indicated the p38/MAPK pathway; the red box represented the target gene, and the blue box represented the differentially expressed miRNA that regulated the target gene
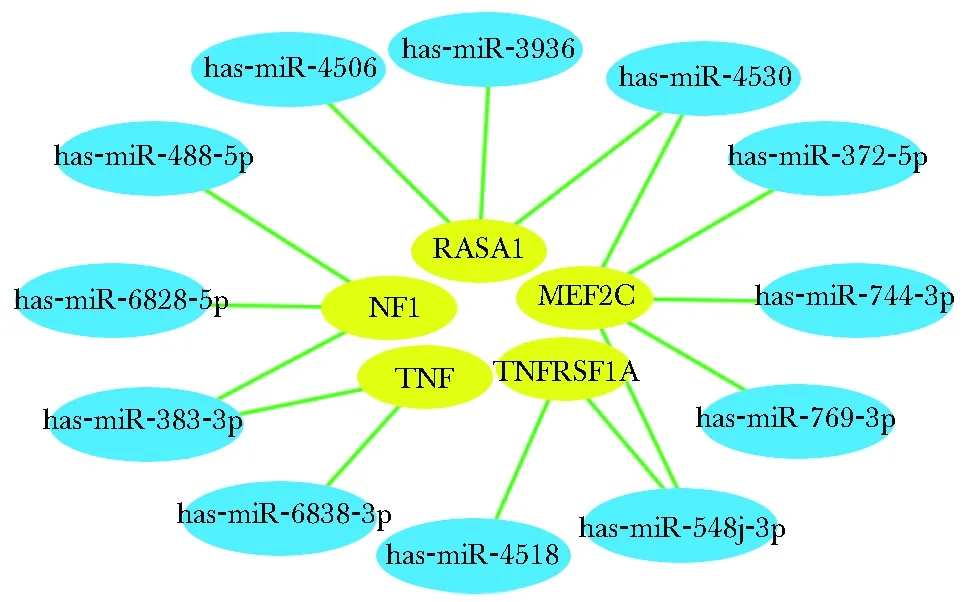
The blue indicated the differentially expressed miRNAs, the yellow indicated the target gene, and the line indicated the regulatory relationship between the two图7 12个表达差异的miRNA和关键靶基因的调控网络图Fig 7 Regulatory network diagram of 12 differentially expressed miRNAs and key target genes
MAPK通路的另一条子通路为p38/MAPK通路,其生理过程为:当TNF与TNFRSF1A胞外区结合时,引起TNFRSF1A的三聚化,其胞内区的死亡结构域与肿瘤坏死因子受体1型相关死亡结构域蛋白(tumor necrosis factor receptor type 1-associated death domain protein,TRADD)相结合[11],进一步与TRAF2的TRAF结构域结合形成死亡诱导信号复合物,进而招募聚集丝裂原激活的蛋白3激酶5(mitogen-activated protein kinase kinase kinase 5,ASK1)[12]。大量集聚活化的ASK1、ASK2等可以通过一系列磷酸化作用激活p38。p38是MAPKs家族成员,是一种促进炎性激酶应激活化的酶[13],当其被激活后,可通过磷酸化修饰激活多种转录因子,如MEF2C、p53等,这些核转录因子可进入细胞核,促进炎性因子的转录表达,进而产生级联式炎性瀑布反应,引起心肌细胞凋亡。本研究检测了p38/MAPK通路中的TNF、TNFRSF1A、TRAF2、p38、MEF2C等5个关键基因的转录水平和蛋白表达水平,结果显示p38/MAPK通路被激活。
综上所述,12个差异表达miRNA显著下调,对5个靶基因的抑制作用减弱,继而造成5个靶基因的表达上调。在ERK通路中,NF1和RASA1的表达上调,负调控该通路核心蛋白Ras蛋白的表达,进而导致ERK通路被抑制,心肌细胞分化受到抑制。而在p38/MAPK通路中TNF、TNFRSF1A的表达上调过度激活p38/MAPK通路,导致MEF2C等转录因子表达上升,促进心肌细胞凋亡。因此,上述两条子通路的异常,可能是导致VSD发生的关键因素。

