寄主转换对美国白蛾幼虫生长发育和消化酶活性的影响
耿薏舒, 赵旭东, 韩阳阳, 乔 恒, 郝德君,*
(1. 南京林业大学南方现代林业协同创新中心, 南京 210037; 2. 南京林业大学林学院, 南京 210037; 3. 上海市林业总站, 上海 200072)
美国白蛾Hyphantriacunea属鳞翅目(Lepidoptera)灯蛾科(Erebidae),是一种寄主范围广、繁殖力强、适生性强、危害严重的世界性检疫害虫(季荣等, 2003)。自1979年首次在我国辽宁省丹东地区发现以来(杨忠岐和张永安, 2007),截至2020年已经扩散至北京、天津、河北、内蒙古、辽宁、吉林、江苏、安徽、山东、湖北、河南、陕西、上海等13个省(区、市)的607个县级行政区(国家林业和草原局2021年第7号公告),仍然呈现疫区数量不断增加,加速向南扩散的特点,对我国的森林资源及生态安全构成严重威胁。
植食性昆虫与寄主植物在长期进化过程中相互作用、相互依存、相互适应,形成了相对稳定的生态关系(钦俊德和王琛柱, 2001)。植食性昆虫通过取食寄主植物获得生长发育所需的营养物质,不同寄主植物也会因自身的营养成分组成的差异而影响植食性昆虫的生长发育和繁殖。而昆虫体内消化酶活性强弱与摄入营养物质的类型和含量有关,反映昆虫对寄主植物营养物质的消化吸收能力,进而影响昆虫的生长发育(Shahbazetal., 2017; Zhaoetal., 2019)。
植食性昆虫长期选择取食一种寄主植物,会形成相对稳定的营养和解毒代谢途径,并对寄主产生适应性(陈澄宇等, 2015)。当外界环境条件改变时,如干旱(Salgado and Saastamoinen, 2019)、营养供给不足或者寄主植物上种群密度过大时(Rieske and Dillaway, 2008; Santanaetal., 2011; Yangetal., 2015),昆虫则会转移到其他寄主植物上以保证其正常的生长发育和种群繁衍(Hägele and Rowell-Rahier, 1999),即转换寄主植物的行为策略取决于昆虫自身生长发育、生殖所需的成本和效益(Karbanetal., 2010)。例如,亚洲玉米螟Ostriniafurnacalis低龄幼虫取食玉米,高龄幼虫则转移至更有利于其生长发育的豆科植物取食(袁志华, 2013);绿盲蝽Apolyguslucorum从四季豆转移至绿豆、缸豆、棉花后,发现转移至棉花种群的海藻糖酶活性最高,淀粉酶和蛋白酶活性最低,种群趋势指数最高,说明棉花更利于绿盲蝽生长发育以及种群繁衍(肖留斌等, 2013);陈萍等(2021)研究发现稻纵卷叶螟Cnaphalocrocismedinalis的玉米种群转换至水稻后适合度和种群增长显著下降,而水稻种群转换至玉米后适合度和种群增长有所上升,表明玉米更有利于提高稻纵卷叶螟种群的适合度。可知,探究植食性昆虫选择寄主植物的行为及其生理适应机制是阐释寄主植物与昆虫相互关系的重要途径(del Campoetal., 2001)。
美国白蛾地理分布范围不断扩大,寄主植物超过600种(Edosaetal., 2019),在我国已记录寄主种类达300余种(李路莎等, 2018)。寄主植物质量是影响多食性昆虫选择寄主的重要因素。如美国白蛾的寄主植物的质量发生改变时,会相应地减少对该寄主的利用,进而影响其生长发育进程和存活率(Schowalter and Ring, 2017)。Mason等(2011)发现美国白蛾即使取食相同的寄主,因分布于不同地区而叶片质量不同,其适应性也存在差异。随着入侵时间及寄主植物的变化,美国白蛾幼虫的取食习性也发生改变。在江苏等地美国白蛾喜食日本晚樱Cerasusserrulata、杨树Populusspp.等阔叶树,而当2018年传入上海地区后,美国白蛾更喜食落羽杉Taxodiumdistichum、水杉Metasequoiaglyptostroboides等杉科植物(卢修亮等, 2021)。目前,对美国白蛾在寄主转换后的适应性及其生理响应机制尚不明确。因此,通过研究美国白蛾转换寄主后对幼虫生长发育、营养指标的影响,进而测定寄主转换后美国白蛾幼虫的消化酶活性,以期明确美国白蛾寄主转换的生理适应性及生理响应机制,为种群监测预报和综合防控提供科学依据。
1 材料与方法
1.1 材料
1.1.1供试虫源:美国白蛾2龄幼虫于2020年5月采自江苏省淮安市淮安区杨树(33.52°N, 119.16°E)。带回实验室后利用人工饲料进行饲养,饲养条件为:温度25±1℃,相对湿度65%±5%,光周期16L∶8D。成虫羽化后,提供30%蜂蜜水。以室内饲养的第2代幼虫作为实验试虫。
1.1.2供试植物:落羽杉和日本晚樱新鲜叶片采自南京林业大学校园内种植的健康树木。带回实验室后对叶片进行清水冲洗,自然晾干后饲喂美国白蛾幼虫。
1.1.3供试试剂: NaCl、Tris-HCl、甘氨酸、氢氧化钠、三氯乙酸、二甲基亚砜(DMSO)、甲醇,购于南京斑马实验器材有限公司,分析纯;偶氮酪蛋白(Azocasein)、N-苯甲酰-DL-精氨酰-4-硝基苯胺盐酸盐(BAPNA)、NAM对甲苯磺酰基-L-精氨酸甲酯盐酸盐(TAME)、N-苯甲酰- L-酪氨酸乙酯(BTEE)购于上海阿拉丁生化科技股份有限公司。淀粉酶与脂肪酶测定试剂盒购于南京建成生物有限公司。
1.2 美国白蛾幼虫寄主转换处理
为避免美国白蛾对寄主植物的取食记忆,第1代幼虫利用人工饲料进行饲养,第2代卵孵化后,将初孵幼虫放置于叶背进行饲养,以浸水的棉花对叶片进行保湿。在养虫盒盖子上戳小孔以便空气流通,加盖后置于培养箱中(饲养条件同1.1节),定期更换叶片。在相同饲养条件下,将第2代美国白蛾卵分别放置于落羽杉和日本晚樱的叶片上饲养,建立美国白蛾的落羽杉种群和日本晚樱种群,每种寄主处理分别设置5次重复。当幼虫生长至3龄时,取蜕皮后2日龄幼虫进行非选择性转换,分别取食原寄主和转换寄主植物,即形成持续取食落羽杉的美国白蛾种群(标记为T-T)、持续取食日本晚樱的美国白蛾种群(标记为C-C)、取食落羽杉转至取食日本晚樱的美国白蛾种群(标记为T-C)和取食日本晚樱转至取食落羽杉种群(标记为C-T) 的4个处理组合;每个处理选取50头幼虫置于养虫盒(长×宽×高=13.5 cm×8 cm×6.5 cm)内,6个生物学重复。
每天14:00时定时观察记录幼虫发育状况。转换寄主后,每2 d对幼虫单头称重,每个处理称重30头幼虫,共记录7次体重,直至幼虫化蛹。同时记录发育历期、幼虫死亡数。化蛹后,分别对雌雄蛹进行性别鉴别(Tuncer and Aker, 2017)并称重。
1.3 美国白蛾营养指标测定
从4个处理的幼虫中各选取20头发育一致的刚蜕皮的5龄美国白蛾幼虫称重,每个处理的幼虫均单头饲养,分别饲喂供试寄主植物新鲜叶片,饲喂前进行叶片称重,24 h后取出剩余植物叶片,饥饿24 h使幼虫排空粪便,称量幼虫鲜重作为饲后体重。再将幼虫、粪便、剩余叶片放入烘箱,80℃下烘干至恒重,分别称量干重。同时,分别取10片日本晚樱花及落羽杉叶片,称重后置于烘箱中干燥至恒重,计算叶片含水量。另取20头幼虫称重后烘干至恒重,计算虫体含水量,以此计算饲前幼虫干重以及饲前叶片干重。参照苏超等(2013)的方法,结合Waldbauer (1968)对相对生长率(relative growth rate, RGR)、相对取食量(relative consumption rate, RCR)、近似消化率(approximate digestibility, AD)、食物利用率(efficiency conversion of ingested food, ECI)及食物转化率(efficiency conversion of digested food, ECD)的定义,依照下列公式计算各营养指标:
RGR(mg/mg·d)=G/(B×T);
RCR(mg/mg·d)=I/(B×T);
ECI(%)=G/I×100;
ECD(%)=G/(I-F)×100;
AD(%)=(I-F)/I×100。
公式中,G为虫体增重(G=饲后幼虫干重-饲前幼虫干重),B为试验期间幼虫的平均体重(B=饲前幼虫干重+饲后幼虫干重/2),I为幼虫的取食量(I=饲前食物干重-饲后食物干重),F为粪便干重;T为试验天数。
1.4 美国白蛾中肠消化酶活性测定
1.4.1酶液制备:选取4个处理中发育一致的4龄幼虫,用0.15 mol/L氯化钠(NaCl)溶液对体表漂洗,滤干后置于冰面上解剖,截取中肠及其内含物,放入离心管中(中肠及其内含物不少于0.1 g),利用电动组织研磨器(天根生化科技有限公司, 北京)研磨均匀。加入预冷的0.15 mol/L NaCl溶液,在冰浴条件下12 000 r/min离心10 min,取上清液利用Infinite 200pro酶标仪(Tecan, 瑞士)测定。
1.4.2蛋白含量和总蛋白酶活性测定:蛋白含量测定参照Bradford(1976)方法,每个处理重复9次。总蛋白酶活性测定参考王琛柱和钦俊德(1996)的方法并加以改进。以20 mg/mL偶氮酪蛋白溶于0.15 mol/L NaCl,取0.1 mL加入0.01 mL中肠酶液和0.04 mL甘氨酸-氢氧化钠(0.1 mol/L)缓冲液。在30℃下反应3 h,加入0.15 mL的20% (m/v) 三氯乙酸终止反应。混合物在4℃ 12 000 r/min离心15 min,取上清液在366 nm处测光吸收值。每个样品设置9个生物学重复及3个技术重复。
1.4.3胰蛋白酶活性测定:参考陈翠翠等(2012)的方法并加以改进。采用两种专性底物即BAPNA和TAME。将BAPNA 底物溶于二甲基亚砜(DMSO) (20 mg/mL),取0.1 mL加入0.01 mL中肠液和0.09 mL Glycine-NaOH缓冲液中反应20 min,加入0.1 mL 30% (m/v)乙酸终止反应,在405 nm处测光吸收值。将TAME底物(2 mmol/L)溶于0.15 mol/L NaCl,取0.1 mL加入0.01 mL中肠酶液和0.09 mL Tris-HCl (0.1 mol/L)缓冲液混匀并计时,在247 nm处测光吸收值,每隔30 s读数一次,共8次。每分钟每毫克蛋白使光密度值增加0.001定义为1个TAME活力单位(U)。每个样品设置9个生物学重复及3个技术重复。
1.4.4凝乳蛋白酶活性测定:将1 mmol/L BTEE底物溶于含10%甲醇(重量/体积)的0.15 mol/L NaCl溶液中,取0.1 mL加入0.01 mL中肠酶液和0.09 mL Tris-HCl (0.1 mol/L)缓冲液中,混匀并计时,在256 nm处测光吸收值,每隔30 s读数一次,共8次。每分钟每毫克蛋白使光密度值增加0.001定义为1个BTEE活力单位(U)。每个样品设置9个生物学重复及3个技术重复。
1.4.5淀粉酶与脂肪酶活性测定:根据试剂盒说明书测定并计算。每个样品设置9个生物学重复及3个技术重复。
1.5 数据分析
利用IBM SPSS Statistics 26.0软件进行数据处理,幼虫发育历期、蛹期、营养指标、酶活性等采用方差分析及Duncan氏新复极差法检验差异显著性,存活率用Kaplan-Meier分析,用Graphpad Prism 8作图,差异显著水平为P<0.05。
2 结果
2.1 寄主转换对美国白蛾幼虫生长发育的影响
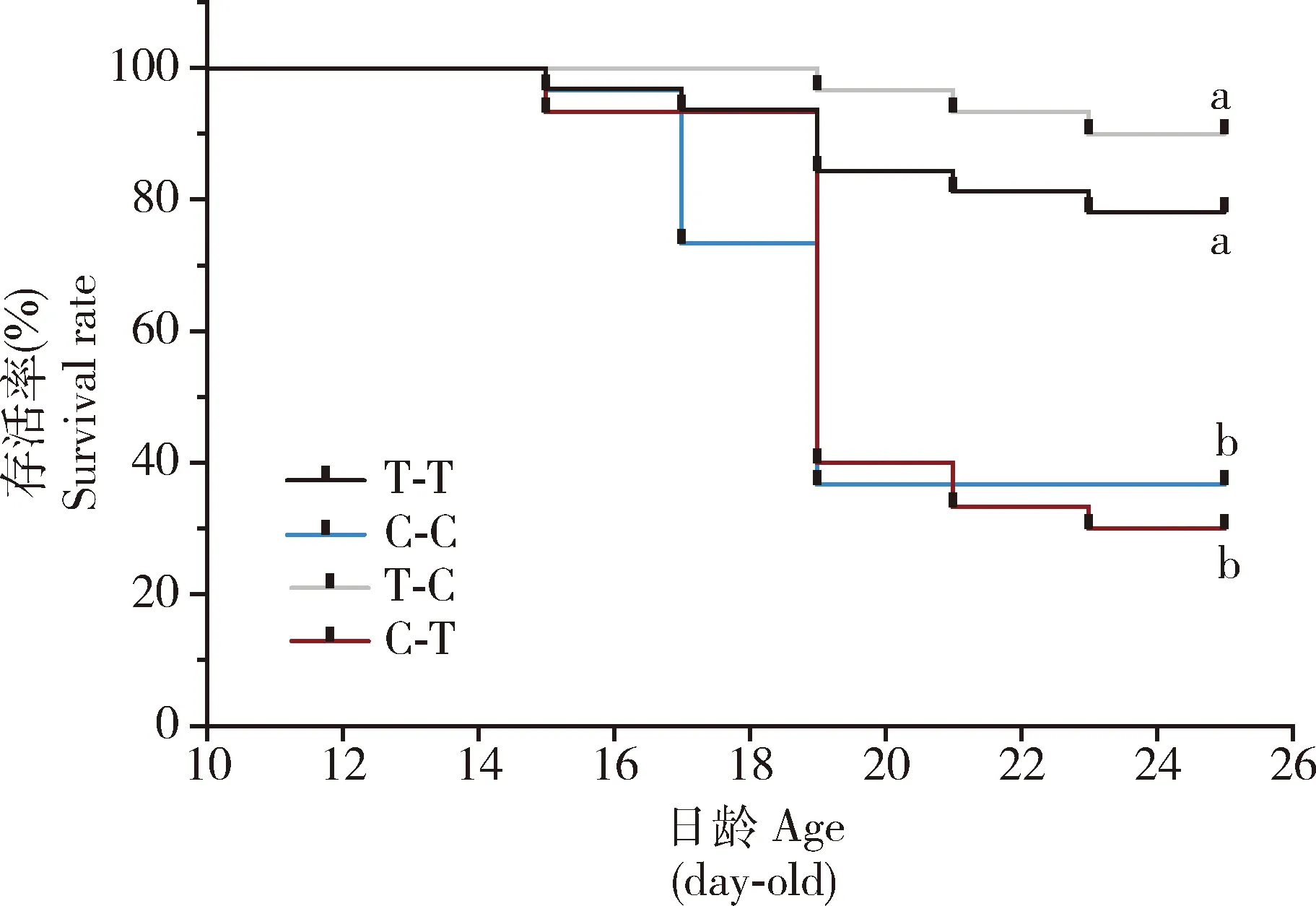
2.1.1发育历期:美国白蛾幼虫在寄主转换条件下幼虫发育历期及蛹期存在显著差异(表1),其中T-T组的幼虫历期为29.46 d,与幼虫历期最长的C-C组相差8.94 d。T-C组的幼虫历期相对T-T组的延长4.21 d,C-T组幼虫历期相对C-C组的短5.14 d,T-C组和C-T组的幼虫历期无显著差异(P>0.05)。各个处理幼虫历期的长短顺序为:T-T 表1 取食原寄主和转换寄主植物的美国白蛾的发育历期 2.1.2存活率:从图1可以看出,寄主转换条件下,T-T组与T-C组的幼虫存活率无显著差异(P>0.05),C-C组与C-T组的幼虫存活率亦无显著差异(P>0.05);但是T-T组的幼虫存活率(78.12%)与T-C组的幼虫存活率(90%)显著高于C-T组(30%)和C-C组的幼虫存活率(36.67%)(P<0.05);C-C组及C-T组幼虫在取食第19天时出现大批死亡,存活率分别降至约40%和37%,而T-T组及T-C组的幼虫存活率相对稳定。 图1 取食原寄主和转换寄主植物的美国白蛾幼虫的存活率 2.1.3幼虫体重及雌雄蛹重:寄主转换前,T-T组的幼虫平均体重(0.017 g)显著高于C-C组 (0.0094 g) (F=66.305,P<0.05)。转换寄主后,T-C组的幼虫平均体重增长速度明显小于T-T组的增长速度;而C-C组的体重增长速度缓慢,在第16天后进入快速增长期,最终幼虫的平均体重为0.169 g,与T-T组无显著差异(P>0.05);C-T组幼虫在第22天(转换后第10天)增长速度最快,明显超过其他处理,最终平均体重显著高于其他处理组的(P<0.05)(图2: A)。 寄主转换后,T-C组的雌雄平均蛹重分别为0.066 g和0.056 g,皆为最低;其他处理组的雄蛹体重无显著差异(F=6.28,P>0.05),雌蛹体重则为T-C 图2 寄主转换下美国白蛾幼虫平均体重(A)及蛹重(B) 对美国白蛾5龄幼虫营养指标测定结果如表2所示,在单位时间内,不同处理的美国白蛾相对生长率、食物利用率和食物转化率均无显著差异(P>0.05);T-C组的相对取食量显著低于其他处理组的(P<0.05),食物利用率(0.61%)和食物转化率(0.79%)略高于其他处理组的;T-C组的近似消化率最低(0.79%),C-C组的最高(0.89%)。可能是由于前期取食落羽杉,转换至日本晚樱后取食量减少,通过提高食物转化率和食物利用率满足生长发育的营养需求。 表2 取食原寄主和转换寄主植物的美国白蛾5龄幼虫的营养效应 由图3可知,寄主转换对美国白蛾幼虫中肠总蛋白酶活性无显著差异(P>0.05);C-C组的胰蛋白酶(强碱和弱碱性)显著高于其他处理组的(F=16.895,P<0.05)和胰凝乳蛋白酶的活性显著高于T-T和T-C组的(F=0.858,P<0.05),而T-T组和T-C组之间无显著差异(P>0.05),其活性顺序为C-C>C-T >T-C>T-T; C-C组和C-T组淀粉酶活性皆显著高于T-T组和T-C组的,但C-C组和C-T组之间、T-T组和T-C组之间无差异显著性(F=11.899,P>0.05);脂肪酶活性则显示T-C组的显著低于其他处理组的(F=7.625,P<0.05)。 图3 取食原寄主和转换寄主植物的美国白蛾4龄幼虫中肠消化酶活性 植食性昆虫与寄主植物的互作关系涉及昆虫的适应性,包括摄取营养和代谢化学防御物质(钦俊德和王琛柱, 2001)。昆虫依赖寄主植物提供营养而完成生长发育,多食性昆虫虽然取食范围广,但对不同寄主植物的营养成分利用能力不同,适合度有明显差异。本研究中,选取美国白蛾两种亲缘关系较远的阔叶树种日本晚樱和针叶树种落羽杉作为幼虫寄主转换试验的供试寄主植物,发现幼虫取食不同寄主后,其幼虫存活率、幼虫历期、蛹期、幼虫体重均有显著差异,如C-C组的幼虫历期和蛹期延长且幼虫存活率降低(表1; 图1),可能是由于多食性昆虫面临原寄主植物营养成份不均衡、次生代谢物质抑制及其含水率存在差异时,通过生理生化机制进行调节(Chenetal., 2011; 苏超等, 2013)。虽然美国白蛾能够适应不同的寄主植物,但适应过程促使其保留利用生长发育寄主的“偏好”(Hafeezetal., 2021)。在转换寄主后,如从日本晚樱转移至落羽杉后,幼虫生长发育加快、体重增加(图2),可能是由于落羽杉中的营养成分更加丰富,更有利于美国白蛾的生长发育。与之相反的是美国白蛾从落羽杉转至日本晚樱后,其幼虫历期和蛹期延长,幼虫体重和蛹重皆为最低,可能是因为面临适合度不高的寄主植物时,需要延长发育历期获取所需的营养累积。如秋白尺蛾Epirritaautumnata在暴发的年份,可部分转移至其他寄主植物,同时其生物学参数如体重,发育历期及存活率也会随着寄主植物的不同呈现出显著差异(Yangetal., 2008)。 适应了特定的寄主植物后,植食性昆虫利用有效的消化生理机制去分解食物,为机体提供营养(Zaluckietal., 2002)。本研究发现美国白蛾幼虫由落羽杉转至日本晚樱后,其相对取食量降低,食物转化率和食物利用率显著升高(表2),表明美国白蛾面临适合度不高的寄主时,在其取食量降低的情况下,可通过提高食物转化率和食物利用率去弥补营养摄入的不足,高食物转化率可能是对低消化率的一种补偿(朱俊洪等, 2005)。反之,当从日本晚樱转至落羽杉后,美国白蛾幼虫相对取食量和食物利用率均显著提高,说明美国白蛾对落羽杉表现较好的适应性。这与Rezaei等(2006)的研究结果一致。美国白蛾幼虫对桑树的相对取食量低于取食杨树,但是其食物转化率和食物利用率都高于杨树(李路莎等, 2018),说明美国白蛾适应寄主转换时,具有平衡生理代谢的调节机制。 消化酶系是昆虫与寄主植物相互适应的重要表现形式,植食性昆虫调节其取食行为和消化酶,使其适应现有食物的营养状况(肖留斌等, 2013)。蛋白酶参与昆虫中肠的各种生理和生化过程,其中丝氨酸蛋白酶在消化过程中发挥重要作用,参与蛋白质的降解和合成(赵旭东等, 2019)。本研究中,发现C-C处理的美国白蛾幼虫胰蛋白酶与胰凝乳蛋白酶的活性更高(图3: B-D),可能与其发育历期有关。昆虫发育历期长,表明单位时间内累计的营养较少,因此需要提高水解蛋白酶活性,加速提高对蛋白质的转化,从而满足其生长发育的需求。与之相比,幼虫由日本晚樱转至落羽杉,胰蛋白酶活性降低,说明昆虫在适应不同寄主过程中,可通过提高中肠总蛋白酶的活性增加对不适寄主营养的利用率,满足幼虫生长发育的营养需求,减少因寄主的营养物质含量低和次生物质含量高等带来的不适性,为寻找适宜寄主提供条件,这可能是昆虫维持种群数量和以及对不适寄主的应对策略(张娜, 2009; 徐伟等, 2012)。针对甜菜夜蛾Spodopteraexigua的研究,发现取食反枝苋的幼虫中肠蛋白酶活性比取食其他寄主植物的高,而反枝苋是一种常见杂草,营养成分较差,玉米营养成分也偏低,甜菜夜蛾在这些寄主上要生存就必须取食较多量的反枝苋或者玉米,就需要更多量的消化酶,而甘蓝营养成分较高,取食量相对较少,需要消化酶少,所以取食反枝苋的甜菜夜蛾幼虫中肠蛋白酶活性偏高,取食玉米的居中,取食甘蓝的明显偏低(Golikhajehetal., 2017; 曾纪岚等, 2019)。同样,前人研究也发现美国白蛾幼虫取食柳树与臭椿的消化酶活性低于喜食寄主桑树与白蜡(魏丹峰, 2017)。昆虫取食不同寄主植物与寄主的营养成分含量密切相关,本课题组前期测定结果表明,日本晚樱的淀粉含量明显高于落羽杉(具体数据尚未发表)。因此,美国白蛾需要更高的淀粉酶活性去消化日本晚樱的淀粉(图3: E)。落羽杉的脂肪含量显著高于日本晚樱,但是,T-C处理的脂肪酶活性最低(图3: F),可能是由于幼虫由落羽杉转至日本晚樱后,取食量和消化率均显著降低,影响幼虫中肠合成更多的脂肪酶,说明昆虫对食物消耗和利用与消化酶的活性有直接关系。植食性昆虫对寄主植物的适应并不仅限于消化酶的活性,还涉及其他代谢过程,例如解毒、应激反应和免疫途径(周福才等, 2010; Huangetal., 2017)。由此可见,美国白蛾对寄主转换具有极高的适应性,这可能是该害虫成功入侵的重要机制之一,进一步加剧了美国白蛾扩散的风险。 不同寄主植物间转换取食,对美国白蛾幼虫的生长发育及消化酶活性皆出现不同程度的改变。本研究发现,美国白蛾幼虫持续取食落羽杉,幼虫历期和蛹期短,幼虫存活率高。从落羽杉转移至日本晚樱后,幼虫历期和蛹期延长,发育减缓,使其适应日本晚樱;而从日本晚樱转至落羽杉后,幼虫补偿式发育,提高了消化酶活性,有利于消化吸收食物中的营养。本研究明确了寄主转换后美国白蛾幼虫的表型可塑型和消化酶的响应,下一步将深入探究相关消化酶的表达,明确美国白蛾对寄主植物的适应机制,为后续探讨消化生理在在美国白蛾的寄主转换适应机制中的作用奠定基础,以便将该策略应用于美国白蛾防控。
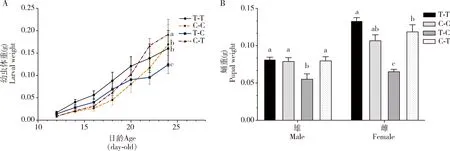
2.2 寄主转换对美国白蛾幼虫营养效应的影响

2.3 寄主转换对美国白蛾幼虫中肠消化酶活性的影响

3 讨论

