定量核磁共振波谱法测定黄芩中的黄芩苷含量研究
范 悦,李 欠,常宝勤
(1.甘肃农业大学农学院,甘肃 兰州 730070;2.甘肃省干旱生境作物学重点实验室,甘肃 兰州,730070)
黄芩[Scutellariae Radix]来源于唇形科植物黄芩[ScutellariabaicalensisGeorgi]干燥的根,始载于《神农本草经》,其性苦,味寒,具有清肺热、除燥湿、泻火解毒、安胎止血等功效[1]。在疾病治疗过程中,黄芩常与其他清热类中药配伍使用,其主要用于温湿、暑湿、胸闷、湿热痞满、肺热咳嗽、高热烦渴等。黄芩产地主要位于西北、东北地区,如黑龙江、辽宁、内蒙古、甘肃等地。黄芩苷是黄芩的主要有效成分之一,属于黄酮类化合物,其含量是评价黄芩质量高低的重要标准[2]。黄芩苷具有抑菌、利尿、抗炎、抗病毒及解痉、抗癌等显著的生物活性[3],在临床医学具有举足轻重的地位。同时,黄芩苷能够吸收紫外线、抑制氧自由基、一定程度上可以抑制机体生成黑色素,因此除常用于医药外,也可用于化妆品[4-5]。目前,在黄芩中提取黄芩苷的方法主要有回流提取法、常规煎煮法、微波提取法、和超声提取法[6-10]。
定量核磁共振波谱(quantitive Nuclear Magnetic Resonance,qNMR)法在化合物的确定及结构分析中具有独特的地位,兼备了定性鉴别和定量测定,现如今,qNMR法已广泛应用于食品、农业、化学及药学,特别是在代谢组学、新药研发、对照品研究等方面应用广泛,对小分子、大分子结构的解析和成分含量的测定都有相关报道[11-14]。核磁共振波谱与其他检测方法相比,不需自身对照品,节约成本且简化和缩短样品前处理的步骤及时间,适合于价格昂贵或难获得标准品的物质的测定[15-19]。qNMR法是基于原子核的积分面积与质子数成正比,因而定量只与原子数有关,因此无需应用任何校正因子和被测物的对照品。内标法中某种确定的物质可以作为参照物,若同时测多种成分含量时只需要一种内标即可,选用的内标物需与待测样品共溶于测试溶剂中,具有适宜宽度的单峰、不与待测样品相互作用、分子量与待测样品特征峰质子数之比合理,信号峰与待测物的信号峰不存在干扰等特点[1]。
目前,黄芩苷含量的测定通常采用荧光分光光度法、紫外分光光度法、法和高效液相色谱法等[20-23],这些方法存在操作复杂、进样时间长、成本高、受环境限制、需使用对照样品测试等缺点,而qNMR法具有检测准确,操作简捷,低成本,且不需要待测物质的对照品等优点。因此建立黄芩中黄芩苷的快速提取和检测方法非常重要。
本研究在有效提取黄芩苷的基础上,建立了一种核磁共振波谱法测定黄芩中黄芩苷含量的方法,对建立的方法进行了验证,并用于实际样品的分析,这对进一步提升黄芩苷的开发和利用具有重大意义。
1 材料与方法
1.1 仪器与试剂
仪器:HX 203T精密电子天平(慈溪市天东衡器厂);JFSD—100粉碎机(上海嘉定粮油仪器有限公司);超声波清洗机(深圳市得康科技有限公司,40 KHz);600 MHz核磁共振谱仪(Bruker);
黄芩药材(兰州安泰堂中药饮片有限公司,产地:甘肃);二甲基亚砜(Dimethyl sulfoxide-d6,DMSO-d6,萨恩化学技术有限公司,批号:HC060001,99.9%);吡嗪(上海麦克林生化科技有限公司);黄芩苷标准品(成都普菲德生物技术有限公司,纯度>98%);甲醇(天津市富余精细化工有限公司,分析纯)。
1.2 试验方法
试验选用相对定量的方法更能精确的测定待测物质的含量。将精密称定重量的待测样样品与已知量的内标物混合测定,通过比较样品特征峰的面积与内标峰面积比值计算待测样品的含量。分别精密称定已准备好的样品和纯度已知的内标物,同时溶于合适的氘代试剂中,混合均匀,配制成溶液,移入符合标准的核磁管,经1H-qNMR测定,分析图谱,选择分离度好且不受其他峰干扰的特征峰作为供试样品和内标的定量峰[17]。运用公式[1]:

Ws为待测样品的量;Wr为内标物的质量;As为待测样品特征峰的峰面积;Ar为内标峰的峰面积;Es待测样品的质子当量重量;Er内标物的质子当量重量(质子当量重量=相对分子质量/特征峰的质子数)
1.2.1 黄芩苷的提取工艺
粉碎黄芩药材,过40目筛,精密称取药材,加入65%甲醇(料液=1:20),用10%的HCl调节混合溶液pH至4,浸润1 h称重,在50℃下,超声提取1 h,待提取液冷却,补重,利用减压抽滤装置进行抽滤,取滤液,80℃水浴浓缩至半,用10%HCl调节pH值至1-2后,80℃保温2 h,待沉淀不在析出,离心机在12000 r/min转速下,离心5 min,弃去上清液,收集沉淀,烘干,称重[10,24]。
1.2.2 内标溶液制备
精密称取1.6018 g内标物吡嗪(99%),溶解至2mL DMSO-d6中,即为内标溶液。
1.2.3 供试品溶液的制备
精密称定“1.2.1”得到的沉淀5 mg于试管中,用移液枪精密加入490µL DMSO-d6和“1.2.2”下已配置好的内标溶液10µL,超声溶解,移至核磁管待测。
1.2.4 核磁测试条件
脉冲序列(Zg)为30,谱宽(SWH)为11904.8Hz,测定温度为293.7 K,脉冲延迟时间(D1)为1 s,脉冲宽度(P1)为14.90 s,扫描次数(NS)为32次。利用核磁共振谱仪测定样品,得到的检测图谱采用手动调整相位和基线,并进行手动积分。
2 结果与讨论
2.1 内标物和氘代溶剂的选择
定量核磁共振波谱法应用于药物含量测定时,内标物的选择是很重要的[25],需要具备较高的纯度,稳定性强,且主要吸收峰不干扰待测物质的波谱信号、不与样品发生反应。选用的氘代溶剂时应注意:有较好的溶解性,信号峰不与待测峰发生重叠。经初步测定,黄芩苷和吡嗪在DMSO-d6中溶解性最好,并且信号峰不与样品峰重叠,也没有干扰。因此试验选择DMSO-d6作为氘代试剂、吡嗪作为内标物。对黄芩苷类进行qNMR分析之前,选择合适的定量峰。优先选择耦合裂分数最少的,且分离度较好的峰,根据以上要求,故以黄芩苷中δ5.24(d 5.23)的峰为定量峰,以δ8.66为内标定量峰(图1-2)。

图1 黄芩苷结构式(左)和吡嗪结构式(右)Fig.1 Baicalin structural formula(left)and pyrazine structural formula(right)
2.2 方法学验证
2.2.1 黄芩苷标准曲线的测定
取黄芩苷标准品,精密称定20 mg,溶解于1 mL DMSO-d6中,分别取450µL、200µL、100µL、50µL、20µL、13µL于试管中,分别加入“1.2.2”配置好的内标溶液50µL,其次分别加入DMSO-d6至500µL,混合均匀,移入核磁管中,在“1.2.4”条件下检测,得到黄芩苷对照品在0.52-16 mg/mL范围内呈现良好的线性关系。

图2 黄芩苷(A)和黄芩药材(B)的1H NMR谱Fig.2 1H NMR spectra of baicalin(A)and baicalin herb(B)
2.2.2 精密度考察
在“1.2.4”试验条件下,精密称取在“1.2.3”的条件下配置好的样品溶液,利用600 MHz核磁共振谱仪重复测定6次,利用公式计算,结果显示黄芩苷的RSD值为0.597%(见表1),表明本方法具有较好的精密度,且样品有良好的稳定性。
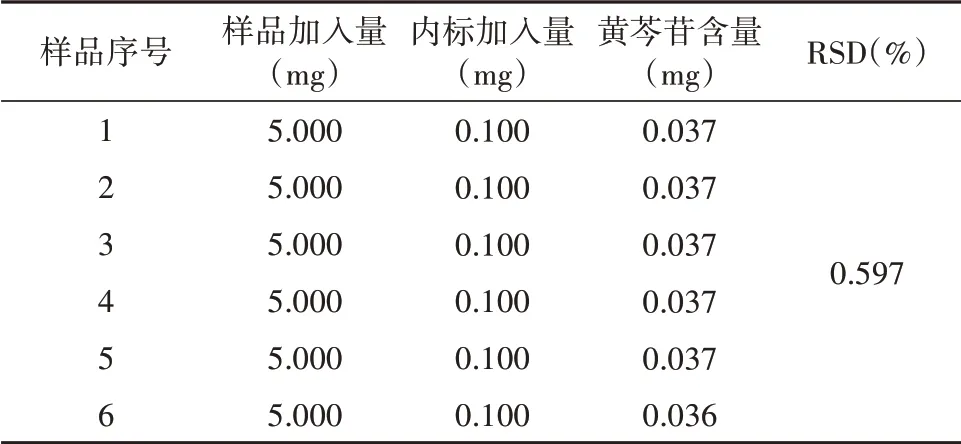
表1 精密度试验Tab.1 The precision test
2.2.3 稳定性考察
在“1.2.4”试验条件下,根据“1.2.3”的条件下将黄芩苷待测样品制成待测溶液于核磁管中,分别在0、4、8、16、20、24 h测定,得到核磁图谱,经分析结果显示黄芩苷的RSD值为0.375%(见表2),表明黄芩苷在室温条件下保存24 h时,稳定性较好。

图3 黄芩苷标准曲线图Fig.3 The Baicalin standard curve graph

表2 稳定性试验Tab.2 The stability test
2.2.4 重复性考察
根据“1.2.3”的试验条件下,平行制备6份供试品溶液,分别制成待测溶液于核磁管中,在“1.2.4”试验条件下检测,得到核磁图谱,以样品定量峰面积与内标物定量峰面积的比值,计算得到黄芩苷的含量,结果黄芩苷的含量为11.914%,RSD值为0.777%(见表3),结果表明该方法重复性良好。

表3 重复性试验Tab.3 The repeatability test
2.2.5 加样回收实验
在“1.2.1”实验条件下得到的样品沉淀,取同一批含量已知的沉淀,精密称定2.500 mg,平行6份,于5 mL的离心管中,分别精密加入黄芩苷标准品1.667 mg、内标物0.1 mg,溶于500µL DMSO-d6中,
3 结论
本试验采用超声法提取黄芩中的黄芩苷,通过混合均匀,移入核磁管中,在“1.2.4”条件下测定黄芩苷含量,结果得到平均回收率为102.538%,RSD值为1.044%(见表4),加标回收率范围在101.015%~104.091%之间,表明试验过程中的系统误差较小,试验方法准确度可靠。优化提取,得到适合定量核磁共振波谱法测定黄芩中黄芩苷含量的最佳提取方法为:过40目筛的黄芩药材,与65%甲醇混匀(料液=1:20),将pH调至4,在50℃下,超声提取1 h,这为优化黄芩中黄芩苷的提取工艺优化提供参考;同时建立了定量核磁共振波谱法检测黄芩中黄芩苷含量的新检测方法,此方法可做到快速取样检测,具有实用性强,效率高、准确性强、节约标准品等特点,尤其对于某些难以长时间保存、化学性质不稳定的成分来说,1H-qNMR为其精准测定和质量控制提供了新的途径。

表4 加样回收试验Tab.4 The sample recovery test

