基于网络药理学和分子对接研究黄芪治疗糖尿病心肌病的作用机制
黄雅兰,刘 秀,吴勇军,向 琴,喻 嵘
(湖南中医药大学,湖南长沙410200)
糖尿病心肌病(Diabetic cardiomyopathy,DCM)由Hamby[1]等人于1974年首次提出,是糖尿病患者在没有其他心脏危险因素的情况下所表现出的心脏结构和功能异常的一种慢性心血管并发症。随着糖尿病在全球的流行,DCM的发病率也逐年上升,成为了糖尿病患者死亡的主要原因之一[2]。DCM的发病机制目前尚未完全清楚,研究表明可能与胰岛素抵抗、糖脂代谢紊乱、氧化应激损伤以及炎症反应等相关[3]。目前许多西药已被证实对DCM具有保护作用,但其副作用大等缺点也是不容小觑。传统中药具有多成分、多靶点、协同作用的特点[4],在治疗糖尿病及其并发症具有独特优势,越来越受到人们关注。
本课题组前期通过数据挖掘发现治疗DCM的传统中药以益气药最多,其中黄芪用药频次最高[5]。黄芪,味甘、性微温,首载于秦汉时期的《神农本草经》。根据2020版的《中国药典》记载,黄芪具有行滞通痹,补气升阳等功效,常被当做补气中药应用,一直以来被医学界誉为“补气诸药之最”。《名医别录》谓其能“止渴……,益气,利阴气”,《日华子本草》中明确记载了黄芪具有治疗消渴的功用。现代药理和临床研究发现,黄芪具有保护心脏、降血糖、抗氧化、调节免疫等药理作用,在糖尿病的防治中具有重要地位[6]。
当前大多数研究主要是从动物实验和临床观察方面来探讨黄芪治疗DCM的疗效和作用机制,而药物、作用靶点和疾病之间的相互作用关系尚未得到阐释。网络药理学能通过有效构建“药物-作用靶点-疾病”调控关系,系统并可视化中药对机体的网络调控作用,分子对接运用计算机技术,能预测蛋白与药物结合位点及结合力的大小,是研究传统中药与疾病的一座桥梁。因此本研究利用网络药理学结合分子对接技术对黄芪治疗DCM的作用机制进行探讨,为深入研究黄芪及含黄芪的中药复方治疗DCM提供了参考依据。
1 材料与方法
1.1 黄芪活性成分筛选及靶点信息查询
在TCMSP,以“黄芪”为关键词,查验黄芪的化合物构成。筛选参数设定为DL(类药性)≥0.18,以及OB(口服生物利用度)≥30%,进行黄芪有效成分的筛选。再借助数据库TCMSP,查询其活性成分的作用靶点,同时借助Uniprot数据库,完成筛选所得靶点蛋白名向基因名的转化。
1.2 DCM相关靶点及黄芪与DCM共同靶点的获取
以“Diabetic cardiomyopathy”为关键词,通过OMIM数据库、GeneCard数据库与NCBI基因数据库开展人类基因检索,对DCM相关的疾病基因加以明确。将这3个数据库的基因归并删重,得到DCM疾病靶点信息。将筛选出的黄芪活性成分靶点与DCM疾病靶点输入韦恩图制作软件Venny 2.1,得到黄芪活性成分靶点与DCM相关靶点的共同部分,即黄芪对DCM作用的潜在靶点。
1.3 蛋白相互作用(Protein-protein interaction,PPI)网络构建
为了明确黄芪活性成分与DCM靶点之间的对应关系,将二者的共同靶点导入String数据库(https://www.string-db.org/)进行PPI分析,属种名设定为“Homo sapiens”,可信度定为>0.7,运用Cysto⁃scape 3.8.0软件构建黄芪活性成分与DCM共同靶点的PPI网络,使用软件内所含Network Analyzer工具实施拓扑分析,根据度值(Degree)排序,对黄芪调控DCM的关键靶点加以明确。
1.4 药物活性成分-疾病靶点网络构建及主要活性成分的筛选
为了更好地理解药物活性成分与疾病以及相应靶点之间的作用关系,以纳入的活性成分、疾病以及作用靶点为基础,使用Cytoscape软件构建活性成分-疾病-靶点可视化网络图。然后,运用Cyto⁃scape软件分析可视化网络的拓扑属性,按照度值(Degree)的高低进行主要成分的筛选,Degree值越高说明该成分越关键。
1.5 基因本体(Gene ontology,GO)富集分析与京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析
将药物疾病共有靶点进行分子功能(Molecular function,MF)、GO生物过程(Biological process,BP)、KEGG通路分析和细胞组分(Cell component,CC)富集分析,引用String数据库,以P<0.05作为筛选条件,明确药物靶点关键的生物作用与药理作用机制方面最可能的途径,并利用R语言分别对GO富集分析中的GO条目和KEGG通路分析中的通路进行可视化。
1.6 黄芪活性成分-疾病-通路-靶点网络构建
将黄芪活性成分、潜在靶点与疾病通路富集分析结果进行映射,导入软件Cytoscape3.8.0,并完成网络图“成分-疾病-通路-靶点”的制作。
1.7 分子对接验证
将“1.4项下”确定的活性成分和PPI网络内的靶点进行分子对接。先借助网站Pubchem,进行关键成分SDF文件的检索,同时借助软件Open Babel 2.3.2,使SDF文件转成PDB文件,从PDB(http://www.rcsb.org/pdb)数据库内检索明确核心靶点的晶体结构,利用PyMOL 2.3.4和AutoDockTools软件分别对受体蛋白进行去水、去配体和加氢、平衡电荷等操作,然后将受体蛋白和配体小分子分别转化为pdbqt格式,最后借助软件AutoDock Vina 1.1.2开展分子对接,将结果以结合能的形式输出,运用Py⁃MOL可视化分析对接结果。
2 结果
2.1 黄芪的活性成分及其靶点
在数据TCMSP内,检索获得黄芪87个化合物成分,将OB≥30%与DL≥0.18当做标准,经筛选,获得活性成分共20个,如表1。通过TCMSP数据库获得活性成分的相应靶点,并通过Uniprot数据库将有效成分靶点蛋白名转化为基因名,剔除重复项后得到黄芪活性成分潜在的作用靶点191个。

续表

续表
2.2 DCM疾病相关靶点及药物与疾病共同靶点的获取
将在GeneCards、NCBI以及OMIM数据库检索获得的DCM相关的基因进行整合删重,得到2535个DCM疾病相关靶点。将筛选所得药物活性成分靶点和疾病靶点,使用Venny 2.1软件绘制韦恩图,获得共同靶点122个,如图1。
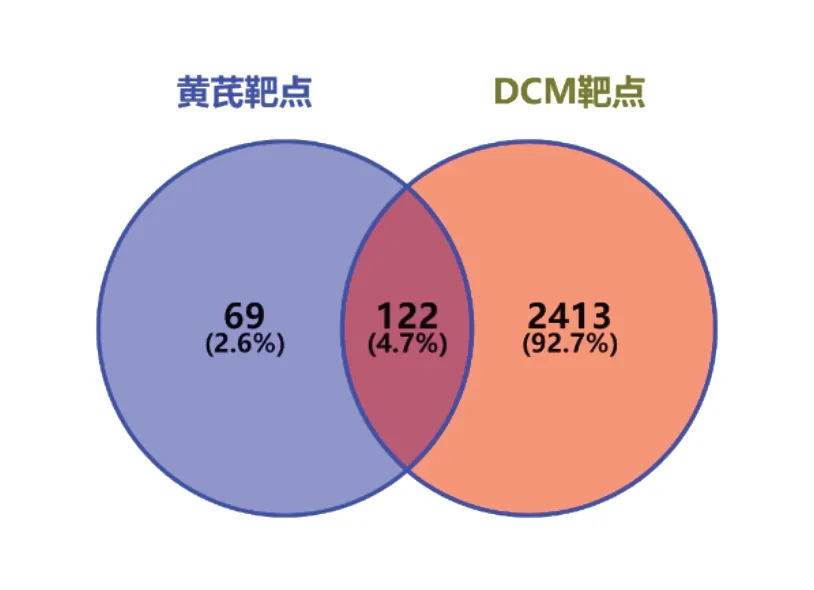
图1 黄芪与DCM的共同靶点韦恩图Fig.1 Venn analysis of Astragali Radix and DCM
2.3 PPI网络的构建
向数据库String内导入黄芪与DCM疾病两者122个联合靶点,对PPI关系展开分析,借助Cyto⁃scape 3.8.0进行黄芪和DCM联合靶点的PPI网络的制作,此网络内分布的节点和边共122个和901条边,平均Degree是14.8,节点大小及颜色与Degree息息相关,节点愈大,颜色愈深,提示Degree愈大,如图2所示。对于PPI网络,借助软件Cystoscape 3.8.0所含Network Analyzer功能开展拓扑分析,基于de⁃gree排序,Degree在平均Degree以上的基因即是核心靶点,总共筛选出个45关键靶点,将前20个靶点使用R 3.6.3进行图片绘制,位居前5的关键靶点是:AKT1(蛋白激酶B1)、IL-6(白细胞介素)、MAPK1(丝裂原活化蛋白激酶1)、MAPK8、VEGFA(血管内皮生长因子),如图3所示,此类核心靶点是黄芪用于DCM治疗的关键靶点。

图2 黄芪与DCM共同靶点PPI网络Fig.2 PPInetwork of Astragali Radix and DCM
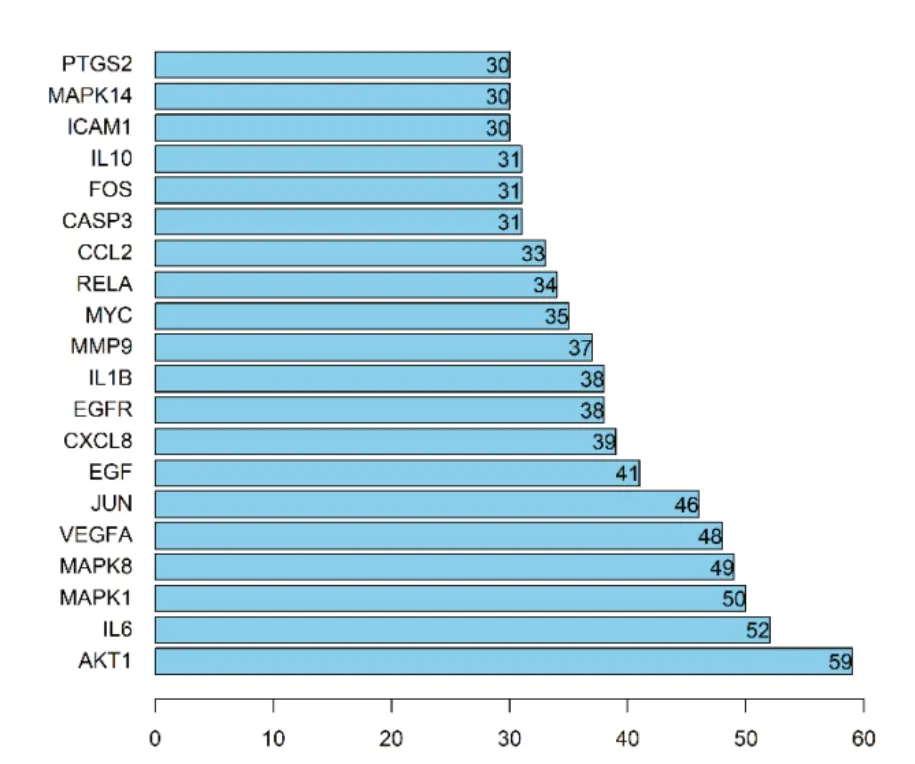
图3 黄芪治疗DCM的前20位核心靶点Fig.3 Top 20 core targets of Astragali Radix in the treatment of DCM
2.4 药物活性成分-疾病靶点网络构建及主要活性成分的筛选
借助软件Cytoscape进行可视化“活性成分-疾病-靶点”网络图,如图4。将得到的可视化图形进行拓扑分析,结果显示共有137个节点,形成357个关系对,该成分靶点网络度值(degree)平均值为5.21,将成分按照degree进行排序,大于平均度值的节点有10个,从高到低为:槲皮素、山奈酚、7-O-甲基-异微凸剑叶莎醇、芒柄花素、异鼠李素、3,9-二-O-甲基尼森香豌豆紫檀酚、毛蕊异黄酮、黄芪紫檀烷苷、常春藤皂苷元、熊竹素,表明这些活性成分可能为黄芪治疗DCM的主要活性成分。
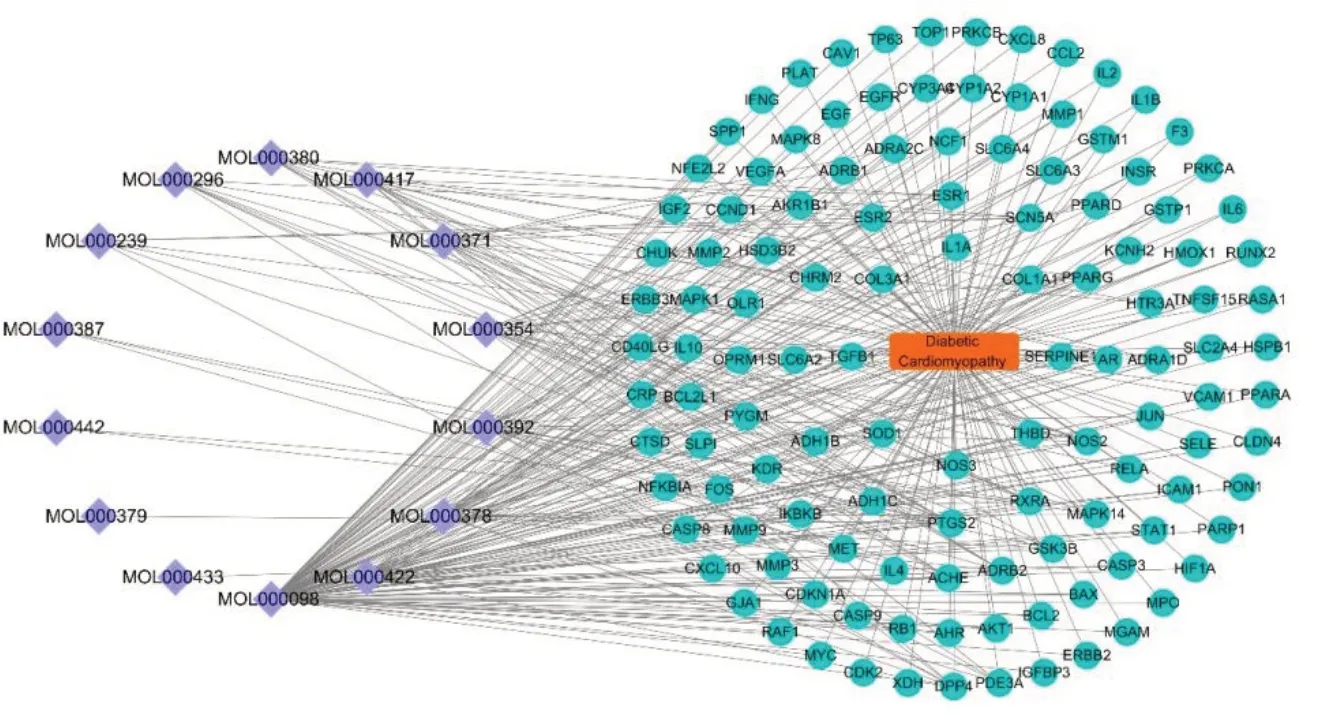
图4 黄芪活性成分-DCM-靶点网络图Fig.4 Network of Astragali Radix active component-DCM-target
2.5 GO富集分析和KEGG通路分析
2.5.1 GO分析
将药物疾病共有靶点开展BP、MF、CC的GO富集分析,筛选条件为P<0.05,富集到的BP共2188条,162项与分子功能相关,65项与细胞组成相关,各取前10项绘制可视化柱状图,见图5。结果显示,生物过程主要富集在对脂多糖应答(response to li⁃popolysaccharide)、对细菌来源分子的反应(response to molecule of bacterial origin)、细胞对化学胁迫反应(celluar respone to chemical stress)、上皮细胞增生(epithelial cell proliferation)、抗氧化反应(response to oxidative stress)等;分子功能主要富集在DNA结合转录因子结合(DNA-binding transcription factor binding)、RNA聚合酶Ⅱ特异性DNA结合(RNA polymerase II-specific DNA-binding)、受体配体活性(receptor ligand activity)等。细胞组分主要富集在膜筏(membrane raft)、质膜微区(membrane microdo⁃main)以及膜区(membrane region)等。
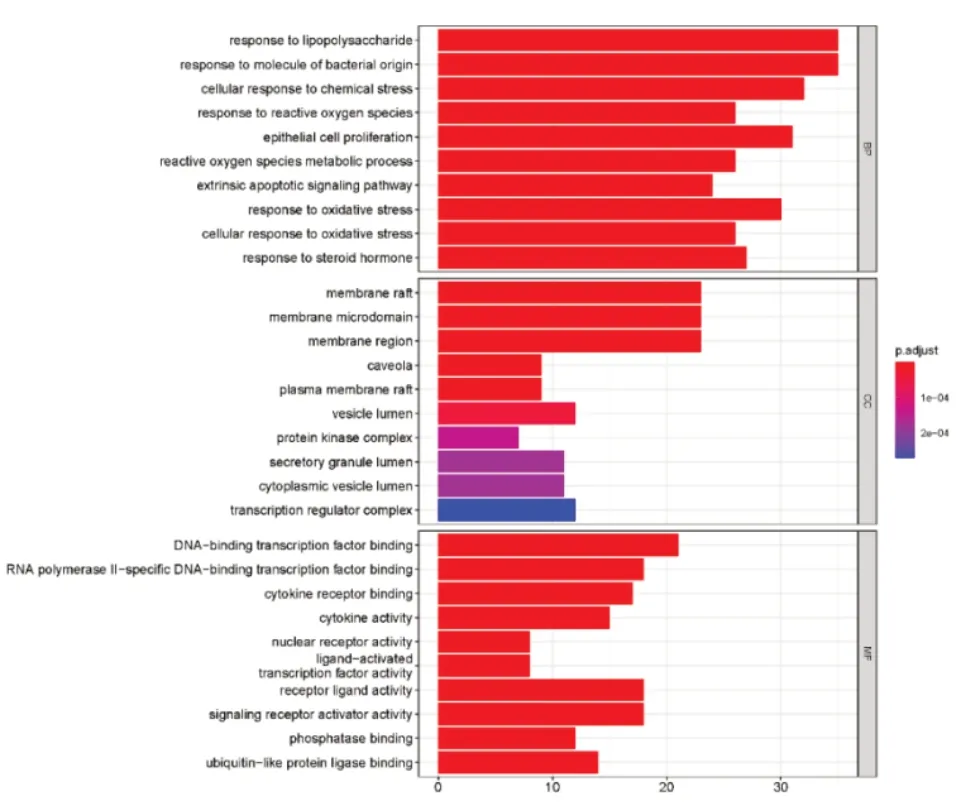
图5 黄芪治疗DCM的GO富集分析Fig.5 GOanalysis of Astragali Radix in the treatment of DCM
2.5.2 KEGG分析
将药物疾病共同靶点进行KEGG通路富集分析,以P<0.05作为条件进行筛选,总共富集到160条信号通路,对前20条通路进行可视化气泡图绘制,见图6。结果表明,主要富集于PI3K-Akt(磷脂酰肌醇3-激酶-蛋白激酶)通路、MAPK信号通路、流体剪切应力与AS、DM并发症中的信号通路AGE-RAGE等,点击相关性最大的PI3K-Akt signal⁃ing pathway信号通路进行可视化处理,见图7。
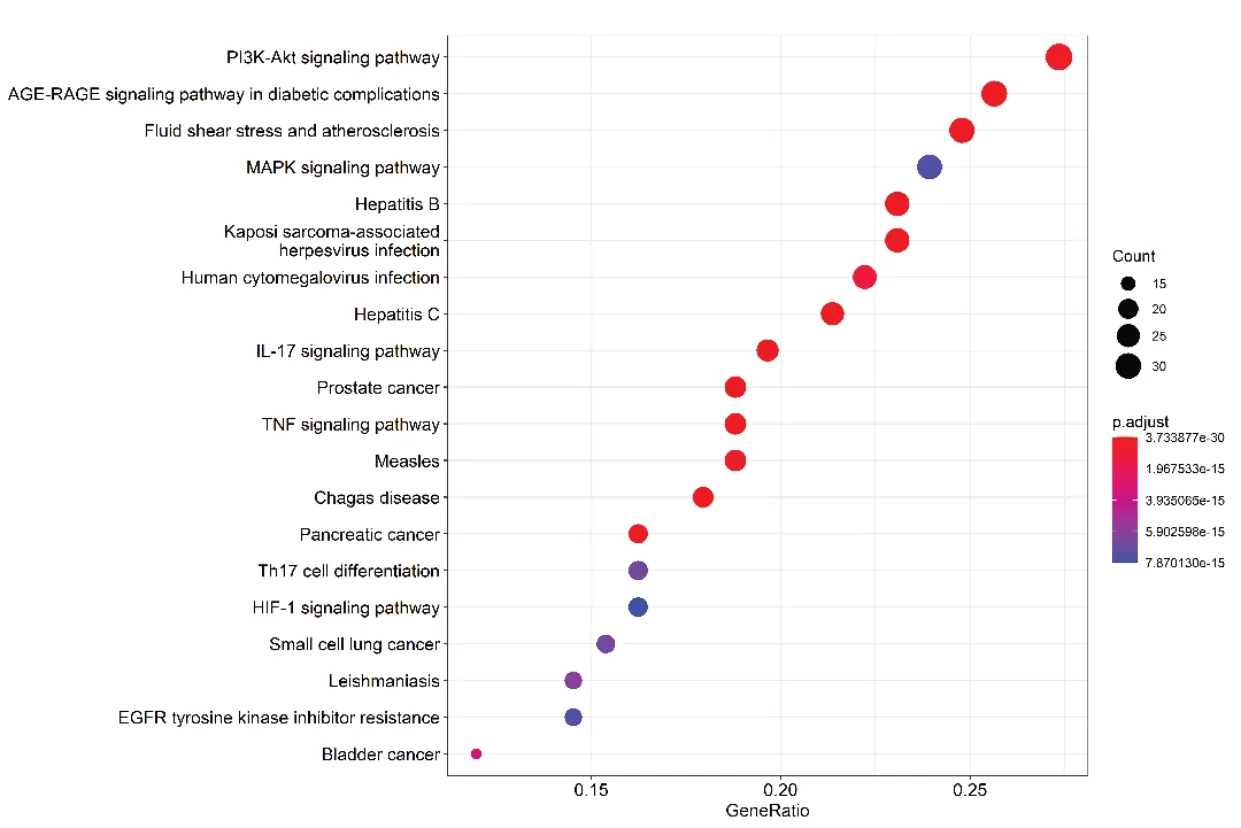
图6 黄芪治疗DCM的KEGG富集分析Fig.6 KEGGanalysis of Astragali Radix in the treatment of DCM

图7 黄芪治疗DCM的重要通路PI3K-Akt信号通路图Fig.7 PI3K-Akt Signaling Pathway of Astragali Radix in the treatment of DCM
2.6 黄芪活性成分-疾病-通路-靶点网络构建
借助软件Cytoscape 3.8.0,完成网络图“成分-疾病-通路-靶点”的制作,见图8,更加直观地展示黄芪在治疗DCM过程中的多成分、多靶点、多通路的作用特点。
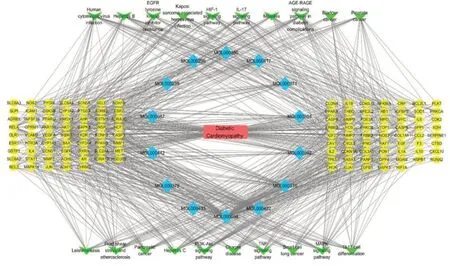
图8 “成分-疾病-通路-靶点”网络图Fig.8 Network of"component-disease-pathway-target"
2.7 分子对接结果
将“1.4项下”获得的10个主要活性成分与PPI网络中度值前5的蛋白靶点进行分子对接。对于结果,结合能愈低,说明配体结合受体愈牢固,若结合能在0以下,表明配体能够自发和受体结合,若为-4.25 kcal/mol及以下水平,表示具备一定结合活性,若为-5.0 kcal/mol及以下水平,表示具备较高结合活性,若为-7.0 kcal/mol及以下水平,表示结合活性非常强。结果显示主要活性成分与核心靶点的结合能介于-5.3 kcal/mol与-9.0 kcal/mol之间,可见,黄芪关键活性成分同关键靶点间的结合活性较高,预测结果具备一定可靠性,见表2。每个蛋白靶点分别选出与之相对接结果最好的活性成分,形成分子对接模式图,见图9。
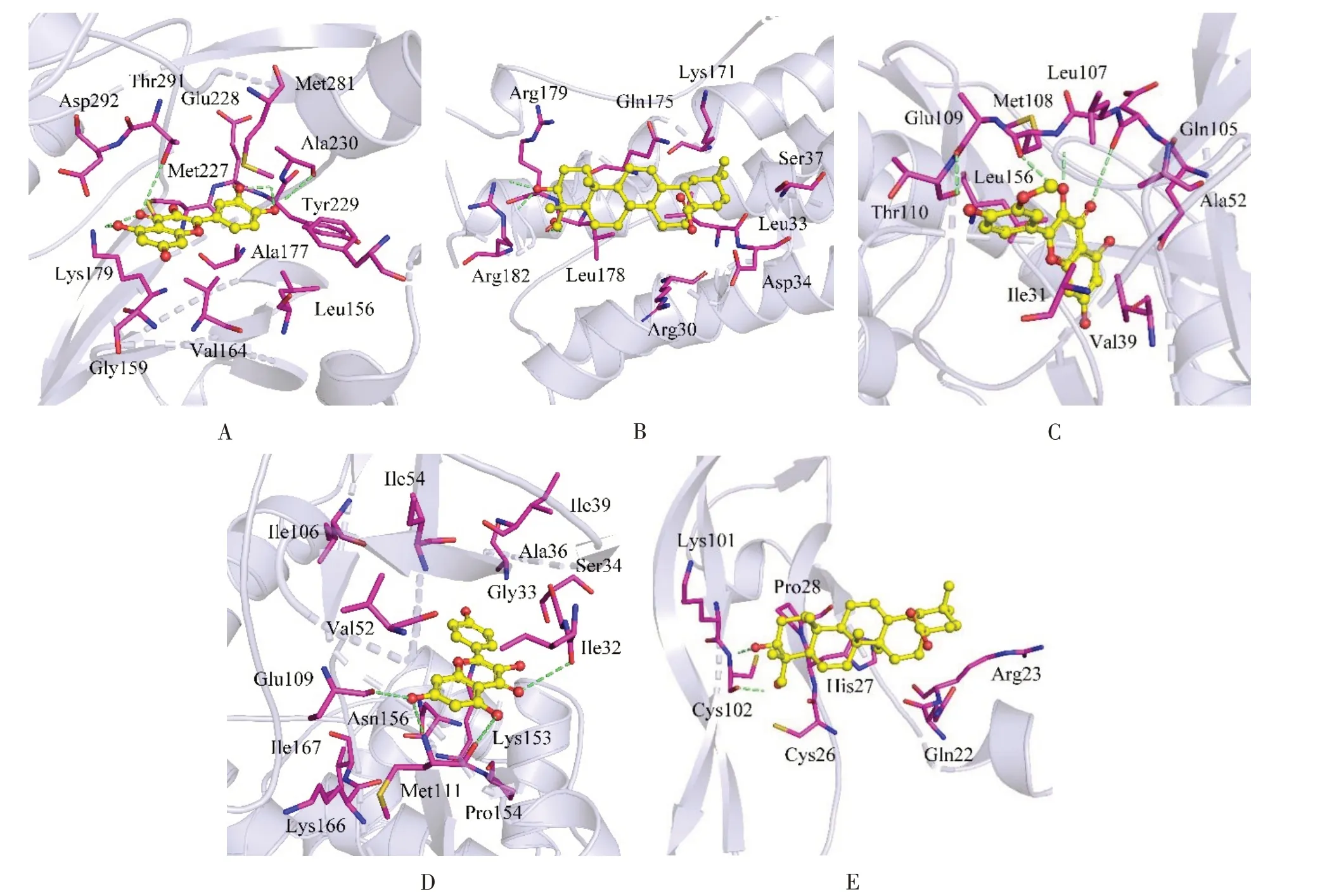
图9 分子对接模式图Fig.9 Molecular docking pattern

表2 主要活性成分与核心靶点结合能Tab.2 The docking score of main active ingredients and core targets
3 讨论
3.1 黄芪4种有效成分对DCM的作用机制
黄芪所含的药用活性成分以黄酮类、氨基酸类、多糖、皂苷类等为主,在研究DCM方面涉及最多的成分为黄芪多糖以及黄芪甲苷。动物实验表明,黄芪多糖能够通过抑制氧化应激损伤[7]、MAPK信号通路活性[8]、干预NRG-1/ErbB/PI3K/Akt信号通路[9]和减少心肌细胞的凋亡等途径,发挥对DCM的保护作用。黄芪甲苷可通过抑制AMPK/mTOR信号通路改善心肌肥厚,减轻心肌的损伤[10]。
进行一系列的分析、验证后我们发现,黄芪有10个活性成分与DCM靶点密切相关。分子对接实验发现,10个活性成分都能成功对接DCM度值位居前5的关键靶点。这10个活性成分中,Quercetin(槲皮素)、Isorhamnetin(异鼠李素)、Kaempferol(山奈酚)、Formononetin(芒柄花素)、3,9-di-O-methylnis⁃solin(3,9-二-O-甲基尼森香豌豆紫檀酚)、Calyco⁃sin(毛蕊异黄酮)、Jaranol(熊竹素)等7个活性成分均属于黄酮类,这极大丰富了对黄芪治疗DCM化学成分的研究。
在探讨线粒体过氧化物酶-3(Prx-3)对DCM高血糖所致心肌损害具有保护作用的实验中,Arkat S等[11]发现槲皮素可以通过激活Nrf2/Nrf1转录途径恢复糖尿病大鼠心肌中Prx-3的表达,可减少或减弱DM所致的心肌氧化应激(OS)和心脏重塑,改善DM大鼠的心功能障碍。已有研究表明[12],山奈酚能够抑制NF-κB因子核转位和激活核因子-红细胞生成素2 p45相关因子-2(Nrf-2)进而显著抑制高糖诱导的炎症细胞因子表达和活性氧(ROS)的生成,从而起到治疗DCM的作用。Wang Y等[13]通过体外实验证明芒柄花素可抑制IL-1β诱导的NF-κB活化和β细胞凋亡发挥抗糖尿病活性。Zhao TT等[14]发现异鼠李素可通过减轻H9c2心肌细胞凋亡和氧化应激而对缺氧/复氧诱导的损伤发挥积极作用。
在DM相关疾病的发病过程中,AGEs(晚期糖基化终产物)发挥着非常关键的作用。Xu Y等[15]研究发现毛蕊异黄酮通过抑制雌激素受体ERK1/2-NF-κB途径可以减少AGEs诱导的巨噬细胞迁移和对内皮细胞的粘附并减轻局部炎症。而槲皮素、山奈酚、异鼠李素及芒柄花素都属于黄酮或异黄酮类物质,已有研究表明,槲皮素[16-17]和山奈酚[18]均可显著降低人体甲基乙二醛(MGO)的浓度,而MGO是AGEs最有效的前体,MGO和AGEs与糖尿病、其并发症和其他与年龄相关的疾病密切相关,这就表明了槲皮素在治疗糖尿病方面有着一定疗效。异鼠李素[19]可抑制Fas介导的外源性细胞凋亡,从而对MGO处理后培养的HBMEC中OGD诱导的细胞毒性具有保护作用。研究表明[20-21],芒柄花素对高糖诱导的小鼠系膜细胞NF-KB信号通路及系膜细胞增殖具有抑制作用,对Ⅱ型糖尿病并发糖尿病骨病大鼠的骨质疏松具有缓解作用。
3.2 黄芪与DCM交集靶点的分析
通过对黄芪与DCM的共同靶点PPI网络拓扑分析发现,degree排在前列的关键靶点含AKT1、IL6、MAPK1、MAPK8以及VEGFA等。AKT1是AKT的主要亚型之一,研究显示,内质网应激是导致β细胞最终无法补偿胰岛素抵抗者体内高血糖症的部分原因,而AKT1蛋白的缺乏会引起低水平的内质网应激,造成更高的细胞凋亡率[22]。IL6是炎性细胞因子家族成员之一,临床研究发现肥胖诱导的胰岛素抵抗与IL6水平的升高有关,当IL6循环水平升高时,会对胰岛素信号级联产生抑制,进而引发胰岛素功能障碍[23],而减肥时会降低循环的IL6水平,提高胰岛素敏感性指数[24]。MAPK1和MAPK8都属于MAPK的家族成员。MAPK1又称ERK2,在人体内由MAPK1基因编码[25]。Zhao J等[26]发现MAPK1基因与MALAT1的基因表达呈明显正相关趋势,并且MAPK1能够通过激活H9C2细胞中的PI3K/AKT信号上调MALAT1的表达,而MALAT1是一种与细胞增殖相关的非编码RNA,从而促进心肌细胞的增殖。MAPK8是一种炎性激酶,又称c-Jun氨基端激酶(JNK),能对由细胞因子、游离脂肪酸和高血糖激活的各种细胞应激信号产生应答,已被发现是2型糖尿病的潜在治疗靶点[27]。VEGFA是一类具有分泌功能的促细胞分裂因子,同时也是一类功能强大的血管通透因子。Agudo J等[28]在成年小鼠身上发现胰岛细胞VEGFA的过度表达可诱导胰岛形成过度的血管增生、形态的改变和促炎细胞因子的产生,进而导致了胰岛素分泌受损、β细胞减少和高血糖。
GO分析发现黄芪可以对脂多糖、细菌、细胞化学胁迫、上皮细胞增生、抗氧化等生物过程起调控作用,涉及膜筏、质膜微区、膜区等细胞组分,通过与DNA结合转录因子、RNA聚合酶Ⅱ特异性DNA结合和发挥受体配体活性等分子功能产生活性,说明了黄芪与DCM的作用机制涉及了多种代谢过程、细胞进程和多种生物分子,它们共同调控复杂的代谢网络,体现出中药的多种成分通过多种途径作用于多靶点的特点。
进行KEGG通路分析的结果显示,主要富集于MAPK、PI3K-Akt及DM并发症中的AGE-RAGE等信号通路。PI3K/Akt信号通路是生物体内重要的调节机制,在调控与DCM相关的心肌细胞增殖、凋亡和炎症反应等多种生物学过程中发挥至关重要的作用[29]。在DCM病人出现心功能受损方面,心肌细胞凋亡是其中的关键一环[30]。众多实验结果皆显示,PI3K/Akt信号途径可发挥众多生物学效应,可防止细胞凋亡,促进细胞存活[31]。有相关报道表明,PI3K/Akt信号转导通路具有抑制炎症和氧化损害的功能,黄芩素能通过PI3K/Akt信号转导通路保护DCM大鼠免受氧化和炎症作用的破坏[32]。在细胞糖代谢等方面,PI3K/Akt信号通路也发挥着关键性影响。
这些年,随着对AGEs的深入探究,人们发现了AGEs参与DCM的多种病理生理过程,当机体处于慢性高血糖状态时,细胞内外会形成AGEs,当AGEs与其受体(RAGEs)结合后启动信号传导,会引发一系列导致血管和心肌损伤的事件[33-34]。以上结果都提示黄芪可能通过诱导胰岛β细胞凋亡和炎性细胞因子激活,调控心肌细胞增殖和胰岛素抵抗等途径发挥防治DCM的作用。
本研究属于网络药理学,尚存在以下局限性:本文涉及的靶点、信号通路较多,需要注意的是,网络药理学是依据现有数据库和已有实验数据进行网络的建模,由于原始实验数据、图谱信息来源于不同的实验条件,故大多实验存在一定的假阳性率,已经评价的小分子化合物及其作用靶点数量均有限。
4 结论
本研究利用网络药理学和分子对接技术发现黄芪主要通过槲皮素、山奈酚、芒柄花素、异鼠李素等活性成分作用于AKT1、IL6、MAPK1、MAPK8、VEGFA等重要靶点,调控诸多不同生物学功能与PI3K-Akt、MAPK及DM并发症中的AGE-RAGE等信号途径起到治疗DCM的作用。本研究表明,黄芪治疗DCM具有多成分、多靶点、多通路的特点,为黄芪治疗DCM的化学物质基础的发现及其作用靶点机制和黄酮类物质的临床应用奠定了基础。

