Ag-TiO2光催化同步去除水中氨氮和总氮
姜娥梅 吴 磊 林 超,2
(1东南大学能源与环境学院, 南京 210096)(2江苏省环境科学研究院, 南京 210036)
在一个反应体系中实现氨氮转化和含氮气体的逸出,是水处理技术追求的目标,已经报道的有同步硝化反硝化[7]、厌氧氨氧化[8-9]和光催化氧化法[10-11]等,这些技术均能将氨氮转化为含氮气体,从而逸出系统,实现同步去除氨氮和总氮(TN)的目的.其中,光催化氧化法因反应速率高、去除效果好、简单易用而成为研究热点[12-13].

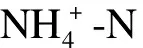
1 实验材料与方法
1.1 实验材料
以德固赛气相纳米TiO2(P25)和硝酸银为原料,用光还原法制备Ag掺杂的TiO2光催化剂.在烧杯中依次加入2.5 g TiO2、一定质量硝酸银和250 mL蒸馏水,使银质量分数分别为0.5%、1.0%、1.5%、2.0%,并向溶液中通入氮气,使溶解氧质量浓度小于0.1 mg/L.加入10 mL乙醇和适量稀氢氧化钠溶液用以还原和pH调节,确保混合液pH值为11,并用125 W汞灯照射混合液10 h,后续进行离心分离并洗涤5次.将洗涤好并烘干24 h后的催化剂研磨成粉,并在200 ℃马弗炉中煅烧6 h后重复研磨,所得粉末为本实验的催化剂.
1.2 材料表征
Ag-TiO2催化剂的Ag实际掺量、晶体结构、粒径大小及元素组成等主要通过XRF、XRD、SEM和XPS进行表征分析,采用的设备分别是X射线荧光能谱仪(ARL,美国热电)、X射线衍射仪(SmartLab,日本理学)、场发射环境扫描电子显微镜(Zeiss,德国)和X射线光电子谱仪(Thermo ESCALAB(250xi)).
1.3 实验步骤
用氯化铵配成250 mL相应浓度的氨氮溶液,并与定量的催化剂加入光催化反应器内,再按实验要求滴入氢氧化钠或盐酸进行pH值调节,并通入氮气降低溶解氧质量浓度.然后将冷凝阱和反应器组装,紫外灯置于冷凝阱中,并遮光处理反应装置,最后打开紫外灯进行反应.实验过程中取样间隔为30 min,共反应180 min.测定时,用0.45 μm孔径水系滤膜处理水样以滤去光催化剂颗粒,再依据《水质 氨氮的测定 纳氏试剂分光光度法》(HJ 535—2009)、《水质 硝酸盐氮的测定 紫外分光光度法》(HJ/T 346—2007)和《水质 亚硝酸盐氮的测定 分光光度法》(GB 7493—1987)分别测定氨氮、硝态氮和亚硝态氮.
该光催化反应对氨氮、总氮的去除率及对产物的选择性计算公式如下所示.其中,产物选择性是指生成产物的量占所消耗反应物量的百分数,包括亚硝态氮、硝态氮和气体选择性:
(1)
(2)
(3)
(4)
γ=(1-α-β)×100%
(5)
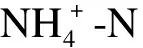
2 结果与讨论
2.1 催化剂的表征
2.1.1 XRF分析
为确定Ag在TiO2中的实际掺入量,对其进行了XRF分析,结果如表1所示.根据Ag的实际质量分数将催化剂记为0.23%Ag-TiO2、0.53%Ag-TiO2和0.94%Ag-TiO2.

表1 Ag-TiO2催化剂的XRF分析结果 %
2.1.2 XRD分析

(a)TiO2
2.1.3 SEM分析
图2(a)、(b)分别为TiO2和0.53%Ag-TiO2的SEM图.如图2所示,纯TiO2平均粒径约26.69 nm,颗粒分布松散;而Ag-TiO2的粒径约23.63 nm,颗粒排列更为紧密.缩小粒径可减少电子与空穴复合机率,增强电荷分离效果,提高催化活性,同时也能减少漫反射,提高光吸收效率[21].

(a)TiO2
2.1.4 XPS分析
图3(a)反映出Ag-TiO2存在Ag、Ti、O元素,且Ag所在的峰强度很弱,表明Ag的掺入浓度较低且分散均匀.由图3(b)可看出,Ag3d3/2和Ag3d5/2特征峰分别对应368.0和374.3 eV,说明Ag的存在形态是零价单质.图3(c)中Ti2p3/2和Ti2pl/2特征峰分别对应458.50和464.24 eV两处峰.图3(d)显示O1s特征峰对应529.74 eV处的不对称宽峰,表明O有多种氧化物存在形态.

(a)全谱图
2.2 吸附与挥发对比实验
催化剂若吸附氨氮会影响光催化反应的效果[6],因此研究了催化剂的吸附效能.在暗室,初始pH值为10时,由图4(a)可知,P25和Ag-TiO2对氨氮的吸附率与无催化剂的对照组一致,均在0~3.8%内波动,说明催化剂对氨氮几乎无吸附作用.同时对比了不同初始pH值下氨氮的挥发情况,控制初始pH值分别为7、9、10、11,由图4(b)可见,当初始pH值为7~10时,氨氮基本没有挥发作用,而pH值为11时挥发率高达15.6%.因为此时溶液中的氨氮主要以NH3形式存在,在与空气的接触下,容易由液相向气相转移.上述吸附与挥发对比实验中,催化剂投加量和氨氮初始质量浓度均为1.0和20 mg/L.
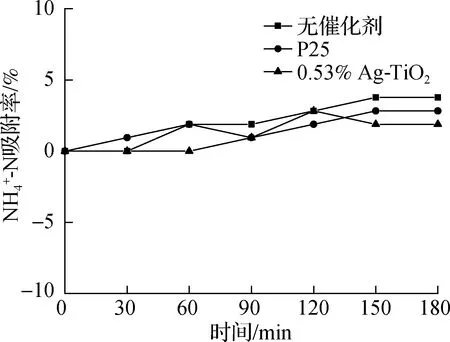
(a)不同催化剂对氨氮的吸附效果曲线
2.3 光催化氧化氨氮效果的影响因素
2.3.1 Ag掺量的影响
为研究Ag实际掺量对光催化氧化氨氮效果的影响,控制氨氮初始质量浓度为20 mg/L,初始pH值为10,催化剂投加量为1.0 mg/L,Ag实际质量分数分别为0、0.23%、0.53%和0.94%,实验结果见图5.在该实验条件下,随Ag掺量的增加,氨氮和总氮去除率均先上升后下降,当Ag质量分数为0.53%时效果最佳,氨氮和总氮去除率分别可达79.8%和72.0%.可见增加Ag掺量具有两面性,有利的是可减小改性催化剂粒径,增加光量子效应,还可使Ag-TiO2光吸收发生红移,以获得更多能量参与,同时Ag掺杂在TiO2中形成的缺陷也可提高催化剂活性[19];不利的是Ag掺量过大时,催化剂内部可能会形成电子-空穴复合中心,从而增大电子-空穴复合机率,由此降低催化活性[22].

(a)氨氮去除效果图
2.3.2 催化剂投加量的影响
为研究催化剂不同投加量对光催化氧化氨氮效果的影响,控制氨氮初始质量浓度为20 mg/L,初始pH值为10,Ag实际质量分数为0.53%,催化剂投加量分别为0.5、1.0、1.5 mg/L,实验结果见图6.可见,增加催化剂投加量会使氨氮和总氮去除率均先上升后下降.当投加量为1.0 mg/L时,达到氨氮和总氮最佳去除率,分别为79.8%和72.0%.这是因为随着催化剂投加量的增加,不仅会提高氧化氨氮的自由基和空穴数量,还会增大污染物与催化剂的接触面积,从而提高反应效率[23].但是当投加量过多时,增加投加量反而会降低氧化效果,可能原因是过量的催化剂一方面会阻碍光线的透过[19],另一方面会发生光散射损失能量[24].

(a)氨氮去除效果图
2.3.3 初始pH值的影响

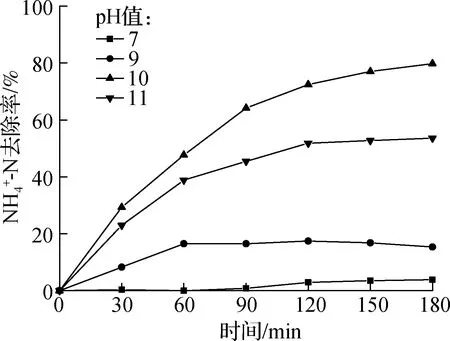
(a)氨氮去除效果图
2.4 氨氮氧化过程与反应动力学
2.4.1 氧化过程中的产物变化
以0.53%Ag-TiO2光催化剂、初始pH值为10、投加量1.0 mg/L的实验组为例,分析光催化氧化过程中各种产物质量浓度及产物选择性的变化过程.由图8可知,随着光催化反应的进行,氨氮和总氮质量浓度逐渐降低,亚硝态氮浓度先升高后降低,在30 min时达到最高质量浓度0.91 mg/L,含氮气体和硝态氮均呈升高趋势.反应180 min后,溶液中氨氮、亚硝态氮、硝态氮和总氮质量浓度分别为4.40、0、1.69和6.09 mg/L,生成含氮气体质量浓度为15.64 mg/L,说明Ag-TiO2氧化氨氮的产物中除含氮气体外,其他产物主要为硝酸盐,基本不生成毒性较大的亚硝酸盐.图9反映了氨氮转化过程中产物选择性的变化情况,在转化的产物中含氮气体选择性最高,且随着反应时间的进行会逐步提高并维持在90%左右;在180 min时,气体选择性为90.2%,亚硝态氮选择性由14%降至0,整个反应过程中硝态氮选择性约10%,变化不明显,说明含氮气体是氨氮氧化过程中的主要产物.
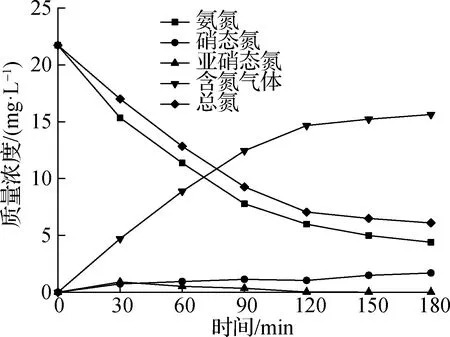
图8 反应中各类型氮质量浓度变化
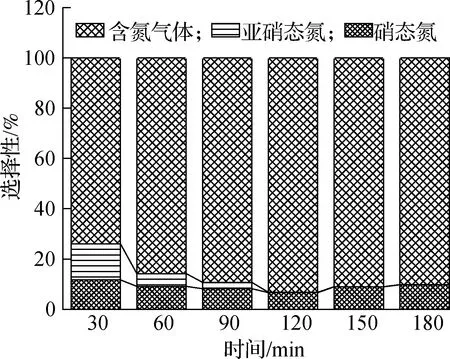
图9 反应产物选择性随时间的变化
2.4.2 反应动力学研究
根据上述影响因素进行反应动力学拟合,结果如表2所示,可见各组实验的反应时间t(min)和ln(C/C0)基本成线性相关,相关系数均能达到0.9以上,基本符合Langmuir-Hinshelwood模型的一级反应动力学方程C1=C0e-kt,其中k为反应速率常数.当催化剂投加量分别为0.5、1.0、1.5 mg/L时,k为0.002 5、0.009 1和0.007 0 min-1,0.002 5比0.009 1提高约2.64倍,控制Ag掺量和初始pH值可使k分别提高约2.36和2.03倍.本文中各因素对反应速率的影响从大到小依次为催化剂投加量、Ag掺量、初始pH值.

表2 光催化氧化氨氮动力学参数表
3 结论
1)催化剂表征结果显示,Ag在TiO2上的负载形态是零价单质,0.53%Ag-TiO2的晶体结构不变,但催化剂粒径缩小,有利于分离空穴电子对,增加催化剂活性,并减少漫反射,提高光吸收效率.
2)在初始pH值为10、催化剂投加量1.0 mg/L情况下,0.53%Ag-TiO2催化剂获得了较高的反应效率,氨氮的转化效率为79.8%,总氮去除率为72.0%,产物对气体的选择性提高至90.2%.
3)本实验中氨氮降解动力学基本符合Langmuir-Hinshelwood模型的一级反应动力学方程,且各因素对反应速率影响从大到小依次为催化剂投加量、Ag掺量、初始pH值.

