基于高通量测序技术的燕窝罐头腐败嗜热菌分析
范力艺,范群艳,胡嘉淼,张 怡※
(1. 福建农林大学食品科学学院,福州 350002;2. 中粮生物科技股份有限公司,北京 100101;3. 中粮营养健康研究院,北京 102200;4. 中粮融氏生物科技有限公司,上海 201500;5. 厦门燕之屋丝浓食品有限公司,厦门 360000)
0 引 言
嗜热菌是指在40~70 ℃能正常生长繁殖的菌群,其最适生长温度一般在50~60 ℃。研究表明嗜热菌只要很少残留于罐头食品中,就会在罐头食品储运过程中大量繁殖从而造成产品腐败,由于其极强的抗逆性,因此在热杀菌强度较高的高温高压杀菌方式都难以在最终产品中完全将其杀死。并且嗜热菌(莫氏菌属)在121 ℃下的值(表示在特定的环境中和特定的温度下,杀灭1个对数值的微生物所需要的时间)为30 min,(地芽孢杆菌属)在121 ℃下的值为1~6 min。而大多数食品在以热处理灭活嗜热菌芽孢的杀菌强度下,即杀菌时间至少达到6时,品质无法得到维持。另外,嗜热菌能够在生产线上的器具和设备表面繁殖形成生物膜,从而加大了消毒清洗的难度。再加上嗜热菌能够在不同的环境中生长,并且可以通过原料、土壤、水或者加工过程进入产品,从而加大了生产过程中的控制难度。
由嗜热菌所引起食品变质的食品安全问题在食品行业受到广泛的关注,嗜热菌引起罐头食品感官特性的变化,不但会引起食品安全问题,而且还会给企业带来严重的经济损失。有研究表明,蔬菜罐头生产线上的嗜热菌污染很可能来自于土壤或者在蔬菜准备阶段时人员污染。关于青豆罐头生产线上微生物污染的调查报告也证实了嗜热菌污染包含原料的初始污染和生产链上的交叉污染。在乳制品行业也有关于嗜热菌污染的研究报道。因此,嗜热菌可以在各个食品行业造成微生物污染,且嗜热菌在低酸罐头中除了具有极强的抗逆性,还具有生长广泛性的特点,涉及食品品类非常多。Andre等收集了法国2002-2012年间变质罐头类食品39种,共462份,结果表明大部分罐头类食品变质的原因是由嗜热菌引起:在所有变质罐头类食品中(穆尔氏菌属)污染占比36%、(地芽孢杆菌属)占比35%、(杆菌属)占比10%,还有9%腐败罐头样品由于(芽孢杆菌属)引起的。而通常所说的罐头平酸酸败就是指属中的(嗜热脂肪地芽孢杆菌属)引起的罐头腐败。
燕窝(L.)是指雨燕科()几种金丝燕分泌出来的唾液,再混合苔鲜、海藻和柔软植物筑成的巢穴,又称燕菜、燕根、燕蔬菜,自明代以来就是中国名贵的滋补食品之一。燕窝富含蛋白质、氨基酸,且其富含的唾液酸具有很高的营养价值和保健功效。2019年中国进口干燕窝已达65.5 t,同比增长27.4%,已成为全球最大的燕窝进口国家。随着时代发展,消费者对于简洁时尚化食品的需求日益增加,健康、方便的饮食概念深入人心,燕窝由于泡发耗时、除毛耗力、炖煮耗功,其家庭烹制难以大规模推广,鲜炖燕、碗燕等即食燕窝罐头产品应运而生,此类产品仿照罐头产品的生产工艺,在保证美味食感的基础上提供了更加便捷的食用方式。但由于燕窝罐头属于低酸性罐头,且燕窝罐头具有加工工序多的特点,因此燕窝罐头容易在冗长的加工过程中被嗜热菌污染,最终的燕窝罐头产品受限于燕窝原料的加工强度而无法完全杀死嗜热菌,从而发生腐败变质。由于燕窝价格昂贵,很难在生产线上对最终产品进行大量抽检,对分析腐败原因造成了阻碍。目前关于燕窝的研究也越来越多,但之前的研究多是集中于燕窝的营养保健功能方面,少有关于燕窝微生物安全方面的研究,而由于嗜热菌引起的即食燕窝罐头腐败问题未见报道。因此,本研究提出两种验证假设,通过16S rRNA扩增子高通量测序结合传统培养分离法,对比燕窝罐头生产线上原料、工序和终产品的微生物组成。主成分分析法确定假定腐败微生物、核心微生物、污染来源,再通过主成分分析(Principal Component Analysis,PCA)聚类分析找出生产线上关键控制点,以期为燕窝罐头安全生产提供理论依据与防控方向。
1 材料与方法
1.1 试验材料与仪器
1.1.1 试验材料
根据前期研究表明,嗜热菌污染来源可能来自于原料也可能来自于工序,笔者考虑了两种假说来解释燕窝罐头的污染。假设一是在同一燕窝生产线灌装后产品与原料所包含的微生物群或者嗜热菌存在差异,则认为腐败微生物不是由原料代入,而是由生产线的工序代入最终产品,因此将调查哪些工序携带了哪些潜在的腐败微生物进入到燕窝到生产线;另一种假说是同一燕窝生产线灌装后产品与原料有着相同的微生物或者嗜热菌组成,在这种情况下,则认为腐败微生物由原料代入生产线,这样能够确定包括假定腐败细菌在内的核心微生物群,并且根据主成分(Principal Component Analysis)分析确定生产线上与原料相关联的几个关键控制工序。本试验假定腐败嗜热微生物为上述所提到的几种罐头主要腐败微生物:、、、。
燕窝样品来源于厦门的一家燕窝公司,生产工序流程如图1所示,每个样品分3个批次取样,同批次中随机取样5次混合成一个批次,采样点工序对应表1所示。
1.1.2 仪器与设备
E.Z.N.A.® soil试剂盒(美国Omega Bio-Tek公司),0.4L FastPfu聚合酶(中国TransGen公司),引物(上海生工公司):338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′),2%琼脂糖(西班牙Biowest公司),AxyPrep DNA Gel Extraction试剂盒 (美国Axygen Biosciences公司),PCR仪:GeneAmp® 9700型(美国ABI公司),微型荧光计:QuantiFluor™-ST(美国Promega公司),高通量测序仪:Illumina MiSeq(美国Illumina公司)。

图1 燕窝罐头生产工序流程图Fig.1 Process diagram of edible bird nest cans production process

表1 采样点工序Table 1 Sampling point procedure
1.2 DNA抽提和PCR扩增
鉴定抽提DNA的浓度和纯度,采用2%琼脂糖凝胶电泳检测DNA提取质量;扩增程序:预变性(95 ℃,3 min),变性(95 ℃,30 s),退火(55 ℃,30 s),延伸(72 ℃,30 s),延伸(72 ℃,10 min)。扩增整个体系为20L,4L 5FastPfu 缓冲液,2L 2.5 mmol/L dNTPs,0.8L引物(5mol/L),0.4L FastPfu 聚合酶;10 ng DNA模板。测序部分由上海美吉生物医药科技有限公司完成。
1.3 Illumina Miseq测序
以2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction 试剂盒进行纯化,Tris-HCl洗脱,2%琼脂糖电泳检测。使用微型荧光计进行检测定量。根据高通量测序仪标准操作规程将纯化后的扩增片段构建PE 2×300的文库。构建文库步骤:1)连接“Y”字型接头;2)使用磁珠筛选去除接头自连片段;3)利用PCR扩增进行文库模板的富集;4)氢氧化钠变性,产生单链DNA片段。利用Miseq PE300平台进行测序。
1.4 高通量测序鉴定
取样5个批次冰糖,5个批次燕窝,管道内壁用棉签涂抹的方法分5个不同时间段进行取样。采用AFNOR-CNERNA的标准重新激活样品中的芽孢,在锥形瓶中每10 g的样品用100 mL的牛肉汤培养基配制,放置于37与55 ℃(嗜热微生物通常在这两个温度下生长),采用无氧(石蜡封口)与有氧条件分别培养7 d,然后摇匀后吸取锥形瓶中液体0.1 mL在锰盐琼脂培养基上置于37与55 ℃,仍然采用无氧(石蜡封口)与有氧条件下培养。之后用十倍稀释法,多次分离单菌落用于分子学鉴定。DNA提取及16S rDNA高通量测序分析:采用细菌基因组DNA提取试剂盒进行DNA提取,将提取的16S rDNA进行PCR扩增。反应过程为94 ℃预变性5 min,然后进入以下循环:94 ℃ 45 s、55 ℃ 45 s、72 ℃1 min,30个循环后72 ℃延伸10 min,最终冷却至4 ℃,扩增结果再进行琼脂糖凝胶电泳,紫外灯下观察扩增效果,若出现1.5 kb的条带,则证明扩增出了16SrDNA序列。将扩增产物送交上海生工生物工程技术服务有限公司进行测序。测序结果与数据库NCBI BLAST比对后,再通过Clustal X1.8软件将代表序列与数据库中所得序列进行完全比对,利用MEGA5.0软件Neighbor.Joining法进行1 000次步长计算构建系统发育树。
1.5 数据处理
采用QIIME(Version1.7.0)计算丰富度指数ACE、Chao1与多样性指数Simpson。然后再划分最小分类单元(Operational Taxonomic Unit,OTU),通过FastTree工具构建OTU代表序列的系统发育树。再通过R软件聚类分析PCA分析通过线性变换,将原始的高维数据(如菌群OTU丰度矩阵)通过线性变换组合,投影到维度较低的空间坐标系(即主成分)中,从而达到降维、简化数据结构的目的,展现样本的自然分布。使用Mothur软件,调用Metastats(http://metastats.cbcb.umd.edu/)的统计学算法,对门、属及种水平的各个分类单元在样本(组)之间的序列量(即绝对丰度)差异进行两两比较检验。采用DPS软件分析数据显著性。
2 结果与分析
2.1 燕窝罐头原料与生产工序细菌群落Alpha多样性分析
对各样品Alpha多样性指数进行显著性分析确定微生物菌群在工序中是否有显著变化,若样品的ACE和Chao1指数都有显著性,可以认为这个工序是高危工序。由于样品YW1、YW2、YW4、YW5属于冰糖灌装生产线,YW3、YW6、YW7属于另外一条燕窝处理生产线,YW8为两种原料灌装混合后的产品,因此两条生产线单独分析,并且在分析时可以先剔除YW3、YW4两个非原料工序(毛巾)。如表2所示,在冰糖的灌装工序中YW5相比YW2微生物的的ACE和Chao1指数都显著增加(0.05),表明灌装液在经过管道时微生物多样性增加,有可能管道内壁由于生物膜的附着会带入更多的微生物,这可能是一个需要关注的高危工序。YW3样品ACE指数和Chao1指数最大,这说明了挑毛车间的毛巾也可能是一个要关注的高危控制点,在生产实际中干燕窝原料在挑毛池中经过无菌水泡发再过滤水分后,需要使用挑毛车间的毛巾擦拭桌面水滴,因此毛巾可能被多种燕窝原料中携带的微生物污染。燕窝是金丝燕分泌出来的唾液,混合苔鲜、海藻和柔软植物筑成的巢穴,不同地区的苔鲜、海藻和柔软植物携带微生物种类都可能不同,因此燕窝中被污染的微生物种类多。Simpson这个反映细菌均匀度的指数没有显著差异,这也表明了没有特别优势的微生物在生产过程繁殖。研究结果表明,冰糖灌装工序,微生物的多样性增加。

表2 燕窝罐头生产工序细菌群落Alpha多样性指数结果Table 2 Results of Alpha diversity index of bacterial community in edible bird nest's cans production procedure
2.2 燕窝罐头原料与不同生产工序中微生物群落的分析
燕窝罐头原料与不同生产工序中微生物群落的门和属水平上的相对丰度如图2。8个样品中优势菌门为Proteobacteria(变形菌门)、Deinococcus-Thermus(异常球菌-栖热菌门)和Bacteroidetes(拟杆菌门)(图2a)。从图2b属水平来看样品中的优势菌属为(不动杆菌属属),这是一种常在人体中分离出的微生物;(异常球菌属),此类微生物耐受性强,并且可能引起食品形成红色菌斑;(瓦菌属),此类微生物多见于呼吸道感染,属于条件致病菌,一旦感染临床治疗困难较大。如图2c热力图所示,YW1、YW2、YW3、YW4、YW5和YW8有着相同的优势菌属和,YW6和YW7有着相同的优势菌属,YW3的优势菌不同于另外几个样品;并且热力图表明,优势菌属从燕窝原料(YW6)到灌装后产品(YW8)的过程明显减少(热图色块从红色变为绿色),优势菌属和从冰糖原料(YW1)到灌装后产品(YW8)过程中也明显减少,这表明这3种优势菌属会在加工过程中减少,并且以往研究也表明这3种优势菌都不是引起罐头腐败的嗜热菌,因此需要对样品微生物进行进一步分析。

图2 燕窝罐头不同生产工序中微生物群落的样品门水平、样品属水平、样品热力图Fig.2 Phylum and genus level of microbial community and heatmap in different production processes of edible bird's nest cans
燕窝罐头原料与不同生产工序中的嗜热脂肪芽孢杆菌的检测结果如表3所示,样品YW1、YW2、YW4、YW5、YW8发现了,YW6、YW7、YW8中发现了,并且还在YW3中发现了。有研究表明,这3种微生物为罐头主要腐败微生物。Cameron综述了在糖类中发现的嗜热菌,并证明冰糖中的嗜热菌是罐头产业的重要安全隐患,这个结果与本文的研究结论一致。常存在于土壤与干燥环境中,其生长环境特点符合燕窝建造的材料(混合苔鲜、海藻和柔软植物)与本身低水分的理化环境(含水率<25%)的要求。在试验中除冰糖原料和干燕窝原料中发现嗜热菌,还在挑毛工序的擦拭毛巾中发现了,这种热抵抗能力强的微生物在罐头工艺工序中被发现,因此还需要对该工序的毛巾着重监控杀菌。从结果来看冰糖原料携带的两种嗜热菌在其相关工序与灌装后产品(YW8)都被检出,这表明很可能是这两种嗜热微生物随着冰糖原料沿着相关工序一直携带到最终产品。

表3 不同生产工序中的嗜热菌属Table 3 Bacillus thermophilus in different production processes
2.3 燕窝罐头原料及不同生产工序中微生物聚类分析
燕窝罐头原料与不同生产工序中微生物聚类分析见图3,将3个平行样品平均值后再通过PCA分析将繁杂工序聚类成关联工序,菌群结构相似的工序在图中表示出更近的距离,以此找到生产工艺中的关键控制点。从图3中可以发现YW1、YW2、YW4、YW5、YW8中微生物群落结构相似,YW6、YW7中微生物群落相似,YW3微生物群落结构与其他样品不同。实际生产中YW1、YW2、YW4、YW5、YW8 都是与冰糖联系非常密切的工序,因此有着很强的关联性;YW6、YW7是干燕窝处理前后的原料,因此微生物结构相似;YW3不同于其他工序。
图3表明,冰糖原料YW1与灌装后产品YW8微生物菌群结构相似,图2c显示YW1与YW8优势均属相同,且表3的检测结果也表明,灌装后产品与冰糖原料腐败微生物相同,都包含了和,因此从整体结果来看符合假设二中所述的微生物污染来自于原料YW1而非工序,从而推断了产品中的与可能是由冰糖原料代入。虽然燕窝原料的菌群结构与灌装后产品不相似,但由于燕窝原料中也携带了这种燕窝罐头中腐败微生物,因此干燕窝原料也极有可能引入也需要对干燕窝原料与相关工序进行控制。以上研究确定了嗜热菌的污染来自于原料而非工序,因此还需要确定原料相关工序是否是高危工序。

图3 燕窝罐头不同生产工序中的微生物主成分分析Fig.3 PCA analysis of microorganisms in different production processes of edible bird's nest cans
2.4 燕窝罐头冰糖原料及与冰糖相关工序所取样本间微生物分类学组成的差异分析
在以上分析基础上,再针对两种原料经过不同工序时微生物分类学组成的差异性进行分析,从而发现一些关键腐败微生物是否在不同加工工序中增加。图4为燕窝罐头冰糖原料及与冰糖相关工序所取样本间微生物分类学差异性分析,结果发现对罐头食品安全威胁很大的在冰糖原料及与冰糖相关工序之间有明显的增长,但是图4燕窝处理过程中此类微生物没有显著增长。在磷酸盐缓冲液中为10 min(磷酸盐缓冲液中以113 ℃杀死一个对数值需要10 min),并且研究已经证实了在介质中比在纯水中有更高的耐热值,因此会对罐头食品微生物安全造成很大威胁。图4表明(YW1-YW2)之间没有显著差异(>0.05),说明了冰糖原料到蒸煮锅的过程没有明显增长,但是(YW2-YW5)有了极显著增长(<0.01),因此可以判断冰糖液经过管道输送后明显增加,且Aphlha多样性分析表明YW1、YW2、YW5中YW5有着更高的微生物多样性,这很可能与管道内部附着的生物膜有关,随着生物膜积累而增加。有研究表明,微生物在管道内部形成生物膜会严重威胁人体健康。早期报道了利用16S rRNA技术研究饮用水生产管道内壁中存在的生物膜和水体中的细菌群落结构及组成,结果发现管道内壁上生物膜的微生物多样性高于水体中微生物多样性。并且还证实了管内壁上附着的生物膜的微生物数量比水体中的微生物数量更多,并且因为多种因素(如水流剪切力等)都会导致生物膜从管壁上脱落进入水体中。研究揭示生物膜在形成的过程主要包括可逆性吸附阶段、不可逆性吸附阶段、群落形成阶段、生物膜成熟阶段及最后老化阶段后脱落水体中。因此,YW5灌装口糖液微生物多样性与的显著增长应该是由于管道内壁生物膜脱落造成的。另外管道长期输送80 ℃以上的糖液,由于在更高的产芽孢温度下产生的芽孢通常有着更高的热抵抗能力,因此残留在管道内壁生物膜中的微生物通常是对热抵抗能力很强的嗜热菌,管道内的嗜热菌生物膜对食品安全威胁更高。这与本文的研究结果一致,进一步说明了冰糖液经过管道是一个高位工序相互印证了管道内壁的生物膜存在极高的食品安全隐患,因此企业需要加大对管道内壁清洗频率、改善清洁方法以保障食品安全。另外从图中可以发现、、(苍白杆菌属)、(沙门杆菌属)在YW1-YW2工序中变化较大,(沙雷氏菌属)在YW1-YW2工序中变化较大。这4个菌属都是典型的人体携带菌。这表明灌装工序应该注意操作人员对产品的质量安全控制。
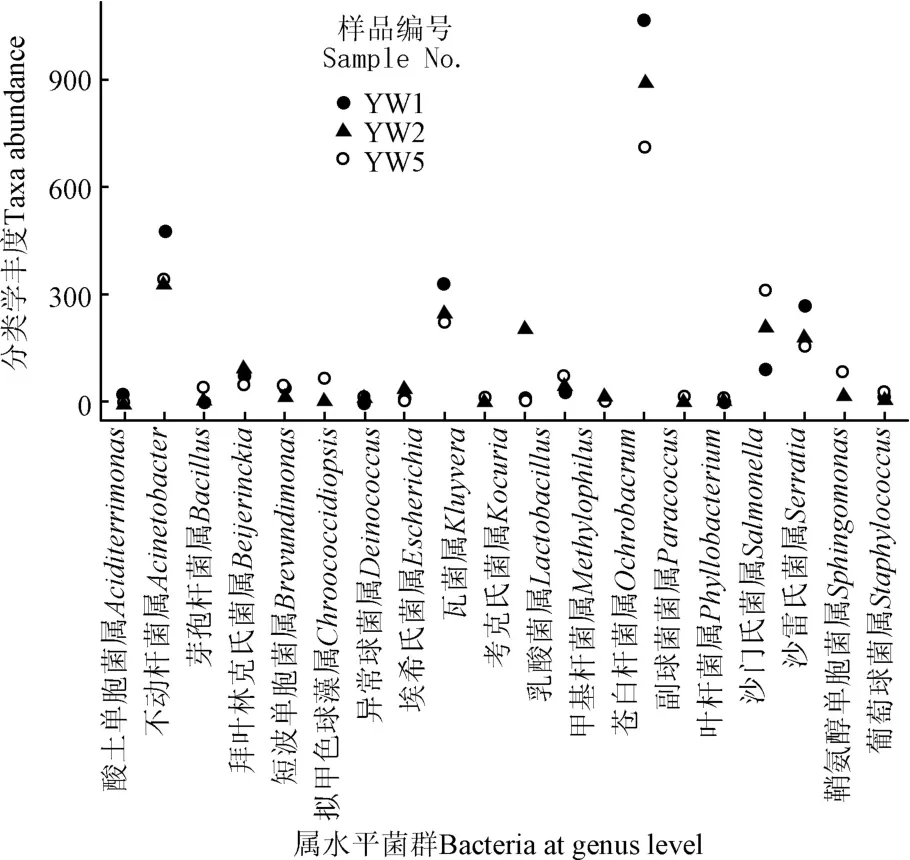
图4 冰糖原料经过相关工序微生物分类学组成的差异分析Fig.4 Differential analysis of microbial taxonomy composition of of rock sugar raw materials

图5 燕窝原料经过相关工序微生物分类学组成的差异分析Fig.5 Differential analysis of microbial taxonomy composition of edible bird's nest raw materials relevant with procedures
2.5 燕窝罐头生产原料和关键工序中微生物的培养与鉴定
通过16S rRNA检测发现冰糖原料中携带了、,干燕窝携带了,这两种微生物均为罐头原料中的主要腐败菌属;再通过多样性指数显著性分析与分类学组成的差异分析确定危险工序为冰糖液输送管道。因此,针对这两种原料和管道内壁这3个生产关键控制点,进行分离培养鉴定,进一步确认原料和危险工序中所携带微生物的种。
通过55 ℃培养分离鉴定结果如表4,干燕窝的菌种分离出了一种嗜热菌,在冰糖中分离出了两种嗜热菌,在管道内壁表面分离出了两种嗜热菌。再通过图6发育树证明了编号为a、b菌与有很高的相似度都属于属,c、e菌也为属,d菌属于属。通过NCBI比对结果,表4显示干燕窝中的菌种a很可能为,d和e为冰糖输送管道中的分离出的两个种,其中一个为,另外一个通过基因比对最高相似度只有97.43%,因此为潜在新菌种。除了c菌报道较少,其他菌种在早期都有研究,在法国腐败罐头调查研究中发现了和,其中的值为10 min,的值为7.95 min(100 ℃杀死1个对数值需要7.95 min),但在不同介质中值变化较大,并且它经常从腐败罐头中分离出来,因此有必要将其接种到燕窝溶液中做进一步研究。从分离鉴定结果来看,管道内壁的微生物中还分离出了一种潜在新菌种,这种菌与奶粉中分离出的有着很强的亲缘关系,并且根据早期研究表明可以在120~125 ℃存活30 min。再从发育树来看与罐头常见腐败微生物嗜热脂肪地芽孢杆菌有很强的情缘关系同属于属,从序列亲缘关系来看,这种微生物有着很强的热抵抗能力。因此从分离培养来看,管道工序仍然是一个需要重点关注的高危工序。

表4 燕窝原料、冰糖原料与管道内壁分离出的嗜热菌Table 4 Thermophilic bacteria isolated from edible bird's nest raw material, rock sugar raw material and the inner wall of the pipe
通过传统培养分离结合分子生物学鉴定了燕窝罐头原料和危险工序中的嗜热微生物,发现了罐头中易分离出的和还发现了与这种热抵抗能力很强的微生物有着很近亲缘关系的潜在新嗜热菌菌种,为今后燕窝企业生产过程中微生物的防控指导提供了一定的理论依据。

图6 基于16S rRNA序列的分离出的嗜热菌系统发育树Fig.6 Phylogenetic tree of thermophiles bacteria in samples based on 16S rRNA sequence
3 讨 论
本文通过16S rRNA高通量测序技术对燕窝罐头原料及各个工序中的微生物群落进行研究,发现冰糖原料与燕窝罐头灌装后产品的优势菌属相似,并且都存在这种可能对产品颜色造成影响的微生物菌属与这种条件致病菌,还发现干燕窝中的优势菌属为这种经常可以从人体分离出的微生物菌属,以此推测这是干燕窝储运过程人为接触的污染。同时,在冰糖原料、干燕窝原料中发现了,结合PCA聚类分析燕窝罐头原料及各个工序中的微生物,结果证明原料与灌装后产品有着相同腐败菌与优势菌,证明了腐败微生物的来源为燕窝罐头原料而非加工工序。
此外通过样本间分类学差异性分析,发现输送冰糖液的管道中显著增加。但是由于16S rRNA高通量测序方法不论是否为活菌都会鉴定出来,为了筛选出活的嗜热菌,因此通过培养分离再结合16S rRNA与系统发育树方法鉴定出5种存活的嗜热菌,以往研究证实了序列与其较为接近的有着很强的耐热性,在125 ~130 ℃的高温下杀菌30 min仍然不能保证食品的安全性,然而在生产过程中管道内冰糖液体的温度最多达到100 ℃,因此输送冰糖的管道内存活的嗜热菌很可能通过冰糖液体代入最后燕窝罐头中,因此该工序有着很大的安全隐患。并且早有研究表明热灌装的管道内部会产生耐热性更强的微生物,并且管道内形成的生物膜的脱落会对后续灌装工艺造成很大食品安全隐患,而用普通针对生产线的安全监管已经无法保证最后罐头达到商业无菌水平。通过分析管道内壁仅仅接触了冰糖液体,由此得出结论该微生物的来源是冰糖,因此应该着重对原料进行控制,如采购冰糖原料时利用16S rRNA技术确保其中没有超强的耐热菌种,或者针对原料进行预处理,先将冰糖在高温高压条件下溶解加热,减少或者完全杀死嗜热微生物再将后续冰糖液体输送管道,以此确保后续工序的安全性。以往研究表明因为罐头产品极低不良率抽检100个成品都可能无法检测到嗜热菌,但也无法保证其他罐头不被嗜热菌污染,因此罐头食品的嗜热菌检测也极为困难。通常罐头食品杀菌标准需要在121 ℃后将不良率控制在十万分之一以下,而燕窝罐头不同一般罐头产品,其极高商品价值与企业品牌价值,对最后产品不良率的期望值更为苛刻,因此这是一个极大的挑战。
本文参考之前针对鸡肉生产线上腐败微生物来源分析,通过16S rRNA结合了两种假设的方法,可以准确发现腐败微生物来源,该方法也是一种非常适合其他食品生产线上的品质控制与腐败微生物调查的方法,可以在各食品企业推广应用,为企业微生物安全防控提供了一定理论指导方向。这种整体探究的方法也为之后学术深入研究提供很好的指导方向,如可在之后的研究中进一步探究管道中生物膜随着时间的变化发生变化,进一步通过形态学与理化性质确认并鉴定嗜热菌,还可以研究分离出的嗜热菌在不同介质中的耐热性等。
4 结 论
基于高通量测序技术结合传统的培养分离方法,对燕窝罐头生产过程中不同工序的微生物多样性进行研究。结果表明,在灌装过程中糖液微生物多样性显著增加,这可能是微生物污染风险较高的生产工艺;(不动杆菌属属)、(异常球菌属)、(瓦菌属)为燕窝罐头生产中的优势菌,但是结合热力图分析表明,这3种优势菌会在生产过程中减少,并且证实了这3种优势菌不是罐头主要腐败嗜热菌。热力图分析与主成分分析法表明罐装后产品与冰糖原料有着相似的菌群结构与相同的优势菌属,并且测序结果证实冰糖原料与最终产品有着相同的腐败嗜热菌,因此推断出嗜热菌是由冰糖原料引入的。再通过对冰糖及其相关工艺样品的微生物分类差异分析,发现典型的罐头腐败菌在冰糖管道内输过程中显著增加,进一步说明了冰糖管道输送工序应该作为关键控制工序重点监控。
最后针对燕窝原料、冰糖原料及输送冰糖管道内的嗜热菌进行分离培养,发现在燕窝原料、冰糖原料、输送冰糖液的管道中存在5种嗜热菌(其中两种是同一种但是登记号不同)。其中从管道中分离出的是一种常见罐头腐败嗜热菌,而分离出的另一种嗜热菌是一种常存在于管道中,这表明运输冰糖的管道可能残留嗜热细菌,因此,在燕窝罐头生产中,运输运输冰糖的管道应该作为高风险工序重点关注。综上所述,本研究证实了冰糖很可能是食用燕窝罐头生产过程中嗜热微生物污染的主要来源,另外与冰糖有关的工序特别是输送冰糖液的管道,存在较高的微生物污染风险,应引起高度重视。

