植物乳杆菌对苏尼特羊肠道菌群、血浆代谢物及肉品质的影响
刘 婷,靳 烨,要 铎,张艳妮,王宏迪,苏 琳,田建军,杜 霞,段 艳※
(1. 内蒙古农业大学食品科学与工程学院,呼和浩特 010018;2. 内蒙古乌拉特中旗农牧和科技局,乌拉特中旗 015300)
0 引 言
近年来中国对于草场保护十分重视,大多传统的放牧方式已被集中圈养所取代。饲养方式的转变不仅可以发展饲养规模,又可减少环境污染和破坏。苏尼特羊是中国蒙古羊的优良品种,因其具有适应能力强、营养价值高、膻味小、肉嫩味美等特点得到牧民及消费者的广泛认可,具有极大的研究价值。为保障羊肉品质在圈养条件下不劣化,提高圈养羊肉品质将成为待解决的首要问题。益生菌能替代抗生素添加到动物饲料中,提高畜禽生产效益,促进动物机体代谢进而改善肉品质。益生菌中乳酸菌可以提高机体的抗氧化能力,减少PSE(Pale,Soft, Exudative)肉的产生,能够减少肠道中胺、硫化氢等有害代谢产物的生成,从而改善肉品风味。植物乳杆菌()是乳酸菌的一种,能与肠道中其他细菌协同作用,争夺利于肠道病原菌生长的营养物质,促进自身定殖并抑制部分致病菌繁殖,研究表明,植物乳杆菌能够应用于饲料及养殖生产中。研究表明,益生菌能提高育肥猪的生长性能,改善了肠道菌群多样性。程光民等研究发现饲喂植物乳杆菌有利于提高杜泊绵羊生长性能、屠宰性能和肌肉品质。李稳稳等基于高通量测序发现益生菌能够调节动物肠道菌群,促进机体有益代谢。
代谢组学贯穿于肉品生产诸多环节当中(动物饲喂、屠宰、加工等),利用高通量检测技术和多元数据处理方法研究物体受外部刺激所产生的所有代谢产物(如氨基酸、有机酸、肽类或酚类物质等),检测动物的血浆、粪便、瘤胃、组织等代谢物生物标志物。代谢组学分析技术有核磁共振技术(Nuclear Magnetic Resonance spectroscopy,NMR)、气相色谱-质谱联用技术(Gas Chromatography-Mass Spectroscopy,GC-MS)以及液相色谱-质谱联用技术(High Performance Liquid Chromatography-Mass Spectroscopy,LC-MS)。NMR检测灵敏度相对较低,对痕量物质检测存在误差;GC-MS则在分析难挥发的代谢组分需经过衍生化处理,若衍生不当,则会降低样品检测的灵敏度;而LC-MS可直接对代谢产物进行定性和定量分析,具有较高的分辨率、检测灵敏度和分析速度,适合代谢组学代谢物的轮廓分析。Artegoitia等利用代谢组学技术筛选了33种肉牛代谢标志产物鉴定瘤胃生理功能。曹青青联合生物组学及代谢组学研究发现唾液乳杆菌(GZPH2)能调节豹纹鳃棘鲈肠道菌群并促进功能性代谢物产生,增强机体抗氧化能力。杜瑞等发现益生菌能影响苏尼特羊肠道菌群及其代谢产物,提高苏尼特羊屠宰性能和胴体品质,尤其是提升肉羊色泽及嫩度,肠道菌群中UCG002升高有利于羊肉剪切力值降低,丰度增加可增加瘤胃中异戊酸和异丁酸的含量进而增加肌肉中PUFA的含量。基于以上研究证明饲喂益生菌能影响动物肠道菌群、机体代谢及圈养羊肉品质,但通过饲喂植物乳杆菌建立苏尼特羊肠道菌群与血浆代谢物之间的关系进而改善肉品质的影响还未见系统研究。因此,本试验基于高通量测序及LC-MS代谢组学技术分析添加植物乳杆菌对苏尼特羊肉品质的作用,摸索肠道微生物及血浆代谢物的变化规律,为今后通过组织靶标代谢产物改善羊肉品质提供理论依据。
1 材料与方法
1.1 材料与试剂
在内蒙古巴彦淖尔市乌拉特中旗,选取12只平均活体质量为(38.42±1.64)kg的3月龄健康无病的纯种苏尼特羊羊羔随机分为对照组(C组)和植物乳杆菌组(R组),每组6只,公母各半。C组饲喂基础饲粮(玉米60%、干草38%、矿物质2%);R组除饲喂基础饲粮之外,补充添加植物乳杆菌粉12g/d(山东宝来利来生物工程股份有限公司),活菌数为3×10cfu/g,每日饲喂1次,参照白艳苹等的研究将添加水平设为2 g/只,试验期间自由饮水、活动,不添加抗生素,进行90 d饲喂试验。
采血针静脉采血用于血液代谢物测定,肉羊屠宰放血后采集背最长肌作为研究对象,从盲肠中收集粪便样品置于15 mL无菌无酶离心管中用于肠道微生物分析。
乙腈(Merck,1499230-935)、乙酸铵(Sigma,70221);核酸染料(Gelview),北京百泰克生物技术有限公司;琼脂粉,西安国安生物科技有限公司;Maker,大连宝生物工程有限公司;粪便DNA提取试剂盒,北京天根生化科技有限公司。
1.2 仪器与设备
ZHJH-C1112C型超净工作台,上海智城分析仪器制造有限公司;Veriti96 Well Thermal Cycler PCR仪,美国Applied Biosystems公司;Real-TimePCR仪,美国Bio-rad公司;胴体直测型pH计、TC-P2A全自动色差计,北京奥依克光电仪器有限公司;CL-M嫰度仪,东北农业大学工程学院;Illumina Miseq MISEQ测序仪,Illumina公司;AB Triple TOF 6600质谱仪(AB SCIEX);Agilent 1290 Infinity LC超高压液相色谱仪,安捷伦公司;ACQUITY UPLC BEH Amide 色谱柱:1.7m,2.1 mm×100 mm column沃特世科技(上海)有限公司。
1.3 方法
1.3.1 肠道微生物菌群测定与分析
参考杜瑞等的方法,采用QIAamp DNA Stool Mini Kit试剂盒提取细菌总DNA,用核酸浓度测定仪测定总DNA浓度,于-20 ℃保存备用。
1.3.2 血浆代谢物测定
1)色谱条件:血浆代谢物测定参考Zhang等的方法。Agilent 1290 Infinity LC超高效液相色谱系统,HILIC色谱柱分离;柱温25 ℃;流速0.5 mL/min;进样量2L;流动相A:水+25 mmol/L乙酸铵+25 mmol/L氨水,B:乙腈;梯度洗脱程序:0~0.5 min,95% B;0.5~7 min,B从95%线性变化至65%;7~8 min,B从65%线性变化至40%;8~9 min,B维持在40%;9.1 min,B从40%线性变化至95%;9.1~12 min,B维持在95%;过程中样品置于4 ℃自动进样器,随机顺序进行样本连续分析,插入QC样品,监测并评价系统稳定性及试验数据可靠性。
2)Q-TOF质谱条件:ESI源条件:离子源气体1:60、2:60,气帘气:30,源温度:600 ℃,喷雾电压:±5 500 V;TOF MS扫描m/z:60~1 000 Da,子离子扫描m/z:25~1 000 Da,TOF-MS单张图谱扫描时间:0.20 s,样品离子单张图谱扫描积累时间:0.05 s;二级质谱:去簇电压:±60 V,碰撞能量:35±15 eV。
1.3.3 羊肉品质测定
肉品质测定参照王柏辉的方法,包括肉色、pH值、嫩度和熟肉率。
1)pH值测定:胴体直插式pH计分别测定宰后45 min和24 h背最长肌的pH值,记作pH和pH。
2)色泽测定:将肌肉切成3 cm×3 cm×1 cm的肉块,屠宰45 min后用TC-P2A全自动色差计测定肌肉色差,每个样品测定3次,记录并取平均值。*值为亮度;*值为红度;值为黄度。
3)嫩度测定:沿羊肉的肌纤维方向进行取样,肉样排酸24 h后,水浴锅75 ℃蒸煮45 min,取出室温冷却后用滤纸擦干表面水分,沿肌纤维方向将其切成3 cm×1 cm×1 cm形状的肉条,用嫩度仪测定剪切力值。
4)熟肉率测定:取50 g左右的肉样记录煮前质量(,g),肉样中心插入温度计,放入在水浴锅85 ℃煮制40 min,待肉样中心温度达到75 ℃后室温冷却,擦干表面水分,记录煮后质量(,g),下式计算熟肉率。
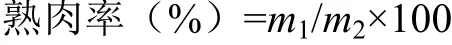
5)屠宰性能测定:所有试验羊宰前24 h禁食,测量方法参考侯艳茹对其屠宰性能相关指标进行测定。
1.4 数据分析
两组数据每组6个平行3次重复,采用SPSS 26.0软件(IBM公司)单因素方差分析student t检验进行显著性分析及典型相关性分析。采用Origin 8.0和Excel 2020软件作图。
选取16S rRNA的V4-V5区序列进行高通量测序分析,进一步对目的聚合酶链式反应产物进行文库构建,由上海美吉生物医药科技有限公司在Illumina MiSeq平台上完成测序后使用QIIME分析平台开展序列的生物信息学分析。
血浆代谢物原始数据转换为 .mzXML格式,采用XCMS软件峰对齐、保留时间校正和提取峰面积。首先进行代谢物结构鉴定、数据预处理,然后进行试验数据质量评价及数据分析。
2 结果与分析
2.1 饲喂植物乳杆菌对苏尼特羊肠道菌群的影响
2.1.1 Alpha多样性分析
Alpha多样性是反映丰富度和均匀度的综合指标,通过测序得到了盲肠样本的总计321 324条高质量序列,共获得了2 138个OTU(Operational Taxonomic Units)操作分类单元,两组覆盖率均达到99%,均满足后续肠道菌群组成分析要求。表1所示R组的Shannon指数、Chao1指数和Ace指数显著高于C组(<0.001),说明R组羊的肠道微生物群落多样性及丰富度高于C组羊。

表1 植物乳杆菌对苏尼特羊肠道菌群α-多样性的影响Table 1 Effect of Lactobacillus plantarum on the α-diversity of intestinal flora in Sunit sheep
2.1.2 Beta多样性分析
1)菌群组成分析:
通过16S rRNA基因测序分析Beta多样性,表2所示两组样品间的差异。在门水平上,两组细菌种类的相对丰度主要以厚壁菌门(Firmicutes)以及拟杆菌门(Bacteroidetes)为主,两者相对丰度之和超过了90%。与 C 组相比,R 组的 Bacteroidetes、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)丰度显著提高(<0.05),而Firmicutes、变形菌门(Proteobacteria)的丰度显著降低(<0.05)。在属水平上,R组拟杆菌属()、瘤胃球菌属_UCG-010(UCG-010)、瘤胃球菌属_UCG-005(UCG-005)、克里斯滕森菌_R-7组(R-7_group)和理研菌_RC9_肠道群(RC9_gut_group)丰度显著提高(<0.05),而另枝菌属()、普雷沃氏菌_UCG-003(UCG-003)丰度显著低于C组(<0.05)。可见,饲喂植物乳杆菌能够改变盲肠微生物群落优势菌群的组成与结构。

表2 植物乳杆菌对苏尼特羊肠道菌群相对丰度的影响Table 2 Effect of Lactobacillus plantarum on the relative abundance of intestinal microflora of Sunit sheep%
2)主成分分析(PCoA)
利用主成分分析(Principal Coordinates Analysis,PCoA)降维排序方法观察分析群体间的差异,鉴别饲喂植物乳杆菌后两组肠道菌群的差异。由图1可知,R组和C组每组样本点分散区域比较密集,组内微生物群落结构相似。两组主成分图略有重叠,但两组肠道菌群差异总体区分不显著,说明苏尼特羊肠道菌群组成具有基因同源性。而从第一主成分能分析出饲喂植物乳杆菌对苏尼特羊的盲肠微生物群落产生一定影响。

图1 主成分分析散点图两组样本分析Fig.1 Principal Coordinates Analysis (PCoA) scatter plot analysis of two groups of samples
2.2 饲喂植物乳杆菌对苏尼特羊肠道菌群的影响
2.2.1 OPLS-DA分析

图2 OPLS-DA得分及置换检验图Fig.2 OPLS-DA score and permutation test
R组和C组的得分不同代表代谢组成不同。采用Permutation test对模型进行检验,和表示置换保留度等于1,即原模型的和值。图2中随机模型的和均逐渐下降,说明原模型不存在过拟合现象。大于0.5,表明两组模型稳定可靠,满足后续苏尼特羊血浆代谢物分析。
2.2.2 血浆差异代谢物分析
以OPLS-DA VIP>1和<0.05作为筛选标准,通过对苏尼特羊血浆显著性差异代谢物的分析,结果如表3所示,通过Fisher精确检验分析计算出两组血浆样品中鉴定的化合物主要与胆汁分泌和胆固醇代谢有关,主要鉴定了6种化合物,3种通路富集均可归类于脂肪代谢。如3-羟基月桂酸、皮质醇、雷米普利、吲哚-3-丙酸等代谢产物均对胆固醇代谢有所影响,能够影响机体糖脂代谢。3-羟基月桂酸属于-羟基脂肪酸的一种,通过自由脂肪酸受体(FFA1-FFA4)和羟基羧酸受体(HCA1-HCA3)的G蛋白偶联受体发挥细胞效应,由细胞线粒体-氧化产生,与脂肪酸代谢性疾病有关。皮质醇介导抗炎作用和肝脏疾病中的程序性细胞死亡,能刺激肝细胞增殖并被肝脏循环吸收。雷米普利能调节昼夜节律基因的表达,抑制血管紧张素转换酶并维持机体葡萄糖稳态与胰岛素水平。吲哚-3-丙酸是一种色氨酸衍生的细菌代谢物,能够引起小鼠体质量的增加变化。表3可见6种代谢物在两组中差异明显,均与胆汁分泌与胆固醇代谢有关。R组中3-羟基月桂酸含量显著低于C组(<0.05),其余代谢物均显著高于C组(<0.05),结果表明饲喂植物乳杆菌能够调节机体脂肪代谢。
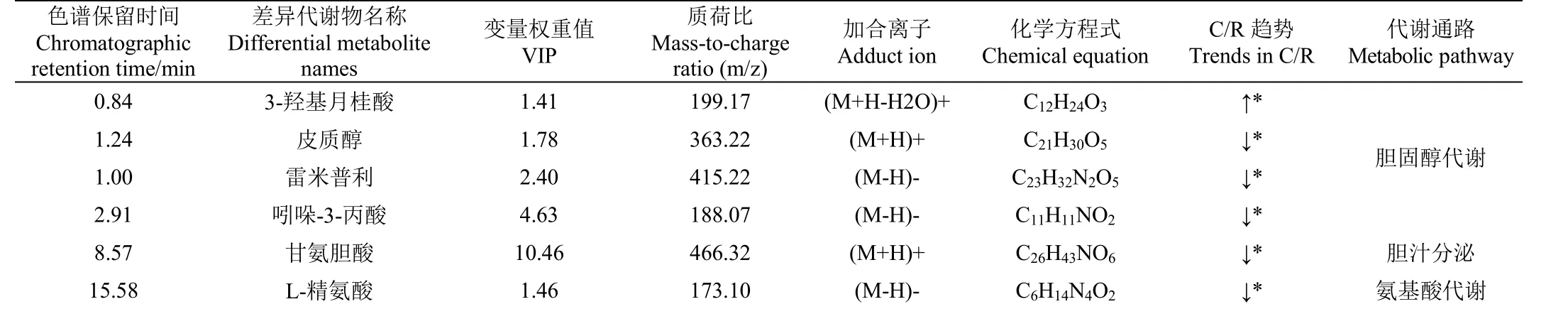
表3 血浆显著性差异代谢物Table 3 Significant differences in plasma metabolites
2.3 苏尼特羊肠道微生物和血浆代谢物的相关性研究
在分析肠道菌群与血浆代谢产物的相关性中发现(图3),大部分肠道菌群与血浆代谢产物都与糖脂代谢相关。如在胆汁分泌及胆固醇代谢中,两组具有显著差异的肠道菌群除Firmicutes、以外,其余肠道菌群 Bacteroidetes、Verrucomicrobia、Actinobacteria、UCG-010、R-7_group及RC9_gut_group的丰度均与血浆代谢物L-精氨酸、甘氨胆酸的含量呈正相关,与3-羟基月桂酸的含量呈负相关。雷米普利与吲哚-3-丙酸的含量与Firmicutes、R-7_groupRC9_gut_group呈正相关,与呈负相关。皮质醇与呈正相关,而与 Firmicutes呈负相关其中,BacteroidetesUCG-001均与甘氨胆酸呈显著正相关(<0.05)。此外,图3还显示了其他肠道微生物与胆固醇代谢和胆汁酸生物合成之间的关系,说明饲喂植物乳杆菌能够利用肠道菌群与血浆代谢物之间的相关关系来调控苏尼特羊机体代谢水平。
2.4 植物乳杆菌对苏尼特羊肉品质的影响
由表4可知,R组亮度值(*)、黄度值(*)、pH值均显著高于C组(<0.05),而蒸煮损失、剪切力则显著低于C组(<0.05),R组的苏尼特羊产业价值更高。pH值指标能够很好的反映肉品质,宰后45min时测得的pH≥6.0为肉质好的肉,而pH>6.0的肉为肉质差的肉,说明试验羊pH和pH均在正常范围内。本试验两组羊肉初始pH值无显著差异,pH值有显著差异,饲喂植物乳杆菌能够显著减缓宰后肌肉细胞糖酵解进程中pH值的降低速率。通过亮度值、黄度值也可看出R组肉色可能由肌内脂肪沉积所致,与血浆代谢物影响脂代谢有关。剪切力与肉的嫩度密切相关,肉的嫩度是反映肉制品食用物理特性的重要指标,R组的剪切力较低嫩度较高,蒸煮损失显著低于C组,说明饲料添加植物乳杆菌能够提高肉的系水力能够提升肉质口感进而改善羊肉品质,杜瑞等添加植物乳杆菌和干酪乳杆菌后同样发现益生菌组羊肉的剪切力值显著低于对照组,能够很好地改善羊肉嫩度。

图3 肠道微生物和血浆代谢物相关性分析Fig.3 Correlation analysis between intestinal microbe and plasma metabolites

表4 植物乳杆菌对苏尼特羊肉品质的影响Table 4 Effects of Lactobacillus plantarum on the meat quality of Sunite sheep
3 讨 论
本试验饲喂植物乳杆菌后使肠道菌群物种丰度增加、粪便及血浆代谢发生变化,可能是肠腔中优势菌(如拟杆菌门、厚壁菌门、变形菌门、疣微菌门等)通过菌群互作利用碳水化合物、脂肪、蛋白质等大分子营养物质为底物,在发酵、酶解后得到的小分子代谢产物与肠上皮细胞各种转运载体吸收作用后进入血液继而影响机体代谢水平。Zhou等研究发现,由于植物乳杆菌NCU116代谢产生的胞外多糖促进了转录因子c-Jun的表达、磷酸化以及c-Jun与 MUC2启动子的结合,进而提高分泌黏蛋白MUC2基因的表达水平,保证了营养物质运输,增强了动物的肠道屏障功能,进而改善了机体代谢。任婧等研究表明植物乳杆菌ST-Ⅲ主要通过菌体自身吸收胆固醇的同化作用以及与胆盐结合作用后的共沉淀作用调控胆固醇代谢水平。Ottosson等研究发现肠道微生物能够参与机体代谢,代谢产物的相关变化可用于探索肥胖等疾病的发生机制研究。本试验饲喂植物乳杆菌后肠道微生物以及等菌属丰度均有显著差异(<0.05),研究表明以为主的肠型中细菌主要靠吸收单糖和降解黏蛋白来获取能量影响机体的能量代谢。在人类和动物肠道及黏膜中广泛存在,与脂肪沉积和代谢综合征密切相关。与肠道短链脂肪酸的合成相关,具有复杂多糖降解及利用所必需的酶和基因簇,与琥珀酸高水平循环致使机体糖代谢受损有关。与肠道细菌类clpb基因呈正相关关系,可长期增加饱腹感减少脂肪量调控脂代谢,等细菌中普遍存在着胆汁酸水解酶,可以促进胆汁酸被水解次级胆汁酸。因此,饲喂乳酸菌能够通过肠道菌群影响酶、蛋白及基因表达继而影响机体能量代谢。
肠道菌群对机体的调控依赖于腺苷酸活化蛋白激酶(Adenosine Monophosphate activated Protein Kinase,AMPK)通路、胆汁酸及短链脂肪酸代谢等。胆汁酸被肠道菌群的酶代谢,维持着肠道微生态平衡,最终影响着脂代谢。胆汁酸及衍生物可能作为信号分子结合与肠道上皮细胞G蛋白偶联胆汁酸受体(G protein bile acid receptor-1,TGR5)和肠L细胞的法尼酯衍生物X受体(nuclearreceptor Farnesoid X Receptor,FXR)信号通路来调节机体脂代谢。FXR 信号通路不仅控制胆汁酸合成,还可以通过调控胆固醇调节元件结合蛋白1c(Sterol-Regulatory Element Binding Proteins 1c,SREBP-1c)的表达来影响乙酰辅酶 A 羧化酶(Acetyl CoA Carboxylase,ACC)等脂代谢基因。通过激活FXR可引起小鼠脂肪变性、脂肪沉积及体重增加进而影响动物脂肪代谢。甘氨胆酸是具有抗肿瘤活性的胆汁酸,可靶向作用于耐药泵和非耐药泵通路。L-精氨酸能够与小肠中功能性基因的表达呈一定相关性,潜在影响着机体脂代谢,加速动物肠道微生物区系的演替和益生菌定植,并改变机体的初级胆汁酸和脂质代谢,促使动物肠道快速发育。周笑犁等发现精氨酸能够下调动物肝脏中ACC mRNA的表达,上调肝脏中过氧化物酶体增殖物激活受体(Peroxisome Proliferator-Activated Receptorγ,PPARγ)mRNA的表达,从而促进脂代谢脂类转运与代谢。甘氨胆酸、L-精氨酸含量显著高于C组(<0.05),表明植物乳杆菌对血浆代谢产物具有调控作用,影响着机体胆汁酸和脂质代谢。同样,血浆皮质醇主要来自肾上腺皮质,是糖皮质激素的一种,对糖类代谢具有很强作用的肾上腺皮质激素,能够通过羟固醇(Oxysterols)转化为胆汁酸后激活FXR信号通路影响胆固醇合成及胆汁酸代谢中关键基因胆固醇7羟化酶CYP7A1的表达,调控着胆固醇代谢水平。肠道菌群作为胆汁酸代谢重要的调节因子,影响机体产生脱羧作用中相关酶系的微生物如厚壁菌门中梭状芽孢杆菌,生成包括脱氧胆酸和胆石酸等次生胆汁酸。此外,变形菌门(Proteobacteria)包括许多病原菌,可以作为鉴定哺乳动物肠道健康的关键,Proteobacteria与皮质醇呈负相关,降低变形菌门的丰度有益于皮质醇参与胆固醇代谢。本研究甘氨胆酸与BacteroidetesUCG-001呈显著正相关(<0.05)。L-精氨酸与Bacteroidetes、Verrucomicrobia、Actinobacteria等肠道菌群呈正相关,与Firmicutes、Spirochaetes、呈负相关。本试验证明植物乳杆菌能够依次对肠道菌群、血浆代谢产物产生作用,两者之间也具有一定相关性,其相关分子机制尚未明确,有待下一步试验研究。
在肉品质分析中,饲喂植物乳杆菌能从不同方面改善苏尼特羊羊肉品质。本试验与之前饲喂的其他复合微生态制剂相比,饲喂此株植物乳杆菌除了能够影响苏尼特羊pH值、嫩度及色泽的变化以外,还能够显著降低羊肉的蒸煮损失。李宗凯等研究也发现益生菌能显著提高育肥猪生长期平均日增质量。Chen等发现饲料中添加粪肠球菌具有更高的屠宰率及肌内脂肪含量、pH值适宜且无PSE肉产生。Rybarczyk等研究发现添加益生菌能够改变肉的色差值进而改善肉品的感官品质。梁荣蓉等总结了利用组学方法找到与肉色相关的差异蛋白、代谢酶类物质,为后期肉色指标变化机制的研究提供靶标方向。本团队前期已对不同饲养方式下的苏尼特羊进行了大量研究,如罗玉龙等发现放牧的饲养条件更有利于营养物质的积累,食用品质较高。王柏辉等进一步发现放牧能够促进肌肉组织中有益脂肪酸(如-亚麻酸、CLA、EPA和DHA的沉积),但舍饲羊的活体、胴体、净肉质量均显著高于放牧羊;苏尼特羊胃肠道菌群主要以拟杆菌门和厚壁菌门为主,放牧组瘤胃菌群中厚壁菌门的相对丰度高于舍饲组,而瘤胃中RC9_gut_group属和丁酸弧菌属更有利于肌肉中n-3 PUFA的沉积。侯艳茹证实饲喂益生菌会改善圈养羊肉品质,比单纯模拟放牧方式增加运动量的效果更好。杜瑞再次证实了益生菌对肉品质的有利作用。综上,本试验更进一步探寻了肠道菌群与靶标血浆代谢产物的关系,肠道菌群可能是影响血浆代谢产物的主要影响因素之一。苏尼特羊血浆代谢产物主要集中于胆固醇代谢和胆汁酸分泌与合成,后期能够通过饲喂植物乳杆菌对肠道菌群的进行调控,找到靶标代谢产物继而调整机体脂代谢,最终达到改善羊肉品质的目的。
4 结 论
1)与对照组相比,植物乳杆菌组参与能量代谢的肠道有益菌群显著提高了肠道拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、拟杆菌属()、克里斯滕森菌属(R-7_group)、理研菌属RC9肠道群(RC9gut_group)和瘤胃球菌属(UCG-010)的丰度(<0.05)。
2)植物乳杆菌组血浆代谢物功能富集在胆固醇代谢及胆汁分泌通路,如甘氨胆酸、吲哚-3-丙酸、皮质醇、L-精氨酸等含量均显著(<0.05)高于对照组。
3)在相关性分析中,调控肠道菌群的组成能够关联影响到靶标血浆代谢物的增多或减少。
3)在肉品质分析中,植物乳杆菌组嫩度、色泽都有所改善,如亮度值(*)、黄度值(*)、pH值均显著(<0.05)高于对照组,而蒸煮损失、剪切力均显著(<0.05)低于对照组。
因此,通过饲喂益生菌调控动物肠道菌群影响机体生理代谢水平改善肉品质是能够实现的,可以成为后期改善羊肉品质重点研究方向,应用前景广泛,对微生物基础动物饲料的开发也提供了一定的理论依据。

