功能性纤维素基水凝胶材料及其应用研究进展
黄彪,林凤采,唐丽荣,卢麒麟,卢贝丽
(1. 福建农林大学,福州 350108; 2. 闽江学院,福州 350108)
水凝胶是一类由天然或合成高分子经物理或化学交联形成具有独特三维网络结构以及可调节物理和化学性质的固体软材料。水凝胶三维网络具有高保水性、弹性和生物相容性,因此它非常适用于组织工程材料、柔性可穿戴设备和生物医药领域[1]。传统构建多功能水凝胶的原料主要是基于石油副产品合成的亲水性聚合物高分子(聚乙烯醇、聚丙烯酰胺等),其化学稳定性好、机械性能较高,但不易降解,缺乏生物功能,从而限制了其应用。近年来,随着全球环保意识的提高,水凝胶材料的研究热点逐步转向具有无毒、可降解、生物相容性好、绿色可再生的天然高分子,例如纤维素、植物多酚、壳聚糖等。
在诸多天然高分子中,人们研究和应用最多的是纤维素,纤维素表面裸露的多羟基结构使其易与水凝胶基体形成良好的分子间相互作用,产生相互叠加及协同作用。同时,纤维素的多羟基结构、还原性及非还原性端基较容易发生多种化学反应,可为纤维素的改性提供活性位点,从而有效提高纤维素水凝胶的功能可调性,赋予纤维素水凝胶材料更多优异特性。因此,与其他天然高分子相比,纤维素在多功能水凝胶材料领域的构建与应用受到了更多的关注。笔者梳理了功能性纤维素水凝胶的研究前沿和动态,介绍了纤维素水凝胶的交联机制及制备策略,重点阐述了功能性纤维素水凝胶的分类和应用研究进展,展望了纤维素水凝胶材料未来可能的发展前景和研究方向。
1 纤维素水凝胶的构建及交联机制
用于构建水凝胶的纤维素通常有2种形态:一种是纳米纤维素,即通过酸水解、高压均质等方法从纤维素大分子结构中疏解和分离出纳米尺度的纤维素,包括纤维素纳米纤维(cellulose nanofibers,CNF)和纤维素纳米晶体(cellulose nanocrystals,CNC)[2]。此外,由特定种类的微生物细菌通过生物诱导合成的细菌纳米纤维素(bacterial cellulose,BC)也常用于纤维素水凝胶的构建。另一种是纤维素溶液,即采用特定的溶剂(如碱/尿素体系、离子液体等)溶解天然纤维素而得到的均相纤维素溶液[3]。纤维素水凝胶的构建关键在于纤维素分子链在凝胶体系中的相互作用形式,其结构与性能可通过调控交联方式或引入不同功能的异质组分进行个性化设计。纤维素水凝胶三维结构的交联方式主要可分为化学交联和物理交联。
1.1 物理交联
基于非共价键作用的物理交联纤维素水凝胶是通过分子链缠结和/或分子间相互作用力(如氢键、疏水作用、静电相互作用和配位键等)而连接在一起的网络结,纤维素水凝胶中聚合物的交联点没有形成新的化学键。物理交联的可逆性赋予水凝胶三维动态交联网络结构,有利于构建对外力具有高能量耗散值或自修复水凝胶。例如本研究团队利用富含邻位酚羟基结构的单宁酸(TA)作为CNC和聚乙烯醇(PVA)的分子桥偶联剂,构建一种基于多重氢键交联的高强韧纳米纤维素物理水凝胶(TA-PVA/CNC)[4]。Mredha等[5]通过受限干燥再溶胀法对纤维素分子链进行重排,制备得到具有自修复性的高强度各向异性水凝胶。纤维素水凝胶中的物理交联形式并不仅限于单一的物理作用,在同一个纤维素水凝胶体系中引入多种物理相互作用可赋予水凝胶更多功能。例如,Zhang等[6]构建了由季铵化的簇状纤维素纳米晶体(Q-TCNCs)和Fe3+双物理交联的聚(丙烯酸-co-丙烯酰胺)(PAAAM)高强度/自愈合水凝胶。Q-TCNCs在复合水凝胶中既是界面相容性纳米增强剂,又是交联剂,通过—N(CH3)3+与—COO-的静电作用形成水凝胶松散的一层交联网络,而PAAAM共价交联网络以及PAAAM的Fe3+与—COO-之间离子配位键则构成水凝胶紧密交联网络。
1.2 化学交联
化学交联纤维素水凝胶是在纤维素分子链之间或者纤维素与其他聚合物之间形成共价键,分子链之间的作用更加紧密,所得到的水凝胶通常具有更好的结构稳定性和力学性能。纤维素水凝胶中化学交联的方式可分为两类:一种是直接引入化学交联剂(如环氧氯丙烷、戊二醛等),在纤维素分子链之间反应形成共价键,从而得到水凝胶的三维网状结构。如段博等[3,7]于碱/尿素体系溶解纤维素后,以环氧氯丙烷(ECH)为纤维素分子链之间的化学交联剂,构建了一系列原创性的功能性纤维素水凝胶。化学交联剂通常都带有毒性,若处理不当,则不利于水凝胶在生物医药领域的应用,因此,近年来一些新型绿色化学交联剂被应用于水凝胶的制备过程。如Kanafi等[8]以柠檬酸为化学交联剂,构建了具有pH响应性的羧甲基纤维素/聚氧化乙烯水凝胶。另一类是采用化学改性的方法在纤维素表面引入新的活性官能团(如羧基、氨基、醛基等),使纤维素分子与高分子聚合物直接形成共价键交联。与外加交联剂相比,该法可以在一定程度上缓解化学交联剂毒性的问题。例如Zhu等[9]通过高碘酸钠氧化CNF使其带上醛基,随后与PVA在酸性条件下进行缩醛反应得到化学交联的具有生物组织柔韧性且抗高温特性的CNF/PVA水凝胶。
在功能性纤维素水凝胶的构建过程,可根据目标水凝胶的功能性需求、生物相容性、反应条件的难易等对化学交联以及纤维素表面改性的方法进行调控。实际制备过程更多的是将物理与化学交联策略相结合使其优势互补,同时通过引入不同功能性的异质组分,调控纤维素水凝胶功能化。例如,Ye等[10]报道了一种各向异性的化学-物理双交联纤维素水凝胶,通过酸处理预拉伸基于碱/尿体系制备的环氧氯丙烷交联纤维素凝胶,使纤维素分子链之间通过形成强氢键作用固定高度取向排列结构,为构建组织工程领域的各向异性仿生材料提供新策略。
2 纤维素水凝胶的功能性分类
随着人们对水凝胶研究的不断深入,单纯通过化学或物理交联形成的纤维素水凝胶已无法满足应用的需求,构建对外界刺激具有特定应答性(应力、温度、pH、磁场等)或具有特殊功能(自愈合、黏附性、导电性、抗冻等)功能性纤维素水凝胶已经成为研究重点。
2.1 自愈合纤维素水凝胶
自然界的植物或动物组织受损后,会进行高效自修复,模仿这一过程而设计和开发的新型纤维素水凝胶即为自愈合纤维素水凝胶。自愈合纤维素水凝胶的三维网络的交联作用是基于动态化学键而构建形成。根据动态键的类型,自愈合纤维素水凝胶的愈合机理可以分为动态非共价键机制和动态可逆共价键机制。
自愈合纤维素水凝胶的动态非共价键机制包括氢键、疏水作用、主客体作用、离子键、静电作用等一种或者多种相互作用结合的方式。氢键是水凝胶体系种最常见的物理相互作用方式,虽然单个氢键的作用力很弱,但多个氢键组合形成的多重氢键作用具有较强的交联作用和动态可逆性,已被广泛运用于自愈合体系的构建中。其中,以基于2-脲基-4[1H]-嘧啶酮(UPy)单元之间高度方向性的自互补四重氢键作用而构建的自愈水凝胶最为典型。如Wang等[11]报道了一种基于UPy多重氢键作用作为动态可逆交联点的自愈合纤维素水凝胶,他们将UPy接枝到纳米纤维素晶体表面(CNC-UPy),随后与PVA复合得到PVA/CNC-UPy超分子水凝胶,室温下该水凝胶可在3 min内完成自愈合。另外,超分子化学中的主客体作用亦是构建自愈合水凝胶常用的方法。例如Mckee等[12]报道了一种基于超分子主客体作用的自愈合、稳定和强韧的纳米复合水凝胶如图1a~c所示,其由3种组分构成:①甲基紫精修饰的聚乙烯醇(PVA-MV)(图1a);②甲基丙烯酸二甲氨基乙基酯(DMAEMA)和萘基官能化甲基丙烯酸酯(NpMA)嵌段共聚物接枝的纳米纤维素晶体[CNC-g-P(DMAEMA-r-NpMA)](图1b);③葫芦[8]脲(CB[8])(图1c)。CB[8]通过主客作用同时结合组分①和②的甲基紫精(MV)和萘基(NP)将以上3组分组装成具有优异力学强度和刚度(其储能模量>10 MPa)的纳米纤维素复合水凝胶(图1d)。该纳米复合水凝胶在室温下具有快速(30 s)自愈合能力,即使切断的水凝胶放置4个月后,当水凝胶断面相互接触后仍然可以在10 s内实现快速自愈合。这种优异的自愈合性能主要来自主客体作用快速和高效的重组能力。
自愈合纤维素水凝胶动态可逆共价键机制包括硼酸酯键、亚胺键、双硫键、酰腙键和狄尔斯-阿尔德(Diels-Alder)反应等,与动态非共价键相比,动态共价键具有较强的分子相互作用,从而使水凝胶具有较好的自愈合稳定性。基于单一动态共价键的自愈合水凝胶已被广泛报道。例如本研究团队采用机械球磨“一锅法”绿色高效制备了基于动态硼酸酯键的聚乙烯醇/微纤化纤维素自愈合水凝胶(图1e),研究发现微纤化纤维素的引入显著提高了水凝胶的力学性能和自愈合能力,水凝胶切开后重新接触,在10 min内可以自愈合[13]。Huang等[14]利用双醛基纳米纤维素晶体与带有氨基的壳聚糖反应,构建了基于动态席夫碱键的纤维素自愈合水凝胶。研究发现,通过多重动态共价键协同作用可以使纤维素水凝胶表现出更为突出的多功能性。例如,Yang等[15]构筑了一种基于双硫键和腙酰键的纤维素自愈合水凝胶,该水凝胶除了具备自愈合性能外,动态可逆键对pH和氧化还原环境具有刺激响应性。与传统纤维素水凝胶相比,纤维素自愈合水凝胶表现出许多优势,其本征的动态可逆交联有效扩展了材料的应用范围、延长了使用寿命,但目前纤维素自愈合水凝胶面临的主要问题是自愈合能力和力学性能之间的相互平衡关系,通常这两种性能是相互对立的,因此,通过改善构筑策略、引入多个可逆交联网络将是该领域未来的发展方向。

a)甲基紫精修饰的聚乙烯醇; b)甲基丙烯酸二甲氨基乙基酯和萘基官能化甲基丙烯酸酯重复单元组成的无规共聚物接枝的纳米纤维素; c)葫芦[8]脲; d)基于CB[8]主客体识别的超分子交联[12]; e) 基于机械球磨“一锅法”绿色制备MFC-PVA-硼砂水凝胶的流程图[13]。图1 基于不同动态键作用的纳米纤维素自愈合水凝胶Fig. 1 Fabrications of nanocellulose self-healing hydrogels through different dynamic bond interactions
2.2 自黏附纤维素水凝胶
自黏附纤维素水凝胶的构建通常是将含有儿茶酚基团的化合物(如花青素、茶多酚等)作为交联网络或增强相引入纤维素水凝胶结构中。海洋贻贝可以在高盐分的海水环境中快速、强韧并持久黏附在岩石、砂砾或船体表面,其强黏附力主要来自于贻贝黏液中的黏附蛋白,这些蛋白质由氨基酸和含有邻苯二酚侧链的3,4-二羟基-L-苯丙氨酸(DOPA)以及其他阳离子组成[16]。研究表明,DOPA的邻苯二酚基团对基材表面的强附着力起着决定性作用,贻贝的水下黏附性主要归因于邻苯二酚侧链与固体表面之间的金属配位或氢键[17]。多巴胺(DA)是DOPA的一种衍生物,已被广泛用于构建具有黏附性的水凝胶。Chen等[18]报道了一种多巴胺修饰的羧甲基纤维素(CMC-DA)水凝胶,结果表明,多巴胺的引入显著提高了纤维素水凝胶的黏附力。基于多巴胺构建的自黏附水凝胶虽然已被广泛报道,但并未得到广泛应用,主要是由于多巴胺价格高昂。相比之下,植物单宁酸和没食子酸等天然高分子同样具有邻苯二酚结构,且较多巴胺廉价易得,近年来在黏附纤维素水凝胶的构建中备受关注。例如,最近Lin等[4]报道了一种基于TA交联的自黏附纳米纤维素/聚乙烯醇水凝胶(TA-PVA/CNC),TA-PVA/CNC水凝胶表面含有大量裸露的邻苯二酚基团可仿生贻贝的黏附机理(图2a)。TA-PVA/CNC对亲/疏水物体表面及生物组织都具有良好黏附性,此黏附性主要来自物理相互作用,如氢键、金属配位、π-π堆积、疏水作用以及TA-PVA/CNC水凝胶与基体表面之间可能同时存在多种物理作用之间的协同作用(图2b)。此外,Shao等[19-20]利用TA修饰的纳米纤维素晶体(TA@CNC)与PVA-硼砂或聚丙烯酸复合构建了系列具有长久、可重复黏附性的纳米复合水凝胶。随着人们对贻贝黏附化学认识的不断深入,今后将有更复杂的自黏附和多功能纤维素水凝胶被开发和设计出来,将在生物传感、柔性穿戴和生物医学等领域得到广泛的应用。

a)TA-PVA/CNC水凝胶对不同材料表面的强黏附性; b)水凝胶与不同材料表面之间的黏附机理示意图[4]。图2 植物多酚交联的纳米纤维素自黏附水凝胶Fig. 2 A self-adhesive nanocellulose hydrogel based on plant polyphenol crosslinked strategy
2.3 导电纤维素水凝胶
导电纤维素水凝胶是将固有导电性的物质与纤维素水凝胶网络相结合而得到的一种功能性软材料。根据水凝胶导电机制的不同,可以分为电子导电水凝胶和离子导电水凝胶。将导电成分直接掺杂或共混到水凝胶网络中,是构建电子导电水凝胶最简单和常用的方法。然而,由于导电聚合物和纳米碳材料的亲水性有限,而金属纳米颗粒/线通常比表面能较高,简单的直接掺杂常常引起导电组分的异相分离或团聚,从而导致水凝胶的导电率受限以及力学性能下降等不利结果。通过合理地设计导电纤维素水凝胶构筑策略可以优化导电组分在水凝胶基体中的分布。对于导电聚合物(如聚吡咯、聚苯胺等)可以通过原位聚合法直接在纤维素水凝胶三维网络的骨架上连续均匀地生长一层导电聚合物,可有效解决导电聚合物分散不均匀问题。
本研究团队基于原位聚合法,成功构建了具有良好导电性和生物相容性的微纤化纤维素增强海藻酸钠导电水凝胶,研究发现复合水凝胶的导电性随微纤化纤维素含量的增加而增大,这主要是由于较高微纤化纤维素含量可以使水凝胶形成更为致密的三维网络结构,利于聚吡咯通过静电相互作用和氢键作用在水凝胶骨架上原位生长形成连续均匀的聚合物导电层(图3)[21]。纳米纤维素具有高长径比和良好的分散性,为解决导电纳米材料(如碳纳米管、石墨烯、金属纳米颗粒等)在水凝胶材料中难以分散的问题提供了可能。如韩景泉等[22]将CNF引入碳纳米管(CNT)悬浮液中,具有的三维网络结构的CNF可有效搭载CNT,得到均一稳定的CNF-CNT复合物,从而在PVA-硼砂水凝胶体系中实现了CNT的均匀分散。CNF-CNT纳米复合物在提高水凝胶力学性能的同时赋予其良好的导电性,在一定范围内,导电性随CNT含量的增加而增大。此外,Ding等[23-24]也利用具有良好分散性的CNF为生物模板,在CNF表面原位聚合聚吡咯和聚苯胺等导电聚合物,再将其均匀分散到高分子聚合物体系中,构建具有立体三维导电网络结构的纳米纤维素导电水凝胶材料或膜材料。导电纤维素水凝胶常用导电物质如表1所示。
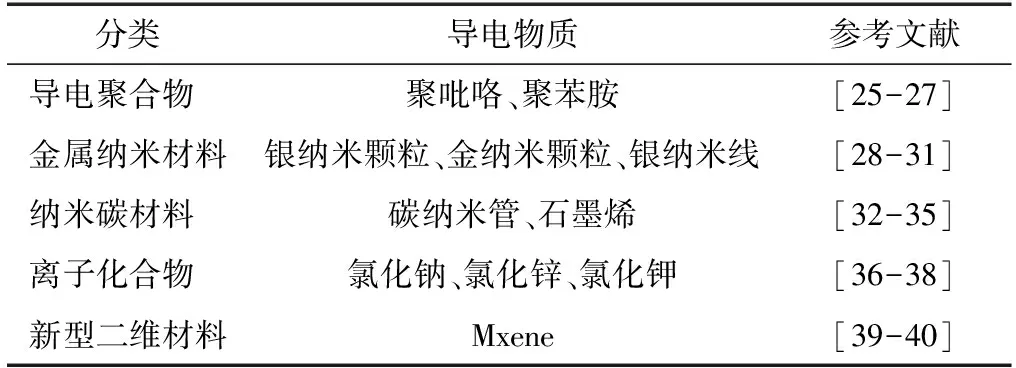
表1 构建导电纤维素水凝胶常用的导电物质Table 1 Conductive substances for the construction of conductive cellulose hydrogels
对于离子导电纤维素水凝胶,纤维素可以作为水凝胶的主体骨架结构,为离子导电聚电解质提供基本三维支持网络和丰富的孔道结构。例如,Nie等[41]向脱木素后的天然木材纤维各向异性排列结构中引入聚丙烯酸(PAA)和Al3+离子,构建了各向异性木材纤维导电水凝胶。水凝胶中的Al3+离子可与PAA发生螯合作用,产生离子导电性能,并应用于柔性电容传感器构建。Zhang等[36]巧妙地将棉纤维溶解于ZnCl2/CaCl2无机盐体系中得到具有优异抗冻性、良好离子导电性和优异热可逆性的新型纤维素水凝胶,整个制备过程无废料产生,纤维素三维网络结构为水凝胶提供了稳定的机械性能。

图3 吡咯原位聚合构建微纤化纤维素增强海藻酸钠导电水凝胶[21]Fig. 3 Microfibrillated cellulose enhancement of conductive properties for sodium alginate hydrogel via in situ polymerization of pyrrole monomer
2.4 环境响应性纤维素水凝胶
环境响应纤维素水凝胶是一类能够识别一种或多种外界刺激(如温度、pH、磁场、光等)变化,并能做出相关应答的凝胶材料[42]。纤维素水凝胶的应答过程主要是通过其自身的化学结构或物理性质的变化影响水凝胶理化状态。将具有刺激响应性官能团或聚合物通过物理或化学法与纤维素水凝胶网络相结合,得到具有环境响应性的水凝胶。纤维素水凝胶的环境刺激响应性可分为化学信号响应和物理信号响应(表2)。

表2 环境响应纤维素水凝胶的分类Table 2 The classification of environmentally responsive cellulose hydrogels
化学信号主要为pH、气体、葡萄糖和离子强度等。含有羧基、氨基等基团的高分子在不同pH溶液中的电离度不同,因而被广泛用于构建pH响应纤维素水凝胶。例如Lin等[59]采用原位聚合法构建了具有pH响应性的纤维素/聚丙烯酰胺(PAM)互穿网络水凝胶,水凝胶中部分水解的PAM的羧酸盐基团(—COO-)在不同pH条件下的电离度差异使水凝胶具有pH响应性。Lu等[43]将带有氨基(—NH2)的明胶引入纤维素水凝胶中,同样得到具有pH响应性纤维素/明胶超分子水凝胶。由于葡萄糖在药物医学领域的重要地位,其相关的响应材料的构筑备受关注。Peng等[50]报道了一种具有pH和葡萄糖双重响应性的纤维素/4-乙烯基苯硼酸水凝胶,通过调控葡萄糖溶液的浓度可以实现对胰岛素释放的自我调节,同时该水凝胶具有良好的生物相容性,可用于葡萄糖刺激响应性智能药物释放系统的构建。CO2作为人体呼吸代谢气体产物,因其溶于水后呈酸性,近年来被认为是一种新型刺激源。Oechsle等[49]报道了一种以CO2为刺激响应开关的CNC(纳米纤维素晶体)/咪唑水凝胶,未来在刺激响应性吸附剂、过滤器和絮凝剂中具有一定的应用前景。
物理刺激主要为温度、电/磁场、和光等。聚N-异丙基丙烯酰胺(PNIPAAm)是一种典型的温敏聚合物,常用于构筑温度响应性水凝胶。如Chang等[60]采用互穿网络技术构筑了温敏性纤维素/PNIPAAm双网络水凝胶,研究了外界温度从20 ℃增加到60 ℃过程中水凝胶体积和溶胀率随温度的变化规律,其相变温度约为33 ℃,高于该温度时水凝胶呈收缩的状态,溶胀率降低。该水凝胶的温敏性主要是由于凝胶体系中分子内氢键和分子间氢键相互竞争的结果,在药物传递领域具有广阔应用前景。在各类响应性水凝胶中,磁响应纤维素水凝胶由于可通过外部磁场在非接触模式下控制其网络结构和溶胀率而备受关注。如Lin等[61]基于碱/尿溶剂体系构筑了磁响应纤维素水凝胶,该水凝胶在磁场作用下快速可调节的溶胀-消溶胀响应特性为构建“远程”药物智能控释系统提供可能。与化学刺激响应相比,物理刺激响应无须改变水凝胶周围的化学环境,使其在生物医药领域的药物靶向释放领域的应用更具潜力。
2.5 抗冻纤维素水凝胶
纤维素水凝胶中含有大量的水分,因此大多数的水凝胶都抵抗不了过冷或过热环境。零度以下的环境中,水凝胶中的溶剂易冻结,进而导致纤维素水凝胶失去原有的柔韧性、导电性、黏附性、自愈合性和环境刺激响应性,从而限制了纤维素水凝胶在极端环境下的使用。针对该问题,当前最行之有效的方法是将二甲基亚砜(DMSO)、多元醇或无机盐引入水凝胶的分散溶液体系中,减小水分子内的氢键,从而降低凝固点。Ye等[62]构建了一种基于DMSO/H2O二元混合溶剂体系的PVA/CNF抗冻水凝胶,结果表明,即便在-70 ℃的低温环境下,水凝胶依然保持良好的柔韧性和高达1.1 S/m的离子导电性。Tong等[63]通过饱和NaCl溶液浸泡策略构筑了一种抗冻纤维素离子水凝胶(DCIH),DCIH在-24 ℃ 条件下其拉伸断裂应变仍能够保持在100%。甘油是一种可与水任意比例互溶且无毒的有机溶剂,甘油/水二元混合溶剂体系的凝固点可低至-46.5 ℃;因此,若将其引入纤维素水凝胶体系中,低温下甘油分子与水分子形成强氢键作用,将与水分子间的氢键竞争,从而有效阻止冰晶的形成,赋予水凝胶良好的抗冻性。Lu等[64]采用溶剂置换法将羟甲基纤维素/PVA水凝胶中的水置换成LiClO4/甘油/水混合溶剂,甘油和无机盐可有效破坏水分子间氢键从而抑制冰晶的形成,使其在低温环境下仍具有良好的柔韧性。基于该水凝胶组装的超级电容即使在-40 ℃,仍然可以提供143.6 F/g的比电容(是20 ℃时的73.75%),库仑效率接近100%。这类抗冻纤维素水凝胶为开发适用于极端环境下的柔性可穿戴传感器提供了科学基础。
3 功能性纤维素水凝胶的应用
纤维素水凝胶凭借优异的结构可调性、功能可设计性,良好的生物相容性、可降解性以及自适应性,在柔性可穿戴电子器件、组织工程、生物医药载体、伤口敷料和农业园艺等领域得到了广泛运用。
3.1 柔性可穿戴电子材料领域的应用
当今社会人们对便携式移动传感设备、可穿戴医疗保健监测系统和仿生软体机器人等柔性电子产品的需求不断增长。导电纤维素水凝胶材料具有低成本、易加工、力学强度可调性和高柔韧性等优点,已成为构建柔性电子设备的热门材料。目前,纤维素水凝胶在该领域的应用主要是构建柔性可穿戴应变/应力传感器、超级电容器等。如Han等[65]利用CNF良好的分散性来搭载碳纳米管,构建了一种基于PVA-硼砂体系和碳纳米管-纤维素纳米纤维(CNT-CNF)的多功能导电水凝胶(CNT-CNF/PVAB)。由该水凝胶组装的超级电容器比电容可达117.1 F/g,在1 000次循环充放电后的电容保持率高达96.4%。
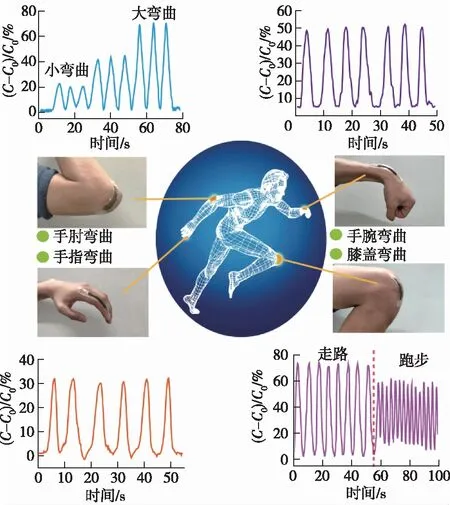
图4 基于纳米纤维素导电水凝胶的柔性电子器件Fig. 4 Flexible electronic devices based on nanocellulose conductive hydrogels
纳米纤维素除了可以作为分散剂,还可以直接作为导电纳米增强材料,但由于纳米纤维素本身不具备导电性,因此首先需要对其进行功能化修饰。近期,本研究团队将原位生长Ag纳米颗粒的纳米纤维素杂化材料(Ag/TA@CNC)引入PVA-硼砂凝胶体系中,构建了一种基于动态硼酸酯键交联的,并集合超拉伸(>4 000%)、高效可重复自愈合性(10 min自愈合效率高达98.6%)、顺应性和应力感知性等于一体的多功能仿生皮肤水凝胶[28]。基于该水凝胶而组装的电容式传感器具有良好的柔韧性,高灵敏度和极宽的检测范围,可用于准确地监测人体活动(图4)。传统单一模式的传感器有时并不能完全满足实际应用的需求,近日,Huang等[66]构建了一种基于细菌纳米纤维素增强水凝的双模式(应变/压力传感性)可穿戴传感器。由该复合水凝胶组装的电阻式应变传感器和电容式压力传感器在各种应变和压力下均具有良好的稳定性、循环重复性和耐用性,可用于监视人体运动,在智能柔性可穿戴设备中具有较大的运用潜力。
3.2 组织工程材料
纤维素水凝胶由于具有独特的三维网络结构、优异的力学性能和良好的生物相容性,成为各类组织工程的理想材料。组织工程材料的形态和结构(如材料的孔隙率、纤维网络结构和密度、表面拓扑结构等)是影响生物细胞与材料相容性的重要因素。在最近的研究中,Kong等[38]受肌肉多级结构的启发,充分利用天然木材的高抗张强度以及水凝胶的柔韧性和高含水量,开发出一种具有类似肌肉结构的高度各向异性、强韧、导电的木材纤维素纳米纤维(CNF)/聚丙烯酰胺(PAM)水凝胶(图5a)。这类受人体肌肉多级结构启发的仿生水凝胶,能够同时兼具力学强度和高度柔韧性,又具有离子传导性,此类多功能纳米纤维素水凝胶将引领未来组织工程材料的发展方向。另一方面,近年来,基于纳米纤维素水凝胶的3D打印技术在组织工程材料领域引起了广泛的关注。直接构建出具有3D构型的仿生材料对组织再生、器官修复和人造器官移植更具有针对性和实用性。Markstedt等[67]结合了CNF剪切变稀以及海藻酸钠(SA)能快速交联的性质配置了用于3D打印的生物墨水,并引入活细胞,以此打印出具有良好生物相容性的活体软组织材料。在此基础上,Abouzeid等[68]报道了一种可用于骨组织的仿生矿化3D打印T-CNF(TEMPO氧化CNF)/SA水凝胶支架(图5b),作者认为该矿化T-CNF/SA/HAp支架在骨组织工程领域具有较大的应用潜力。
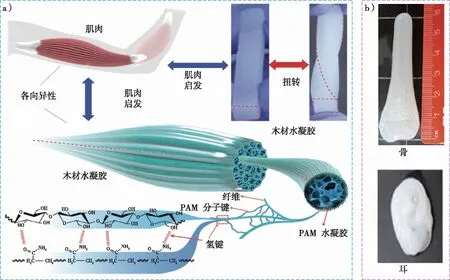
a)肌肉启发的木材纤维素纳米纤维水凝胶[38];b)3D打印不同设计形态的人体组织支架[68]。图5 基于纳米纤维素水凝胶的组织工程材料Fig. 5 Tissue engineering materials based on nanocellulose hydrogels
3.3 生物医药载体材料
基于独特的网络结构、表面化学可调控性、良好的生物相容性和生物可降解性,在生物医药方面,功能性纤维素水凝胶成为药物、细胞或其他生物活性物质递送的优良载体,也为设计和构建其他医药材料提供了良好的基础材料。纤维素水凝胶药物释放系统通常可以设计为在生物体特定的位置(组织、细胞),通过环境刺激(如温度、pH、光、磁场或电场等)响应性,通过控制水凝胶的不同溶胀结构特性而达到药物智能释放的目的。如Lin等[61]构建了一种磁响应β-环糊精/纤维素水凝胶药物智能控释载体(图6a)。该体系中,β-环糊精通过环氧氯丙烷交联接枝到纤维素水凝胶网络上,其特殊的大环空腔结构作为药物负载的“容器”,引入的Fe3O4纳米颗粒均匀分散在纤维素基本骨架上,赋予水凝胶良好的磁场响应性。如图6b所示,当外界磁场关闭时,由于纤维素水凝胶具有多孔网络结构,β-环糊精空腔内的药物分子凭借内外浓度差可通过多孔网络自由扩散到溶液中;当磁场开启后,分散于纤维素网络上的Fe3O4纳米颗粒在磁场作用下相互吸引团聚,致使凝胶网络结构收缩,孔隙率迅速减小,导致药物的扩散通道被“关闭”,从而使药物释放量迅速减低。该磁性纤维素水凝胶实现了体外“远距离”控制药物释放,无须和药物载体直接接触,操作方便可控,为药物智能控释载体的设计提供了参考。
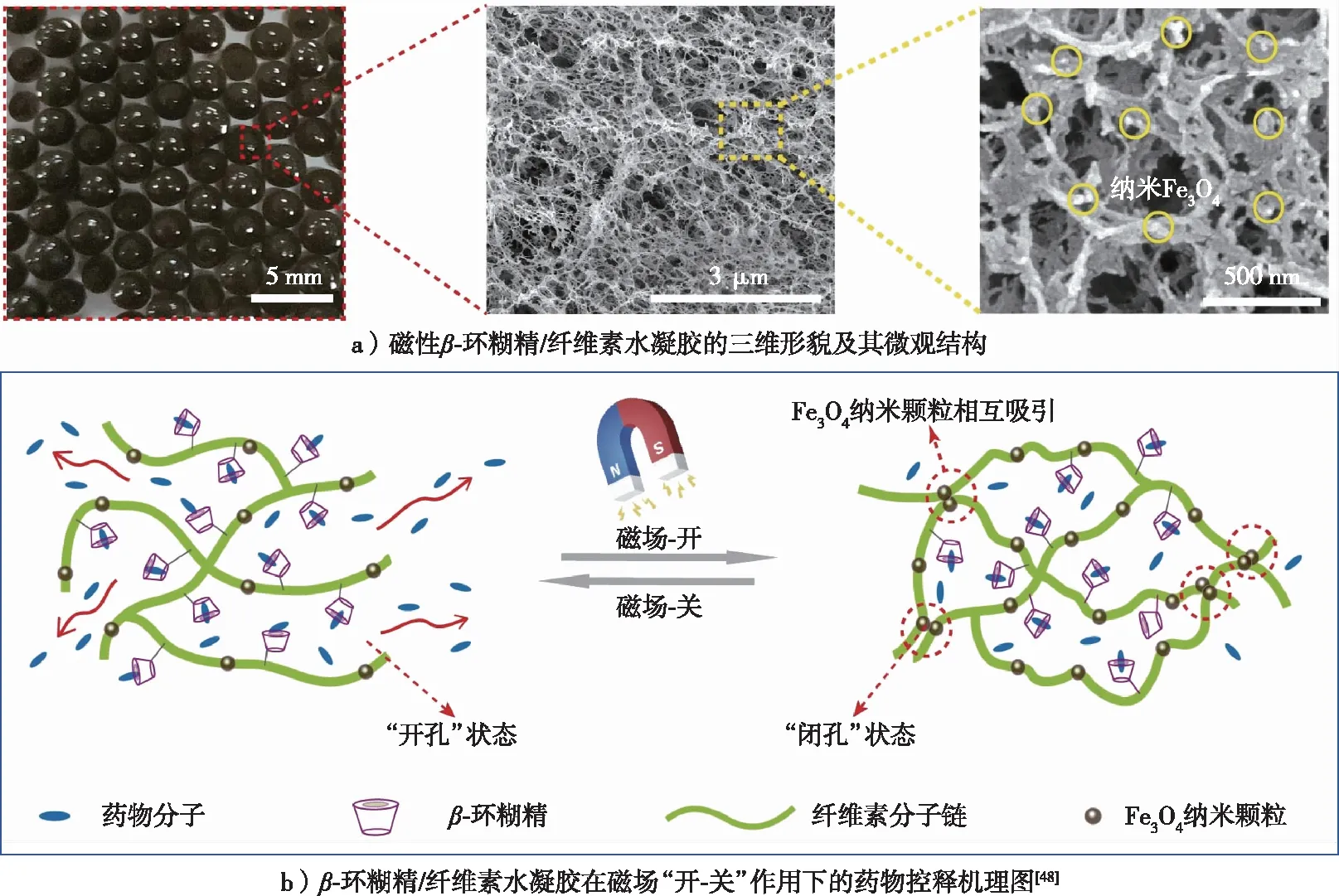
图6 纤维素基水凝胶药物缓释载体Fig. 6 Drug sustained release carrier based on cellulose-based hydrogels
纤维素水凝胶良好的生物相容性使其亦可作为可注射药物缓释载体,如Laurén等[69]报道了一种用锝-99m标记的CNF构建可注射水凝胶作为药物定点释放的载体,在整个药物缓释过程CNF水凝胶载体在体内较为稳定,不发生结构垮塌或扩散,并且在完成药物定点缓释后,CNF水凝胶可以通过外科手术取出或者通过注射活性酶降解为可吸收的葡萄糖。此外,纯CNF水凝胶多孔三维网络结构也可以为细胞的生长提供3D支撑网络环境。Bhattacharya等[70]报道了一种基于CNF的3D细胞培养支架水凝胶,HepaRG和HepG2细胞在纯CNF水凝胶支架上增殖分化明显,且细胞的球形三维形态与外加了生物活性物质的CNF水凝胶相比没有明显区别,说明CNF水凝胶固有的生物相容性即可为细胞的生长提供良好的微环境,这对构建生物活性物质释放载体、细胞治疗和在组织工程领域具有重要意义。
3.4 伤口敷料
人体皮肤是身体重要的天然保护屏障,可在抵御环境有害物质或微生物的侵袭,然而,在日常生活中难免会发生皮肤的损伤,这就需要对皮肤进行适当的处理,避免感染。伤口敷料是治疗皮肤损伤简便而有效的方法。一般来说,伤口敷料需要有良好的透气性、无毒且不会引起过敏反应,能够在保持伤口表面湿润性的同时又能够吸收渗出的脓液,具有抗菌性和促进伤口自愈合等特性。纤维素水凝胶亲水性的3D网络结构可以吸收大量的水分,可为伤口提供所需的湿度环境。此外,纤维素水凝胶通过负载抗菌成分(Ag、ZnO、壳聚糖、单宁酸等)[71-72,14]或抗生素后[73],在吸收伤口脓液的同时可以起到杀菌消毒作用,加上纤维素固有的生物相容性、生物可降解性以及环境友好性,近年来纤维素水凝胶在伤口敷料方面的运用受到了广泛的关注。Liu等[74]将载有四环素盐酸盐(TH)的PDA与羧基化纤维素纳米纤维(TOCNF)复合,经Ca2+交联形成水凝胶(PDA-TA/TOCNFs),结果表明,在较低pH或近红外(NIR)辐射下,水凝胶可以按需释放TH药物,促进皮肤的再生。在另一项研究中,Huang等[14]基于动态席夫碱键交联水溶性羧甲基壳聚糖(CMC)和双醛基纳米纤维素晶体(DACNC)构建了一种用于促进伤口自愈合的可注射水凝胶。此外,也有许多工作表明细菌纳米纤维素(BC)对伤口愈合也有极大的促进作用。Czaja等[75]报道了BC水凝胶用于二度烧伤皮肤的治疗,结果表明,使用BC水凝胶敷料的患者要比使用传统烧伤敷料的患者皮肤愈合速度要快。以上这些基于纳米纤维素而设计的复合水凝胶具有多种优势,在伤口敷料方面具有较大的运用潜力。
3.5 其他应用
水资源,特别是淡水资源的短缺严重阻碍了一些地区的发展,尤其是在亚洲中西部、非洲和南美洲等地,高效合理地利用水资源尤为重要。纤维素水凝胶优异的高吸水和保水性在农业园艺方面可发挥重要的作用。水凝胶在雨天或灌溉时充分吸水,在溶胀过程中材料从较硬的干态转变为具有蓄水能力的湿润状态,当周围的湿度下降时,水凝胶又会缓慢释放出吸收的水分,保证农作物的生长需求。Zhou等[76]制备了一种基于羧基化CNF和羧甲基纤维素钠接枝聚(丙烯酸-co-丙烯酰胺)的超吸水纳米复合水凝胶,水凝胶的吸水率主要取决于羧基化CNF的含量,同时,羧基化CNF的引入有效提高了水凝胶的耐盐性和抗热性,这些优良特性使其有望运用于农作物智能灌溉体系中。
粮食短缺一直是世界性的问题,每年仅因食物腐烂就造成大量的食物浪费,这一问题在果蔬的运输和保存过程尤为突出。近日Jung等[77]发现纳米纤维素晶体可以作为水果的有效保鲜剂,他们开发了一种基于纳米纤维素晶体和鸡蛋蛋白可食用、易洗涤的多功能纳米复合水凝胶保鲜涂层。该多功能水凝胶涂层以CNC为主体成分,为涂层提供良好的力学性能,其余成分包括蛋白和少量蛋黄以及姜黄素,蛋白可以形成均匀的隔绝空气膜,姜黄素起抗菌作用。这种无毒、绿色、可食用、易洗涤的多功能水凝胶涂层可以为减少食物浪费提供一种有效的解决方案。
4 展 望
功能性纤维素水凝胶由于具有优异的柔韧性、刺激响应性、生物相容性、可降解等突出特点而成为功能材料领域的研究热点。纤维素分子链表面丰富的羟基结构具有易形成氢键和易化学改性的特点,因此未来在功能性纤维素水凝胶的构筑过程中采用多种方式协同交联的策略将更为普遍。同时,设计和开发绿色交联剂和低能耗的反应体系用于取代传统有毒的化学交联试剂和有机溶剂将是研究者一致追求的目标。近年来,功能性纤维素水凝胶的研究逐渐增多且不断深入,但是个体纤维素水凝胶的功能性还较为单一,例如同时集自愈合、高强度、黏附性、导电性等功能于一体的多功能纤维素水凝胶还较少,因此设计和构筑集合多功能于一体的纤维素水凝胶材料以同时满足不同领域的应用需求是未来的重点研究方向。此外,目前对于刺激响应性纤维素水凝胶的研究还主要以化学信号和物理信号为主,生物信号刺激响应的纤维素水凝胶鲜有报道,同时,如何使其实现对多种外界刺激(例如温度、光、湿度和压力等)的同时识别和感应,构建具有双重或多重环境响应性纤维素水凝胶还有待进一步深入探索。例如利用功能性纤维素水凝胶组装能够同时识别多种体内微环境变化(如体温、pH、神经微电流、激素等)的生物传感器,对当前人类抗击新型冠状病毒肺炎、埃博拉病毒等突发性公共卫生事件具有重要作用。
在实际应用开发方面,目前功能性纤维素水凝胶的大部分研究都集中在柔性可穿戴传感器、药物缓释载体和伤口敷料领域,但其中也存在如传感器的灵敏度不足、药物载体刺激响应时间过长、伤口敷料免疫排斥等问题,同时由于技术成熟度的原因,多数功能性纤维素水凝胶还处于实验研究阶段,未能真正投入工业生产。如何将功能性纤维素水凝胶普及到日常生活中,实现产品化,发挥水凝胶的应用潜力,还需开展大量的研究工作。随着人类环保意识的不断提高以及绿水青山的发展理念不断深入人心,利用天然高分子来源丰富、可再生、生物相容性好、绿色无毒、易功能化改性等突出优点,结合多学科交叉融合技术,以纤维素为原料的多功能水凝胶在环保生物传感器、生物医药和组织工程、智能软体机器人等领域的技术必将逐渐趋于成熟,从而推动人类走向更加绿色和便捷的智能生活。

