兔脾淋组织肌肉注射对猪外周血细胞转录谱的影响
庄许诺, 陆芍华, 严梦涵, 何 晴, 包松英, 江兴华, 王全溪 [1.福建省兽医中药与动物保健重点实验室(福建农林大学),福建 福州 50002; 2.中西兽医结合与动物保健福建省高等学校重点实验室,福建 福州 50002; .兆丰华生物科技(福州)有限公司,福建 福州 50014]
摘要: 选取10头经检测确定为猪瘟抗原抗体双阴性的断奶外三元仔猪,随机分为A、B组,每组5头.A组(对照组)仔猪肌肉注射灭菌生理盐水(1 mL·头-1),B组(兔脾淋组织注射组)仔猪肌肉注射兔脾淋组织(1 mL·头-1).注射后的第3天,采集仔猪外周血,基于Illumina测序平台进行转录组测序分析,筛选差异表达基因,进行基因本体(GO)及京都基因和基因组数据库(KEGG)富集分析,并采用RT-qPCR验证差异表达基因的表达水平.结果显示:A、B两组样品的测序长度均约为6×109 bp,测序质量符合要求;两组外周血细胞共筛选到差异表达基因1 246个.GO富集结果表明,差异表达基因富集到的生物过程有56个GO条目,细胞组成有19个GO条目,分子功能有10个GO条目.KEGG富集结果表明,共有17条显著性富集KEGG通路.本研究重点分析了A、B两组样品T细胞受体和Toll样受体的KEGG通路,验证差异表达基因的表达水平,结果显示,与A组相比,B组CD4/8、TCRα、AP-1、NAFT基因的表达水平显著上调,与转录组数据一致.以上结果表明,兔脾淋组织肌肉注射第3天可显著影响猪外周血转录组谱,特别是可调节T细胞受体和Toll样受体的KEGG通路,提高猪的免疫功能.
目前,猪瘟疫苗有兔化弱毒细胞苗、脾淋组织苗、E2亚单位苗等.猪瘟脾淋苗是猪瘟兔化弱毒苗的一种,于1954—1958年经兔体继代958代后获得,并持续使用至今.猪瘟脾淋苗免疫72 h即可产生强大的免疫力,可在疫区对发病猪进行紧急免疫,并可有效控制疫情[1].猪瘟脾淋苗是将猪瘟兔化弱毒毒株接种于成年兔子,然后在无菌条件下采集兔子体内含毒浓度最高的肠系膜淋巴结和脾脏,再将收集到的淋巴结和脾脏制备成疫苗[2].猪瘟脾淋苗与其他疫苗最大的区别是,该疫苗含有较多的兔脾淋组织.
兔脾淋组织对于猪瘟疫苗免疫效果具有一定的增强作用.如蒋冬福等[3]用1%兔脾淋组织稀释猪瘟细胞苗,2周后检测抗体水平,发现比用生理盐水稀释的猪瘟细胞苗,其抗体水平显著性提高.可见,注射兔脾淋组织可以提高猪机体的免疫功能,从而提高猪瘟的免疫效果,但兔脾淋组织提高猪免疫功能的分子机制仍然需要进一步厘清.
对单一基因的表达进行分析不能完整地解释某一机制,需要一次性对多个基因的表达进行分析,如果单纯使用荧光定量PCR方法则费时费力.高通量测序快速准确,且可一次性大规模获得转录本,近年来已在生物医学研究上得到广泛应用.本研究采用转录组学技术对注射兔脾淋组织3 d的断奶仔猪外周血进行差异表达基因的筛选和分析,探究兔脾淋组织提高猪免疫功能的分子机制,旨在为该疫苗的使用提供科学依据.
1 材料与方法
1.1 材料
兔脾淋组织由兆丰华生物科技(福州)有限公司提供,按猪瘟兔化脾淋苗标准生产.
动物组织总RNA提取试剂盒、RT-qPCR试剂盒均购于兰博利德试剂有限公司,Promega反转录试剂盒购于厦门泰京生物技术有限公司.
1.2 试验动物的筛选
筛选无特定病原体的外三元健康哺乳母猪6~10头,从母猪所产的28~30日龄仔猪中,选取10头经检测确定为猪瘟抗原抗体双阴性的仔猪进行下一步试验.
1.3 试验分组
将筛选出的仔猪随机分为A、B两组,每组5头.A组(对照组)仔猪注射生理盐水(1 mL·头-1),B组(兔脾淋组织注射组)仔猪肌肉注射兔脾淋组织(1 mL·头-1),第3天采集两组猪外周血液,抗凝处理后,分离淋巴细胞送北京诺禾资源生物有限公司进行转录组测序.
1.4 转录组测序与分析
提取样品总RNA检测纯度,采用Illumina HiSeqTM2500系统测序获得原始数据,检测数据质量后进行基因表达差异分析.得到差异表达基因后,采用Cluster Profiler软件的内部函数完成基因本体(gene ontology, GO)富集分析及京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)富集分析.首先将差异表达基因映射到各自的GO数据库条目,然后计算每个条目的基因数量.将校正后的P≤0.05作为阈值,将满足该条件的GO项定义为显着富集.
KEGG是有关通路的主要公共数据库.将满足Q≤0.05、P≤0.05的通路定义为差异表达转录本中的显著性富集通路.
1.5 转录组RT-qPCR验证
为了验证转录组数据的准确性,采用RT-qPCR方法对部分差异表达基因进行分析.首先采用总RNA提取试剂盒提取总RNA,将获得的RNA按照Promega逆转录试剂盒说明书的步骤进行cDNA的逆转录.逆转录体系为:2 μL 25 mmol·L-1MgCl2、1 μL GoScriptTM逆转录酶、4 μL GoScriptTM5×缓冲液、0.5 μL Recombinant RNasin®核酸酶抑制剂、1 μL Oligo(dT)引物、1 μL随机引物、1 μL 10 mmol·L-1PCR Nucleotide Mix、3 μL mRNA,用无核酸酶水加至20 μL.将转录体系置于42 ℃反应15 min,72 ℃反应15 min.以获得的cDNA为模板,进行RT-qPCR检测.RT-qPCR循环条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,72 ℃延伸15 s,共45个循环.利用GraphPad Prism软件计算差异表达基因的表达水平,各试验重复3次.RT-qPCR所用基因的引物序列如表1所示.

表1 RT-qPCR引物序列Table 1 RT-qPCR primers sequences
2 结果与分析
2.1 转录组测序质量与数据统计
对照组的过滤后序列数占总序列数的93.10%,带接头的序列、带N碱基的序列、测序质量低的序列分别占总读数的6.90%、0.00%、0.00%;试验组的过滤后序列数占总序列数的93.38%,带接头的序列数、带N碱基的序列数、测序质量低的序列数分别占总序列数的6.68%、0.00%、0.00%:表明测序结果质量良好,可以用于后期分析.
使用HISAT2软件将过滤后的碱基数与参考基因组进行比对,获取读长在参考基因组上的定位信息.结果(表2)显示,每头猪均获6×109以上的碱基数,Q30碱基百分比均大于90%,GC含量约为58%.差异表达基因的筛选结果(图1)显示,本研究共获得1 246个差异表达基因,其中,上调的基因有685个,下调的基因有561个.
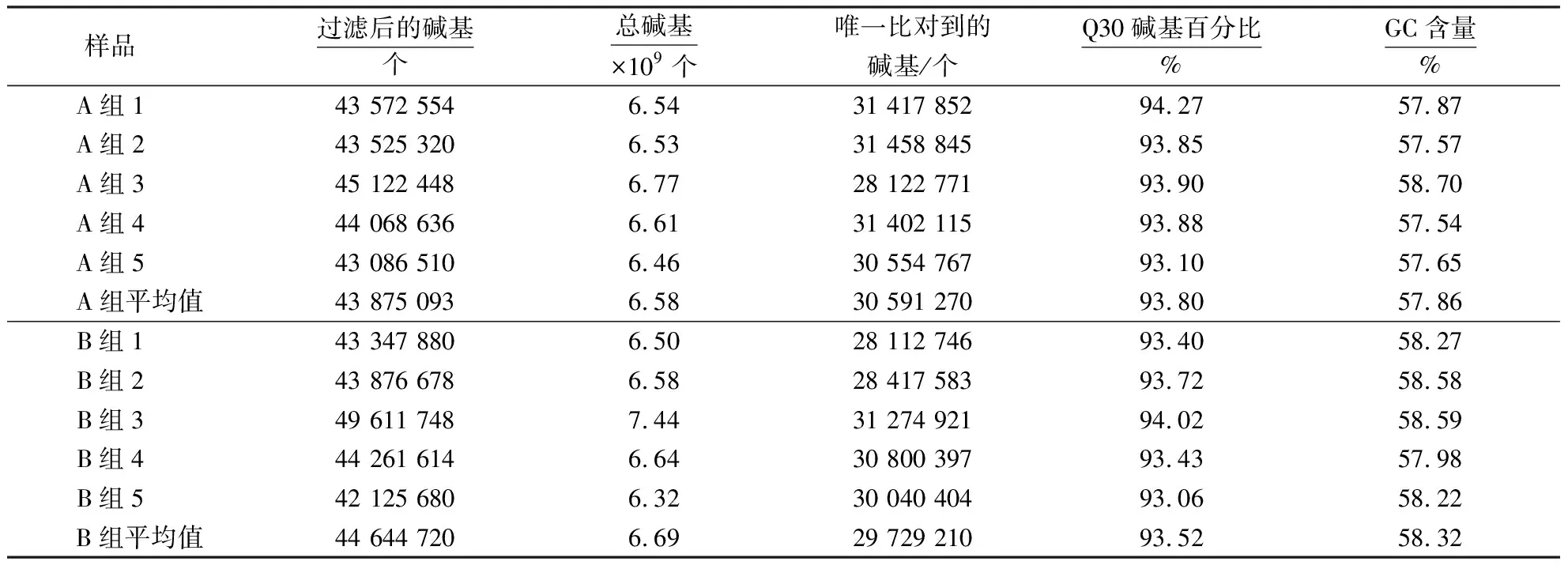
表2 转录组测序结果统计Table 2 Transcriptome sequencing results
2.2 差异表达基因的GO富集结果
差异表达基因富集到的生物过程有56个GO条目,细胞组成有19个GO条目,分子功能有10个GO条目.结果(图2)显示:生物过程主要富集到酰胺生物合成过程、细胞酰胺代谢过程、肽代谢过程等10个,共有192个差异表达基因上调,57个差异表达基因下调;细胞组分主要富集到核糖体、胞质核糖体、核糖体亚基等10个,共有191个差异表达基因上调,165个差异表达基因下调;分子功能主要富集到核糖体的结构成分、结构分子活性等10个,共有111个差异表达基因上调,69个差异表达基因下调.
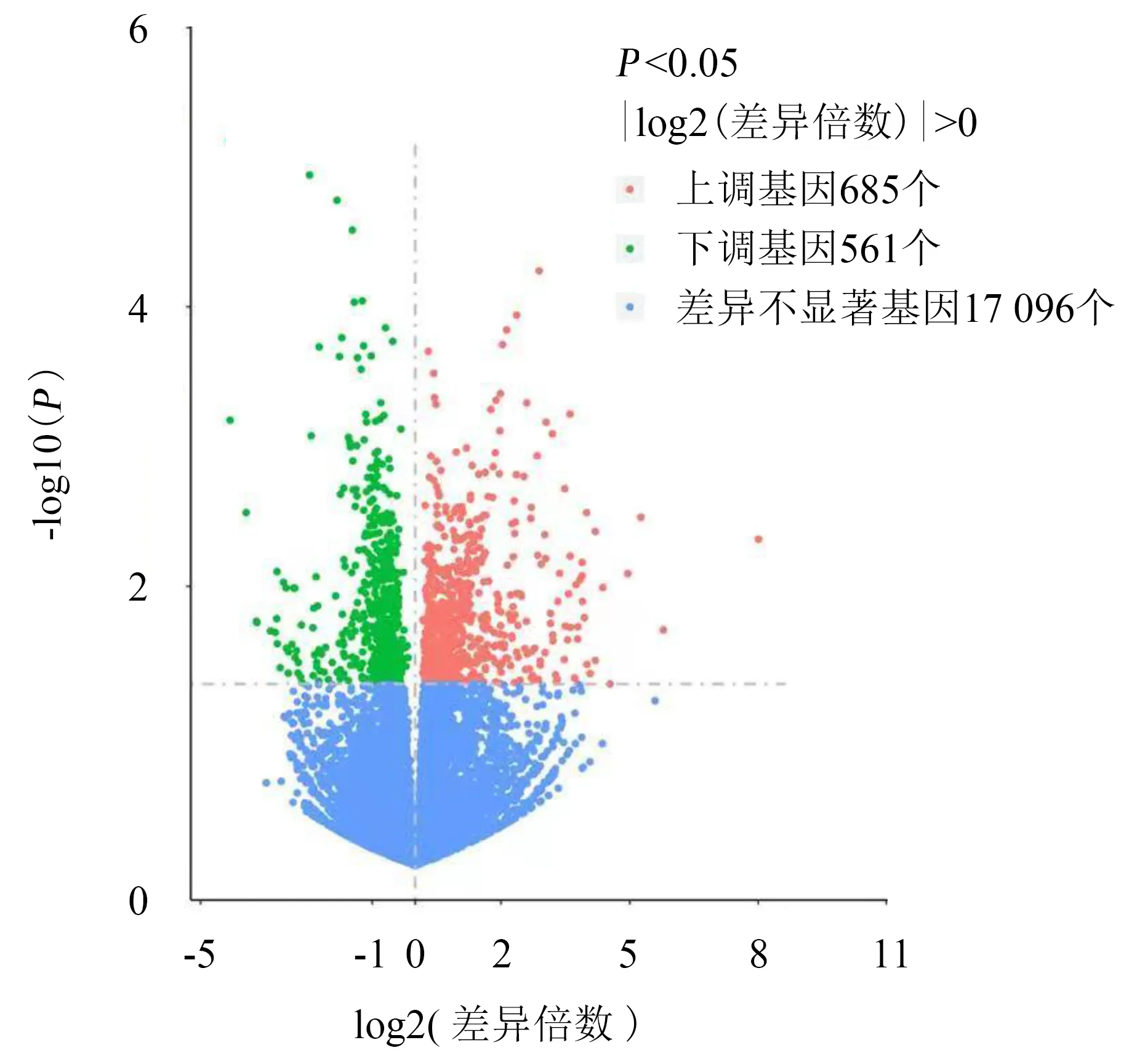
图1 差异表达基因的筛选结果Fig.1 Differentially expressed genes screened
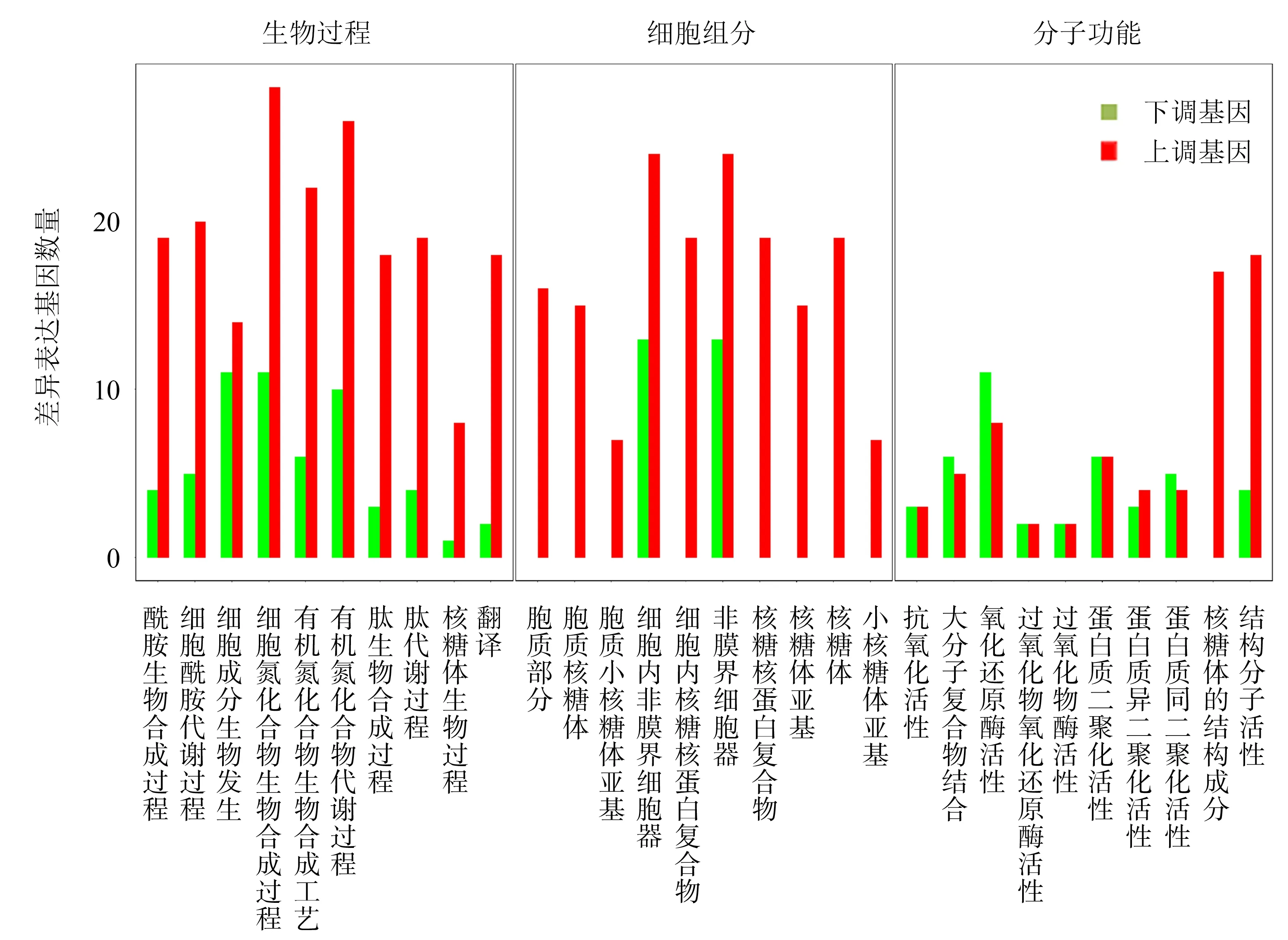
图2 差异表达基因GO富集结果Fig.2 GO enrichment analysis of differentially expressed genes
2.3 差异表达基因的KEGG通路富集结果
1 246个差异表达基因富集到的KEGG通路有289条,满足P<0.05、Q<0.05的通路只有两条,分别是核糖体、血小板活化;只满足P<0.05的通路有17条(表3).
2.4 转录组的RT-qPCR验证结果
为了验证转录组测序结果的准确性,随机选取9个差异表达基因进行RT-qPCR分析.结果(图3)显示,RT-qPCR与转录组测序之间的差异表达基因的表达趋势基本一致,表明转录组测序结果的质量和可靠性是可以保证的.
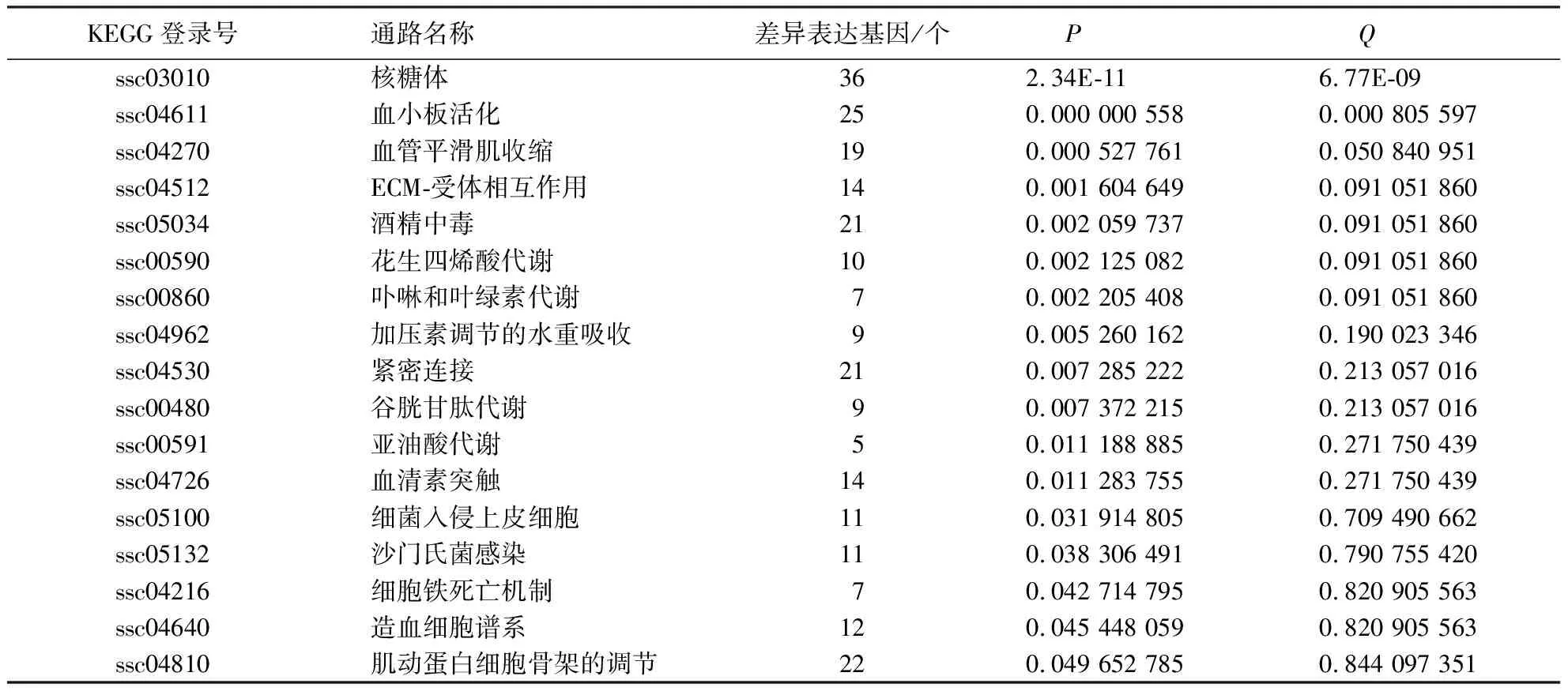
表3 兔脾淋组织注射3 d后的KEGG通路富集结果Table 3 KEGG pathway analysis after injection of rabbit spleen and lymph tissue fluid for 3 days
2.5 与免疫功能相关的KEGG通路富集结果
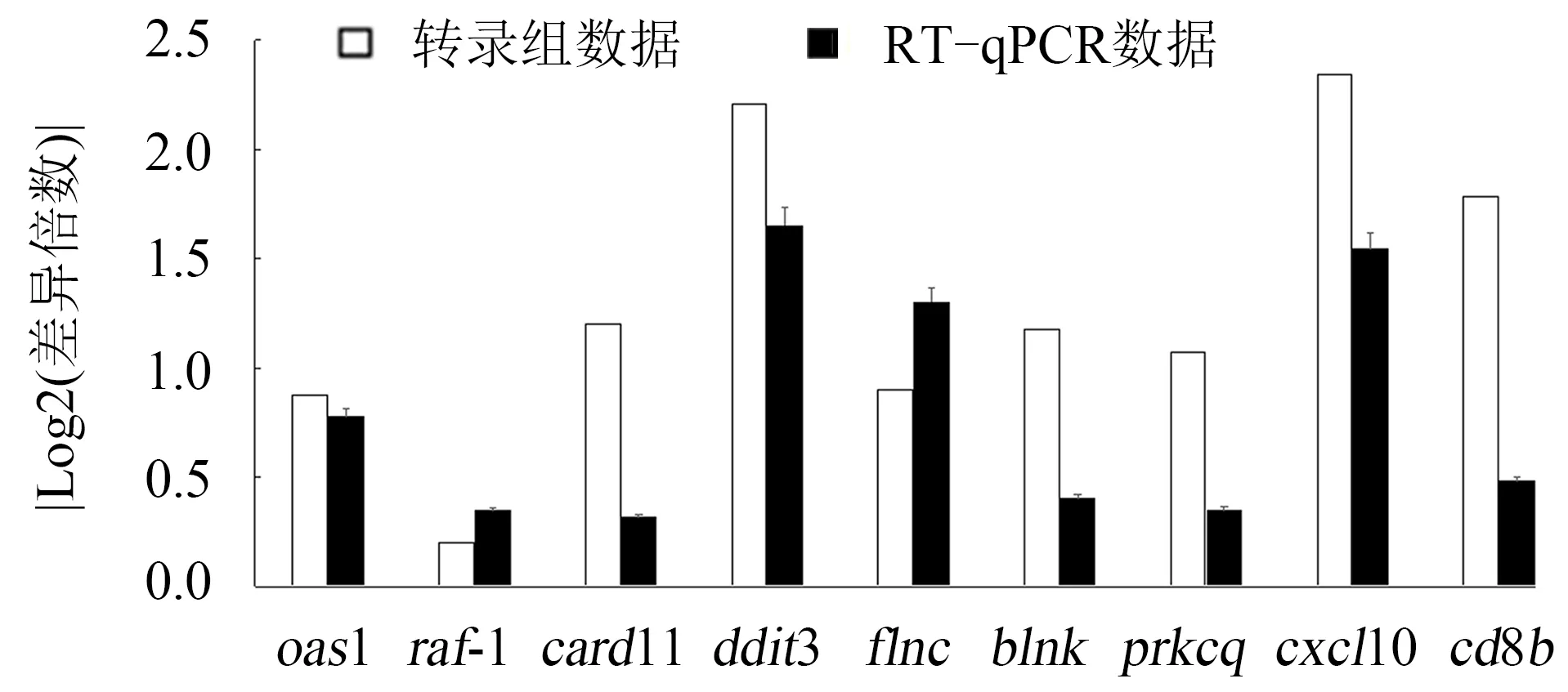
图3 9个差异表达基因转录组数据与RT-qPCR数据的比较Fig.3 Comparison of RNA-seq data and RT-PCR data of 9 differentially expressed genes
对涉及到的289条KEGG通路进行了分析,发现与免疫功能相关的T细胞受体通路和Toll样受体通路没有达到显著性富集,但通路中依然富集到差异表达基因.与未注射无毒兔脾淋组织的对照组相比,注射兔脾淋组织组的CD4/8、TCRα、CD3δ、NFAT、Raf、PKC、CARMA1、AP-1基因的mRNA水平显著上调(附件图Ⅰ、图Ⅱ,扫OSID码可见).
随后采用RT-qPCR验证了TCRα、CD4/8、AP-1、NFAT基因的表达情况.验证结果(图4)表明,兔脾淋组织注射3 d后,TCRα、CD4/8、AP-1、NFAT基因的mRNA水平显著上调,其结果与KEGG通路中差异表达基因表达水平的趋势一致.可见,兔脾淋组织注射3 d后,可上调TCRα、CD4/8、AP-1、NFAT基因的表达水平,提高机体免疫功能.
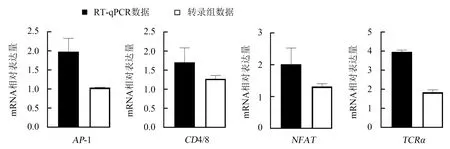
图4 RT-qPCR对4个基因mRNA表达水平的验证Fig.4 mRNA expression levels of differentially expressed genes in KEGG pathway by RT-qPCR
3 讨论与结论
本次转录组测序是基于Illumina测序平台的RNA 测序技术,可研究特定组织或细胞在某个时期转录出来的所有mRNA,是基因功能与结构研究的基础,对认知生物发育和疾病发生具有重要作用[4].转录组测序具备高通量、高灵敏度、应用范围广等优势,已成为转录组研究的主要方法.高通量转录组测序技术在挖掘差异表达基因,揭示生物基因表达及调控机理发挥了重要作用[5].本研究通过分析比较对照组和试验组的差异表达基因,发现有1 246个差异表达基因,其中,上调的基因有685个,下调的基因有561个.基因的上调和下调促使某些表达蛋白和因子分泌发生了变化,通过一系列的信号通路过程最终对机体产生重要影响[6].
猪瘟脾淋苗的主要成分是兔脾脏、淋巴结组织,脾脏和淋巴结既是免疫器管又为造血器官.本研究通过GO富集分析发现,差异表达基因的主要功能与细胞、细胞组成、细胞器、细胞过程、代谢过程、炎症、免疫相关;通过KEGG通路分析发现,差异表达基因主要在核糖体、血小板活化、趋化因子、人巨细胞病毒感染、T细胞受体、Toll样受体等通路上.兔脾淋组织注射3 d后,其差异表达基因主要富集在血小板活化通路上,这与脾脏淋巴组织功能相吻合.
刘新平等[7]研究表明,健康兔脾淋组织液对猪瘟疫苗免疫抗体效价有明显的增强作用.本研究结果也表明,兔脾淋组织对猪外周血中一些免疫相关基因的表达水平有明显的促进作用,表明兔脾淋组织可以增强机体免疫力.NFAT基因是Ca2+依赖的转录因子,在T细胞免疫应答中发挥着重要作用[8].Chen et al[9]研究表明,刺激转录因子中的NFAT基因能抵抗机体的炎症反应,阻挡病原体,能有效地提高机体的免疫能力.T细胞受体作为T细胞识别抗原的分子在免疫应答和免疫调节中发挥着重要的作用[10],TCR以非共价键的形式与CD3分子结合形成复合物,通过特异性识别并结合抗原提呈细胞或者靶细胞表面的抗原肽,启动第一传导信号,从而诱导T细胞活化并发挥适应性免疫效应的功能[11].
在Toll样受体信号通路中的FOS(原癌基因)是上调的,FOS为c-fos基因转录产生的成熟mRNA编码的一个核磷蛋白.C-fos基因是人或动物细胞中固有的正常基因,属于即刻早期应答基因.FOS作为一类核蛋白转录因子,在调控细胞生长、分裂、增殖、分化乃至程序性死亡等方面具有重要作用[12].FOS蛋白与JUN蛋白组成的二聚体复合物AP-1,以磷酸化的c-JUN/c-FOS形式与基因序列上的AP-1结合位点结合[13],在炎症、肿瘤发生时AP-1是调节炎症因子表达的重要转录因子[14].AP-1可通过与NFAT家族的转录因子协同激活不同的细胞类型参与调控机体的炎症反应[15],且NFAT/AP-1与DNA形成的三元复合物能激活细胞因子引起炎症反应;细胞因子也可以反向调节激活免疫应答中的NFAT/AP-1复合物[16],形成正反馈.
本研究通过转录组分析兔脾淋组织肌肉注射对猪外周血细胞转录谱的影响,同时关注了与免疫相关的差异表达基因,发现兔脾淋组织能够增强猪机体免疫功能,可能通过调节CD4/8、TCRα、AP-1等免疫相关基因的表达水平来影响T细胞受体和Toll样受体的KEGG通路来调节机体免疫功能.

