光和机械损伤胁迫对采后茶鲜叶香气品质的影响
王辉强, 肖梦暄, 安 琪, 郑芳玲, 肖明霁, 戴前颖,2
(1.安徽农业大学茶树生物学与资源利用国家重点实验室,安徽 合肥 230036; 2.安徽农业大学茶与食品科技学院,安徽 合肥 230036)
茶是世界三大无酒精饮料之一,因其迷人的风味以及独特的健康功效而广受欢迎[1].茶叶的风味物质可以被归为两类,分别是挥发性化合物和非挥发性化合物,其中,挥发性化合物含量仅占茶叶干重的0.05%~0.02%[2],但对于茶叶的感官品质却十分重要.目前已在各类茶叶中鉴定出了超过700余种挥发性化合物,这些挥发性化合物按照化学结构的不同可以分为醇类物质、醛类物质、酮类物质、酯类物质、烯烃类物质、酸类物质、杂环化合物和碳氢化合物等十余个大类化合物[3],而茶叶香气是由各类不同含量的挥发性成分所构成的一个整体轮廓,不同挥发性成分含量的微弱差异也可能导致茶叶呈现出不同的香气轮廓,从而对茶叶的整体品质产生影响.
茶叶香气一部分来源于茶树鲜叶中本身存在的游离态香气物质,但这类香气物质含量占比很低,茶叶的大部分香气物质来源于酶促反应的合成[4].茶叶香气物质生化合成途径可以分为4种,分别为萜烯类化合物合成途径、脂肪酸合成途径、类胡萝卜素合成途径和苯丙素类/苯环型化合物合成途径[5].茶叶中的萜烯类香气物质是甲戊二羟酸衍生的链状或环状烯烃类衍生物,根据其聚合程度的不同可以分为挥发性单萜类(C10)、倍半萜类(C15)、二萜类(C20)、三萜类(C30)和多萜类[6],其中对于香气有重要贡献作用的主要是以香叶醇、芳樟醇、橙花叔醇为代表的呈现花果香的挥发性单萜和倍半萜类香气物质.脂肪酸源香气物质是由亚麻酸和亚油酸等脂肪酸类物质氧化降解形成的一类化合物,其对于茶叶香气的形成具有重要影响.研究表明,茶叶中的青气主要来源于脂肪酸氧化降解形成的脂肪醇及其对应的脂肪醛,如2-己烯醛(青气)、顺式-3-己烯醇(青气)等物质[7].茶叶中的类胡萝卜素主要包括胡萝卜素、叶黄素、玉米黄质、叶黄素和番茄红素等色素物质,占茶叶干重的0.032%~0.125%,它们是β-紫罗酮、大马士酮和茶螺烯酮等茶叶香气物质的前体[8].苯丙素类/苯环型化合物衍生物是茶叶香气的重要化合物,主要有芳香族醇及其氧化形成的醛类物质,如苯甲醇、苯乙醇、苯甲醛等花果香物质[9-10].
茶叶香气的形成、释放与环境条件的胁迫息息相关,环境胁迫可诱导植物产生许多香气物质[11],这些香气物质可以帮助茶树抵御外界胁迫,同时也是茶叶品质的重要组成成分[11].目前对于环境胁迫影响茶叶香气品质的研究主要集中于茶树生长阶段,而在茶叶加工中也伴随着不同程度的胁迫处理,如乌龙茶在加工过程中伴随着光胁迫和机械损伤胁迫.通过研究不同胁迫条件对于采后茶叶香气品质的影响能够为需要体现花果香的红茶加工工艺的优化提供一定的科学依据和数值参考.本研究以同一品种、同一规格、同一生长环境的采后鲜叶为原料,分别设置了光胁迫、机械损伤胁迫、光胁迫+机械损伤胁迫3种胁迫处理方式以及鲜叶、无任何处理的空白对照,采用顶空固相微萃取(headspace-solid phase microextration, HS-SPME) 结合气相色谱—质谱(gas chromatography-mass spectrometry, GC-MS)检测分析了样品的香气物质组成,并采用多元统计分析法以及热图分析揭示不同胁迫处理下采后茶叶香气的差异,并推测差异形成原因,旨在为茶叶的生产加工提供参考.
1 材料与方法
1.1 材料
以于安徽农业大学大杨店农业园采摘的夏季‘龙井43’茶树品种的一芽三叶为原料.
主要试剂有氯化钾(分析纯,购于国药集团化学试剂有限公司)、环己醇(色谱纯,购于上海阿拉丁生化科技股份有限公司)、C6-C25正构烷烃(色谱纯,购于上海安谱实验科技股份有限公司).
主要设备有符合GB/T 23776—2018[12]的茶叶感官审评杯和审评碗等、AR224CN电子分析天平(奥豪斯仪器有限公司)、数显鼓风干燥箱(上海博讯实业有限公司)、恒温水浴锅(江苏金坛杰瑞尔电器有限公司)、多功能粉碎机(九阳电器有限公司)、Agilent 7870A-5975气相色谱—质谱联用仪(美国Agilent公司)、固相微萃取头(57328-U 50/30 μm,DVB/CAR/PDMS,美国Supelco公司).
1.2 样品制备
试验设置5个处理,分别是鲜叶(FL)、空白对照(CK)、光胁迫处理(SS)、机械损伤胁迫处理(MDS)、光胁迫+机械损伤胁迫处理(SMDS).不同处理组样品的制备方法如下.
FL组:鲜叶采摘后立即转移至液氮中保存.
CK组:将150 g鲜叶置室内自然摊放,每5 min称重一次,待鲜叶减重率达到40%左右时,收集样品转移至液氮中保存.
SS组:将150 g鲜叶置室外进行日光照射,萎凋过程中每隔5 min称重一次,待鲜叶减重率达到15%时,移入室内继续失水至减重率达到40%左右时,收集样品转移至液氮中保存.
MDS组:将150 g鲜叶在室内摊放至减重率为15%左右时,进行摇青.摇青过程按照“轻—重—轻”的原则,由一位专业人员分别进行3次摇青,每次摇青时间为1 min,摇青结束后将茶叶静置30 min.待3次摇青结束后,将茶叶继续摊放在室内,直至减重率达到40%左右时,收集样品转移至液氮中保存.
SMDS组:将150 g鲜叶在室外日光照射至减重率为15%左右时,移入室内进行摇青.摇青过程按照“轻—重—轻”的原则,由一位专业人员分别进行3次摇青,每次摇青时间为1 min,在每次摇青结束后将茶叶静置30 min.待3次摇青结束后,将茶叶继续摊放在室内,直至减重率达到40%左右时,收集样品转移至液氮中保存.
1.3 茶叶香气的检测
1.3.1 茶叶感官审评 选取均符合GB/T 23776—2018[12]茶叶感官审评方法的感官审评室和审评用具.感官审评小组由10位(4男,6女)受过感官审评训练、感官灵敏且稳定性好的茶学专业审评员组成.称取3 g茶叶用150 mL沸水冲泡5 min后过滤出茶汤作为样品,将所有样品进行编码并按照随机的顺序呈送给感官审评小组成员进行感官审评.感官审评小组成员首先需要对对照样的5个感官属性(甜香、花香、果香、木质香、青气)进行打分.打分结束后,由小组成员讨论判定对照样的感官属性强度,随后参照对照样对其他试验样的各项感官属性强度进行评分.
1.3.2 HS-SPME萃取条件 挥发性化合物采用HS-SPME提取.具体流程为:称取1 g磨碎茶叶和5 g氯化钾置于100 mL顶空萃取瓶中,内置磁力搅拌子,加入含有10 μL 4.01 μg·g-1环己醇内标母液的热水50 mL,在60 ℃恒温磁力搅拌锅中水浴平衡5 min后插入固相微萃取头,吸附香气50 min后将萃取头插入GC前进样口进样,解吸5 min后取出.每个样品设3次平行.
1.3.3 GC-MS条件 采用Agilent 7870A-5975气相色谱—质谱联用仪检测,色谱柱选用DB-5MS毛细管柱(0.25 mm×0.25 mm×0.25 μm).
GC参数:进样口温度250 ℃,分流比3∶1.升温程序:初始温度40 ℃保持1 min;以3 ℃·min-1的速率升温至180 ℃,保持2 min;以15 ℃·min-1的速率升温至240 ℃,保持3 min;总时长56 min.
MS条件:接口温度250 ℃,离子源温度230 ℃,EI电离方式,电子能量70 eV,扫描质量范围40~400 amu.
载气:氦气(99.999%)、流速(1 mL·min-1).
1.4 数据处理
使用Excel 2013软件计算平均值和相对标准偏差,采用Origin 2016软件绘制图表.
挥发性成分定性:使用安捷伦MSD Chemstation软件数据处理系统,利用谱库(NIST 11.L)检索结果对未知挥发性化合物进行定性,然后按照Kovats保留指数计算法计算保留指数(retention index, RI),与网站https://webbook.nist.gov/chemistry/cas-ser中用DB-5MS色谱柱鉴定的化合物的RI进行核查定性.
挥发性成分定量:通过比较各化合物的峰面积与内标物的峰面积,计算出各化合物的相对含量.
使用SPSS 20.0软件进行方差分析(ANOVA),采用SIMCA-P 14.1软件对挥发性化合物进行偏最小二乘法判别分析(partial least squares-discriminate analysis, PLS-DA).
2 结果与分析
2.1 不同胁迫处理下茶叶香气物质的HS-SPME/GC-MS检测
采用HS-SPME萃取茶叶的挥发性组分,经GC-MS分析,计算各物质的RI.参考文献和网站中相同色谱柱的RI并去除硅元素、卤族元素、RI相差较大(RI±20)的杂质以及咖啡碱等物质,对剩余化合物的相对含量进行计算.结果(表1)显示,在所有样品中共检测出102个挥发性化合物,其中在FL、CK、SS、MDS、SMDS组的样品中分别检测出47、63、58、56、55个挥发性化合物.在102个挥发性化合物中筛选出71个具有香气特性的挥发性化合物,包括醇类物质、醛类物质、酮类物质、酯类物质、烯烃类物质、碳氢化合物、杂环化合物,化合物含量较高的物质主要有芳樟醇(花香)[4]、香叶醇(玫瑰花香)[4]、水杨酸甲酯(冬青油香气)[13]、己酸己烯酯(果香)[13]等香气物质.
各处理组样品不同类化合物的含量如表2所示.醇类物质是所有样品的第一大类香气物质,含量为119.12~314.81 μg·kg-1,各处理组含量的大小表现为:SS>MDS>SMDS>CK>FL,醇类物质的主体物质是芳樟醇和香叶醇等萜烯醇类物质,含量占醇类物质总量的60%以上.酯类物质是第二大类香气物质,含量为24.76~184.60 μg·kg-1,各处理组含量的大小表现为:MDS>SMDS>SS>CK>FL,值得注意的是胁迫处理组的酯类物质含量相较于鲜叶有大幅提升,表明酯类物质在采后过程中大量生成,而胁迫处理则提升了酯类物质的合成效率.醛类物质是第三大类香气物质,含量为15.42~40.95 μg·kg-1,各处理组含量的大小表现为:MDS>CK>SMDS>SS>FL,含量相对较高的醛类物质主要有2-己烯醛(青气)[14]、反式-3-己烯醛(青气)[14]和己醛(果香)[15].烯烃类物质含量为7.46~43.12 μg·kg-1,各处理组含量的大小表现为:MDS>SS>CK>FL>SMDS,含量相对较高的烯烃类物质主要有β-罗勒烯(花香)[13]、β-月桂烯(木质香)[13]和D-柠檬烯(柠檬香)[16].杂环化合物含量为0.43~48.16 μg·kg-1,MDS组的杂环化合物含量显著高于其他处理组,而杂环化合物中又以吲哚(花香、皮革)[17]的含量最高,是杂环化合物的主体物质.酮类物质和碳氢化合物的含量较低,普遍在5 μg·kg-1以下,在茶叶中较为重要的香气物质主要有顺茉莉酮(花香)[18]和β-紫罗酮(花香)[18].
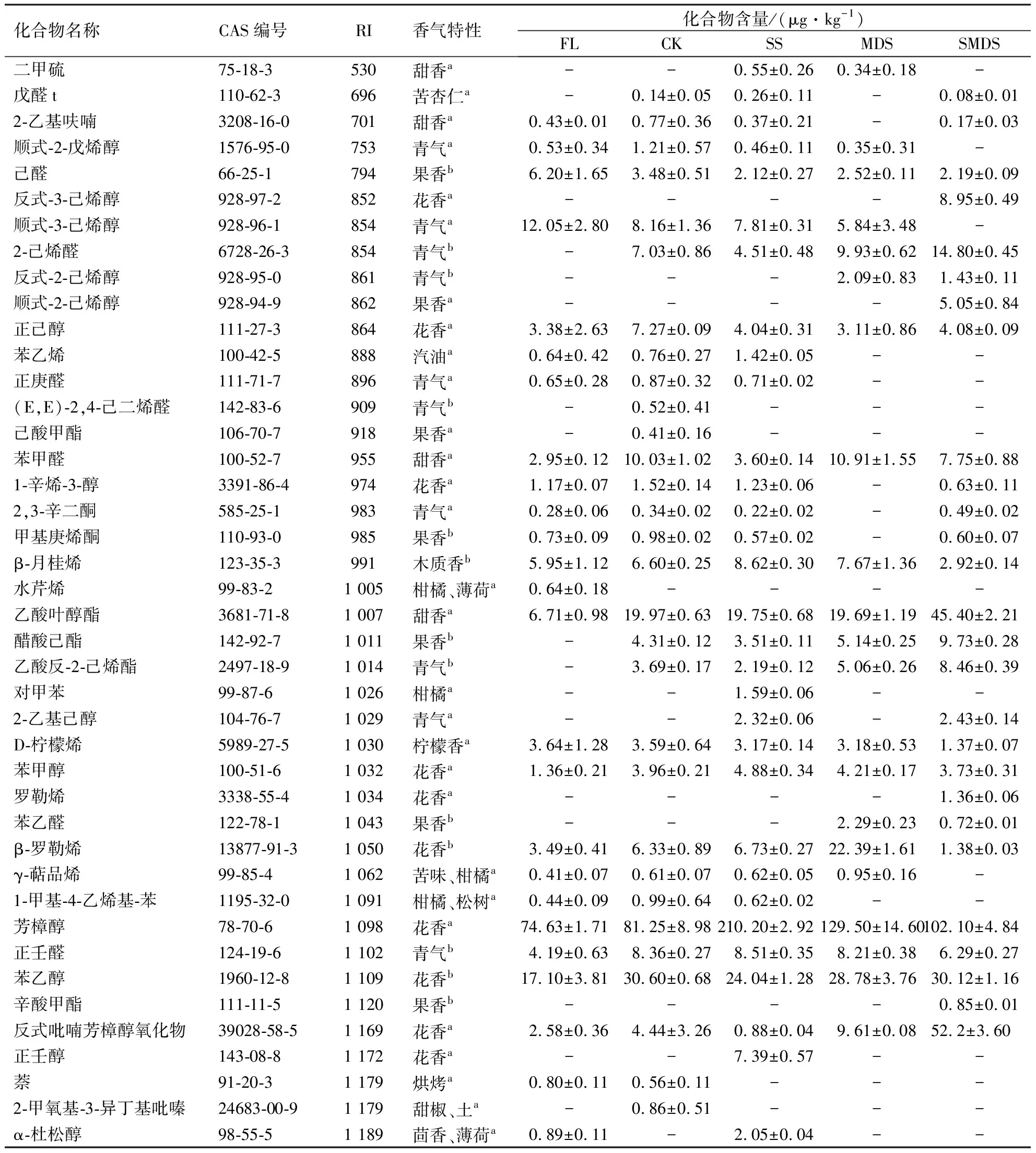
表1 基于HS-SPME/GC-MS检测不同胁迫处理下茶叶的挥发性化合物含量1)Table 1 Levels of volatile compounds in tea leaves of different treatment groups by HS-SPME/GC-MS
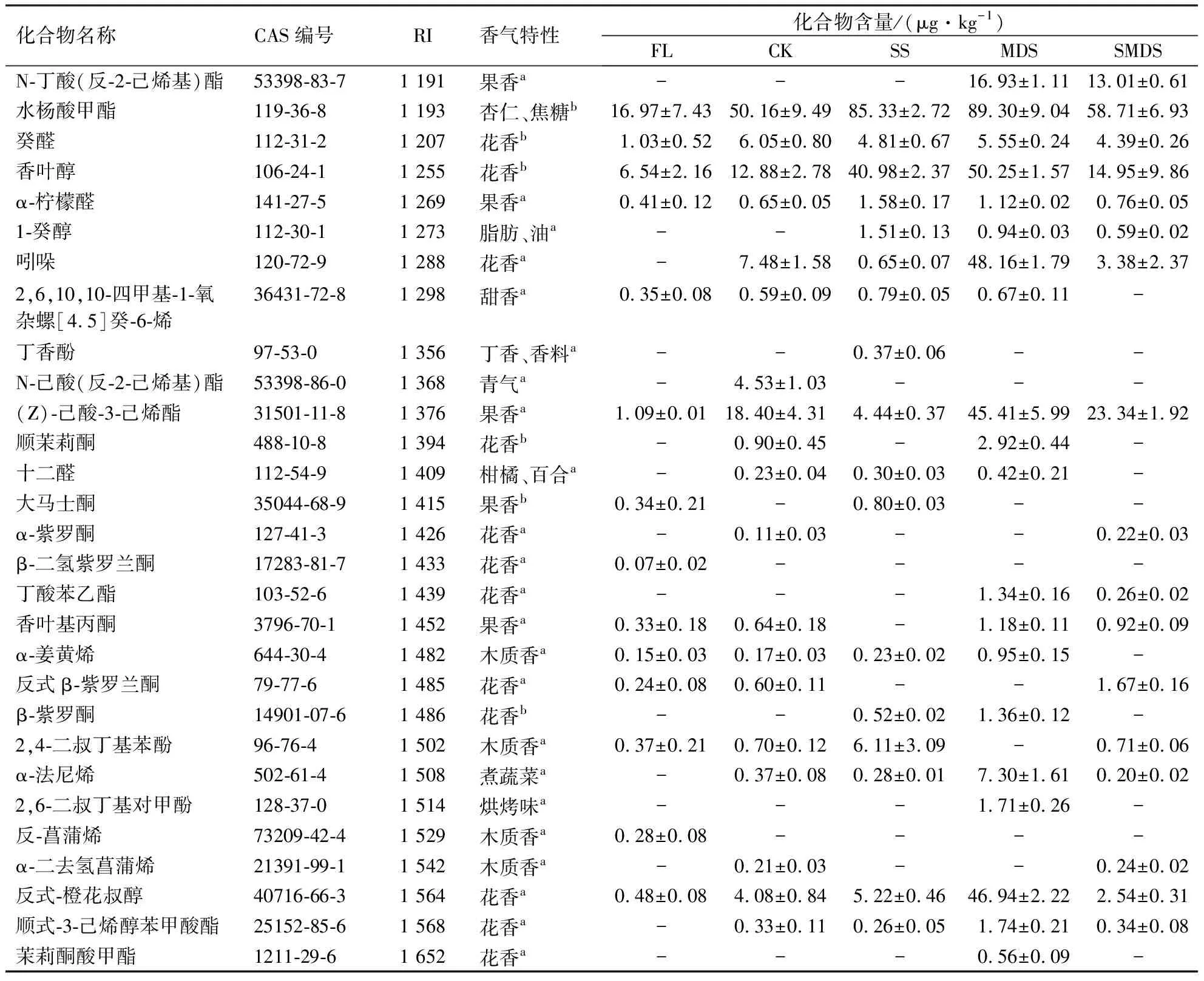
续表1
2.2 不同胁迫处理下茶叶香气物质的PLS-DA分析
对各处理组样品的102个挥发性化合物进PLS-DA分析.图1(A)为PLS-DA模型的得分图,拟合参数R2X=0.937、R2Y=0.966、Q2=0.908,表明该模型对于数据具有较高的解释度和较好的预测率[19].PLS-DA分析结果显示,PLS-DA模型包含两个主成分,FL、CK组分布在右侧的第1、4象限,SS、MDS组分布在左侧的第2象限,而SMDS组分布在左侧的第3象限,胁迫处理组与非胁迫处理组之间得到了很好的区分,且不同胁迫处理组间也存在显著差异,这表明不同胁迫处理下的茶叶香气组成的确存在显著差异.置换检验结果[图1(B)]显示,截距R2=0.135,Q2=-0.65,表明该模型未过拟合,结果可靠[20].

(A)PLS-DA得分图;(B)置换检验图.图1 不同胁迫处理下茶叶香气物质的多元统计结果 Fig.1 Multivariate statistical analysis of aromatic compounds in different treatment groups
2.3 不同胁迫处理下茶叶香气感官品质的差异
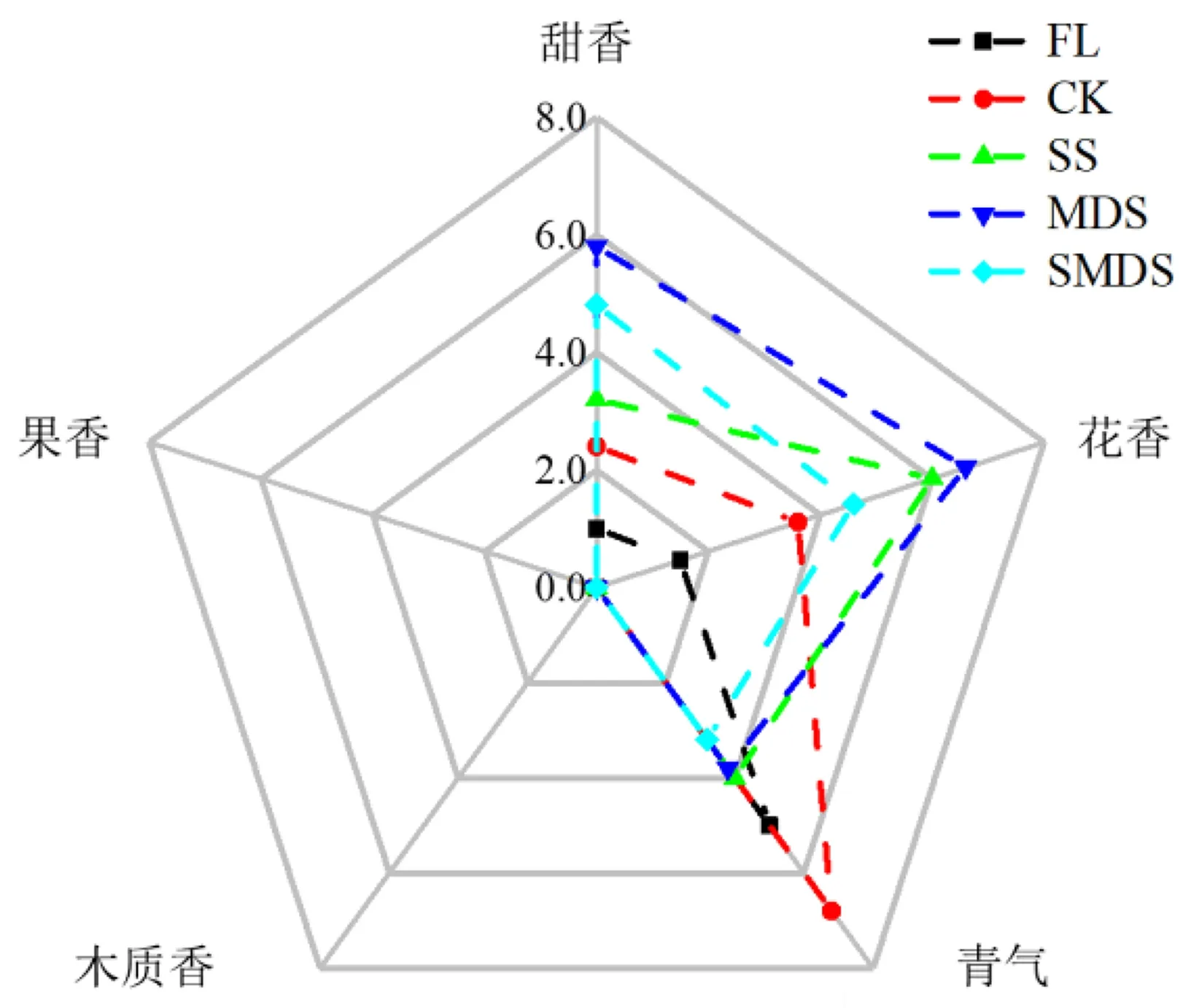
图2 基于九点标度法的茶叶香气感官审评结果Fig.2 Sensory evaluation of tea aroma based on 9-point scale method
2.3.1 茶叶香气感官审评结果 基于九点标度法对各处理组样品进行分析,结果(图2)显示,不同处理组甜香因子得分高低依次是MDS、SMDS、SS、CK、FL,花香因子得分高低依次是MDS、SS、SMDS、CK、FL,青气因子得分高低依次是CK、FL、SS、MDS、SMDS.所有审评员均表示未感受到果香和木质香,因此这两者审评因子得分都为0.综上可以看出,MDS组的甜香和花香最优,CK组的甜香和花香明显弱于其他处理组,而SMDS组的甜香和花香则不如单一胁迫处理组.在青气因子上,CK组的青气明显高于其他处理组,而SMDS组的青气得分最低.从感官审评角度来看,对采后叶片进行一定的胁迫处理的确能达到改善茶叶香气品质的目的.
2.3.2 茶叶香气物质总量的差异 将各处理组样品中具有香气特性的71个挥发性化合物,除去一些诸如脂肪、化学气味等特殊气味化合物,按照化合物的香气特性可以分为花香、果香、甜香、青气、木质香五大类.五大类香气物质总量如图3所示.
不同胁迫处理组香气物质总量为204.35~703.41 μg·kg-1,胁迫处理组高于非胁迫处理组,其中,MDS组的香气物质总量显著高于其他处理组,各处理组总量的大小表现为:MDS>SS>SMDS>CK>FL.
不同处理组花香物质总量为112.03~356.97 μg·kg-1,样品在花香物质总量上呈现出与香气物质总量相同的趋势,各处理组总量的大小表现为:MDS>SS>SMDS>CK>FL,胁迫处理组的花香物质总量显著高于非胁迫处理组,且MDS组的花香物质总量明显高于其他胁迫处理组.
不同处理组果香物质总量为12.73~77.76 μg·kg-1,各处理组总量的大小表现为:MDS>SMDS>CK>SS>FL,其中,除了SS组之外,其他胁迫处理组的果香物质总量都高于非胁迫处理组.但果香的总体含量较低且易被花香、甜香掩盖,审评员的感受度低.
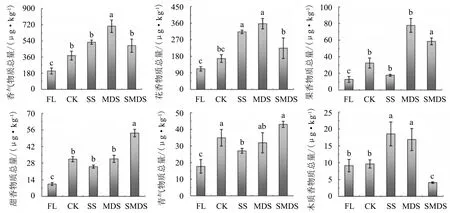
图柱上附不同字母表示差异显著(P<0.05),附相同字母表示差异不显著(P>0.05).图3 基于GC-MS检测的不同胁迫处理下茶叶香气物质总量Fig.3 Comparison on the content of volatile aroma compounds in different treatment groups based on GC-MS
不同处理组甜香物质总量为10.42~53.34 μg·kg-1,各处理组总量的大小表现为:SMDS>MDS>CK>SS>FL.
不同处理组青气物质总量为17.70~42.93 μg·kg-1,各处理组总量的大小表现为:SMDS>CK>MDS>SS>FL,其中,SMDS组的青气物质总量显著高于其他处理组.在青气物质总量上,胁迫处理组与非胁迫处理组的含量差异较小,但在感官审评结果中,两者的青气因子得分呈现出了显著差异,这可能是由于胁迫处理组增加的其他香气属性发生了相互作用,掩盖了青气的感受.
不同处理组木质香物质总量较低,为4.07~18.53 μg·kg-1,造成了审评员在感官审评中对木质香的感受均为0.各处理组木质香物质总量的大小表现为:SS>MDS>CK>FL>SMDS,可见,光胁迫会引起该物质的上升,为了避免茶叶中出现较多的木质香,应尽可能地避免光照.
综上所述,胁迫处理能够显著提高采后茶叶的香气物质总量和花果香物质含量,而在不同的胁迫处理组中,又以机械损伤胁迫对于花果香物质含量的提升效果最佳,光胁迫次之,两种胁迫的叠加处理对于花果香物质含量的提升效果劣于其他两种单一胁迫处理,这一结果与之前的感官审评结果类似.因此,对于追求花果香的茶叶加工,推荐采用机械损伤胁迫;对于追求甜香的茶叶,加工时宜适当增加光胁迫.
2.4 不同代谢途径下茶叶香气物质的差异
在71个具有香气特征的挥发性化合物中,共有49种挥发性化合物的代谢途径可通过文献和资料进行查找,这些化合物按照代谢途径的不同分为4类,分别是萜烯类香气化合物合成途径、脂肪酸源香气化合物合成途径、类胡萝卜素源香气化合物合成途径和苯丙素类/苯环型化合物合成途径[21].将这49种化合物进行热图分析,结果(图4)表明,MDS、SS组的萜烯类物质含量显著大于其他处理组,萜烯类物质大多呈现花果香.同一胁迫处理对于不同的脂肪酸源香气物质含量的影响是不同的,不同处理间的脂肪酸源香气物质含量并未呈现出明显的高低规律.从化合物数量的角度看,MDS组中高于均值的脂肪酸源香气物质共有6种,是所有处理组中最少的;CK、SS、SMDS组中高于均值的脂肪酸源香气物质的数量依次为10、8、7.类胡萝卜素源香气化合物和苯丙素类/苯环型化合物衍生物的数量都较少,且无统一的变化规律,因此可能无法通过采用单一的胁迫方式来提高这两种代谢途径的香气物质含量.
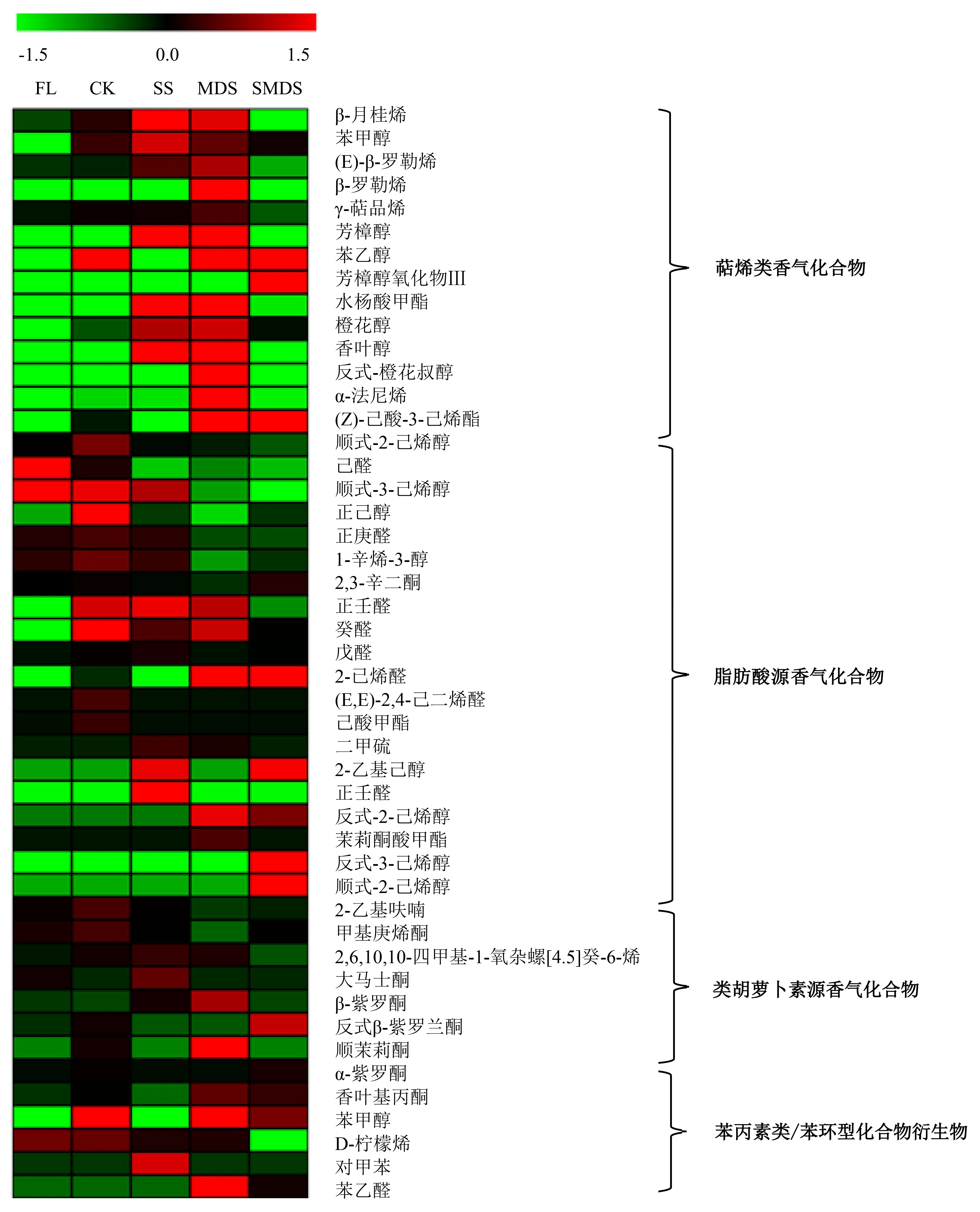
红色表示含量高于均值,绿色表示含量低于均值.图4 不同胁迫处理下茶叶香气化合物的热图Fig.4 Heatmap analysis of volatile aroma compounds in different treatment groups
3 讨论
与其他植物类似,茶叶香气的形成与释放受到环境因素的影响.在环境胁迫的条件下,茶树会收到胁迫信号的传导,相应地做出胁迫反应,调控某些香气合成基因的表达,诱导某些香气物质的合成与释放,减轻胁迫对植物的负面影响,从而使自身更加适应于环境变化[10].在实际生产加工中,可以通过对茶叶实施适度的胁迫来提升香气的释放,从而达到增加茶叶香气的目的.本研究结果表明:相较于非胁迫处理组,胁迫处理组茶叶的花果香更加显著,青气物质含量更低,综合感官品质明显优于前者;通过一定的胁迫处理能够显著提高花果香物质含量,尤其以单一胁迫处理的提升效果最佳,复合胁迫处理对于花果香物质含量的提升效果不如单一胁迫处理;胁迫处理组与非胁迫处理组的青气物质含量差异较小,胁迫处理对于采后鲜叶青气物质含量无明显提升作用.综上所述,可以看到适度的胁迫处理可以有效提升茶叶香气品质,尤其对于花果香物质含量的提升效果最为显著,这对于一些需要体现花果香的红茶品质改良具有重要意义.
茶叶中的萜烯类物质呈现迷人的花果香特征[22].本研究结果显示:不同胁迫处理间的萜烯类香气物质含量存在显著差异,机械损伤胁迫处理组和光胁迫处理组的萜烯类香气物质含量明显高于空白对照组、复合胁迫处理组;Jang et al[23]研究表明,日光中的紫外线能够诱导茶叶释放出香叶醇、芳樟醇和芳樟醇氧化物等萜烯类香气物质;Gui et al[24]研究表明,在乌龙茶摇青过程中所施加的机械损伤能够使茶叶细胞破碎,细胞质中的糖苷酶与液泡中的萜烯类糖苷底物得以接触,进而大量生成萜烯类香气物质.因此,光胁迫处理组和机械损伤处理组萜烯类物质含量的上升很可能是由于胁迫处理刺激了萜烯类物质合成相关基因表达的上调以及萜烯类糖苷的水解.作为茶叶中青气主要来源的脂肪酸源香气物质,在不同胁迫处理下的整体含量并未得到有效提升,但反式-2-己烯醛、反式-2-己烯醇和茉莉酸甲酯等部分香气物质的含量在经过胁迫处理后出现了显著上升,这可能是由于外界胁迫处理对于茶叶中不同的脂肪酸源香气物质的形成存在刺激或抑制两种不同的机制.与脂肪酸源香气物质一样,类胡萝卜素源香气化合物和苯丙素类/苯环型化合物衍生物在不同的胁迫处理下,整体含量并未显示出明显的提升或者下降趋势,而这两种化合物形成路径多且较为复杂,很难通过采用单一的胁迫方式以提高这两种代谢途径的香气物质含量.
本研究通过对采后鲜叶模拟外界胁迫条件以刺激茶叶香气的释放发现,光胁迫和机械损伤胁迫处理的确能够有效地提升茶叶的香气品质,但由于缺乏对相关香气合成基因的转录定量分析以及酶活性研究,且部分香气化合物的胁迫信号传导路径仍然不明,很难确定胁迫诱导了哪些基因的表达以及酶活性的变化,需要进一步的观察及验证.

